
探讨肿瘤患者凝血功能异常时凝血因子活性变化及临床意义。
收集2020年1月至2021年6月在河南省肿瘤医院住院接受治疗的肿瘤患者的临床资料。采用血栓弹力图(TEG)监测其凝血功能,凝血功能呈异常状态的196例肿瘤患者为试验组,呈正常状态的36例肿瘤患者为对照组。根据TEG检测结果的总体凝血指标(CI)值将试验组分为两组:高凝试验组(n=104):CI值>3;低凝试验组(n=92):CI值<-3。每个试验组再根据TEG结果的R值、K值、α角、MA值分成3个亚组,即高凝一组(n=37)、高凝二组(n=34)、高凝三组(n=33);低凝一组(n=33)、低凝二组(n=30)、低凝三组(n=29)。同期测定并比较试验组和对照组所有患者凝血因子(F)Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅺ、Ⅻ和血管性血友病因子(vWF)的活性。
与对照组比较,高凝一组FⅡ、FⅤ、FⅦ、FⅧ、FⅪ和vWF活性升高,分别为(1 105±281)、(1 352±326)、(1 628±397)、(1 795±314)、(1 389±288)和(1 908±486)U/L(均P<0.01);高凝二组FⅡ、FⅤ、FⅦ、FⅧ、FX和vWF活性升高,分别为(1 068±189)、(1 194±205)、(1 529±394)、(1 562±241)、(1 150±196)和(1 722±415)U/L(均P<0.05);高凝三组FⅦ、FⅩ和vWF活性升高,分别为(1 411±196)、(1 212±327)和(1 713±457)U/L(均P<0.01)。低凝一组FⅤ、FⅧ、FⅨ、FⅫ和vWF活性降低,分别为(732±96)、(695±64)、(1 216±191)、(832±128)和(1 088±117)U/L(P<0.05);低凝二组FⅤ、FⅦ、FⅧ和FⅫ活性降低,分别为(714±102)、(1 125±108)、(783±95)和(912±111)U/L(P<0.01);低凝三组FⅪ、FⅫ和vWF活性降低,分别为(812±92)、(827±179)和(916±76)U/L(P<0.01)。
肿瘤患者凝血功能异常时仅有部分凝血因子活性发生明显改变。高凝状态时,FⅡ和FⅩ的活性较高,成为抗凝治疗的重要因素,FⅤ、FⅧ活性升高易引发深静脉血栓;低凝状态时,FⅤ和FⅧ活性显著下降,常引发出血或渗血。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肿瘤患者由于体内癌细胞本身的促凝特性,凝血因子分泌异常,导致肿瘤患者凝血功能紊乱。尤其术中受到创伤及围手术期药物和输血的应用,可进一步激活凝血过程,加重凝血功能紊乱,易造成患者血栓、出血或渗血等[1]。流行病学调查发现,在所有首次发生静脉血栓栓塞症(VTE)的病例中,有20%~30%与肿瘤相关,肿瘤患者VTE的发生率比非肿瘤患者高4~7倍,且呈逐年上升趋势[2]。故准确监测肿瘤患者凝血功能,查找导致凝血出现异常状态的原因,对纠正患者凝血异常、预防血栓形成、减少术后出血或渗血具有重要意义。近年来,对肿瘤患者凝血功能的研究主要围绕凝血因子、血细胞成分、血管内皮损伤等参与凝血过程的相关因素进行,本研究旨在探讨肿瘤患者凝血功能异常时凝血因子活性的变化及临床意义。
病例对照研究。收集2020年1月至2021年6月在河南省肿瘤医院住院治疗的凝血功能呈异常状态的196例肿瘤患者为试验组,男105例,女91例,年龄32~70(46±13)岁;纳入标准:(1)确诊为恶性肿瘤患者;(2)无遗传性凝血疾病肿瘤患者;(3)单一因素造成凝血功能异常肿瘤患者;排除标准:(1)正在或使用过抗凝或抗血小板药物肿瘤患者;(2)半年内有血栓或不明原因出血史肿瘤患者;(3)两种及以上因素造成凝血功能异常肿瘤患者。同期收集凝血功能正常的36例肿瘤患者为对照组,男21例,女15例,年龄36~67(48±12)岁。本研究已获得河南省肿瘤医院伦理委员会审批(批准文号:2019112819),所有研究对象均签署知情同意书。
1.凝血功能测定:使用TEG5000型血栓弹力图仪(美国Hemostasis System 公司)测定患者的凝血功能状态,所用试剂均在有效期范围内。血栓弹力图(TEG)主要参数:(1)R值:表示凝血因子的活性,正常值5~10 min;R>10 min时,说明凝血因子活性低;R<5 min时,说明凝血因子活性高;(2)K值和α角:反应纤维蛋白原活性,正常值1 min≤K≤3 min和53°≤α≤72°;当K>3 min 或α<53°时,表示纤维蛋白原活性低;当K<1 min或α>72°时,表示纤维蛋白原活性高;(3)MA值:代表血小板数量和聚集功能,正常值50 mm≤MA≤70 mm;MA<50 mm时,代表血小板功能弱;MA>70 mm时,代表血小板功能强;(4)总体凝血指标(CI):CI正常值:-3≤CI≤3;CI>3时,说明患者处于高凝状态;CI<-3时,说明患者处于低凝状态。
2.凝血因子活性测定:使用全自动血凝仪(法国思塔高公司)测定凝血因子(F)Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅺ、Ⅻ和血管性血友病因子(vWF)的活性,所用试剂均在有效期范围内。凝血因子活性测定值>正常参考值上限为该因子活性高,凝血因子活性测定值<正常参考值下限为该因子活性低。
3.分组:根据TEG结果将试验组患者分为2组。高凝试验组(n=104):CI值>3;低凝试验组(n=92):CI值<-3;每个试验组再根据TEG结果的R值、K 值、α角、MA值分成3个亚组。(1)高凝一组(n=37):CI值>3且R<5 min;高凝二组(n=34):CI值>3且K<1 min或α>72°;高凝三组(n=33):CI值>3且MA>70 mm。(2)低凝一组(n=33):CI值<-3且R>10 min;低凝二组(n=30):CI值<-3且K>3 min 或α<53°;低凝三组(n=29):CI值<-3且MA<50 mm。(3)对照组(n=36):CI值、R、K、α角、MA检测结果均在正常值范围之内。
4.统计学分析:采用SPSS 19.0软件进行统计分析。正态分布计量数据采用表示,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni法。双侧检验,检验水准α=0.05。
1.TEG检测结果比较:低凝一组的R值、低凝二组的K 值和α角、低凝三组的MA值与对照组比较,差异均有统计学意义(均P<0.01),结果见表1。高凝一组的R值、高凝二组的K值和α角、高凝三组的MA值与对照组比较,差异均有统计学意义(均P<0.01),结果见表2。
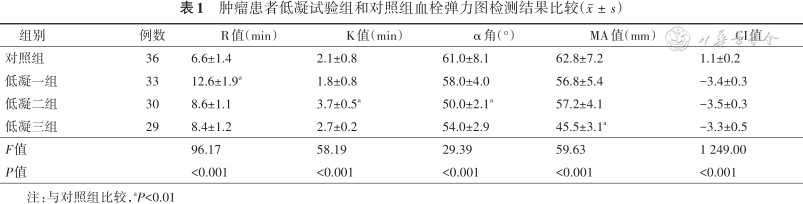
肿瘤患者低凝试验组和对照组血栓弹力图检测结果比较()
肿瘤患者低凝试验组和对照组血栓弹力图检测结果比较()
| 组别 | 例数 | R值(min) | K值(min) | α角(°) | MA值(mm) | CI值 |
|---|---|---|---|---|---|---|
| 对照组 | 36 | 6.6±1.4 | 2.1±0.8 | 61.0±8.1 | 62.8±7.2 | 1.1±0.2 |
| 低凝一组 | 33 | 12.6±1.9a | 1.8±0.8 | 58.0±4.0 | 56.8±5.4 | -3.4±0.3 |
| 低凝二组 | 30 | 8.6±1.1 | 3.7±0.5a | 50.0±2.1a | 57.2±4.1 | -3.5±0.3 |
| 低凝三组 | 29 | 8.4±1.2 | 2.7±0.2 | 54.0±2.9 | 45.5±3.1a | -3.3±0.5 |
| F值 | 96.17 | 58.19 | 29.39 | 59.63 | 1 249.00 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
注:与对照组比较,aP<0.01
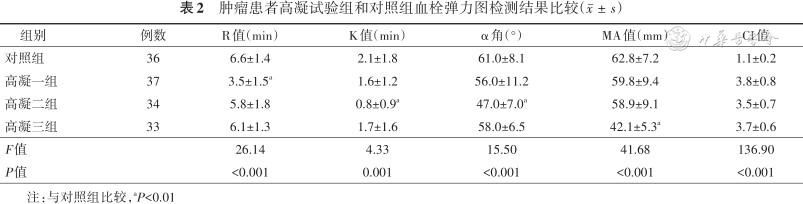
肿瘤患者高凝试验组和对照组血栓弹力图检测结果比较()
肿瘤患者高凝试验组和对照组血栓弹力图检测结果比较()
| 组别 | 例数 | R值(min) | K值(min) | α角(°) | MA值(mm) | CI值 |
|---|---|---|---|---|---|---|
| 对照组 | 36 | 6.6±1.4 | 2.1±1.8 | 61.0±8.1 | 62.8±7.2 | 1.1±0.2 |
| 高凝一组 | 37 | 3.5±1.5a | 1.6±1.2 | 56.0±11.2 | 59.8±9.4 | 3.8±0.8 |
| 高凝二组 | 34 | 5.8±1.8 | 0.8±0.9a | 47.0±7.0a | 58.9±9.1 | 3.5±0.7 |
| 高凝三组 | 33 | 6.1±1.3 | 1.7±1.6 | 58.0±6.5 | 42.1±5.3a | 3.7±0.6 |
| F值 | 26.14 | 4.33 | 15.50 | 41.68 | 136.90 | |
| P值 | <0.001 | 0.001 | <0.001 | <0.001 | <0.001 |
注:与对照组比较,aP<0.01
2.凝血因子活性检测结果比较:与对照组比较,低凝一组FⅤ、FⅧ、FⅫ和vWF活性较低,其中 FⅤ、FⅧ和FⅫ活性下降显著(均P<0.01);低凝二组FⅤ、FⅦ、FⅧ和FⅫ活性较低(均P<0.01);低凝三组FⅡ、FⅩ、FⅪ、FⅫ和vWF活性较低(均P<0.01),结果见表3。与对照组比较,高凝一组FⅡ、FⅤ、FⅦ、FⅧ、FⅪ和vWF活性较高,增加显著(均P<0.01);高凝二组FⅡ、FⅤ、FⅦ、FⅧ、FⅩ和vWF活性较高,(均P<0.01);高凝三组FⅦ、FⅩ和vWF活性较高,其中vWF增加显著(均P<0.01),结果见表4。
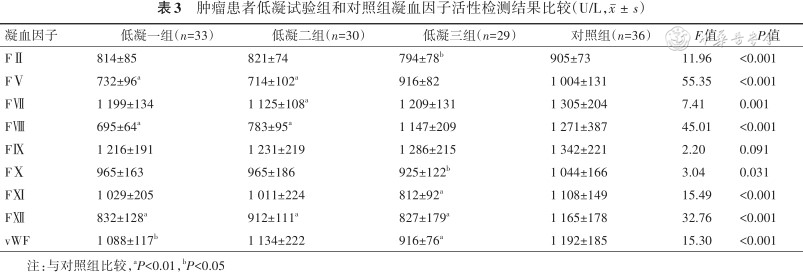
肿瘤患者低凝试验组和对照组凝血因子活性检测结果比较(U/L,)
肿瘤患者低凝试验组和对照组凝血因子活性检测结果比较(U/L,)
| 凝血因子 | 低凝一组(n=33) | 低凝二组(n=30) | 低凝三组(n=29) | 对照组(n=36) | F值 | P值 |
|---|---|---|---|---|---|---|
| FⅡ | 814±85 | 821±74 | 794±78b | 905±73 | 11.96 | <0.001 |
| FⅤ | 732±96a | 714±102a | 916±82 | 1 004±131 | 55.35 | <0.001 |
| FⅦ | 1 199±134 | 1 125±108a | 1 209±131 | 1 305±204 | 7.41 | 0.001 |
| FⅧ | 695±64a | 783±95a | 1 147±209 | 1 271±387 | 45.01 | <0.001 |
| FⅨ | 1 216±191 | 1 231±219 | 1 286±215 | 1 342±221 | 2.20 | 0.091 |
| FⅩ | 965±163 | 965±186 | 925±122b | 1 044±166 | 3.04 | 0.031 |
| FⅪ | 1 029±205 | 1 011±224 | 812±92a | 1 108±149 | 15.49 | <0.001 |
| FⅫ | 832±128a | 912±111a | 827±179a | 1 165±178 | 32.76 | <0.001 |
| vWF | 1 088±117b | 1 134±222 | 916±76a | 1 192±185 | 15.30 | <0.001 |
注:与对照组比较,aP<0.01,bP<0.05
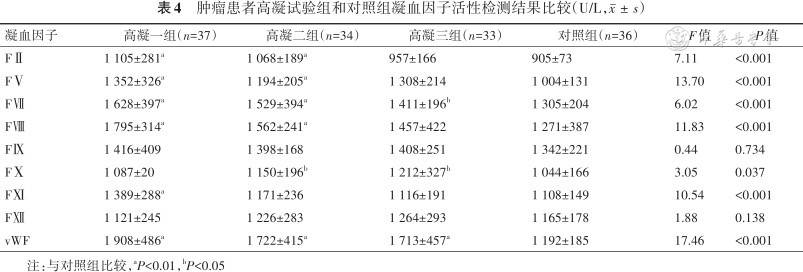
肿瘤患者高凝试验组和对照组凝血因子活性检测结果比较(U/L,)
肿瘤患者高凝试验组和对照组凝血因子活性检测结果比较(U/L,)
| 凝血因子 | 高凝一组(n=37) | 高凝二组(n=34) | 高凝三组(n=33) | 对照组(n=36) | F值 | P值 |
|---|---|---|---|---|---|---|
| FⅡ | 1 105±281a | 1 068±189a | 957±166 | 905±73 | 7.11 | <0.001 |
| FⅤ | 1 352±326a | 1 194±205a | 1 308±214 | 1 004±131 | 13.70 | <0.001 |
| FⅦ | 1 628±397a | 1 529±394a | 1 411±196b | 1 305±204 | 6.02 | <0.001 |
| FⅧ | 1 795±314a | 1 562±241a | 1 457±422 | 1 271±387 | 11.83 | <0.001 |
| FⅨ | 1 416±409 | 1 398±168 | 1 408±251 | 1 342±221 | 0.44 | 0.734 |
| FⅩ | 1 087±20 | 1 150±196b | 1 212±327b | 1 044±166 | 3.05 | 0.037 |
| FⅪ | 1 389±288a | 1 171±236 | 1 116±191 | 1 108±149 | 10.54 | <0.001 |
| FⅫ | 1 121±245 | 1 226±283 | 1 264±293 | 1 165±178 | 1.88 | 0.138 |
| vWF | 1 908±486a | 1 722±415a | 1 713±457a | 1 192±185 | 17.46 | <0.001 |
注:与对照组比较,aP<0.01,bP<0.05
肿瘤患者凝血因子活性与肿瘤细胞分泌的因子增加程度有关,凝血因子活性增高,机体的凝血-纤溶系统失衡,患者出现高凝状态,严重者会出现血栓[3]。高凝状态及静脉血栓有助于肿瘤细胞的生长、侵袭及远处转移[4]。患者若出现低凝状态,则会导致组织损伤、炎症和失血等症状[5],严重创伤还可出现较高病死率[6]。TEG以全血为检测标本,模拟人体内凝血状态,测定凝血因子和纤维蛋白原活性、血小板功能以及纤维蛋白溶解程度,对患者凝血功能进行监测和评估,从活性和功能两个方面反映患者的凝血状态,也是利用全血测定患者凝血功能较理想的方法[7, 8]。
凝血因子是参与血液凝固的重要组成部分,凝血因子活性增高时,容易出现高凝状态,甚至血栓。相反,则会出现低凝状态、出血或渗血。研究表明,肿瘤细胞可表达凝血因子,包括促凝血蛋白、纤溶蛋白和微粒等。在FⅦ、Ⅸ、Ⅹ等参与下,促凝血蛋白的组织因子将凝血酶原转化为凝血酶,也是恶性肿瘤的促凝剂,直接激活FⅩ,使细胞表面凝血活性增加,产生Xɑ因子,并随后激活凝血系统[9]。Mi等[10]研究发现,肿瘤生长过程中凝血因子的激活导致晚期乳腺癌患者呈高凝状态。及时识别肿瘤患者的凝血功能障碍,发现相关凝血因子活性异常变化,对肿瘤疾病诊断、病因分析及治疗方法等方面发挥着重要作用[11]。
本研究结果表明,高凝一组的FⅡ、FⅤ、FⅦ、FⅧ、FⅪ、vWF活性和高凝二组FⅡ、FⅤ、FⅦ、FⅧ、FⅩ、vWF活性显著增高。FⅡ、FⅦ及FⅩ是依赖维生素K的相关蛋白,当国际标准化比值(INR)<1.5时,FⅡ、FⅦ和FⅩ的活性水平高于各自的最低止血水平,血浆中内源性FⅡ和FⅩ的活性水平成为是否需要抗凝治疗的重要因素,针对此类因子导致高凝的肿瘤患者,可根据INR数值使用华法林进行抗凝治疗[12]。FⅤ是活化FⅩ的重要辅助因子,能与机体中的钙离子(Ca2+)、凝血活酶因子(PF3)等相互作用,从而形成凝血酶原酶复合物,然后有效促进凝血。FⅤ活性在乳腺肿瘤中的表达与肿瘤的侵袭性和整体生存有关,也是乳腺癌浸润免疫细胞的标志物[13]。FⅧ在人体中参与FⅩ活性,并且在Ca2+的参与下促进凝血酶的形成。FⅧ活性增高,可使用FⅧ抑制剂进行抗凝治疗。下肢深静脉血栓(DVT)与血浆FⅤ、FⅧ活性关系十分密切,肿瘤患者高凝体质更易出现血栓,FⅤ、FⅧ活性检测对DVT的预防具有重要作用[14]。高凝三组仅有vWF活性显著增高,vWF含量与血小板黏附和聚集能力成正比。在血小板功能较强时,患者vWF含量较高,血浆黏滞性增加,易出现高凝状态,甚至血栓形成,需要进行抗凝血因子和抗血小板的双抗治疗[15]。
低凝一组FⅤ、FⅧ、FⅨ、FⅫ和vWF活性明显下降,低凝二组FⅤ、FⅦ、FⅧ和FⅫ活性较低,证明FⅤ、FⅧ是最不稳定的凝血因子之一。FⅤ活性在肝功能失代偿或肝脏严重受损时才减少,它是判断肿瘤患者肝功能的一个良好指标。患者合并弥散性血管内凝血(DIC)时,凝血因子大量消耗,FⅧ活性水平明显降低。由于新鲜冰冻血浆或冷沉淀富含FⅤ、FⅧ,因而成为因凝血因子缺乏发生出血或渗血肿瘤患者治疗的首选,尤其是肝癌患者,对稳定其凝血功能和提高生存率有积极意义[16]。FⅫ缺乏多无自发性出血,很少有严重出血现象[17]。低凝三组FⅡ、FⅪ、FⅫ和vWF活性降低,在手术引起低凝状态或出血时,FⅪ和FⅫ活性常常较低,但是,出血程度的轻重与FⅪ和FⅫ水平并不完全成正比[17],由于FⅫ在血液循环中处于不活动状态,对FⅪ和FⅫ活性与出血的关注较少。低凝三组是因血小板功能弱导致的低凝状态,由于vWF含量与血小板功能关系紧密,针对这类肿瘤患者急需补充机采血小板。临床上,对于因血小板功能差导致低凝状态伴出血或渗血患者,在补充血小板的同时,应输注冷沉淀或新鲜冰冻血浆,及时补充凝血因子,治疗效果比单一输注血小板疗效要好[18]。
本研究也存在一些局限性:(1)分析样本量较小;(2)单因素分析,研究过程中发现有部分患者是两种或两种以上因素造成凝血功能异常;今后需加大样本量,增加多因素分析,为临床诊疗提供帮助。
所有作者均声明不存在利益冲突



























