
研究一种新型的3D打印仿真肺结节无创定位模型用于肺结节切除手术中指引肺小结节定位切除,并分析其准确性和切除效率。
入选2020年4月至2021年4月四川大学华西医院胸外科采用仿真肺结节定位模型进行胸腔镜手术中肺结节定位,并行肺结节切除手术的66例患者,男13例,女53例,年龄25~79(52.7±11.4)岁。其中单发结节患者24例(36.4%),同时性多发结节42例(63.6%)。使用患者的胸部高分辨CT影像数据进行数字重建,并3D打印制备个体化的1∶1等大仿真肺结节定位模型,用于手术中指引肺结节实时定位。分析手术相关参数、结节定位情况、结节切除情况,以及病理结果等资料。术前计划切除的结节按主要病灶结节和额外结节两种类别分别评估该模型指引定位的准确性和切除效率。
根据术前评估,66例患者计划切除的主要病灶结节71个,中位最大径0.9 cm(0.6~1.3 cm);计划切除的额外结节77个,中位最大径0.5 cm(0.4~0.7 cm)。所有患者均行全胸腔镜手术,单孔52例(78.8%),三孔14例(21.2%);单发结节患者中行肺段切除18例、楔形切除6例;多发结节患者中行肺段切除5例、楔形切除14例,混合术式23例(其中肺叶切除+肺段切除2例、肺叶切除+楔形切除7例、肺段切除+楔形切除14例)。全组中位手术时间93 min(45~240 min),平均每个结节切除中位时间51.4 min(6.7~147.0 min)。主要病灶结节全部成功切除并在手术台上由外科医生在切除标本中全部剖出,额外结节全部成功切除并在切除标本中剖出85.7%(66/77);模型指引的两种结节定位准确率均为100%。所有主要病灶结节均为恶性,剖出的额外结节恶性比例为21.2%(14/66)。
本中心设计的基于3D打印的仿真肺结节定位模型技术是一种无创、准确、便捷的肺小结节定位方法,特别在同时性多发肺结节的定位中更具独特优势。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
本文介绍了一种我国原创的新型肺小结节定位方法,利用患者已有的CT检查影像数据,采用3D打印技术制成1∶1等大的仿真肺结节定位模型,用于手术过程中实时指引肺小结节的精准定位和切除,并可在切除的离体标本中指导小结节的剖出。该方法避免了对患者在术前或者术中进行额外有创的或者器械的定位操作,完全无创,简便易行,还可同时定位多发结节,具有一定的临床应用前景,期望在以后的临床工作中进一步实践检验。
随着胸部高分辨CT(HRCT)的广泛应用,越来越多肺部小结节被检出。同时性多发肺结节也逐渐成为突出问题,其中相当比例的结节为恶性,需要外科手术切除。最新研究表明,小肺癌行亚肺叶切除的远期预后不亚于肺叶切除,且能更好地保留患者肺功能[1]。肺小结节的准确定位是亚肺叶切除的关键,否则需要扩大切除,甚至进行整个肺叶的切除以确保目标结节包含于切除范围内。目前主要的肺结节定位方法包括术前CT引导经皮穿刺定位、电磁导航支气管镜定位,或术中手指触诊等[2]。这些方法具有需额外检查操作进行有创定位、耗时、定位材料移位脱落等诸多问题,甚至造成空气栓塞等严重并发症;而术中手指触诊常常感觉不到结节的位置,在微创腔镜下手术对手指触诊的限制更大;而多发结节的定位更是一个没有解决的难题。对此,本中心设计了一种新型肺结节定位方法,采用个体化的3D打印1∶1等大仿真肺结节定位模型对单发及多发肺结节进行手术中实时无创定位,指引肺结节的定位切除,现将结果报告如下。
本研究为病例系列研究,前瞻性纳入2020年4月至2021年4月在四川大学华西医院胸外科采用个体化的3D打印1∶1等大仿真肺结节定位模型进行肺结节定位并行手术切除的66例患者资料,其中男13例,女53例,年龄25~79(52.7±11.4)岁。纳入标准:(1)单发或者多发的肺结节,最大直径均<1.5 cm;(2)结节位于肺野的中或外三分之一;(3)计划手术方式为肺段或者楔形切除;(4)研究者判断结节在术中难以用手指扪及。排除标准:(1)需行肺叶切除的病灶;(2)不需结节定位的肺段切除。该研究通过四川大学华西医院伦理委员会批准(2020-1107),所有患者签署手术知情同意书。
其中单发结节24例(36.4%),同时性多发结节42例(63.6%)。按术前计划切除的主要病灶结节共71个,中位最大径为0.9 cm(0.6~1.3 cm);术前计划切除的额外结节共77个,中位最大径为0.5 cm(0.4~0.7 cm)。有3例患者同期切除了超过5个结节,其中1例患者同期定位并切除了12个结节。
1.主要病灶结节(M):患者术前HRCT上显示多发结节,其中具有高危影像学特征,经医生评估为具有侵袭性、需限期手术的结节。高危影像学特征参考Fleischner学会在2017年及2018年发布的相关临床指南[3, 4]。
2.额外结节(A):患者术前HRCT显示多发结节,其中影像学表现为可疑恶性,经医生评估暂不具有侵袭性,同时可通过本次手术同期切除且损失肺组织在可承受范围的结节。
3.计划切除结节(P):术前计划通过此次手术同期切除的结节,其数目等于主要病灶结节数与额外结节数之和:。
4.剖出主要病灶结节数(Dm):在手术切除标本中剖寻到的主要病灶结节数目。
5.剖出额外结节数(Da):在手术切除标本中剖寻到的额外结节数目。
6.恶性主要病灶结节数(Mm):主要病灶结节中病理证实为恶性的数目。
7.恶性额外结节数(Ma):额外结节中病理证实为恶性的数目。
8.影像学切除结节数(R):通过手术前后HRCT对比,影像学消失且位于手术切除范围内的结节数目,这些结节判定为手术切除而非自然消失。
3D打印仿真肺结节定位模型为四川大学华西医院胸外科研发,申请专利(专利号:201820438425.4)。制备步骤如下:(1)数字建模:获取患者术前1周内的胸部HRCT的影像数据(图1),导入Mimics软件V21.0(比利时Materialise公司),进行整个肺、解剖标志及结节三维模型的数字重建,并完成相应优化和后期处理(图2);(2)切片及3D打印:将重建文件导入Magics软件V21.0(比利时Materialise公司)完成切片后,发送并驱动3D打印机,采用立体光固化成型工艺,根据预设参数启动光固化3D打印机进行生产制备;(3)后处理:模型初步打印完成后去除其支撑材料并进行打磨和固化。最终获得个体化的1∶1等大3D打印仿真肺结节定位模型(图3)。




本方法为术中无创定位,无需对患者进行术前额外准备和操作。全身麻醉双腔气管插管行单肺通气,在打孔进入胸腔后,保持肺原位,肺处于半膨胀状态,开始定位。将仿真肺结节定位模型摆放于胸腔镜屏幕旁,由主刀医生实时对照模型上的结节位置,利用肺部各解剖标志点与肺结节之间的距离、比例等空间几何关系,“按图索骥”进行定位,并作缝线标记(图4)。解剖标志常参照肺裂、肺前后沿、肺尖肺底、大血管心脏压迹等。如因翻动肺叶造成空间关系变化,可重新鼓肺恢复初始关系,以便对照仿真模型。
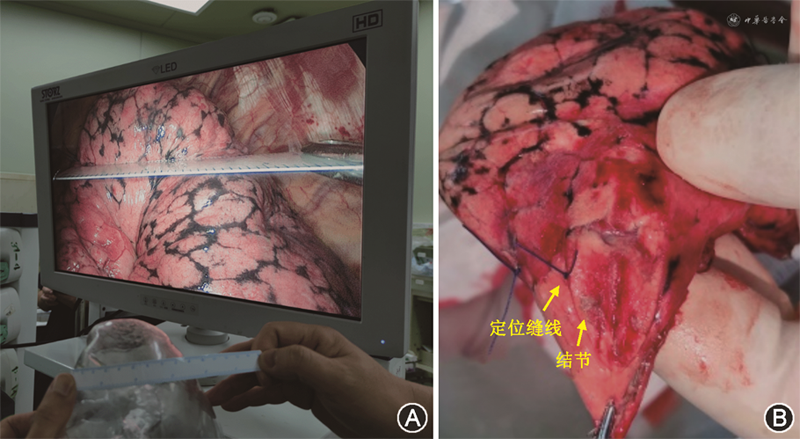

所有患者均接受全胸腔镜手术。对于单发结节,根据结节大小、位置及实性成分选择相应的术式,包括肺叶切除、肺段切除及楔形切除;对于多发结节,首先依据主要病灶结节确定主要术式,再设计次要术式切除额外结节,尽可能保留肺功能。额外结节若与主要病灶结节位于同一肺叶且较为集中,可通过主要术式一并切除;额外结节若与主要病灶结节位于同一肺叶但位置较远,则单独楔形切除;若额外结节位于不同肺叶,则主要通过楔形切除处理,必要时采用肺段切除。其他小结节若切除需损失较多正常肺组织,或影像学判断为低风险,则不追求同期切除,而采取密切随诊的策略。
1.手术中结节定位的统计纳入范围:为了准确计算该仿真肺结节定位模型的定位准确率,手术切除过程中未使用该模型进行定位的结节均不纳入统计。包括:(1)多发结节病例,其中有较大的肿瘤,需行肺叶切除,这个肺结节无需定位,不纳入统计,仅将该病例中位于其他肺叶的进行了定位后行亚肺叶切除的结节纳入统计;(2)多发结节病例中,同一肺叶中有多个结节且分布离散,需采取肺叶切除一并处理,这部分结节无需定位,不纳入统计,仅将该病例中位于其他肺叶的进行了定位后行亚肺叶切除的结节纳入统计。
2.定位成功判定标准:(1)主要病灶结节必须同时满足以下2个条件才认为定位成功:在切除的标本中剖出和影像学切除;(2)对额外结节标准:影像学切除则认为定位切除成功,而不要求剖出结节。如术中因定位困难而改变预定的手术方式进行扩大切除,也认为定位失败。
3.定位成功率评估:按上述标准,主要病灶结节定位成功率采用主要病灶结节剖出率(Dm%)评估,即剖出的主要病灶结节的比例:。额外结节定位成功率采用额外结节切除率(Ra%)评估,即影像学切除的额外结节的比例:。由于额外结节通常为密度浅淡的小结节,在切除的标本中剖寻此类结节是一个难点,采用额外结节剖出率(Da%)来评估该仿真模型帮助外科医生剖寻额外结节的能力,即成功剖出的额外结节占所有切除额外结节的比例:。
4.定位效率评估:采用每例患者平均每个结节切除所需手术时间来评估该定位方法的定位效率,包含麻醉、定位、手术切除及剖寻结节的整个手术时间。
5.其他指标:为了描述和讨论结节性质,计算主要病灶结节和额外结节的恶性比例。主要病灶结节恶性率(Mm%)为病理证实为恶性的主要病灶结节占切除(剖出)主要病灶结节的比例:。额外结节恶性率(Am%)为病理证实为恶性的额外结节占剖出额外结节的比例:。
采用SPSS软件24.0对数据进行分析。年龄为正态分布定量资料,以表示;结节最大径、出血量和手术时间为非正态分布定量资料,为突出显示数值范围,采用中位数(最小值~最大值)表示。
本研究共纳入66例患者,均行胸腔镜手术,其中单孔52例(78.8%),三孔14例(21.2%)。按照上述手术原则,24例单发结节患者中,肺段切除18例(75.0%),楔形切除6例(25.0%);46例多发结节患者中,肺段切除5例(11.9%)、楔形切除14例(33.3%),以及混合术式23例(54.8%)(其中肺叶切除+肺段切除2例、肺叶切除+楔形切除7例、肺段切除+楔形切除14例)。出血量为15.0 ml(5~60 ml)。总体并发症发生率为13.6%(9/66),其中术后持续漏气(>5 d)5例(7.6%)、乳糜胸1例(1.5%)、肺部感染3例(4.5%),无术后出血、支气管胸膜瘘、肺栓塞、心脑血管事件等并发症发生,无围手术期死亡(表1)。

66例肺结节患者的基线特征[例(%)]
66例肺结节患者的基线特征[例(%)]
| 特征 | 数值 | |
|---|---|---|
| 总例数 | 66 | |
| 年龄(岁,) | 52.7±11.4 | |
| 性别(例,男/女) | 13/53 | |
| 影像学结节数目(个) | ||
1 | 24(36.4) | |
2 | 15(22.7) | |
3 | 11(16.7) | |
4 | 8(12.1) | |
5 | 3(4.5) | |
≥6 | 5(7.6) | |
| 切除结节数目(个) | ||
1 | 30(45.5) | |
2 | 17(25.8) | |
3 | 10(15.2) | |
4 | 5(7.6) | |
5 | 1(1.5) | |
≥6 | 3(4.5) | |
| 手术类型 | ||
单孔胸腔镜 | 52(78.8) | |
三孔胸腔镜 | 14(21.2) | |
| 手术方式 | ||
单发结节a | 24(36.4) | |
| 肺段切除 | 18(27.3)[75.0] | |
| 楔形切除 | 6(9.1)[25.0] | |
多发结节b | 42(63.6) | |
| 肺段切除 | 5(6.9)[11.9] | |
| 楔形切除 | 14(19.4)[33.3] | |
| 肺叶+肺段 | 2(2.8)[4.8] | |
| 肺叶+楔形 | 7(9.7)[16.7] | |
| 肺段+楔形 | 14(19.4)[33.3] | |
注:a方括号内数据为占单发病例的比例(%);b方括号内数据为占多发病例的比例(%)
66例患者中,主要病灶结节总数为71个,定位后剖出主要病灶结节71个,定位成功率为100%;额外结节总数为77个,影像学切除额外结节77个,定位成功率为100%。剖出额外结节66个,额外结节剖出率为85.7%(66/77)。所有患者均未因术中定位困难而改变预定的手术方式进行扩大切除。中位总手术时间(含麻醉、定位、手术切除及剖寻结节的时间)为93 min(45~240 min),平均每个结节切除中位时间为51.4 min(6.7~147.0 min)。
手术后病理证实所有主要病灶结节均为恶性,比例为100%,类型包括浸润性腺癌及微浸润性腺癌。共剖出额外结节66个,其中恶性结节14个(21.2%),类型包括微浸润性腺癌10个(71.4%)、原位腺癌4个(28.6%)。
肺部小结节的精确定位可以帮助在完整切除肿瘤同时最大程度保留肺功能[2]。目前肺小结节定位可分为术前及术中两大类。术前定位主要包括经皮穿刺定位和经纤维支气管镜穿刺定位。经皮穿刺是目前应用最为广泛的方法,标记材料包括定位针(Hookwire)、弹簧圈、液体材料以及放射性同位素等。定位针存在移位甚至脱落导致定位失败的缺陷[5],染料则存在弥散过快导致定位不准的问题[4]。此外,有创的经皮穿刺定位可引起患者疼痛并可能导致气胸、血胸等并发症[6, 7, 8],更有空气栓塞等严重并发症的发生[2,7, 8]。定位过程中需多次CT检查以确认定位准确及并发症,增加放射暴露。经皮穿刺定位常受结节位置所限,如距脏层胸膜较远或穿刺路径因肩胛骨阻挡则无法定位。经支气管镜穿刺定位常结合电磁导航或虚拟支气管镜导航(VAL-MAP)[9, 10]。相比经皮穿刺其并发症发生率较低,不受限于结节位置,但仍有操作烦琐、耗时、成本高昂、需借助特殊设备等缺陷,并高度依赖操作者经验,学习曲线长。另外,也有研究利用3D打印制作经皮穿刺定位板,于术前紧贴于患者胸壁,沿该定位板的针道引导进针穿刺定位肺小结节[11, 12, 13, 14],虽减少了放射暴露,但并发症、定位针移位等其他问题仍未解决。目前术中实时定位还没有有效方法,术者主要通过手指触诊或辅助超声等,其总体定位成功率低[15]。而对于多发结节,上述方法均无法安全有效完成所有结节的定位。有团队通过经皮穿刺弹簧圈标记的方法完成了最多6个结节的定位[16],但随着穿刺过程增多,并发症发生率、放射暴露、定位耗时也明显增加[16, 17, 18]。综上,目前的肺结节定位方法普遍存在额外有创操作、烦琐、耗时等问题,且对多发结节无法安全有效地完成定位。
针对上述问题,本中心设计开发了一种新的定位方法,基于数字重建和3D打印技术,利用患者术前本来就要完成的检查——HRCT影像数据,制备个体化的1∶1等大肺结节仿真定位模型,用以指引术中肺结节的无创实时定位。本病例系列研究表明,所有计划切除的结节均成功定位并切除,定位成功率为100%。同时该模型还可辅助医生在切除的标本中剖寻密度淡或位置深的小结节。在便捷和效率方面,该定位技术无需额外检查操作设备,无需术前额外的定位时间,操作简便,定位时间短,每个结节整个手术中位用时仅51.4 min。此外,本研究中单孔胸腔镜手术占78.8%,说明该仿真模型在单孔术式下也能够准确快速定位结节,不受术式影响;同时性多发肺结节病例占63.6%,其中同期切除超过5个结节的患者有3例,甚至有1例患者同期定位并切除了12个结节,这表明该仿真模型在同时性多发结节的定位中有独特优势。该定位方法也无需穿刺,没有创伤,不会在术前造成患者额外疼痛,也不存在气胸、血胸等并发症,克服了穿刺定位技术的主要缺陷。综上,本中心设计的仿真肺结节定位模型是一种无创、高效、准确的定位方法,更能解决同时性多发肺结节的定位难题。
本研究中,切除的主要病灶结节中位最大径为0.9 cm(0.6~1.3 cm),额外结节中位最大径为0.5 cm(0.4~0.7 cm),表明本研究切除的结节以亚厘米结节为主,尤其额外结节,以0.5 cm的小结节为主。这些小结节通过传统的方法难以准确定位,但本中心的仿真肺结节定位模型能够高效准确地定位这些小结节。
对于定位操作,在刚进入胸膜腔肺组织稍微萎陷时,就首先开始依次对所有计划切除的结节进行定位,此时肺组织萎陷程度不大,结节与周围的空间解剖和比例关系变化不大。而且在实践中也发现轻微的肺萎陷对定位影响不大。但在肺萎陷程度较大时,需适当鼓肺恢复膨胀状态;例如胸膜腔粘连的病例,在胸膜腔粘连松解后,应重新鼓肺后再开始定位。
另外对于位置较深或位于肺段交界处的结节,往往需行肺段切除甚至跨段切除,本仿真肺结节定位模型可以指引在肺结节的肺表面投影位置做标记,一方面可以直观判断是否有足够的切除边界,另一方面可以指导在切除下来的标本中更容易解剖到小结节。而对于位置更深靠近肺门的结节(肺野内三分之一),往往直接采用肺段切除、联合肺段切除,甚至需肺叶切除,则无需定位。
研究表明肺结节人群中约30%为同时性多发肺结节[19],而目前对同时性多发肺结节的处理尚无统一定论。有学者主张仅手术处理主要病灶而随诊观察其他结节,也有学者提出手术优先切除主要病灶兼顾次病灶[19]。本研究的多发结节病例中,主要病灶结节全部为恶性,包括浸润性腺癌及微浸润性腺癌,均具有一定程度的浸润;而同期手术切除并剖出的额外结节中,21.2%为恶性,包括原位腺癌甚至微浸润性腺癌。该结果表明相当比例的额外结节具有恶性倾向甚至浸润能力,若未同期切除,将来会进一步浸润进展,使患者遭受二次手术,同时承受巨大心理负担。笔者认为对于多发肺结节的手术规划应同时考量以下原则:(1)浸润风险高、对患者预后影响最大的主要病灶结节,例如病灶较大、实性成分较多、随访过程中有进展的结节,应当切除;(2)浸润风险较低、对患者预后影响较小的额外结节,例如病灶较小、无实性成分、随访过程中稳定的结节,综合评估若能在正常肺组织损失较小的情况下一并切除,则应在准确定位后都予精准切除,并尽可能采取楔形切除;(3)并非所有肺结节都需同期手术切除:若影像学判断为低风险的结节,而切除又需损失较多正常肺组织,则不追求同期切除,应密切随诊。符合以上原则的手术规划要求准确定位结节及评估手术切除范围。本中心设计的仿真肺结节定位模型可以直观体现结节与周围肺组织的位置关系,帮助医生设计合理的切除计划和范围,同时辅助术中准确定位并完成精准切除,力求最大限度保留肺功能,让多发肺结节的精准外科治疗成为可能。
本研究也有一定局限性:未设置对照组与目前的定位技术对比;未单独计算定位的时间,不能更精确地评估定位效率。该模型的定位准确性及高效性还需进一步在多中心应用验证。
所有作者均声明不存在利益冲突



























