
随着2008年我国正式将风疹疫苗纳入扩大免疫规划,婴幼儿免疫覆盖率自2012年持续维持在95%以上,因此在人群中建立了一定的免疫屏障,使得我国风疹发病率逐年下降,并逐步阻断了本土流行风疹病毒的传播,显示我国正在向风疹消除目标迈进。然而,为了加速我国风疹消除进程,应根据监测实情科学制定重点人群的补充免疫策略,提升应对暴发疫情的处置能力,同时有必要通过构建医防融合机制并推进先天性风疹综合征监测,从而为风疹消除提供证据支持。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
世界卫生组织(World Health Organization,WHO)于1989年提出了全球控制和消除麻疹的目标,成为继天花和脊髓灰质炎后第三个要在全球范围内消除的病毒性传染病。由于麻疹和风疹同为发热出疹性疾病,其流行病学特征相似且可获得有效的麻疹和风疹联合疫苗,控制和消除风疹可推动早日实现全球麻疹消除目标;同时感染风疹病毒(rubella virus,RV)可引发先天性风疹综合征(congenital rubella syndrome,CRS)等严重后果,因此WHO建议整合麻疹和风疹的控制和消除工作,并于2012年正式确立了消除风疹的目标,目前该计划已列入了《2021—2030年全球麻疹和风疹战略框架》[1]。作为WHO西太平洋区(WHO Western Pacific Region,WPRO)最大的成员国,中国应加快风疹消除的进程,因此本文就我国目前风疹控制和消除进展以及所面临的机遇和挑战加以综述。
风疹是一种急性呼吸道传染病,在我国法定报告传染病中被归类为丙类传染病[2],患者感染后临床症状轻微,以皮肤出疹、低热、局部淋巴肿大等为主,并发症较少;但是由于其病原体风疹病毒RV属于致畸性病原体,如体内无保护性抗体的妊娠期妇女在妊娠早期感染RV,其结果可导致流产或者死胎,或使得新生儿出生后表现为CRS[3]。根据估算数据,在世界范围内每年约有10.5万例CRS患儿出生[4, 5]。由于目前尚无针对CRS的临床治疗手段[6],一旦感染将会造成不可逆的损伤,为患儿家庭和社会都带来了严峻负担。然而,由于我国至今未开展全国CRS监测,因此CRS相关数据极少。
WHO将消除风疹定义为,基于监测网络系统运行良好的状态下,所在国家或地区内至少12个月未监测到本土RV的传播。当该国家或地区持续36个月无本土风疹病例报告时,可提交地区证实委员会进行消除风疹证实[7]。
风疹消除目标是2012年在第65届世界卫生大会上首先被提出的,初期目标为2020年WHO六个区域中的至少五个区域能够实现消除风疹,该决议同时被纳入《2012—2020年全球疫苗行动计划》中。在此之后,欧洲区、美洲区和东南亚区确立了消除风疹和CRS的目标[8, 9],而我国所在的WPRO于2014年地区委员会会议上明确提出建立本地区风疹消除的目标,之后于2017年10月,WPRO地区委员会通过决议,即“敦促该区域所有成员国尽快消除风疹”[10]。2021年,WHO发布了《2021—2030年全球麻疹和风疹战略框架》[1],再次明确并设立了至2030年之前实现和维持区域性麻疹和风疹消除的目标。
根据WHO最新数据统计,全球已有83个国家和地区证实消除风疹[5],而在WHO各区域中仅美洲区于2015年正式宣布消除风疹和CRS[11],WPRO中已有澳大利亚、新西兰、韩国、文莱四国,以及中国澳门、中国香港地区证实消除风疹[12, 13, 14]。目前能有效预防RV感染和CRS发生的唯一措施是接种含风疹成分的疫苗(rubella containing vaccine,RCV)[15]。截至2020年,194个国家和地区中已有173个将RCV纳入国家免疫计划,全球婴幼儿RCV覆盖率已上升至约70%[16]。除此之外,全球风疹报告病例数也有较大程度降低,与2000年的670 894例相比,2018年全球风疹报告病例数下降了约96%。以上数据充分证实了风疹消除的可行性。
高水平的风疹疫苗免疫覆盖率可以确保建立人群中针对风疹病毒的免疫屏障,进而阻断病毒的传播,是消除风疹的关键环节之一。2008年起我国正式将风疹疫苗纳入我国扩大免疫规划,并在全国逐步推行婴幼儿二剂次常规疫苗免疫接种。我国目前使用的RCV主要为国产的BRDII疫苗株,进口的RA27/3疫苗株虽然在全球其他国家广泛使用,而我国在2010年后已较少使用,经相关研究证明两者具有相当的免疫原性。BRDII疫苗株自我国20世纪70年代流行的2A基因型野毒株减毒而来,该疫苗于1993年正式获批后被广泛使用[17],对我国控制RV感染和预防CRS发生起到了重要作用[17, 18, 19]。
RCV在20世纪90年代开始作为二类疫苗推广使用,仅部分省份开展有偿的RCV接种服务,免疫策略也不尽相同[20, 21]。因此,在RCV尚未正式纳入我国扩大免疫计划(expanded programme on immunization,EPI)之前,全国人群疫苗免疫覆盖率相对较低(<50%)[20]。
在2008年RCV正式纳入EPI之后,在全国范围内对适龄儿童开展2剂次免费常规免疫接种服务,其中8月龄和18月龄各接种1剂次[22]。然而,在该策略实行的早期由于RCV供应有所缺乏,致使疫苗接种率并不理想,据估算2008年第一剂次RCV(RCV1)和第二剂次RCV(RCV2)的免疫覆盖率仅分别为51.5%和39.0%。随着RCV常规免疫逐步覆盖全国,免疫接种服务不断完善,疫苗免疫覆盖率逐年攀升,在2012年后RCV1和RCV2均持续维持在95%以上的水平,其中2014年免疫覆盖率最高约为99%[17]。持续多年的高水平疫苗免疫覆盖率为我国控制和消除风疹打下了坚实基础。
风疹自1989年起被列为我国传染病防治法中所规定的法定报告丙类传染病,在2004年之前主要以我国145个县作为监测点开展哨点监测,该监测共覆盖了110万人口(约占当时中国总人口的1%)。自2004年,风疹开始进入全国疾病监测信息管理系统,该系统采用从下至上的报告制度,由检测确诊的地方医院和县级疾病预防控制中心收集个案病例监测数据,随后逐级上报至中国疾病预防控制中心。2009—2013年,在WHO的建议和支持下,卫生部在黑龙江和山东两省试点开展了为期四年的风疹和CRS监测项目[21],为我国在开展风疹以及CRS监测和控制积累了一定的工作经验。2012—2013年,卫生部与WHO选择湖北作为试点省份实施了为期1年的麻疹和风疹联合监测项目。在获得整合麻疹和风疹监测的工作经验后,2014年根据WHO WPRO发布的“消除麻疹现场指南”的建议[23],风疹被正式纳入了全国麻疹监测系统,明确规定各省份应开展基于病例且有实验室检测支持的麻疹和风疹监测[17];同年,作为血清学病例诊断证据的补充,核酸检测推广至地市级实验室。在风疹纳入全国麻疹监测系统后,所有监测指标均维持在较高水平[17]。流行病学监测系统的高质量运转成为风疹控制和消除的必要前提条件。
流行病学监测数据显示,在RCV正式纳入我国EPI之前,风疹处于自然流行的状态,自然流行周期为7~8年(流行高峰分别为1993—1994年、2001年和2008年)。随着RCV常规免疫在全国的逐步推进,流行周期有所延长,报告病例数与发病率呈逐年下降趋势,至2017年达到历史最低水平(1 669例,0.12/10万)。然而,2018年由输入基因型引起了我国部分省份的风疹发病率回升,并在2019年引起了全国范围的暴发流行(32 520例,2.33/10万)。随后在2020年新冠疫情严格的管控措施影响下,风疹发病再次下降至较低水平(2 505例;0.18/10万)[24](图1)。2005—2013年,实验室确诊病例所占比例仅为14%,而在2014年风疹纳入全国麻疹监测系统后,该比例上升至42%,并自2015年一直维持在80%左右[17],实验室监测敏感性的提升为我国风疹控制和消除工作提供了一定保障。
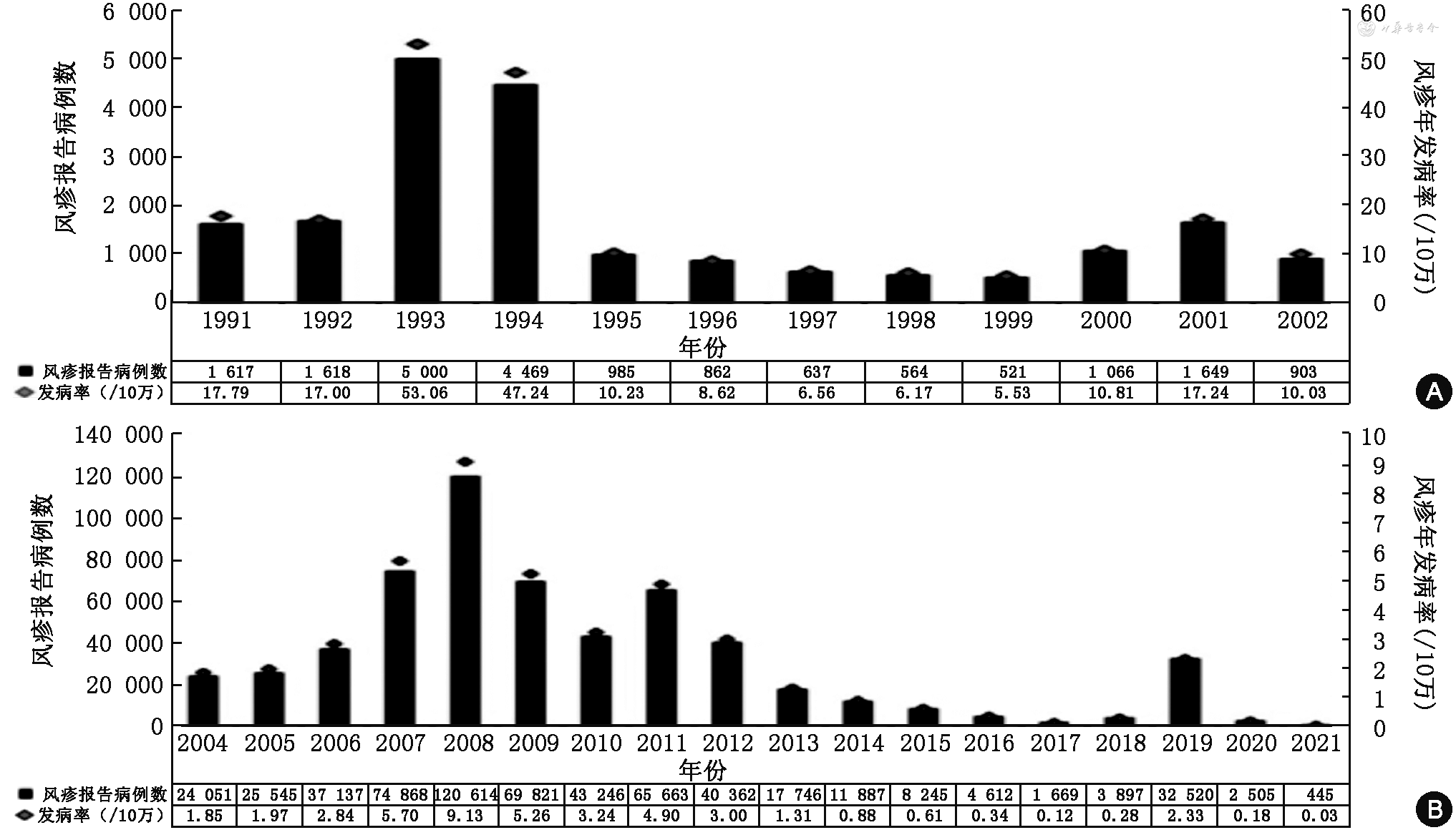

注:2021年为1—5月份数据。不包括中国香港、澳门、台湾数据
除2020年受到新型冠状病毒疫情影响外,2004—2019年风疹发病呈现出显著的季节性分布特征,每年3—6月份为发病高峰期,而12月份会再次出现小幅回升(图2)。在年龄分布上(图3),<10岁年龄组儿童风疹发病比例呈整体下降趋势,从2004年的47.2%逐渐下降至2019年的3.2%,2020年稍有回升(15.6%);10~29岁年龄组青少年和成年人发病比例自2004年的49.1%逐年上升至2007—2008年的66.5%,随后一直维持在>50%的水平,然而该比例在2017年后迅速上升超过70%,并在2018—2019年风疹复发和暴发中成为最主要的发病人群,其中2019年所占比例最高为87.6%。监测数据显示,报告的风疹病例中85%以上均未接种过RCV或RCV免疫史不详[24, 25]。以上数据均表明,我国风疹发病年龄整体后移,这与我国风疹疫苗普及相对较晚,早期的疫苗接种率较低有关。有研究数据显示,儿童中较低的RCV疫苗免疫覆盖率可引起RV传播动力学的改变,使得风疹发病逐渐向大年龄组人群转移,因而会导致育龄期妇女在内的成年人中易感染者比例增大,从而增加CRS发生的风险[26]。
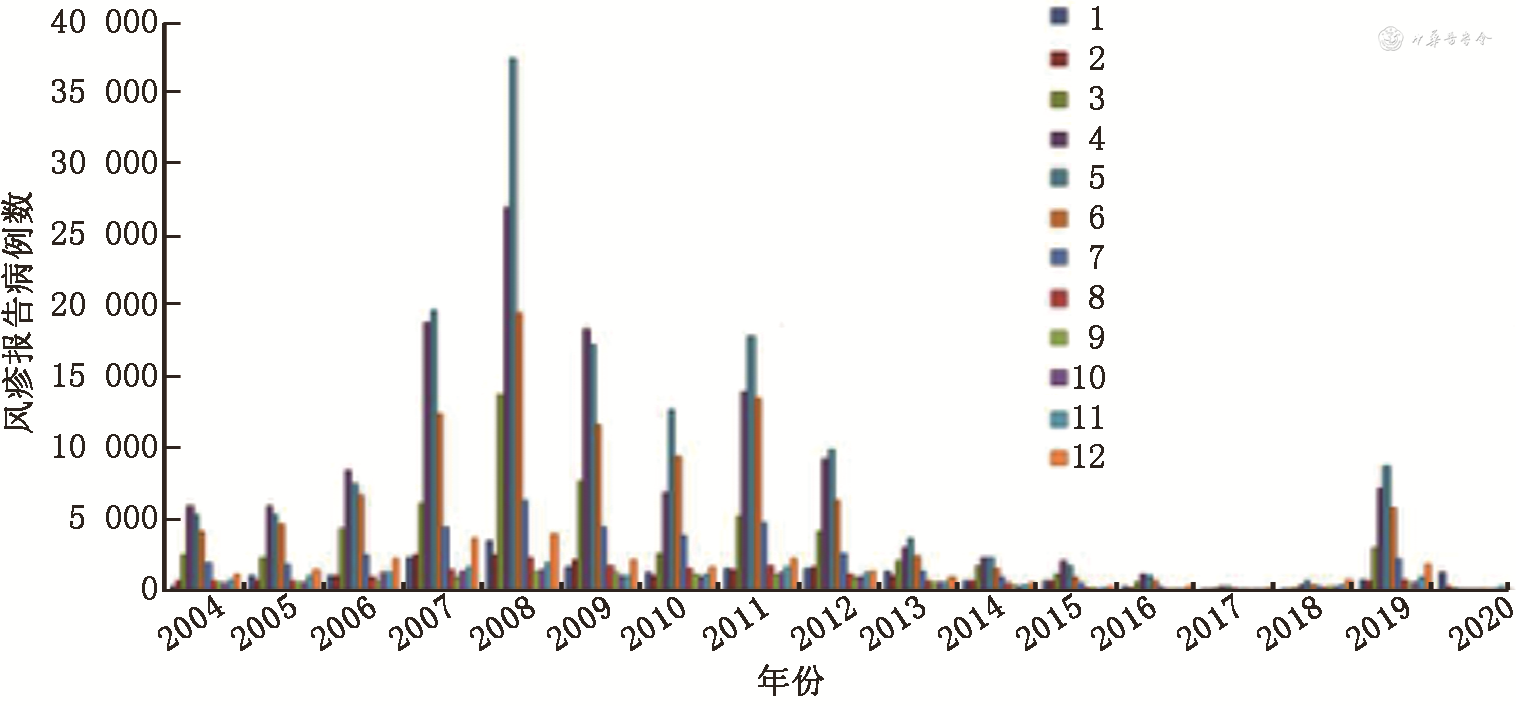

注:不包括中国香港、澳门、台湾数据


注:不包括中国香港、澳门、台湾数据
基于病例的实验室监测在风疹控制和消除进程中起着关键作用,WHO发布的证实麻疹和风疹消除的框架文件中包含了三个必要的证实标准[27],分别是至少36个月无本土风疹病例报告,高质量的监测体系,以及病毒学监测数据证实无本土RV的流行,其中后两项与实验室监测密切相关。
为了对麻疹和风疹监测提供高质量支持,WHO于2000年建立了全球实验室网络-覆盖了191个国家的全球麻疹和风疹实验室监测网络(Global Measles and Rubella Laboratory Network,GMRLN)[28],其包含了703个实验室网络,在确诊感染病例、追踪病毒传播,证实消除等环节起到了至关重要的作用[29]。在中国卫生部的支持下,我国国家麻疹实验室于2001年正式成立,2003年被WHO认证成为麻疹和风疹WPRO参比实验室,随后在国家和各省市疾控中心支持和配合下,逐步建立了麻疹和风疹实验室三级监测网络,其由1个国家级实验室、32个省级实验室以及339个地市级实验室组成,部分省市还扩展至县级实验室,网络实验室数量占到了GMRLN的50%以上[30]。全国实验室网络承担着标本采集,疑似病例的实验室检测确诊,病毒学监测等职责,高效运转的实验室监测网络为我国控制和消除麻疹提供了重要的技术保障[31]。
RV是一类高传染性的呼吸道病毒,是马氏病毒科风疹病毒属的成员之一。病毒核衣壳内包含有单股正链RNA(基因组全长约9762nt)[32],包含两个开放阅读框,分别编码非结构蛋白P150和P90,以及结构蛋白C、E1和E2,WHO将E1基因中的739个核苷酸片段(8731-9469nt)作为基因型划分和病毒学监测的靶基因[33, 34]。RV仅有1个血清型,基于靶基因序列可划分为13个基因型(1a,1B,1C,1D,1E,1F,1G,1H,1I,1J,2A,2B、2C),如今全球主要流行基因型是1E和2B基因型,且地理分布较为广泛[28],因此仅使用WHO基因分型方法已无法满足现阶段病毒溯源的需求。随后有研究者提出了基因亚型的分析方法,建议将1E和2B基因型进一步划分为基因亚型[35],分别为1E-L0,1E-L1,1E-L2,1E-L3,1E-L4;2B-L0,2B-L1,2B-L2a,2B-L2b,2B-L2c,2B-L3,2B-L4。
对风疹进行病毒学监测,可以通过分析毒株基因序列从而追溯病毒的来源,掌握病毒的流行和传播模式,证实病毒传播的阻断。1999年起我国开始实行风疹病毒学监测,随着数据的积累逐渐建立起我国流行风疹病毒毒株库和病毒基因序列数据库。截至2020年,国家麻疹风疹实验室从全国29个省份共获得风疹病毒株近5 400株,共监测到4个基因型,分别为1F和2A基因型,以及1E基因型(1E-L1、1E-L2亚型)、2B基因型(2B-L1、2B-L4和2B-L2c亚型),其中4株2A基因型RV株均来源于疫苗相关病例[36, 37];2B-L4基因亚型仅2000和2008年分别在安徽、山东和海南三个省份零星检测到[38, 39]。
通过对1999—2020年间我国流行RV变异变迁规律研究,结果提示,在过去22年间我国流行RV发生了三次基因型/亚型的转换:(1)第一次基因型更替发生在2001—2002年风疹流行期,1E-L1基因亚型在2001年首次检测到后迅速取代之前流行的1F基因型,成为2002年后的绝对优势本土流行基因型别[40, 41, 42],而1F基因型自2002年后未再被监测到[43, 44]。(2)随着2B-L1于2011年输入我国后,该病毒在我国自东向西快速蔓延并逐渐覆盖全国,其检出比例也从2011年的11.8%逐年上升至2015—2016年间的90%以上,2016年之后全国各省未再检出1E-L1基因亚型,此为第二次基因亚型更替,即2B-L1基因亚型完全取代1E-L1基因亚型在我国广泛流行,与此同时,随着1E-L1基因亚型的消失,我国风疹发病率也在2017年降至最低。(3)2B-L1基因亚型的流行状态并不稳定,在我国经历了一段极速扩张期后,自2016年后其在我国的传播链呈逐渐下降趋势,至2019年上半年仅在5个省份监测到2个传播链,之后未再检出。同时,输入性1E-L2和2B-L2c基因亚型分别于2018年先后在我国广西(1月份)和四川(8月份)首次监测到,之后在我国迅速扩张并形成了稳定的本土传播,这两个基因亚型的共循环成为导致2018年风疹发病回升和2019年暴发流行的重要原因,因此我国流行RV在2018—2019年间第三次完成了基因亚型的更替,这两个基因亚型在我国流行的时间和地理分布上具有一定的重叠性(图4)。以上风疹流行基因型转换的现象在其他国家也有所报道,如美国[45]、意大利[46]等。


注:不包括中国香港、澳门、台湾数据
分析我国流行RV频繁发生转换可能有以下三个原因:(1)自2012年以来,我国常规婴幼儿二剂次免疫覆盖率一直保持在较高的水平(>95%),在一定程度上提升了群体免疫力同时也削减了易感人群的数量,使得流行病毒(如1E-L1和2B-L1基因亚型)的传播链逐渐减少并进一步被阻断。(2)基因型/亚型的更替伴随着风疹的流行(如2001—2002年风疹的流行和2018—2019年风疹的复合和暴发),当新的基因型/亚型经境外输入至某一地区后,如果其易感宿主竞争力较本土流行株更为强势时,就可能取代劣势株成为新的本土流行株,从而出现流行基因型/亚型的替换。(3)基因型转换与病毒输入的时机以及当时易感人群的分布密切相关。除以上因素,BRDII疫苗株是否能有效保护人群免受输入病毒感染有待进一步研究证实。
由于RCV在我国的有效推行,两剂次疫苗免疫覆盖率自2012年以来均达到95%以上,因此在人群中建立了一定的免疫屏障,从而使得我国本土流行RV逐渐被阻断(1E-L1和2B-L1基因亚型),我国风疹发病率从2008年的9.13/10万逐年下降至近年的0.20/10万以下,同时也降低了所有年龄组的风疹发病,显示了疫苗免疫直接或间接地保护了易感人群免受RV的感染。同时,流行病学监测和实验室监测两大监测网络的高效运转,也为风疹的控制和消除提供了有力保障。此外,自新冠病毒暴发流行以来,全国采取了一系列防控举措,也为我国风疹的控制和消除提供了良好的契机。
1. 针对重点人群,开展风疹疫苗接种,建立有效免疫屏障。数据显示,我国风疹发病年龄正在向后推移,10~29岁青少年和成年人发病比例逐渐增高。为了避免我国风疹再次发生暴发流行以及潜在的CRS发生风险,应尽早对该年龄组人群制订切实有效的补充免疫措施,同时各医疗机构也应积极开展RCV疫苗接种的宣教工作,以填补目标人群的免疫空白,构筑起消除风疹所需的有效免疫屏障,从而控制RV感染并进一步预防CRS的发生。
2. 维持高质量的风疹监测,加强风疹暴发疫情处置。在疫苗免疫保护下虽然有效阻断了本土流行病毒的传播,但是在易感人群的不断累积下,境外输入病毒的暴发流行引起了风疹发病的回升。因此,在强化传染病疫情报告制度以及维持高质量风疹监测的基础上,各省疾控部门提升暴发疫情的应急处置能力是非常必要的,做到在发现传染病疫情后,迅速采取有效措施阻断病毒的传播,防止疫情的扩散。
3. 建立并推进全国CRS监测系统。我国尚未开展CRS常规监测,因而至今仍缺乏CRS疾病负担的本底数据,因此各省疾控部门应基于本省风疹监测数据,RCV免疫策略和免疫覆盖率,以及血清流行病学调查结果全面开展CRS风险评估;同时,由于CRS 病例诊断依赖于经验丰富的医生,因此需要构建医防融合机制来建立并推进全国CRS监测工作,从而为风疹消除提供证据支持。
4. 在防控新冠疫情的同时,做好麻疹和风疹的免疫和监测。目前正值新型冠状病毒疫情全球大流行,我国也面临着外防输入和内防反弹的巨大防控压力,因此对于MMR常规免疫接种和病例监测等工作可能会造成一定的影响,进而会阻碍麻疹消除目标的进程,而由于麻疹消除和风疹控制工作是整合在一起的,使得风疹的控制和消除工作也会面临一定的挑战。因此在防控新冠疫情的同时,需要同时做好麻疹和风疹的免疫和监测等工作。
综上所述,我国正在向风疹消除目标迈进,然而为了进一步有效阻断RV在人群中的传播,在持续保持常规RCV的高免疫覆盖率的基础上,应根据监测实情针对免疫空白人群科学制定补充免疫策略;在维持高敏感性高质量运转的风疹监测同时,应进一步提升应对暴发疫情的处置能力;同时,急需构建医防融合机制来开展CRS监测,进而才能加速实现我国风疹和CRS的消除进程。
所有作者均声明不存在利益冲突



























