
观察肝硬化合并自发性细菌性腹膜炎(SBP)患者外周血和腹水中固有淋巴样细胞(ILC)亚群的变化。
收集2019年11月至2020年11月在驻马店市中心医院住院的62例肝硬化患者的病例资料,其中肝硬化合并单纯腹水41例(单纯腹水组),肝硬化合并SBP 21例(SBP组),同时收集同期进行健康查体的对照者20名(健康对照组)。所有患者和对照者采集外周血,分离外周血单个核细胞(PBMC),肝硬化患者常规穿刺获取腹水,分离腹水单个核细胞,流式细胞术检测PBMC和腹水单个核细胞中ILC1、ILC2、ILC3亚群的比例变化。分选腹水中CD3-CD19-CD20-CD14-细胞(即lin-细胞),使用脂多糖(LPS)刺激培养24 h,实时定量PCR法检测lin-细胞中转录因子T-bet、GATA3和RORγt mRNA相对表达量,酶联免疫吸附试验检测培养上清中细胞因子水平。比较各组间外周血和腹水中ILC亚群的区别。
单纯腹水组男29例、女12例,年龄M(Q1,Q3)为49(33,78)岁,SBP组男12例、女9例,年龄50(37,76)岁,健康对照组男11名、女9名,年龄48(32,69)岁。三组外周血和腹水中均可检测到lin-CD45+CD161+CD127+ILC细胞,总ILC细胞占PBMC的比例在单纯腹水组、SBP组及健康对照组之间的差异无统计学意义(P=0.235)。总ILC占腹水单个核细胞的比例在单纯腹水组及SBP组之间的差异亦无统计学意义(P=0.232)。CD117-CRTh2-ILC1、CRTh2+ILC2、CD117+CRTh2-ILC3占外周血ILC的比例在单纯腹水组、SBP组及健康对照组之间的差异均无统计学意义(均P>0.05)。SBP组ILC1占腹水ILC的比例高于单纯腹水组(35.69%±3.39%比26.40%±3.85%,P<0.001),而ILC2占腹水ILC的比例低于单纯腹水组(36.83%±7.70%比48.35%±9.45%,P<0.001),ILC3占腹水ILC的比例在两组间的差异无统计学意义(P=0.230)。SBP组腹水lin-细胞经LPS刺激后T-bet mRNA相对表达量和干扰素(IFN)-γ分泌水平均高于单纯腹水组(均P<0.001),GATA3 mRNA相对表达量、白细胞介素(IL)-5/IL-13分泌水平均低于单纯腹水组(均P<0.05),lin-细胞中RORγt mRNA相对表达量、IL-17/IL-22分泌水平在两组之间的差异均无统计学意义(均P>0.05)。
肝硬化合并SBP患者外周血中ILC亚群比例无变化,腹水中ILC1细胞比例升高,ILC2细胞比例降低。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝硬化所致的机体免疫功能不全和致病菌移位增加了肝硬化失代偿期患者的感染风险。细菌感染是肝硬化患者最严重和致命的并发症之一,细菌感染可诱导机体系统性炎症应答,造成氧化应激和线粒体功能不全,诱发慢加急性肝衰竭发生[1, 2]。肝硬化失代偿期患者感染后容易导致自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP),但由于缺乏典型临床表现,早期诊断困难,在重症病例中可迅速发展为感染性休克,造成循环衰竭,导致患者死亡[3]。固有淋巴样细胞(innate lymphoid cells,ILC)是新近鉴定的一类固有免疫细胞,不表达T淋巴细胞和B淋巴细胞抗原受体,主要位于组织器官中,发挥抗感染、黏膜屏障构建、调控机体炎症应答、协调适应性免疫应答等多种功能[4]。ILC分为ILC1、ILC2和ILC3等三个亚群,不同亚群在肝脏疾病中发挥的功能亦有差异[5, 6]。鉴于固有免疫细胞在肝硬化发病中的重要调控作用,本研究检测了肝硬化合并SBP患者外周血和腹水中ILC亚群的变化。
横断面研究。纳入2019年11月至2020年11月在驻马店市中心医院住院的62例肝硬化患者,其中肝硬化合并单纯腹水41例(单纯腹水组),肝硬化合并SBP 21例(SBP组);纳入标准:(1)年龄>18岁;(2)影像学检查发现中至大量腹水;(3)单纯腹水诊断标准:腹水中性粒细胞计数<250×106/L且腹水培养阴性。SBP诊断标准:腹水中性粒细胞计数>250×106/L,或腹水培养阳性,排除腹腔内的、可手术治疗的感染来源[7]。排除标准:(1)合并人类免疫缺陷病毒感染;(2)合并恶性肿瘤;(3)合并自身免疫性肝炎、原发性胆汁性胆管炎、原发性硬化性胆管炎、系统性红斑狼疮、类风湿性关节炎等免疫性疾病;(4)合并妇科疾病等非肝脏疾病造成的腹水;(5)妊娠及哺乳期妇女。所有肝硬化腹水患者在入院后常规进行腹腔穿刺放腹水,腹水送检常规、生化和培养。所有患者在进行腹腔穿刺前均未接受抗感染治疗。同时纳入20名在驻马店市中心医院体检中心进行查体的健康者作为健康对照组。本研究通过驻马店中心医院伦理委员会审批(编号:2019市医伦理07012号),所有患者和对照者均签署知情同意书。
1. 主要试剂和仪器:人Ficoll淋巴细胞分离液、Percoll密度梯度分离液、脂多糖(lipopolysaccharide,LPS)均购自美国Sigma公司,RPMI1640培养液和胎牛血清均购自美国Gibco公司,抗lineage(lin,包含CD3/CD19/CD20/CD14)-藻红蛋白(PE)、抗CD45-异硫氰酸荧光素酯(FITC)、抗CD161-别藻蓝蛋白(APC)、抗CD127-藻红蛋白 Cy7(PE Cy7)、抗CD117-多甲藻黄素-叶绿素-蛋白质复合物 Cy5.5(PerCP Cy5.5)、抗辅助性T细胞2趋化因子受体同源分子(CRTh2)-藻红蛋白德克萨斯红(PE Texas Red)均购自美国BD公司,Trizol试剂购自美国Invitrogen公司,PrimeScript反转录试剂盒、TB Green实时定量PCR检测试剂盒均购自北京TaKaRa生物技术公司,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉华美公司。FACS Aria Ⅱ流式细胞仪为美国BD公司产品,ABI7500实时定量PCR仪为美国Applied Biosystems公司产品,全自动酶标仪为美国BioRad公司产品。
2. 外周血单个核细胞(PBMC)的分离:所有患者和对照者均于清晨、空腹采集乙二胺四乙酸(EDTA)抗凝外周血10 ml,使用人Ficoll淋巴细胞分离液分离PBMC,加入RPMI1640+10%胎牛血清于37 ℃、5% CO2条件下培养。
3. 腹水中单个核细胞的分离:患者常规进行腹腔穿刺术获取腹水,将腹水于4 ℃、364 × g离心10 min,收集沉淀的细胞,使用Percoll密度梯度分离液分离腹水中的单个核细胞,加入RPMI1640+10%胎牛血清于37 ℃、5% CO2条件下培养。
4. 流式细胞术检测:PBMC或腹水中获取的单个核细胞转入FACS管中,使用磷酸盐缓冲液(PBS)洗涤2次,然后加入抗lin-PE、抗CD45-FITC、抗CD161-APC、抗CD127-PE Cy7、抗CD117-PerCP Cy5.5、抗CRTh2-PE Texas Red各5 μl,同时设立同型对照,4 ℃、避光孵育30 min,然后使用PBS洗涤2次,加入含4%多聚甲醛的PBS溶液固定后上机。使用CellQuest Pro软件获取细胞,使用FlowJo V10软件分析结果。
5. PBMC和腹水单个核细胞中ILC1、ILC2和ILC3的亚群分析:首先利用前向角(FSC)和侧向角(SSC)对单个核细胞圈门,在单个核细胞中根据lin和CD45的表达水平筛选出lin-CD45+的细胞,在lin-CD45+细胞中根据CD161和CD127的表达筛选出CD161+CD127+细胞,lin-CD45+CD161+CD127+细胞即为ILC[8]。在ILC细胞中,根据CD117和CRTh2的表达情况,将ILC分为3个亚群[8]:ILC1为CD117-CRTh2-,ILC2为CRTh2+,ILC3为CD117+CRTh2-。
6. lin-细胞的分选和培养:使用抗lin-PE抗体对10例肝硬化合并单纯腹水和10例肝硬化合并SBP患者腹水单个核细胞进行染色(每例患者需约5 000 ml腹水),使用FACS Aria Ⅱ流式细胞仪对PE染色阴性的细胞进行分选,即为lin-细胞。向lin-细胞中加入LPS(1 μg/ml)刺激培养24 h,收集细胞和上清。
7. 实时定量PCR法检测lin-细胞中ILC1转录因子T-bet、ILC2转录因子GATA3和ILC3转录因子RORγt mRNA:使用Trizol试剂提取lin-细胞中的总RNA。取1 μg总RNA,使用PrimeScript反转录试剂盒将总RNA反转录为cDNA,使用TB Green实时定量PCR检测试剂盒对转录因子T-bet、GATA3和RORγt mRNA进行检测,以β-肌动蛋白作为内参照,采用2-ΔΔCT法进行半定量分析。实时定量PCR引物序列见表1。

实时定量PCR引物序列
实时定量PCR引物序列
| 引物名称 | 序列 |
|---|---|
| T-bet上游 | 5′-CGGCTGCATATCGTTGAGGT-3′ |
| T-bet下游 | 5′-GTCCCCATTGGCATTCCTC-3′ |
| GATA3上游 | 5′-TCATTAAGCCCAAGCGAAGG-3′ |
| GATA3下游 | 5′-GTCCCCATTGGCATTCCTC-3′ |
| RORγt上游 | 5′-GCAGCGCTCCAACATCTTCT-3′ |
| RORγt下游 | 5′-ACGTACTGAATGGCCTCGGT-3′ |
| β-肌动蛋白上游 | 5′-GCATGGGTCAGAAGGATTCCT-3′ |
| β-肌动蛋白下游 | 5′-TCGTCCCAGTTGGTGACGAT-3′ |
8. ELISA法检测干扰素(IFN)-γ、白细胞介素(IL)-5、IL-13、IL-17和IL-22:使用ELISA检测试剂盒对培养上清中IFN-γ、IL-5、IL-13、IL-17和IL-22水平进行检测。
9. 统计学分析:所有数据均采用SPSS 21.0软件进行分析。符合正态分布的计量资料以表示,采用独立样本t检验进行两组间比较,单因素方差分析进行多组间比较。不符合正态分布的计量资料以M(Q1,Q3)表示,采用Mann-Whitney检验进行两组间比较。采用率和频数描述定性资料,使用χ²检验进行比较。相关性分析采用Spearman检验。双侧检验,检验水准α=0.05。
1. 一般情况:各组的一般情况见表2。SBP组均出现发热或腹痛症状,腹水镜检可见脓球,且在腹水培养中检测到致病菌,其中大肠埃希菌17例、肺炎克雷伯菌2例、铜绿假单胞菌2例,所有致病菌均对碳青霉烯类抗生素敏感,使用美罗培南或亚胺培南西司他丁钠抗感染治疗后SBP症状好转。
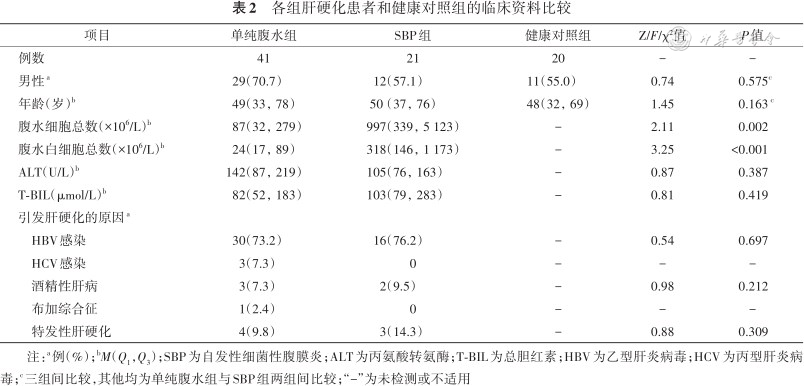
各组肝硬化患者和健康对照组的临床资料比较
各组肝硬化患者和健康对照组的临床资料比较
| 项目 | 单纯腹水组 | SBP组 | 健康对照组 | Z/F/χ²值 | P值 |
|---|---|---|---|---|---|
| 例数 | 41 | 21 | 20 | - | - |
| 男性a | 29(70.7) | 12(57.1) | 11(55.0) | 0.74 | 0.575c |
| 年龄(岁)b | 49(33,78) | 50(37,76) | 48(32,69) | 1.45 | 0.163 c |
| 腹水细胞总数(×106/L)b | 87(32,279) | 997(339,5 123) | - | 2.11 | 0.002 |
| 腹水白细胞总数(×106/L)b | 24(17,89) | 318(146,1 173) | - | 3.25 | <0.001 |
| ALT(U/L)b | 142(87,219) | 105(76,163) | - | 0.87 | 0.387 |
| T-BIL(μmol/L)b | 82(52,183) | 103(79,283) | - | 0.81 | 0.419 |
| 引发肝硬化的原因a | |||||
HBV感染 | 30(73.2) | 16(76.2) | - | 0.54 | 0.697 |
HCV感染 | 3(7.3) | 0 | - | - | - |
酒精性肝病 | 3(7.3) | 2(9.5) | - | 0.98 | 0.212 |
布加综合征 | 1(2.4) | 0 | - | - | - |
特发性肝硬化 | 4(9.8) | 3(14.3) | - | 0.88 | 0.309 |
注:a例(%);bM(Q1,Q3);SBP为自发性细菌性腹膜炎;ALT为丙氨酸转氨酶;T-BIL为总胆红素;HBV为乙型肝炎病毒;HCV为丙型肝炎病毒;c三组间比较,其他均为单纯腹水组与SBP组两组间比较;“-”为未检测或不适用
2. 肝硬化患者外周血中ILC亚群的变化:外周血中lin-CD45+CD161+CD127+ILC占PBMC的比例在单纯腹水组、SBP组及健康对照组之间的差异无统计学意义(13.13%±2.84%比13.66%±3.57%比12.04%±3.10%,F=1.48,P=0.235),ILC1占PBMC的比例单纯腹水组、SBP组及健康对照组之间的差异无统计学意义(29.18%±7.34%比29.51%±7.95%比30.23%±7.90%,F=0.13,P=0.880),ILC2占PBMC的比例在单纯腹水组、SBP组及健康对照组之间的差异无统计学意义(43.67%±10.24%比41.72%±9.49%比40.78%±9.44%,F=0.66,P=0.521),ILC3占PBMC的比例在单纯腹水组、SBP组及健康对照组之间的差异无统计学意义(28.13%±9.02%比28.77%±8.27%比28.99%±7.73%,F=0.08,P=0.921)。肝硬化患者PBMC中ILC比例与ALT(r=0.140,P=0.279)、T-BIL(r=0.136,P=0.293)均无相关性。
3. 肝硬化患者腹水中ILC亚群变化:腹水中ILC占腹水单个核细胞的比例在单纯腹水组和SBP组之间的差异无统计学意义(12.27%±2.29%比13.22%±3.94%,t=1.21,P=0.232)。腹水中ILC1占腹水单个核细胞的比例在SBP组高于单纯腹水组(35.69%±3.39%比26.40%±3.85%,t=9.36,P<0.001)。ILC2占腹水单个核细胞的比例在SBP组(36.83±7.70%)低于单纯腹水组(36.83%±7.70%比48.35%±9.45%,t=4.823,P<0.001)。ILC3占腹水单个核细胞的比例在SBP组和单纯腹水组之间的差异无统计学意义(27.48%±5.80%比25.25%±7.29%,t=1.21,P=0.230)。肝硬化患者腹水中ILC比例与ALT(r=0.053,P=0.681)、T-BIL(r=-0.118,P=0.374)均无相关性。
4. SBP组腹水中lin-细胞转录因子表达和细胞因子分泌变化:SBP组腹水lin-细胞经LPS刺激后,转录因子T-bet mRNA相对表达量高于单纯腹水组(1.77±0.41比1.03±0.12,t=5.50,P<0.001),转录因子GATA3 mRNA相对表达量低于单纯腹水组(0.88±0.12比1.10±0.15,t=3.63,P=0.002),RORγt mRNA相对表达量在单纯腹水组和SBP组lin-细胞中的差异无统计学意义(1.06±0.13比1.08±0.15,t=0.32,P=0.754)。LPS刺激后,SBP组腹水lin-细胞分泌IFN-γ的水平高于单纯腹水组,IL-5和IL-13的分泌水平低于单纯腹水组,IL-17和IL-22水平在单纯腹水组和SBP组之间的差异无统计学意义(表3)。

各组肝硬化患者腹水lin-细胞分泌细胞因子水平的比较(ng/L,)
各组肝硬化患者腹水lin-细胞分泌细胞因子水平的比较(ng/L,)
| 项目 | 单纯腹水组 (n=10) | SBP组 (n=10) | t值 | P值 |
|---|---|---|---|---|
| IFN-γ | 95.55±17.85 | 133.5±23.88 | 4.03 | <0.001 |
| IL-5 | 60.90±9.78 | 47.30±14.41 | 2.47 | 0.024 |
| IL-13 | 300.80±54.77 | 237.00±54.93 | 2.60 | 0.018 |
| IL-17 | 63.90±9.57 | 70.30±11.65 | 1.34 | 0.196 |
| IL-22 | 279.50±50.56 | 257.70±38.38 | 1.09 | 0.292 |
注:SBP为自发性细菌性腹膜炎;IFN为干扰素;IL为白细胞介素;仅纳入单次腹水量>5 000 ml的患者,每组10例
目前认为肝硬化是一种多系统性疾病,主要由于进展性肝病所致的炎症应答诱发。肝硬化患者容易罹患细菌感染,可能导致急性失代偿或慢加急性肝衰竭,短期死亡率极高。固有免疫细胞是机体防御微生物感染的第一道防线,肝脏内巨噬细胞和肥大细胞活化可发挥促进炎症应答和促进血管通透性的作用,诱导中性粒细胞、淋巴细胞、嗜酸性粒细胞、单核细胞等多种炎症细胞向肝脏的募集浸润,促进肝脏炎症损伤。但是,随着肝硬化病程进展,外周血中性粒细胞和单核细胞抗感染功能逐渐降低,进而促进疾病进展[9]。但固有免疫应答功能障碍在肝硬化患者中的作用和机制及其复杂,且尚未完全阐明。
ILC是新近鉴定的一类固有免疫细胞,根据其表面标志和功能的不同分为ILC1、ILC2和ILC3亚群,分别在转录因子T-bet、GATA3和RORγt的作用下,分别以分泌IFN-γ、IL-5/IL-13、IL-17/IL-22等因子,发挥相应生物学活性[10]。不同ILC亚群在多种组织器官的纤维化过程中发挥不同的免疫调控作用。肝脏中的ILC1可通过分泌多种促炎因子促进非酒精性脂肪性肝病和慢性乙肝疾病进展,诱导肝纤维化甚至肝硬化发生[11, 12],并可发挥抗病毒和抗细菌感染活性[13]。有研究发现,ILC2可通过分泌IL-5和IL-13促进嗜酸性粒细胞功能,诱导肝星状细胞分泌IL-10和转化生长因子-β,促进肝纤维化发生[14]。然而,心脏中的ILC2可通过分泌IL-33发挥免疫调控作用,改善和缓解心肌损伤诱导的心脏纤维化[15]。因此,ILC2在纤维化中发挥的作用可能与其所处的组织微环境密切相关。与之相似的是,ILC3在四氯化碳诱导的小鼠肝纤维化模型中发挥促进纤维的作用[16],但在高脂饮食诱导的小鼠脂肪性肝炎模型中,ILC3可通过分泌IL-22发挥增强肝脏脂类代谢、抑制凋亡的活性[17]。虽然ILC主要定植在黏膜组织中,但既往的研究发现,外周血中亦存在ILC[8,18],本研究结果也表明,外周血ILC亚群在健康对照和肝硬化患者之间的差异无统计学意义,ILC比例与肝硬化患者肝功能亦无显著相关性。因此,尚不能确定ILC是否参与了肝硬化的疾病进程。
肝硬化腹水患者容易罹患细菌感染,而由于肠道菌群移位造成革兰氏阴性菌感染所致的SBP是肝硬化腹水患者最常见的感染并发症[3]。本研究对腹水中的ILC进行了检测,肝硬化患者腹水中存在ILC,腹水中的ILC可能来源于腹膜生理性渗出、门静脉高压造成的血管通透性升高以及SBP造成的外周炎症细胞募集浸润和肠道黏膜原位ILC的移位。ILC比例在单纯腹水和合并SBP患者之间无明显差异,且腹水ILC比例与患者肝功能亦无显著相关性。但不同ILC亚群在肝硬化合并单纯腹水及合并SBP患者中存在差异。细菌感染所致的腹膜炎可诱导腹水中ILC1比例升高,ILC2比例降低,ILC3比例无变化,这一结果亦通过检测转录因子表达和细胞因子分泌加以证实。这说明急性感染可能诱导了肝硬化患者ILC1细胞比例升高,通过分泌IFN-γ发挥抗感染和诱导炎症应答的活性,在清除细菌感染的同时也可能造成炎症损伤,而ILC2细胞比例降低,但ILC2在肝硬化合并SBP中的作用尚不清楚。
本研究存在一定的局限性,首先,ILC作为新近鉴定的固有免疫细胞亚群,对其表面标志的研究尚存在一定争议。Trabanelli等[18]认为CD161并非在所有ILC中具有表达,不能将CD161作为ILC鉴定的标志。但Mazzurana等[8]则发现,大多数NKG2A-细胞并不表达转录因子Eomes但却表达CD161,说明ILC与自然杀伤细胞可能是两类不同的细胞亚群。本研究采用CD161作为表面标志进行ILC鉴定。其次,本研究使用lin-(包括CD3-、CD19-、CD20-、CD14-)作为ILC分选标志,虽然在分选前已经对外周血和腹水中的单个核细胞进行了提取,去除了以粒细胞为主的多核细胞,lin-的单个核细胞中仍有少量非ILC存在。在人体标本获取数量伦理学因素的基础上,为获得有效数量的ILC,本研究仍采用lin-单个核细胞进行体外分析,亦可得到有效的结论。
综上,肝硬化合并SBP患者腹水中ILC1细胞比例升高,ILC2细胞比例降低。ILC亚群比例失调在肝硬化合并SBP患者清除细菌感染和诱导炎症损伤中可能发挥重要作用。
所有作者均声明不存在利益冲突



























