
神经重症医学作为新兴的神经病学和神经外科学亚专业,在中国的发展面临许多挑战。缺乏主题创新、设计合理及实施规范的临床研究是亟待解决的“瓶颈”问题。为解决这些问题,多学科专家学者共同探讨目前神经重症学科发展和临床研究的局限性和面临的挑战,总结出六个主要的优先发展和研究方向,包括脑水肿发生机制、转归预测以及基于新靶点的治疗药物的研发;多模态神经功能监测指导下的个体化评估与管理;血管开通后再灌注损伤的防治;脑损伤后意识障碍的机制、评估及管理策略;神经重症医疗质量控制和可持续改进体系的建立;智能化神经重症诊疗体系建设。希望这些指导意见能够促进我国神经重症医学的发展,全面提升神经重症医疗服务质量。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经重症医学(neurocritical care medicine)作为新兴的神经病学和神经外科学亚专业,综合神经病学、神经外科学、重症医学、麻醉医学、急诊医学及神经影像、神经介入等多学科知识、技能,为神经系统疾病危重患者提供全面、系统和高质量的医学监护与救治。由于中枢神经系统结构和功能复杂,脑组织耐受缺血缺氧能力差,神经功能评价、监测方法多样,治疗干预手段复杂且有限,因此,神经系统急危症的管理要求更高的紧迫性、统筹性和协调性。这些专科特点催生了神经重症医学专业的出现和发展。研究显示,神经重症患者在神经重症监护室(neuro-intensive care unit,NICU)接受治疗,可以获得更好的远期临床转归。目前在欧美国家,收治神经危重症患者较多的医院,大多设有NICU。
但是,这一学科在中国的发展还面临许多挑战。首先,我国各地区NICU建设水平参差不齐、多种模式并存,缺乏规范化的亚专业培训和认证机制,缺少基于核心指标的神经重症医疗质量监测和可持续改进的体系;其次,面对大量的监测数据,缺乏信息整合平台,无法有效及时识别有意义的信息,进而利用多维度数据指导临床决策;第三,一些神经系统疾病的继发性损伤显著影响患者预后,但是现在尚不完全清楚这些继发性损伤的发病机制、病理生理学改变,缺乏有效干预措施。综合而言,缺乏主题创新、设计合理及实施规范的临床研究是亟待解决的“瓶颈”问题。
为响应“健康中国2030”规划纲要战略部署,把握“十四五”国家计划的开局有利时机,提升我国神经重症领域临床研究水平,并推动学科发展,特邀请全国神经重症医学、重症医学、神经病学、神经介入、神经影像、生物医学工程等领域的专家学者,共同探讨目前神经重症学科发展和临床研究的局限性和面临的挑战,并展望未来需要优先发展的研究方向。
1.背景及研究现状:脑水肿是常见的神经系统疾病并发症,可见于缺血性卒中、出血性卒中、创伤性脑损伤(traumatic brain injury,TBI)、脑肿瘤、颅内感染等疾病。脑水肿会引起局部或全脑血流和代谢异常,甚至导致脑疝,严重时危及生命。因此,如何准确预测脑水肿发生,如何有效预防和治疗,一直是神经重症领域的研究重点。迄今为止,所有针对脑水肿的治疗方法都以非特异性或间接的方式起作用。例如,渗透疗法(如甘露醇、高张盐水等)在水肿形成后清除组织间液,去骨瓣减压术(decompressive craniectomy,DC)[1]通过提供更多空间来减轻水肿的脑组织对重要脑结构的压迫。虽然渗透疗法已在临床上广泛应用;然而,对于不同类型和不同发病机制的脑水肿,这些药物的疗效仍然存在争议。有些研究甚至发现,渗透性药物的不恰当应用可能会加重脑水肿的进程。而且,多种因素限制了DC的应用范围,例如对于病情危重以及存在危及生命的合并症的患者无法实施,而且手术时机尚无定论[2]。因此,建立基于新型影像技术和生物学标记物的脑水肿预测模型,探索不同类型的脑水肿形成的分子生物学机制,研发针对新型干预靶点的治疗药物,是目前脑水肿诊疗研究的重要方向。
前期脑水肿早期预测模型研究显示,年龄越小、美国国立卫生院卒中量表(NIHSS)评分越高、血糖升高、中线移位的程度、基底池消失、CT上较大的脑实质低密度等是恶性水肿的可靠早期预测因子[3, 4, 5]。血管再通治疗可降低恶性脑水肿的风险。随着现代影像技术的发展,一些新技术如动态对比增强MRI可用于评估血脑屏障的通透性,具有预测脑水肿的潜力[6]。未来仍然需要建立包括新型影像学、生物学标记物对脑水肿的精准预测模型,并验证能否辅助临床决策,最终改善患者预后。
近期有关脑水肿新型干预靶点的研究主要包括:(1)脑脊液流入和水通道蛋白(aquaporins,AQPs)[7]:近年发现的脑淋巴系统是脑有害代谢产物清除途径之一,存在于血管旁间隙,主要由星形胶质细胞及其水通道蛋白-4(aquaporin-4,AQP-4)组成。脑脊液通过脑淋巴系统流入组织间隙可能是导致脑缺血后脑组织水肿的主要始动因素[8]。缺血性卒中后间质液清除效率降低,AQP-4在缺血性脑卒中后脑水肿中起着复杂的双重作用[9]。AQP-4抑制剂有望在未来治疗脑水肿的临床研究中显示较好的有效性及安全性。(2)磺酰脲受体-1(sulfonylurea receptor-1,SUR-1)调控的非选择性阳离子通道(nonselective cation channel)NCCa-ATP[10]:该通道是受细胞内钙和ATP调节的非选择性阳离子通道。SUR-1对磺酰脲类抑制剂(如格列本脲)敏感,在脑缺血和TBI动物模型中,使用格列本脲治疗可显著减少脑水肿的发生,表明SUR-1调节的NCCa-ATP是脑损伤引起细胞毒性水肿的关键分子,而格列本脲有望成为治疗细胞毒性水肿的突破口。GAMES-RP是一项评估格列本脲治疗大面积梗死后脑水肿的安全性和有效性的随机双盲安慰剂对照研究,结果显示具有脑水肿风险的大面积脑梗死患者对格列本脲的耐受性良好[11]。今后的研究需要进一步评估静脉注射格列本脲减轻脑水肿、改善患者预后的临床疗效。(3)其他干预靶点包括[12]:基质金属蛋白酶、血管内皮生长因子、Na+-K+-Cl-协同转运蛋白-1和B型内皮素受体。目前在国际临床试验注册网站https://clinicaltrials.gov/注册的治疗脑水肿相关的药物研究见表1[13]。
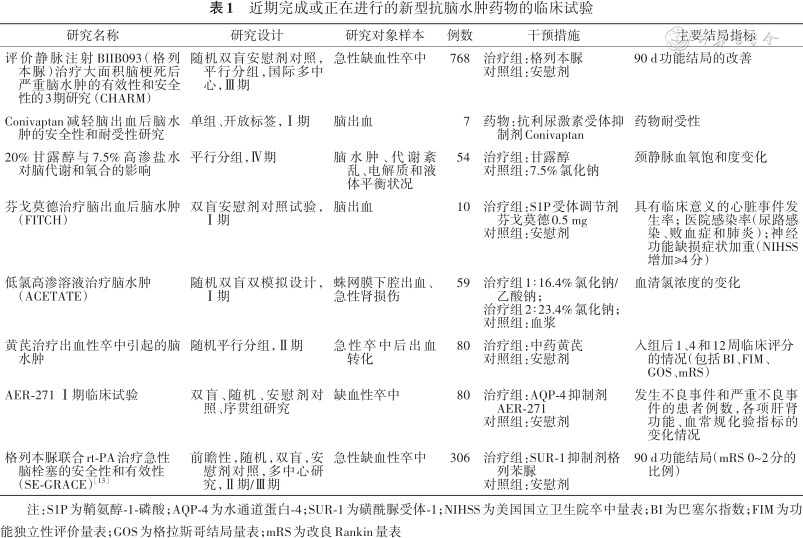
近期完成或正在进行的新型抗脑水肿药物的临床试验
近期完成或正在进行的新型抗脑水肿药物的临床试验
| 研究名称 | 研究设计 | 研究对象样本 | 例数 | 干预措施 | 主要结局指标 |
|---|---|---|---|---|---|
| 评价静脉注射BIIB093(格列本脲)治疗大面积脑梗死后严重脑水肿的有效性和安全性的3期研究(CHARM) | 随机双盲安慰剂对照,平行分组,国际多中心,Ⅲ期 | 急性缺血性卒中 | 768 | 治疗组:格列本脲 对照组:安慰剂 | 90 d功能结局的改善 |
| Conivaptan减轻脑出血后脑水肿的安全性和耐受性研究 | 单组、开放标签,Ⅰ期 | 脑出血 | 7 | 药物:抗利尿激素受体抑制剂Conivaptan | 药物耐受性 |
| 20%甘露醇与7.5%高渗盐水对脑代谢和氧合的影响 | 平行分组,Ⅳ期 | 脑水肿、代谢紊乱、电解质和液体平衡状况 | 54 | 治疗组:甘露醇 对照组:7.5%氯化钠 | 颈静脉血氧饱和度变化 |
| 芬戈莫德治疗脑出血后脑水肿(FITCH) | 双盲安慰剂对照试验,Ⅰ期 | 脑出血 | 10 | 治疗组:S1P受体调节剂芬戈莫德0.5 mg 对照组:安慰剂 | 具有临床意义的心脏事件发生率;医院感染率(尿路感染、败血症和肺炎);神经功能缺损症状加重(NIHSS增加≥4分) |
低氯高渗溶液治疗脑水肿 (ACETATE) | 随机双盲双模拟设计,Ⅰ期 | 蛛网膜下腔出血、 急性肾损伤 | 59 | 治疗组1∶16.4%氯化钠/乙酸钠; 治疗组2∶23.4%氯化钠; 对照组:血浆 | 血清氯浓度的变化 |
| 黄芪治疗出血性卒中引起的脑水肿 | 随机平行分组,Ⅱ期 | 急性卒中后出血转化 | 80 | 治疗组:中药黄芪 对照组:安慰剂 | 入组后1、4和12周临床评分的情况(包括BI、FIM、GOS、mRS) |
| AER-271 Ⅰ期临床试验 | 双盲、随机、安慰剂对照、序贯组研究 | 缺血性卒中 | 80 | 治疗组:AQP-4抑制剂AER-271 对照组:安慰剂 | 发生不良事件和严重不良事件的患者例数,各项肝肾功能、血常规化验指标的变化情况 |
| 格列本脲联合rt-PA治疗急性脑栓塞的安全性和有效性(SE-GRACE)[13] | 前瞻性,随机,双盲,安慰剂对照,多中心研究,Ⅱ期/Ⅲ期 | 急性缺血性卒中 | 306 | 治疗组:SUR-1抑制剂格列苯脲 对照组:安慰剂 | 90 d功能结局(mRS 0~2分的比例) |
注:S1P为鞘氨醇-1-磷酸;AQP-4为水通道蛋白-4;SUR-1为磺酰脲受体-1;NIHSS为美国国立卫生院卒中量表;BI为巴塞尔指数;FIM为功能独立性评价量表;GOS为格拉斯哥结局量表;mRS为改良Rankin量表
2.挑战和未来研究方向:(1)对不同类型、处于不同阶段的脑水肿的分子生物学机制仍然不完全清楚,因此脑水肿发生、发展的病理生理过程也未得到完整描述。(2)脑水肿风险预测主要依据患者的人口学、临床和简单的影像特征,敏感度和特异度有限。探索有预测价值的新型神经影像、电生理、生物学标记物,据此构建精确、个体化的脑水肿预测模型,识别恶性脑水肿高危患者,是给予针对性预防和干预的前提和基础。(3)前期基础研究已经发现了一些脑水肿的可能干预靶点,但是有待转化为有效、安全的临床治疗方法。未来需要开展针对新型药物的随机双盲安慰剂对照研究,进一步验证这些药物治疗神经系统损伤后脑水肿的有效性和安全性。
1.背景及研究现状:各种病因导致的急性脑损伤患者,预后与原发性损伤及随后出现的一系列继发性脑损伤(如脑水肿、颅内压增高、癫痫发作、脑低灌注或高灌注等)有关。预防、诊断、治疗继发性脑损伤是神经重症监护与管理的核心内容,神经功能监测在其中起到举足轻重的作用。常规的生命体征和神经系统查体虽然是主要的监测手段,然而,临床查体发现的体征往往滞后于实际生理功能和组织结构改变,并且由于多数患者存在意识障碍,不能充分配合查体,使得获得的神经系统功能信息十分有限。在这样的背景下,多模态监测(multimodal monitoring,MMM)技术逐渐发展起来。MMM应用多种监测手段,从不同角度评价脑功能,将数据进一步整合分析,系统性评估脑生理状态/病理功能改变,使精准个体化管理成为可能[14]。
MMM采用的手段可以包括颅内压监测、经颅多普勒(transcranial doppler,TCD)脑血流监测、连续、定量脑电图(electroencephalography,EEG)监测、近红外光谱(near-infrared spectroscopy,NIRS)脑氧监测、脑微透析监测等。其中应用较为广泛的是通过同步采集脑血流、NIRS脑氧监测、颅内压与连续动脉血压监测,计算脑血流动力学参数或颅内压与动脉压的Pearson相关系数,或使用传递函数计算脑血流与动脉压波形之间的相位差、增益等参数,评估脑血流自动调节功能。脑血流自动调节监测既有助于预测急性脑损伤患者的预后,也可用于指导这些患者的血压或颅内压管理[15]。一些学者提出了“最佳动脉压”的理论[16],这一理论近年在神经危重症、围手术期监测、新生儿重症等领域应用广泛。Petersen等[17]前瞻性入组了90例接受血管内治疗的急性缺血性卒中患者,在取栓术后监测计算组织氧反应指数(tissue oxygen reactivity index,TOx),首次将“最佳动脉压”理论应用于急性缺血性卒中血管再通治疗后的血压管理。
2.挑战和未来研究方向:(1)近年来,神经功能监测技术发展迅速,许多新的监测技术已经揭示了脑损伤的病理生理过程。进一步整合多模态监测信息,开发下一代信息学工具以识别复杂的生理事件和决策支持工具以实现有针对性的个体化管理,将具有很大的创新性。(2)多模态神经功能监测对继发性脑损伤的评估价值仍然需要前瞻性多中心队列研究验证。需要开发更多的能够指导临床决策的半定量或定量指标,并开展随机对照研究,对这些监测模型敏感性、特异性进行验证。(3)需要开发佩戴舒适、信号稳定的采集系统和设备,使得多模态监测技术简便,便于操作、适于在神经重症监护病房的推广。
1.背景及研究现状:对于缺血性卒中,急性期血管再通治疗(包括静脉溶栓和血管内治疗)可有效减少梗死面积并改善临床结局[18]。近期的真实世界队列及临床研究证实,即使大血管完全开通的前提下,仍然有近50%患者3个月临床结局不良,即无效再通[19]。缺血-再灌注损伤可能是其中的重要原因。明确再灌注损伤的发生机制,探索新的可干预靶点是改善血管再通治疗患者预后的重要研究方向。
既往研究发现,缺血再灌注过程中可能发生下列病理生理变化[20]。活性氧(reactive oxygen species,ROS)的过量产生引起氧化应激,氧化应激损伤内皮细胞,导致内皮下细胞外基质暴露于血流中,引起微血管血小板黏附和活化、血栓形成。损伤的内皮细胞释放金属蛋白酶,它攻击基底层,导致血脑屏障(blood-brain barrier,BBB)通透性增加。受损的内皮细胞与调节性T细胞和活化白细胞相互作用,从而加剧血管内血栓形成。此外,活化的星形胶质细胞和小胶质细胞释放大量炎症因子包括趋化因子、一氧化氮、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1b(interleukin-1b,IL-1b)、白介素-6(interleukin-6,IL-6)、ROS、前列腺素等,随后的炎症反应会导致高度的细胞毒性,促进缺血半暗带的神经元凋亡。氧化应激导致周细胞持续收缩,毛细血管管腔缩小。由于星形胶质细胞肿胀的端部受压,管腔狭窄进一步恶化,最终可能导致无复流现象。
从病理生理学角度来看,缺血再灌注损伤潜在的治疗靶点及策略[21]包括:(1)抗炎治疗[22];(2)血脑屏障保护;(3)清除过多的ROS;(4)Rho激酶抑制剂;(5)他汀类药物;(6)其他药物[22]:如丁基苯肽、去甲斑蝥素、米诺环素、红细胞生成素、丙泊酚、维生素C、视黄酸二甲双胍、黄体酮等,可能具有改善BBB通透性的作用,也能改善再灌注损伤(血管再通治疗联合改善再灌注损伤的研究详见表2[23, 24, 25, 26, 27, 28, 29, 30])。

急性血管开通联合改善再灌注损伤治疗的研究
急性血管开通联合改善再灌注损伤治疗的研究
| 研究名称 | 研究设计 | 研究对象 | 例数 | 干预措施 | 主要结果或主要终点 |
|---|---|---|---|---|---|
| 已完成的研究 | |||||
依达拉奉在4.5 h时间窗治疗急性缺血性卒中的上市后登记研究(PROTECT4.5)[23] | 前瞻性观察研究 | 发病4.5 h内接受依达拉奉治疗的急性缺血性卒中 | 11 384 | 单用依达拉奉组 依达拉奉联合rt-PA组 | 发病后4.5 h内应用依达拉奉联合rt-PA治疗急性缺血性卒中是安全的,联合治疗组sICH的发生率显著降低、预后较好 |
rt-PA与依达拉奉联合治疗研究(YAMATO)[24] | 多中心、前瞻性、随机、开放标签研究 | 发病4.5 h内的急性缺血性卒中,MCA-M1 或M2段闭塞 | 165 | 早期治疗组:在rt-PA之前或期间静脉注射依达拉奉30 mg 延迟治疗组:在rt-PA之后静脉注射依达拉奉并评估早期再通 | 依达拉奉的输注时间并不影响rt-PA治疗后早期再通率、症状性脑出血或良好预后 |
尿酸联合rt-PA治疗急性缺血性脑卒中的疗效评估(URICO-ICTUS)[25] | 一项双盲、安慰剂对照、2b期试验 | 发病4.5 h急性缺血性卒中,且接受阿替普酶静脉溶栓治疗 | 411 | 治疗组:尿酸1 000 mg 对照组:安慰剂 | 主要预后指标:EIW定义为治疗后72 h内NIHSS评分增加≥4分,且无出血或卒中复发 结果:EIW在尿素治疗组比例较低 |
急性缺血性卒中再灌注和低温治疗(ReCCLAIM)[26] | 前瞻性单臂开放标签临床试验 | 急性缺血性卒中;ASPECTS 5~7分;NIHSS评分>13分 | 20 | 动脉内治疗后立即进行血管内低温治疗 | 对梗死体积较大的急性缺血性卒中患者,动脉内治疗后进行低温治疗是安全的 |
对卒中患者的血管内低温治疗-2(ICTuS-2)[27] | 前瞻性、随机、单盲、多中心2/3期研究 | 发病3 h内急性缺血性脑卒中,静脉注射r-tPA、NIHSS评分≥7分且≤20分(左侧半球卒中)或≤24岁(右半球卒中),年龄22~82岁 | 120 | 低温治疗组:快速输注2 L(0.9%)生理盐水(4 ℃),然后用血管内冷却装置,目标体温33 ℃,持续24 h 正常体温组:输入相同体积的室温生理盐水 | 低温治疗对于接受rtPA的缺血性卒中患者是安全的 |
再灌注治疗联合辛伐他汀对急性缺血性卒中的疗效(STARS07)[28] | 多中心,Ⅳ期,前瞻性,随机,双盲,安慰剂对照试验 | 发病12 h内急性缺血性卒中 | 104(55例接受rt- PA治疗) | 治疗组:辛伐他汀40 mg口服 对照组:安慰剂 | 辛伐他汀联合rt-PA治疗急性缺血性卒中是安全的,出血并发症发生率低;由于样本例数较少,对评估辛伐他汀的有效性效度不足 |
3K3A活化蛋白C治疗缺血性脑卒中的安全性评价(RHAPSODY)[29] | Ⅱ期临床试验,评估药物的最大耐受剂量 | 接受静脉溶栓和(或)血管内机械取栓的患者 | 110 | 分别给予不同剂量的3K3A-APC:120、240、360、540 μg/kg | 维持PAR1细胞保护活性最大耐受剂量是540 μg/kg;探索性分析中出血率降低的趋势需要进一步验证 |
Nerinetide(NA1)对急性缺血性卒中的安全性和有效性研究(ESCAPE-NA1)[30] | 多中心、双盲、随机、安慰剂对照研究,Ⅲ期 | 发病12 h内急性大动脉闭塞所致的缺血性卒中 | 1 105 | 试验组:静脉注射NA1 2.6 mg/kg(最大剂量270 mg) 对照组:生理盐水 | NA1没有改善血管内取栓后获得良好临床结果的患者比例 |
| 正在进行的研究 | |||||
急性缺血性卒中溶栓治疗后应用大剂量阿托伐他汀治疗的安全性和有效性研究(SEATIS) | 随机,开放标签研究 | 年龄≥18岁,且 发病前mRS<2分 | 254 | 两种不同剂量的阿托伐他汀(80和20 mg)在静脉注射rt-PA后24 h内至少2周 | 90 d时高剂量组和中剂量组的mRS 0~2分的患者百分比 |
急性缺血性卒中血管开通联合低温治疗(ReCCLAIM-Ⅱ) | 多中心前瞻性随机对照试验 | 年龄≥18且≤85岁,ASPECTS 5~10分,NIHSS≥8分,发病前mRS<2分 | 120 | 应用Proteus IVTM系统对接受急性血管再通治疗的患者进行亚低温治疗 | 动脉穿刺后1 h内达到目标体温<34 ℃的受试者比例;就诊到血管再通的时间;再通36 h内每组的出血转化率 |
注:rt-PA为重组组织型纤溶酶原激活物;ASPECTS为艾伯塔卒中项目早期CT评分;NIHSS为美国国立卫生院卒中量表;mRS为改良Rankin量表;EIW为早期缺血恶化
2.挑战和未来研究方向:(1)随着急性缺血性卒中血管再通治疗的普及,脑缺血再灌注损伤的评估和治疗再次成为了卒中领域的研究热点。然而,脑缺血再灌注损伤目前仍然没有统一的诊断标准,同时也缺乏可靠的定量/或半定量的评估方法。这使得针对再灌注损伤的干预措施的疗效评估也缺乏客观的统一标准。(2)针对缺血再灌注损伤的潜在干预靶点的药物疗效评估大部分只做了动物实验的验证,对一些临床前研究证实可能有效的药物还需要开展更多的临床随机对照试验。(3)针对再灌注损伤的级联反应过程,需要探讨潜在获益的与血管再通治疗联合干预的神经或血管保护药物,包括干预的时机、给药方式、治疗药物等,证实其临床有效性及安全性也是需要回答的问题。(4)术后的系统化管理,包括血压管理、抗栓药物选择、镇静镇痛治疗等,目前都缺乏明确的临床研究证据。
1.背景及研究现状:意识障碍在神经危重症患者中极为常见,需要精确评估患者的意识水平和判断预后,便于制定临床治疗决策、合理配置医疗资源。由于重度脑损伤患者往往合并感觉、运动、语言、认知功能受损,常规的床旁查体有时难以判断真实的意识水平。对一些特殊类型意识障碍的患者,如植物状态、最小意识状态患者长期预后的判断及有效治疗;脑损伤后临床无反应患者的潜在意识(covert consciousness)的识别,是神经重症领域内需要回答的问题,一直是研究热点。
关于意识障碍的评价,近年人们通过基于任务的功能磁共振(functional MRI,fMRI)和EEG等手段,揭示重度脑损伤合并意识障碍患者有无潜在的意识。(1)fMRI:研究发现,对临床诊断为植物状态的患者给予运动想象指令,fMRI能观察到大约20%的患者的相应脑区活动增加,证实此类患者并非真正处于“植物状态”[31],并且神经功能成像有助于识别意识能够改善的患者。因此,英美国家的学会指南以及部分专家建议,如果条件允许,可通过fMRI评估临床考虑为植物状态的患者有无潜在意识[32]。(2)EEG的传统判读方法如观察背景节律、对刺激的反应性等仅能大致评估亚急性-慢性期患者的脑损伤严重程度。近年有学者重点采集分析无临床行为反应的患者收到运动想象指令后,中央区μ节律和β频带的变化,识别出认知-运动分离(cognitive motor dissociation)的患者,使EEG对意识水平和预后的评估更加精确。在这一研究路线基础上,有学者进一步采用人工智能技术识别EEG对运动指令的反应,在意识障碍的早期完成评估,证明早期EEG的反应性对预后也有预测价值[33, 34]。除运动指令之外,也有学者尝试给予单音调声音或语言等刺激,通过与健康者比对,识别不同的特异性刺激产生的事件相关电位,分别评估患者意识有无反应和语言功能是否保留,以及和远期预后的相关性。
意识障碍的治疗,目前对亚急性-慢性意识障碍的治疗主要包括增强多巴胺能或GABA能信号投射的药物治疗以及电生理干预两大途径。前者使用左旋多巴、哌甲酯、金刚烷胺、溴隐亭、阿扑吗啡、唑吡坦等药物,后者有大脑深部电刺激(deep brain stimulation,DBS)、经颅磁刺激(transcranial magnetic stimulation,TMS)、迷走神经刺激等方式。其他一些非药物治疗如感觉刺激、音乐疗法也有人尝试。但是到目前为止,经随机对照试验证实有助于促进意识恢复的,仅金刚烷胺一种干预方式。关于意识障碍的药物和非药物治疗的主要研究详见表3[35, 36, 37, 38, 39, 40, 41, 42, 43]。
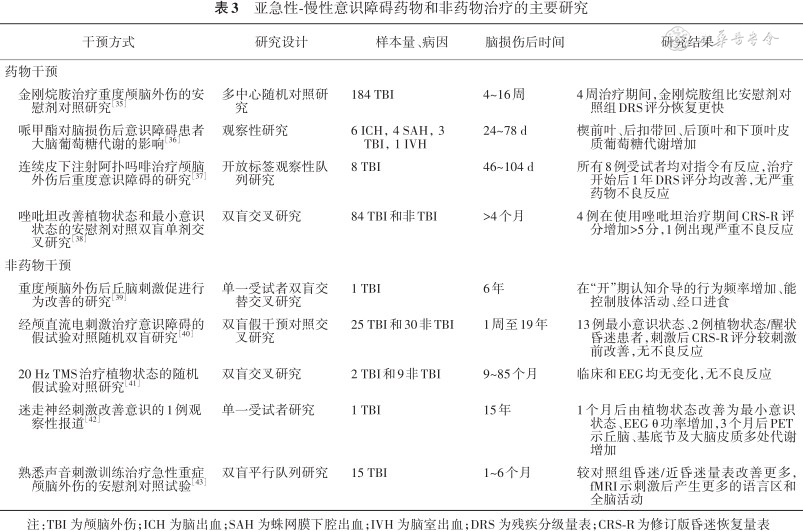
亚急性-慢性意识障碍药物和非药物治疗的主要研究
亚急性-慢性意识障碍药物和非药物治疗的主要研究
| 干预方式 | 研究设计 | 样本量、病因 | 脑损伤后时间 | 研究结果 |
|---|---|---|---|---|
| 药物干预 | ||||
金刚烷胺治疗重度颅脑外伤的安慰剂对照研究[35] | 多中心随机对照研究 | 184 TBI | 4~16周 | 4周治疗期间,金刚烷胺组比安慰剂对照组DRS评分恢复更快 |
哌甲酯对脑损伤后意识障碍患者大脑葡萄糖代谢的影响[36] | 观察性研究 | 6 ICH,4 SAH,3 TBI,1 IVH | 24~78 d | 楔前叶、后扣带回、后顶叶和下顶叶皮质葡萄糖代谢增加 |
连续皮下注射阿扑吗啡治疗颅脑外伤后重度意识障碍的研究[37] | 开放标签观察性队列研究 | 8 TBI | 46~104 d | 所有8例受试者均对指令有反应,治疗开始后1年DRS评分均改善,无严重药物不良反应 |
唑吡坦改善植物状态和最小意识状态的安慰剂对照双盲单剂交叉研究[38] | 双盲交叉研究 | 84 TBI和非TBI | >4个月 | 4例在使用唑吡坦治疗期间CRS-R评分增加>5分,1例出现严重不良反应 |
| 非药物干预 | ||||
重度颅脑外伤后丘脑刺激促进行为改善的研究[39] | 单一受试者双盲交替交叉研究 | 1 TBI | 6年 | 在“开”期认知介导的行为频率增加、能控制肢体活动、经口进食 |
经颅直流电刺激治疗意识障碍的假试验对照随机双盲研究[40] | 双盲假干预对照交叉研究 | 25 TBI和30非TBI | 1周至19年 | 13例最小意识状态、2例植物状态/醒状昏迷患者,刺激后CRS-R评分较刺激前改善,无不良反应 |
20 Hz TMS治疗植物状态的随机假试验对照研究[41] | 双盲交叉研究 | 2 TBI和9非TBI | 9~85个月 | 临床和EEG均无变化,无不良反应 |
迷走神经刺激改善意识的1例观察性报道[42] | 单一受试者研究 | 1 TBI | 15年 | 1个月后由植物状态改善为最小意识状态、EEG θ功率增加,3个月后PET示丘脑、基底节及大脑皮质多处代谢增加 |
熟悉声音刺激训练治疗急性重症颅脑外伤的安慰剂对照试验[43] | 双盲平行队列研究 | 15 TBI | 1~6个月 | 较对照组昏迷/近昏迷量表改善更多,fMRI示刺激后产生更多的语言区和全脑活动 |
注:TBI 为颅脑外伤;ICH 为脑出血;SAH 为蛛网膜下腔出血;IVH 为脑室出血;DRS 为残疾分级量表;CRS-R为修订版昏迷恢复量表
2.挑战和未来研究方向:(1)意识障碍发生、恢复机制的基础研究:脑干上行网状激活系统与丘脑核团之间、中间环路与额顶叶神经网络之间的连接节点的具体位置、神经元类型、传导通路,目前尚未完全清楚。未来可能需要利用脑库标本、非人灵长类动物模型、弥散张量成像等技术进一步研究明确,以使DBS或TMS等电生理干预靶点更加精确,开发靶向作用于关键核团的药物。(2)提高判断潜在意识的精确性:未来的研究方向包括:寻找不依赖语言和认知功能,并且同时具有较高敏感度和特异度的刺激方式,如声音或视觉刺激,来区分觉醒度保留和真正昏迷的患者;通过不同层次、类型的刺激,进一步明确患者为高级认知功能受损还是觉醒度下降,精准判断临床无反应的原因;改进检测手段,提高识别大脑皮质电活动或血流变化的空间分辨率,如使用高场强MRI或植入皮质电极;将神经功能成像、电生理、行为学多模式评价进行整合。(3)利用脑机接口(brain-computer interfaces,BCI)技术实现与意识障碍患者交流:对于存在潜在意识的临床无反应患者(包括眼球固定或视物追踪功能受损的患者),如何与他们交流,是长期以来的研究热门。其中从机制而言最有潜力的技术是BCI。BCI可以基于EEG或近红外光谱仪(NIRS),通过检测事件相关电位或局部脑血流的变化,识别大脑对外界刺激的反应,来感知受试者的意图。未来需要着力解决的问题主要是提高BCI识别意图的精确性,同时使BCI设备更加简便易用。开发可穿戴设备提高易用性,或颅内植入式BCI设备提高识别精度,是未来可能的研究趋势之一。
1.背景及研究现状:神经重症医学是一门新兴学科,目前在国内仍缺乏有效的神经重症医学的医疗服务质量的关键评估指标和可持续改进体系。通过建立急重症神经系统疾病医疗管理评估的核心指标体系,监测医院的急危重脑损伤的医疗质量,规范临床路径,发现临床实践与证据之间的差距,从可干预的主要问题和影响因素作为切入点,制定持续质量改进的干预模式,并将此模式推广至全国,从而不断提高急危重症神经系统疾病的诊治的医疗质量。
目前关于神经重症医疗监控的研究,国内外相对较少。2013年,Su等[44]发表了一项中国NICU的现况调查结果。此研究对全国100所三级医院的NICU主任进行问卷调查,了解各单位的基本情况、设备和技术信息以及人员配备情况。2020年张琳琳等[45]发表了一项2013-2017年全国三级公立医院神经重症医疗质量现状分析结果,共纳入了全国506家三级公立医院220 027例神经重症患者,结果显示我国神经重症医疗质量逐年上升,救治水平在逐步提高,未来仍需继续关注结构、过程、结局指标,以持续改进。
Lele等[46]报道了一项美国神经重症学会(Neurocritical Care Society,NCS)的调查结果。这项研究描述NICU实施质量改进(quality improvement,QI)过程的现状。主要内容包括:QI项目的实施率、对现有QI过程的满意度、NICU QI的障碍、卒中核心评价指标(stroke core measures,STK)、卒中指南依从性(get with the guidelines,GWTG)、创伤质量改善计划(trauma quality improvement program,TQIP)和美国神经病学学会(American Association of Neurology,AAN)绩效评估。这项研究显示,少数NICU建立了专门的NICU QI项目,缺乏这样的项目可能会导致医生和患者的不满。机构和部门支持可能是成功和令人满意地实施NICU QI的关键因素。
2.挑战和未来研究方向:(1)神经重症目前仍是新兴亚专科,病房建设、人员配备尚不规范。亟待建立针对神经重症的医疗质量控制体系。(2)缺乏具体神经重症的质量监控指标。完善的神经重症质量监控关键指标应该通过系统设计的临床研究来实现,包括多中心、Delphi方法的引入,建立并验证模型的全过程,并达到临床应用的可行性及普适性。其中可能包括神经系统原发病的管理、多系统并发症的管理、镇静镇痛、营养管理等方面。(3)建立健全神经重症医疗质量控制及改进体系需要多学科、各级医院和卫生管理部门的通力合作,实施过程需要顶层设计、上下联动、共同面对巨大挑战。
1.背景及研究现状:在NICU中通过床旁无创监测可以采集到多种连续的评估数据信息,包括机械通气、颅内压、血流动力学、体温、液体摄取量、连续的神经系统检查和其他神经生理学参数等。在临床工作中,医生和护士在面对这些海量信息时,能否做出正确的判断和解读是拟定治疗方案的关键。人工智能(artificial intelligence,AI)的最新进展使AI技术从实验室走向实际的临床实践成为可能。建立AI辅助的神经重症辅助诊疗系统且得到验证实施,可辅助临床医护人员更及时地发现神经系统功能恶化的早期征象并给予适当的治疗措施,从而改善患者的预后。通过远程会诊以降低成本并解决神经重症医护力量及专业技术在地区之间的不平衡问题。通过AI辅助诊疗体系的建立对辅助NICU医疗质量的控制,建立可持续改进的医疗质量监控系统必将起到推动作用。近年来神经重症监护数据综合分析和智能化诊疗决策方面取得了一些进展[47],这些方法可用于指导患者治疗模式,包括麻醉/镇痛剂、抗癫痫发作药物、颅内压、血压、血糖、液体/电解质、神经肌肉阻滞和呼吸机设置等。
2.挑战和未来研究方向:(1)目前智能化管理已经在神经重症领域颅内压、血流动力学、癫痫持续状态、机械通气等管理方面取得了进展,实施AI对神经功能评价并应用在决策干预方案中将是未来重点方向。这些自动化程序将缩短病情恶化与干预之间的时间间隔,开创全新的临床管理模式。(2)在临床实践中,基于AI诊疗决策模型的目的是使患者维持在一个良好的生理状态,而不是纠正一个特定的生理变量。因此,在这个方面的研究设计上需要考虑到临床结局的重要性。(3)AI技术从理论到临床实践需要符合伦理要求,以保护患者的人身权益。(4)描述、预测和治疗是NICU收集、分析大数据的主要目的,需要合适高效的数据预处理、特征提取、统计推断和分析工具。未来需要增加能在床旁使用的专业设备,建立数据标准化格式、共同变量数据集。
撰写小组:濮月华(首都医科大学附属北京天坛医院神经内科);张哲(首都医科大学附属北京天坛医院神经内科)
讨论专家(按姓氏笔画顺序):王丽华(哈尔滨医科大学附属第二医院神经内科);王芙蓉(华中科技大学同济医学院附属同济医院神经内科);毛玲(华中科技大学同济医学院附属协和医院神经内科);田成林(解放军总医院第一医学中心神经内科);朱雨岚(哈尔滨医科大学附属第二医院神经内科);刘佩芳(哈尔滨医科大学附属第二医院神经内科);张乐(中南大学湘雅医院神经内科);宋波(郑州大学第一附属医院神经内科);张忠玲(哈尔滨医科大学附属第一医院神经内科);张猛(陆军军医大学陆军特色医学中心神经内科);张颖冬(南京医科大学附属南京医院神经内科);李玮(陆军军医大学陆军特色医学中心神经内科);李淑娟(首都医科大学附属北京朝阳医院神经内科);郑华光(首都医科大学附属北京天坛医院健康管理中心);罗本燕(浙江大学医学院附属第一医院神经内科);岳伟(天津市环湖医院神经内科);黄凯滨(南方医科大学南方医院神经内科);滕伟禹(中国医科大学附属第一医院神经内科)
指导专家:宿英英(首都医科大学附属北京宣武医院神经内科重症监护病房);周建新(首都医科大学附属北京天坛医院重症医学科);王拥军(首都医科大学附属北京天坛医院神经内科)
所有作者均声明不存在利益冲突


























