
明确我国现有核酸检测试剂对新型冠状病毒德尔塔变异株的适用性,了解全国临床实验室对德尔塔变异株的检测能力。
采用基因工程方法制备无生物传染危险性的噬菌体病毒样颗粒模拟样本,发放到全国8 488家实验室,开展全国新型冠状病毒德尔塔变异株核酸检测室间质量评价。样本盘包括3支不同浓度的德尔塔变异株样本(7.5×102、1.5×103、6.0×103 拷贝/ml)、1支非变异株弱阳性样本(7.5×102 拷贝/ml)和1支阴性样本。计算实验室检测不同浓度德尔塔变异株样本的符合率、同等浓度水平的德尔塔变异株和非变异株样本的符合率,以及使用实验室数≥100家的各检测试剂对不同浓度德尔塔变异株样本的检测符合率、同等浓度水平的德尔塔变异株和非变异株样本的检测符合率。
本次室间质量评价共计收到8 127份回报结果,成绩合格的实验室占98.77%(8 027/8 127)。样本的总符合率为99.64%(40 490/40 635),阴性符合率为99.73%(8 105/8 127),阳性符合率为99.62%(32 385/32 508)。德尔塔变异株阳性样本符合率随浓度减少相应降低。同浓度(7.5×102 拷贝/ml)水平的德尔塔变异株和非变异株样本符合率分别为99.41%(8 079/8 127)、99.51%(8 087/8 127),差异无统计学意义(P=0.392)。使用实验室数≥100家的各检测试剂的样本总符合率、阴性符合率和阳性符合率均>98%,对7.5×102 拷贝/ml的德尔塔变异株和非变异株样本检测的符合率差异均无统计学意义(均P>0.05)。
德尔塔变异株未影响我国现有核酸检测试剂的适用性。临床实验室对德尔塔变异株和非变异株具有同等检测能力,但少部分实验室对弱阳性样本的检测能力需进一步提高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着全球新型冠状病毒肺炎疫情的持续发展,新型冠状病毒不断发生变异。其中,德尔塔变异株已在全球187个国家蔓延,成为现阶段全球新型冠状病毒大流行的主要毒株[1]。我国近期境外输入型病例均为感染了德尔塔变异株,且已造成全国多个地区的散发疫情。
核酸检测是新型冠状病毒肺炎确诊的金标准,对疫情防控具有重要作用。我国临床实验室使用的新型冠状病毒核酸检测试剂多为疫情初期建立,引物探针设计均基于最初的病毒株序列。而德尔塔变异株在ORF1a、ORF1b、ORF3a、ORF7a、S、N和M基因均存在突变位点,如果突变出现在引物-探针的关键结合位点,则会影响引物-探针和目的序列特异性结合的效率,甚至造成核酸检测的假阴性结果[2, 3, 4, 5]。为明确德尔塔变异株对现有核酸检测的影响,评价我国临床实验室对德尔塔变异株的检测能力,本研究采用无生物传染危险性的噬菌体病毒样颗粒样本,开展了全国新型冠状病毒德尔塔变异株核酸检测室间质量评价(EQA),现将结果报告如下。
本次EQA样本为基因工程方法制备的无生物传染危险性的噬菌体病毒样颗粒模拟样本。在全球共享流感数据倡议组织(GISAID)数据库中下载获取德尔塔变异株的序列(BetaCoV/India/ILSGS00922/2021|EPI_ISL_1663498,GISAID),并以非变异株(Wuhan-Hu-1)基因组序列(BetaCoV/Wuhan/Hu-1/2019/EPI_ISL_402125,GISAID)作为参考序列。针对德尔塔变异株和非变异株的ORF1ab、S、E、N基因分别选取13 000 bp左右,在3′端和5′端各添加一段19 bp的茎环结构和KpnI、PacI限制性酶切位点,由生工生物工程(上海)股份有限公司进行基因合成。对合成的包装序列进行KpnI和PacI双酶切及切胶纯化,连接至可稳定表达MS2噬菌体衣壳蛋白的pACYC-MS2克隆载体上。重组质粒经测序鉴定成功后,转化BL21(DE3)大肠杆菌进行MS2噬菌体毒样颗粒(VLP)的诱导表达和纯化。纯化后的VLP经双酶(DNase I和RNase A)消化和逆转录PCR测序鉴定,进行数字PCR定量。依据数字PCR定量结果,用DMEM培养基(美国Gibco公司)作为样本稀释液,分别对德尔塔变异株和非变异株VLP进行2倍梯度稀释,选取预期浓度的样本,再次进行数字PCR定量,确定其浓度与预期相符。
本次EQA样本盘共包含1支阴性样本和4支阳性样本,各样本具体信息详见表1。阴性样本为DMEM,用以考核实验室是否存在扩增产物的污染或操作时是否存在交叉污染。阳性样本为3支不同浓度德尔塔变异株样本(7.5×102、1.5×103、6.0×103 拷贝/ml)和1支非变异株弱阳性样本(7.5×102 拷贝/ml),用以考察参评实验室对不同浓度德尔塔变异株样本的检出率,以及同等浓度水平的德尔塔变异株和非变异株样本的检出率是否存在差异。
新型冠状病毒德尔塔变异株核酸检测室间质量评价结果
新型冠状病毒德尔塔变异株核酸检测室间质量评价结果
新型冠状 病毒 | 变异类型 | 浓度 (拷贝/ml) | 回报 结果数(份) | 样本符合率 [例(%)] |
|---|---|---|---|---|
| 阴性 | DMEM | - | 8 127 | 8 105(99.73) |
| 阳性 | Delta(B.1.617.2) | 6.0×103 | 8 127 | 8 114(99.84) |
| 阳性 | Delta(B.1.617.2) | 1.5×103 | 8 127 | 8 105(99.73) |
| 阳性 | Delta(B.1.617.2) | 7.5×102 | 8 127 | 8 079(99.41) |
| 阳性 | 非变异株 (Wuhan-Hu-1) | 7.5×102 | 8 127 | 8 087(99.51) |
注:“-”示阴性样本无浓度
本次EQA成绩合格的标准是所有阴性和阳性样本均被正确检出,即实验室检测结果和预期结果100%符合;否则为成绩不合格。计算实验室检测结果的总符合率、阳性符合率和阴性符合率,评价实验室对不同浓度德尔塔变异株样本检测结果的符合率、同浓度德尔塔变异株和非变异株样本的符合率是否存在差异;对参评实验室分别按所用检测试剂等进行分组,计算每种试剂对各样本测定的总符合率、阴性符合率、阳性符合率、各靶区域循环阈值(Ct值)的变异系数(CV)。
使用SPSS 19.0软件进行数据的统计和分析。计数资料以频数及百分率(%)表示,组间比较采用χ²检验。双侧检验,检验水准α=0.05。
纯化后的VLP经双酶消化和1%的琼脂糖凝胶电泳验证,如图1所示,可看到未消化的VLP由于表面残留的核酸,导致迁移率增强,条带下移,并且出现“拖尾现象”;而消化后的VLPs其等电点为3.9,则在2 000~2 500 bp之间出现单一的核酸-衣壳蛋白复合物条带。对VLPs提取RNA后进行逆转录PCR扩增,扩增产物经Sanger测序鉴定含有目的RNA序列。对稀释后的VLPs样本进行数字PCR定量,结果表明样本浓度和预期相符(表1)。
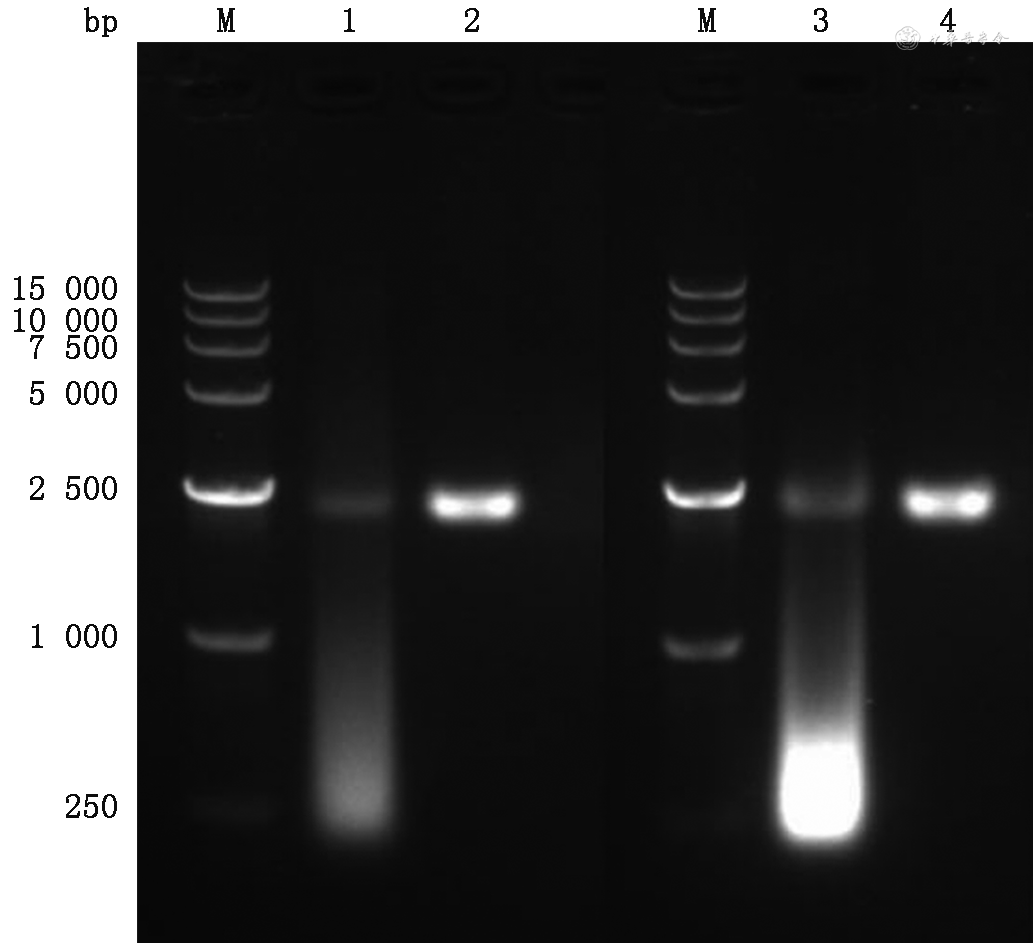

注:M为15 000 bp标准带;1为德尔塔变异株双酶消化前噬菌体毒样颗粒(VLP);2为德尔塔变异株双酶消化后VLP;3为非变异株双酶消化前VLP;4为非变异株双酶消化后VLP
本次EQA共计收到8 127份回报结果,包括疾病预防控制中心、二级或三级公立医疗机构、独立医学实验室、海关所属国际旅行卫生保健中心等,覆盖全国31个省(直辖市/自治区)。其中EQA成绩合格的实验室为8 027家(98.77%,8 027/8 127),不合格的实验室100家(1.23%,100/8 127)。实验室使用的核酸提取方法包括手工-柱提取法、自动化仪器-柱提取法、手工-磁珠提取法、自动化仪器-磁珠提取法和化学裂解法,93.16%(7 571/8 127)的实验室使用的是自动化仪器-磁珠提取法,1.80%(146/8 127)的实验室使用化学裂解法。实时荧光逆转录PCR(rRT-PCR)方法是实验室使用最多的核酸检测方法,占99.72%(8 104/8 127),恒温扩增、RNA捕获探针和双扩增方法分别占0.10%(8/8 127)、0.17%(14/8 127)和0.01%(1/8 127)。核酸检测试剂使用的实验室数以及实验室占比见表2(仅对使用数≥100家的检测试剂进行统计分析),其中上海伯杰医疗科技有限公司(国械注准:20203400065)、中山大学达安基因股份有限公司(国械注准:20203400063)和圣湘生物科技股份有限公司(国械注准:20203400064)的核酸检测试剂使用最为广泛,分别占本次EQA的20.00%(1 625/8 127)、14.81%(1 204/8 127)和11.58%(941/8 127)。
不同检测试剂对不同浓度新型冠状病毒德尔塔变异株与非变异株的检测符合率
不同检测试剂对不同浓度新型冠状病毒德尔塔变异株与非变异株的检测符合率
检测 试剂 | 实验 室数 (家) | 检测 靶基因 | 阴性样本 | 变异株阳性样本(6.0×103 拷贝/ml) | 变异株阳性样本 (1.5×103 拷贝/ml) | 变异株阳性样本 (7.5×102 拷贝/ml) | 非变异株 弱阳性样本 (7.5×102 拷贝/ml) | 分析性能 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
符合率 [例(%)] | CV (%) | 符合率 [例(%)] | CV (%) | 符合率 [例(%)] | CV (%) | 符合率 [例(%)] | CV (%) | 符合率 [例(%)] | CV (%) | 总体 符合率 [例(%)] | 阴性 符合率 [例(%)] | 阳性 符合率 [例(%)] | ||||
| 1 | 1 625 | ORF1ab | 1 618/1 625 (99.57) | - | 1 622/1 625 (99.82) | 4.66 | 1 623/1 625 (99.88) | 4.05 | 1 617/1 625 (99.51) | 4.48 | 1 619/1 625 (99.63) | 4.32 | 8 099/8 125 (99.68) | 1 618/1 625 (99.57) | 6 481/6 500 (99.71) | |
| N | - | 4.30 | 4.42 | 5.53 | 4.12 | |||||||||||
| 2 | 1 204 | ORF1ab | 1 203/1 204 (99.92) | - | 1 203/1 204 (99.92) | 7.21 | 1 202/1 204 (99.83) | 7.14 | 1 199/1 204 (99.58) | 4.38 | 1 201/1 204 (99.75) | 4.36 | 6 009/6 020 (99.82) | 1 203/1 204 (99.92) | 4 806/4 816 (99.79) | |
| N | - | 6.77 | 6.60 | 6.31 | 4.81 | |||||||||||
| 3 | 941 | ORF1ab | 939/941 (99.79) | - | 940/941 (99.89) | 4.36 | 938/941 (99.68) | 4.94 | 934/941 (99.26) | 4.38 | 937/941 (99.57) | 4.36 | 4 688/4 705 (99.64) | 939/941 (99.79) | 3 749/3 764 (99.60) | |
| N | - | 4.81 | 4.78 | 6.31 | 4.81 | |||||||||||
| 4 | 897 | ORF1ab | 896/897 (99.89) | - | 896/897 (99.89) | 5.16 | 895/897 (99.78) | 4.99 | 890/897 (99.22) | 5.02 | 888/897 (99.00) | 4.00 | 4 465/4 485 (99.55) | 896/ 897 (99.89) | 3 569/3 588 (99.47) | |
| N | - | 4.96 | 4.56 | 6.10 | 4.33 | |||||||||||
| 5 | 891 | ORF1ab | 890/891 (99.89) | - | 890/891 (99.89) | 4.16 | 890/891 (99.89) | 4.34 | 889/891 (99.78) | 4.45 | 886/891 (99.44) | 4.49 | 4 445/4 455 (99.78) | 890/891 (99.89) | 3 555/3 564 (99.75) | |
| N | - | 5.00 | 5.06 | 5.76 | 4.88 | |||||||||||
| E | - | 4.48 | 4.81 | 4.48 | 4.89 | |||||||||||
| 6 | 868 | ORF1ab | 867/868 (99.88) | - | 867/868 (99.88) | 6.19 | 862/868 (99.31) | 5.69 | 858/868 (98.85) | 5.57 | 868/868 (100.00) | 6.20 | 4 322/4 340 (99.58) | 867/868 (99.88) | 3 455/3 472 (99.51) | |
| N | - | 6.35 | 5.73 | 6.80 | 6.59 | |||||||||||
| 7 | 528 | ORF1ab | 524/528 (99.24) | - | 527/528 (99.81) | 5.43 | 528/528 (100.00) | 4.67 | 525/528 (99.43) | 4.98 | 526/528 (99.62) | 4.75 | 2 630/2 640 (99.62) | 524/528 (99.24) | 2 106/2 112 (99.72) | |
| N | - | 5.50 | 5.18 | 6.85 | 4.73 | |||||||||||
| E | - | 4.69 | 4.23 | 4.30 | 4.45 | |||||||||||
| 8 | 400 | ORF1ab | 399/400 (99.75) | - | 400/400 (100.00) | 5.17 | 400/400 (100.00) | 4.86 | 400/400 (100.00) | 4.79 | 399/400 (99.75) | 5.28 | 1 998/2 000 (99.90) | 399/400 (99.75) | 1 599/1 600 (99.94) | |
| N | - | 5.14 | 4.90 | 5.72 | 4.91 | |||||||||||
| 9 | 190 | ORF1ab | 190/190 (100.00) | - | 190/190 (100.00) | 5.21 | 189/190 (99.47) | 4.93 | 188/190 (98.95) | 4.76 | 189/190 (98.42) | 5.28 | 944/950 (99.37) | 190/190 (100.00) | 754/760 (99.21) | |
| N | - | 5.29 | 5.39 | 7.20 | 4.91 | |||||||||||
| 10 | 144 | ORF1ab | 144/144 (100) | - | 144/144 (100.00) | 5.45 | 144/144 (100.00) | 5.36 | 144/144 (100.00) | 5.28 | 143/144 (99.31) | 4.67 | 719/720 (99.86) | 144/144 (100.00) | 575/576 (99.83) | |
| N | - | 7.04 | 7.10 | 8.34 | 6.96 | |||||||||||
| E | - | 6.38 | 5.77 | 5.16 | 6.11 | |||||||||||
| 11 | 142 | ORF1ab | 141/1 42 (99.30) | - | 142/142 (100.00) | 4.59 | 142/142 (100.00) | 4.33 | 142/142 (100.00) | 4.40 | 142/142 (100.00) | 4.13 | 709/710 (99.86) | 141/1 42 (99.30) | 568/568 (100.00) | |
| N | - | 4.27 | 3.98 | 5.48 | 4.05 | |||||||||||
| E | - | 4.67 | 5.73 | 5.10 | 4.26 | |||||||||||
| 12 | 128 | ORF1ab | 126/128 (98.44) | - | 127/128 (99.22) | 8.07 | 128/128 (100.00) | 7.36 | 128/128 (100.00) | 7.34 | 127/128 (99.22) | 6.67 | 636/640 (99.38) | 126/128 (98.44) | 510/512 (99.61) | |
| N | - | 5.44 | 5.76 | 6.55 | 6.00 | |||||||||||
注:仅对本次室间质量评价中使用实验室数≥100家的检测试剂进行统计分析;不同数字代表的检测试剂公司如下:1为上海伯杰医疗科技有限公司(国械注准:20203400065);2为中山大学达安基因股份有限公司(国械注准:20203400063);3为圣湘生物科技股份有限公司(国械注准:20203400064);4为武汉明德生物科技股份有限公司(国械注准:20203400212);5为上海之江生物科技股份有限公司(国械注准:20203400057);6为中山大学达安基因股份有限公司(国械注准:20203400749);7为迈克生物科技股份有限公司(国械注准:20203400184);8为江苏硕世生物科技股份有限公司(国械注准:20203400384);9为北京金豪制药股份有限公司(国械注准:20203400322);10为上海复星长征医学科学有限公司(国械注准:20203400299);11为北京卓诚惠生生物科技股份有限公司(国械注准:20203400179);12为重庆中元汇吉生物技术有限公司(国械注准:20210400228);ORF1ab:开放阅读框1ab基因;N:衣壳蛋白基因;E:包膜蛋白基因;“-”示阴性样本无Ct值及相应CV值
1.样本检测情况:样本的总符合率为99.64%(40 490/40 635),阴性符合率为99.73%(8 105/8 127),阳性符合率为99.62%(32 385/32 508)(表1)。浓度为6.0×103、1.5×103、7.5×102拷贝/ml的德尔塔变异株样本,阳性符合率分别为99.84%(8 114/8 127)、99.73%(8 105/8 127)和99.41%(8 079/8 127),随样本浓度降低,实验室检测的符合率降低(表1)。而7.5×102 拷贝/ml浓度水平的非变异株样本符合率为99.51%(8 087/8 127),与同浓度的德尔塔变异株样本阳性符合率相比,差异无统计学意义(χ²=0.731,P=0.392)。
实验室共计回报145个错误的检测结果,其中假阴性结果占84.83%(123/145),假阳性结果占15.17%(22/145)。对浓度为6.0×103、1.5×103、7.5×102 拷贝/ml的德尔塔变异株样本,实验室分别回报了13、22、48个假阴性结果。对7.5×102 拷贝/ml的非变异株样本,实验室回报了40个假阴性结果。由此可见,假阴性结果主要集中在7.5×102 拷贝/ml的德尔塔变异株和非变异株样本上,占所有假阴性结果的71.54%(88/123)。
2.不同检测试剂的样本检测情况:使用实验室数≥100家的各检测试剂的样本总符合率、阴性符合率和阳性符合率均>98%(表2)。对同浓度的德尔塔变异株样本,各检测试剂的阳性符合率差异均无统计学意义(χ²=14.798、14.745、6.344,均P>0.05)。各检测试剂在检测7.5×102 拷贝/ml的德尔塔变异株和非变异株样本时,样本符合率差异均无统计学意义(均P>0.05)。对使用实验室数≥100家的检测试剂各靶区域的Ct值进行统计分析(表2),结果表明使用同一种试剂,实验室间报告的Ct值的CV差异较大,CV范围为3.98%~8.34%。
德尔塔变异株世界范围的大流行,给疫情防控带来了新的挑战。2020年3月,本中心首次开展新型冠状病毒核酸检测EQA时,实验室合格率为80.30%[6],而本次新型冠状病毒德尔塔变异株核酸检测EQA成绩合格的实验室占98.77%,全国实验室的检测能力大幅提升。
本次EQA重点考核的是实验室对德尔塔变异株的检测能力。结果表明,各浓度德尔塔变异株样本的符合率均高于99%,同浓度(7.5×102 拷贝/ml)水平的德尔塔变异株和非变异株样本的阳性符合率差异无统计学意义。由此可见,目前我国临床实验室对德尔塔变异株和非变异株具有同等的检测能力。本次EQA实验室共计回报145个错误结果,假阴性结果和假阳性结果分别占84.83%(123/145)和15.17%(22/145),说明假阴性结果仍是目前实验室结果不准确的主要原因。依据《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》,实验室应使用高敏感性(检测下限≤500 拷贝/ml)的试剂进行临床样本的检测[7]。因此,本次EQA样本盘设置了3个浓度梯度的德尔塔变异株样本,分别为6.0×103、1.5×103和7.5×102 拷贝/ml,以及1个7.5×102拷贝/ml的非变异株样本,以充分评价实验室对弱阳性样本的检测能力,反映实验室层面的假阴性结果,即标本中存在足够量的病毒核酸但没有被检出的情况[8]。本研究结果中,实验室检测的符合率随样本浓度降低而呈现下降趋势,说明弱阳性样本是影响检测准确性的重要原因。对于浓度同为7.5×102 拷贝/ml的德尔塔变异株和非变异株弱阳性样本,实验室分别回报了48和40个假阴性结果,占所有假阴性结果的71.54%(88/123),说明少部分实验室对于弱阳性的样本的检测能力仍不足。尽管德尔塔变异株感染者体内病毒载量较高,通常为非变异株感染者的100~1 000倍[9, 10],感染持续时间延长,病毒在体内转阴需要13~15 d,有的患者甚至需要20 d以上,远远长于原始毒株的7~9 d[11, 12],其核酸检测的阳性率较高,但在潜伏期或病程后期,样本中新型冠状病毒载量可能较低[13]。因此,临床实验室需保证对于德尔塔变异株弱阳性样本的检测能力,最大程度地避免漏检。此外,对于1.5×103 拷贝/ml和6.0×103拷贝/ml的德尔塔变异株样本,实验室也分别回报了22个和13个假阴性结果,其中24家实验室报告了2个假阴性结果,8家实验室报告了3个假阴性结果,这32家实验室中,县级医院占半数以上(59.38%,19/32),且此前从未参加全国新型冠状病毒核酸检测EQA。这些实验室的检测能力严重不足,应从人员、仪器、试剂耗材、标准操作程序、环境所涉及的各个环节查找可能导致假阴性结果的原因。本次EQA中的假阳性结果占比相对较低(15.45%,19/123),均为随机错误,无检测试剂倾向性,可能由于样本检测操作过程中的交叉污染或以往扩增产物遗留污染所致[14, 15, 16]。
各试剂检测德尔塔变异株样本总符合率、阴性符合率和阳性符合率均>99%(表2),检测同浓度(7.5×102 拷贝/ml)的德尔塔变异株和非变异株样本时符合率差异无统计学意义,且各靶基因检测的Ct值亦无差异。本次EQA样本包含GISAID数据库中现有德尔塔变异株序列ORF1a基因C1191T/C1267T/C3037T、ORF1b基因C14408T/G15451A/C16466T、ORF3a基因C25469T、S基因T22917G/C22995A/A23403G和N基因A28461G/G28881T/G29402T等突变位点,上述结果说明这些突变位点均不在现有检测试剂引物-探针和目的序列结合的关键区域。在临床标本检测中,国内外已有试剂对其他变异株靶基因漏检的报道。例如,比利时实验室人员使用罗氏试剂检测时发现,8例26340C>U突变的样本E基因全部漏检,进化分析表明变异株来自英国、瑞士和土耳其等国家[17]。意大利、德国等实验室使用Thermofisher和Cepheid试剂,也均发现含有特定变异位点的样本N基因无法检出,该变异株在西班牙、澳大利亚、丹麦、美国和英国等多个国家均有流行[2,18]。因此,为避免德尔塔变异株某一突变位点造成的单个靶区域的假阴性结果,在新型冠状病毒肺炎疫情防控中,实验室应使用双靶检测试剂[2,19, 20],并持续关注变异位点可能对检测造成的影响。
通过对Ct值的分析发现,同一种试剂检测同一样本的同一靶区域,不同实验室回报的Ct值差异很大,CV最大可达8.34%。这是由于不同实验室的检测流程存在差异,样本提取时使用的样本量、提取试剂、提取仪、洗脱体积以及最终获得的核酸浓度,样本检测时使用的扩增仪、反应体系配制的准确程度,结果判读时基线和阈值线的设置等因素均会造成实验室检测的差异。虽然商品化试剂在批准上市前已经建立了性能参数,完成了性能确认,但这并不意味着该性能在实验室均可复现,每个实验室在将商品化试剂应用于临床检测前,需进行检测限和重复性的性能验证[16,21],建立标准操作程序(SOP),日常检测均进行EQA,以持续保证检测结果的准确可靠。
所有作者均声明不存在利益冲突



























