
探讨程序性细胞死亡配体1(PD-L1)在同步放化疗非表皮生长因子受体(EGFR)突变局部晚期非小细胞肺癌(NSCLC)中的表达及其与患者预后的关系。
回顾性分析中国医学科学院肿瘤医院放疗科2016年1月至2017年12月收治的根治性同步放化疗非EGFR突变局部晚期不可手术的19例NSCLC患者的临床资料。采用免疫组化方法以兔单克隆抗体SP263检测PD-L1在NSCLC组织中的表达,以肿瘤阳性细胞比例≥1%为PD-L1阳性表达,分别分析PD-L1表达≥1%和≥25%与NSCLC患者临床特征和预后的关系。
19例NSCLC患者中,PD-L1阳性表达13例,其中PD-L1表达≥25%者4例。PD-L1表达≥1%和PD-L1表达<1%组年龄、吸烟史、病理类型和TNM分期差异均无统计学意义(均P>0.05)。15例患者可进行疗效评价,其中部分缓解(PR)7例,疾病稳定(SD)7例,疾病进展(PD)1例。PD-L1表达<1%组患者客观缓解3例,疾病控制4例;PD-L1表达≥1%组患者客观缓解4例,疾病控制10例。PD-L1表达<25%组患者客观缓解6例,疾病控制11例;PD-L1表达≥25%组患者客观缓解1例,疾病控制3例。PD-L1表达≥1%组患者的中位生存时间为35个月(95%CI:12.7~57.3个月),PD-L1表达<1%组患者的中位生存时间为40个月(95%CI未达终点),差异无统计学意义(P=0.284);PD-L1≥25%组患者的中位生存时间为12个月(95%CI:0.0~34.5个月),PD-L1<25%组患者的中位生存时间为40个月(95%CI:27.4~52.6个月),差异无统计学意义(P=0.241)。
PD-L1阳性接受同步放化疗非EGFR突变局部晚期NSCLC患者的预后有不良趋势,有必要扩大样本量探索PD-L1在局部晚期不可手术NSCLC患者中的预后意义,并探讨免疫治疗对不同PD-L1表达水平患者的疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的85%,超过30%的患者确诊时已处于局部晚期,通常预后较差[1, 2]。NSCLC传统的预后因素除了肿瘤TNM分期外,还包括患者的性别、体力状况评分以及体重下降情况[3],但这些因素尚不足以全面解释患者之间的预后差异。因此,探索新的、更准确的预后预测标志物对患者的个体化治疗具有指导性意义。
程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)是一种Ⅰ型跨膜蛋白,通过与T细胞上表达的程序性细胞死亡受体1(programmed cell death 1,PD-1)相互作用,抑制免疫应答[4]。目前,已在黑色素瘤、NSCLC、乳腺癌、卵巢癌、肝细胞癌等多种恶性肿瘤中检测到PD-L1的表达或过表达[5],针对PD-L1/PD-1通路的免疫检查点抑制剂(immune-checkpoint inhibitors,ICIs)的使用也在抗肿瘤治疗中取得了突破性进展[6, 7]。近年来,有研究相继报道在局部晚期不可手术的NSCLC中,PD-L1抑制剂巩固治疗不但可以提高患者的局部无进展生存时间,还可以改善总生存时间(overall survival,OS),5年生存率达到42.9%[8, 9, 10]。目前,免疫巩固治疗已成为局部晚期不可手术的NSCLC标准治疗的一部分,但真正能从ICIs治疗中获益的患者却很有限。PD-L1表达是第一个用于免疫治疗疗效预测的生物标志物,已有多个NSCLC免疫治疗相关的临床试验对其有效性进行了评估[11]。PACIFIC研究的结果也显示,在肿瘤细胞PD-L1表达≥1%的患者中,免疫巩固治疗可带来OS的获益,而在PD-L1表达<1%的患者中未观察到类似结果[12]。本研究回顾性分析了中国医学科学院肿瘤医院放疗科收治的19例接受同步放化疗的不可手术局部晚期NSCLC患者的临床病理资料,初步探讨肿瘤细胞PD-L1表达与预后的关系。
1. 对象:收集2016年1月至2017年12月在中国医学科学院肿瘤医院放疗科接受同步放化疗的NSCLC患者资料。纳入标准:(1)原发肿瘤组织经病理组织学证实为NSCLC;(2)表皮生长因子受体(epidermal growth factor receptor,EGFR)突变检测为阴性;(3)根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7版分期分为不可手术的ⅢA期或ⅢB期;(4)接受放疗照射剂量≥50 Gy;(5)治疗前肿瘤原发灶石蜡标本可获得,并有足量的组织进行检测;(6)既往无其他恶性肿瘤治疗史。
共有19例接受同步放化疗的局部晚期NSCLC患者符合入组标准,进入本研究。19例NSCLC患者全部为男性,年龄41~69岁,中位年龄59岁。17例患者有吸烟史。11例患者治疗前有PET-CT指导分期。ⅢA期10例,ⅢB期9例。鳞癌14例,腺癌5例。所有患者均接受调强放疗,总照射剂量为54~70 Gy,放疗期间同步化疗方案多为依托泊苷或紫杉醇联合铂类的双药化疗。本研究符合赫尔辛基宣言对伦理的要求,所有患者在治疗前均已签署知情同意书。
2. PD-L1的检测和结果判定:兔单克隆抗体PD-L1(克隆编号SP263)和免疫组化检测试剂盒均购于上海罗氏诊断产品有限公司。将甲醛固定石蜡包埋的NSCLC组织,4 μm连续切片,封固于带正电荷的载玻片上。按照试剂盒说明书提供的检测步骤在BenchMark ULTRA自动染色仪上进行免疫组化染色。由2位有经验的病理学家对染色结果进行阅片。PD-L1表达阳性的肿瘤细胞定义为部分或全部肿瘤细胞膜呈现任何强度的染色即算作阳性细胞,然后计算肿瘤细胞阳性比例(tumor proportion score,TPS),即任何强度的PD-L1膜染色阳性肿瘤细胞数占肿瘤细胞总数的百分比。参照文献[12, 13]的方法,将TPS≥1%定义为PD-L1表达阳性,分别将患者分为TPS≥1%组和TPS<1%组以及TPS≥25%组和TPS<25%组进行后续分析。
3. 评价标准:根据患者治疗结束后4~6周增强CT的结果,按照实体瘤疗效评价标准(1.1版)对同步放化疗后近期疗效进行评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)[14]。客观缓解为CR+PR患者,疾病控制为CR+PR+SD患者。OS的定义为从病理诊断日期到患者因任何原因死亡或末次随访的日期。
4. 随访:以电话随访或者患者来院复查的方式对所有患者进行随访,随访截至2021年7月5日。
5. 统计学方法:采用SPSS 25.0统计学软件对数据资料进行分析,各组间计数资料的比较采用Fisher精确概率法检验。通过Kaplan-Meier法和Log Rank检验比较各组患者OS的差异。双侧检验,检验水准为α=0.05。
1. PD-L1的表达情况:免疫组化检测结果如图1所示。19例NSCLC患者中,PD-L1阳性表达(TPS≥1%)13例,其中PD-L1表达≥25% 4例。
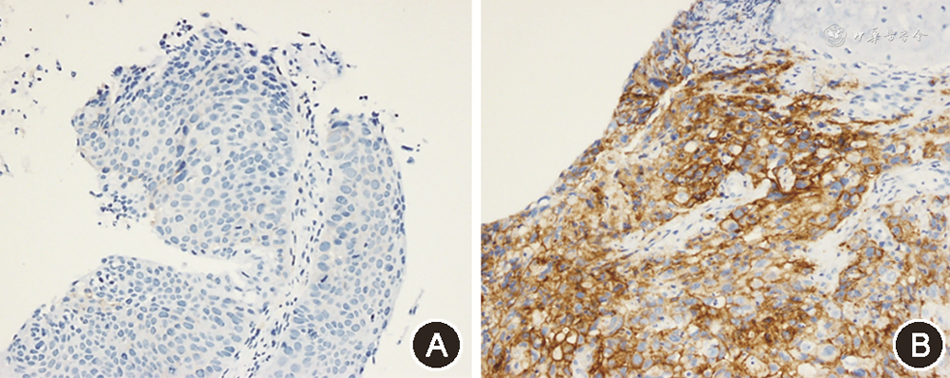

2. PD-L1的表达与NSCLC患者临床病理特征的关系:PD-L1表达≥1%和PD-L1表达<1%组NSCLC患者的年龄、吸烟史、病理类型、TNM分期的差异均无统计学意义(均P>0.05),PD-L1表达≥25%和PD-L1表达<25%组NSCLC患者的年龄、吸烟史、病理类型、TNM分期的差异亦均无统计学意义(均P>0.05,表1)。
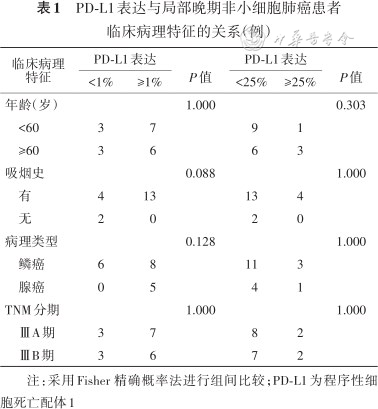
PD-L1表达与局部晚期非小细胞肺癌患者临床病理特征的关系(例)
PD-L1表达与局部晚期非小细胞肺癌患者临床病理特征的关系(例)
临床病理 特征 | PD-L1表达 | P值 | PD-L1表达 | P值 | ||
|---|---|---|---|---|---|---|
| <1% | ≥1% | <25% | ≥25% | |||
| 年龄(岁) | 1.000 | 0.303 | ||||
<60 | 3 | 7 | 9 | 1 | ||
≥60 | 3 | 6 | 6 | 3 | ||
| 吸烟史 | 0.088 | 1.000 | ||||
有 | 4 | 13 | 13 | 4 | ||
无 | 2 | 0 | 2 | 0 | ||
| 病理类型 | 0.128 | 1.000 | ||||
鳞癌 | 6 | 8 | 11 | 3 | ||
腺癌 | 0 | 5 | 4 | 1 | ||
| TNM分期 | 1.000 | 1.000 | ||||
ⅢA期 | 3 | 7 | 8 | 2 | ||
ⅢB期 | 3 | 6 | 7 | 2 | ||
注:采用Fisher 精确概率法进行组间比较;PD-L1为程序性细胞死亡配体1
3. 近期疗效:19例NSCLC患者中,有15例患者可以进行同步放化疗后的近期疗效评价,其中PR 7例,SD 7例,PD 1例,无CR患者,客观缓解7例,疾病控制14例。1例进展患者的治疗失败原因为胸腔内播散和远处转移,患者在进行胸水引流和胸腔内注射化疗药物缓解症状后接受了系统性化疗。
4. PD-L1的表达与NSCLC患者近期疗效的关系:PD-L1表达<1%组患者客观缓解3例,疾病控制4例;PD-L1表达≥1%组患者客观缓解4例,疾病控制10例。PD-L1表达<25%组患者客观缓解6例,疾病控制11例;PD-L1表达≥25%组患者客观缓解1例,疾病控制3例。
5. 生存情况:19例患者的中位随访时间为58个月。截至末次随访日期,生存6例,死亡13例,全组患者的中位OS为39个月(95%CI:32.9~46.1个月)。
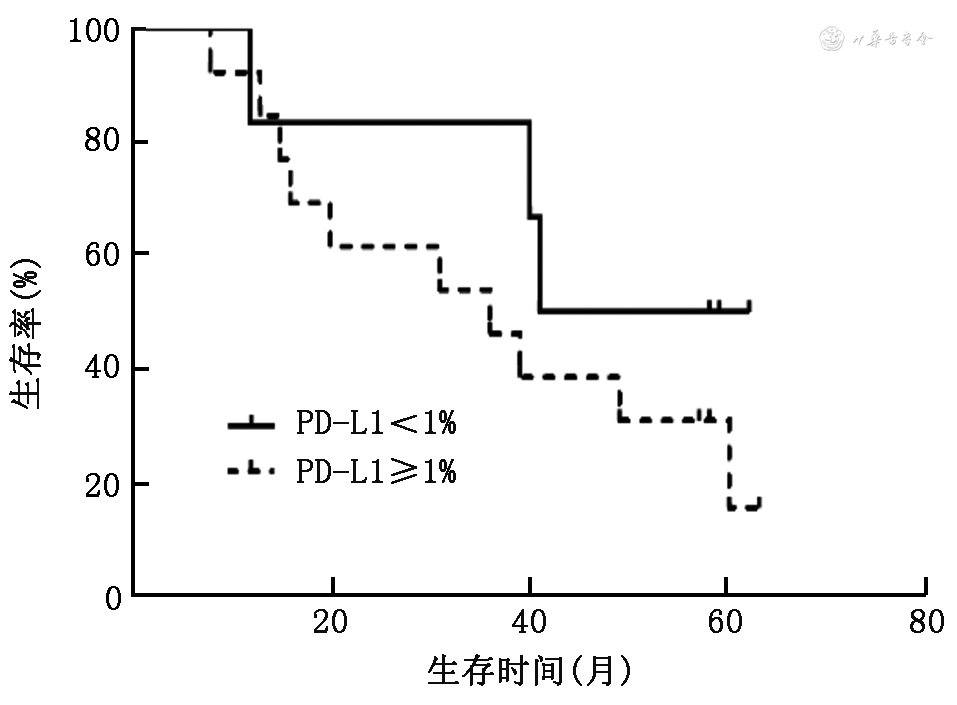
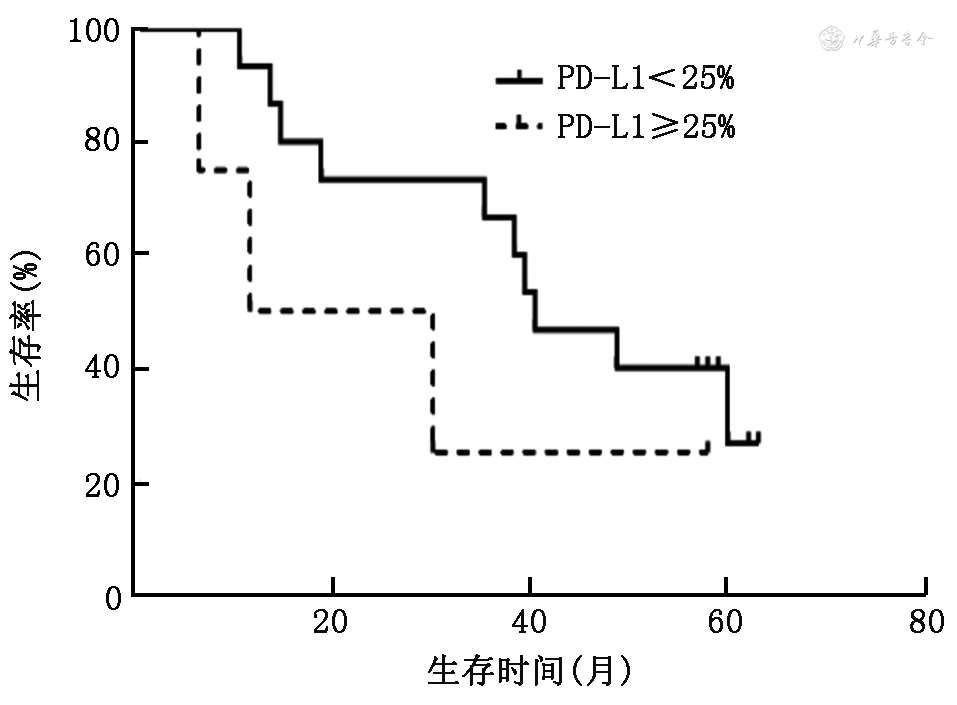
6. PD-L1的表达与NSCLC患者生存的关系:PD-L1表达<1%组和PD-L1表达≥1%组NSCLC患者的中位OS分别为40个月(95%CI未达终点)和35个月(95%CI:12.7~57.3个月),差异无统计学意义(χ²=1.15,P=0.284;图2)。PD-L1表达<25%组和PD-L1表达≥25%组患者的中位OS分别为40个月(95%CI:27.4~52.6个月)和12个月(95%CI:0.0~34.5个月),差异亦无统计学意义(χ²=1.38,P=0.241;图3)。


有研究显示,PD-L1在NSCLC患者中的表达为24%~60%,其以TPS≥5%为阳性界值,检测的抗体也多种多样[15]。在PACIFIC的研究中,当使用兔单克隆抗体SP263对PD-L1进行检测时,PD-L1表达≥1%的患者占67%[12],与本研究相似;但PD-L1表达≥25%的患者比例(35%)略高于本研究,这可能与本研究样本量较少有关。
PD-L1的表达与实体肿瘤的不良预后有关,但在各肿瘤亚型中的相关性不同[16]。荟萃分析显示,PD-L1的表达增加了肺癌患者的死亡风险[17]。但该研究主要纳入2017年以前的文献,且以可手术切除的早期肺癌为主,当时免疫治疗刚在接受同步放化疗的局部晚期NSCLC患者中取得进步,因此,PD-L1表达在该部分患者中的预后作用尚无定论。近年来,有学者对PD-L1表达与接受同步放化疗不可手术NSCLC患者预后的关系进行研究[13,18, 19, 20]。Vrankar等[18]的研究表明,PD-L1表达阳性是局部晚期NSCLC患者同步放化疗后的独立不良预后因素。与本研究不同的是,Vrankar等[18]在研究中用SP142抗体进行检测,以综合阳性评分对PD-L1的表达进行判断。Vrankar等[13]又以SP263抗体在117例接受同步放化疗的局部晚期NSCLC患者中进行了PD-L1检测,以TPS≥1%为阳性表达判断标准,结果显示,PD-L1表达与局部晚期NSCLC患者的预后无关,也未观察到不良预后趋势。这是目前纳入病例数较多的关于PD-L1表达与接受同步放化疗的不可手术切除的Ⅲ期NSCLC患者预后关系的研究,但该研究未说明是否含有EGFR突变的患者,因为EGFR突变本身可能会对NSCLC患者的预后产生一定的影响[21],因此排除EGFR突变患者进行分析可能会使研究结果更加严谨。另外一项使用SP263抗体对PD-L1检测的研究虽然未发现PD-L1表达是不可手术的局部晚期NSCLC的独立预后因素,但显示PD-L1表达阴性的患者预后更好,这可能与使用不同的评价指标有关[19]。Tokito等[20]采用EPR1161抗体对PD-L1进行检测,以TPS≥5%为阳性界值,未显示PD-L1表达与局部晚期NSCLC患者的预后有关。近期一项研究分析了28-8、22C3、SP263和SP142抗体在肿瘤细胞中的表达与NSCLC患者预后的关系,结果显示,使用SP142抗体检测的PD-L1过表达(TPS≥50%)是NSCLC患者的独立不良预后因素,而使用28-8、22C3和SP263抗体检测的PD-L1过表达(TPS≥50%)是大细胞癌亚型患者的独立不良预后因素[22]。因此,有必要分析不同抗体、不同PD-L1表达在局部晚期不可手术NSCLC患者预后中的作用。
肿瘤细胞PD-L1和细胞毒性T细胞上的PD-1相互作用可导致肿瘤生长加速,而抗PD-L1抗体治疗或敲除移植瘤小鼠中的PD-1基因减缓肿瘤生长[23],这为针对PD-1/PD-L1通路ICIs的研发和应用提供理论基础。尤其是在转移性NSCLC中,PD-L1表达被用来筛选符合ICIs治疗的患者或用来判断患者的生存获益情况。在PD-L1表达≥50%的晚期NSCLC患者中,与接受含铂类化疗方案相比,采用帕博利珠单抗治疗的患者会有明显的生存获益[24, 25]。在KEYNOTE-042研究中,入组标准变为PD-L1表达≥1%的局部晚期或转移性NSCLC患者,与化疗方案相比,帕博利珠单抗治疗仍可使患者生存获益,并且PD-L1表达≥50%的患者获益更明显[26]。针对局部晚期不可手术的Ⅲ期NSCLC免疫治疗的研究中,PACIFIC研究设计并未纳入PD-L1表达情况,虽然结果显示,局部晚期不可手术NSCLC患者在接受同步放化疗后无PD的情况下,可获益于免疫巩固治疗[8, 9, 10];但也有研究显示,当PD-L1表达<1%时,与安慰剂组相比,度伐利尤单抗治疗并未给入组患者带来生存获益[12]。目前,在欧洲和日本也只批准在PD-L1表达≥1%的患者中使用度伐利尤单抗。因此,研究免疫治疗在不同PD-L1表达水平不可手术Ⅲ期NSCLC患者中的疗效,具有指导意义。本研究为回顾性研究,研究之时免疫治疗尚未开展,全组患者客观缓解7例,疾病控制14例,这与PROCLAIM研究相似,甚至略高[27]。Vrankar等[18]在研究中分析PD-L1表达(SP142抗体,PD-L1界值为5%)与NSCLC患者客观缓解率的关系,结果显示,PD-L1阴性组的客观缓解率(79.3%)虽高于PD-L1阳性组(50.0%),但差异无统计学意义(P=0.200)。该研究整体疗效高于本研究,可能是因为Vrankar等[18]评估的是治疗后5个月的疗效,本研究只评估了同步放化疗后1个月的疗效,而放疗具有特殊的生物学效应,放疗后肿瘤在3个月甚至半年时还会持续缩小。
总之,PD-L1表达阳性且接受同步放化疗的非EGFR突变局部晚期NSCLC患者的生存有降低趋势,有必要扩大样本量探索PD-L1在局部晚期不可手术的NSCLC患者中的预后作用,并进一步探讨免疫治疗对不同PD-L1表达水平NSCLC患者的疗效。
所有作者均声明不存在利益冲突































