
探讨65岁及以上老年乳腺癌患者治疗方式选择并综合分析其影响因素。
收集2009年1月至2015年12月在北京协和医院手术治疗的521例年龄≥65岁的老年乳腺癌患者的临床资料,全部为女性,年龄65~98岁。按照年龄分为65~74岁组(n=353)和≥75岁组(n=168)。比较两组间包括患者年龄、功能状况、治疗方式、病理特点、合并症和生存时间等变量的差异。并分析其综合治疗方式的差异及其对临床疗效的影响。
两组患者手术方式主要为改良根治术[分别为39.1%(138/353)和33.9%(57/168)]、保乳手术[(分别为56.9%(201/353)和61.3%(103/168)]。术后选择辅助治疗的患者中,除化疗外两组间差异均无统计学意义(均P>0.05)。单因素分析显示,化疗的选择与年龄、手术方式、病理类型、肿瘤负荷、分子分型、功能状况以及合并症有关(均P<0.05)。美国东部肿瘤协作组(ECOG)评分和合并症数量是影响老年乳腺癌化疗选择的独立影响因素[ECOG评分:调整后OR=0.45(95CI:0.26~0.75),合并症数量:调整后OR=0.63(95CI:0.41~0.98);均P<0.05]。521例老年乳腺癌患者的5年无病生存率为86.3%,5年总生存率为88.8%,乳腺癌特异性生存率为94.3%。
≥65岁老年乳腺癌患者的综合治疗方式不受年龄影响,但与肿瘤负荷、病理类型、分子分型、合并症及ECOG评分相关。其中,ECOG评分和合并症数量是影响术后辅助化疗选择的独立影响因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着世界范围内乳腺癌整体发病率的不断增高以及我国社会老龄化的加剧,老年乳腺癌发生率在逐年增加[1]。老年乳腺癌的个体化治疗策略问题也日益引发关注,成为目前临床工作面临的重要课题。≥65岁老年乳腺癌患者具有体能异质性大,治疗耐受性差及合并症多等不同于年轻乳腺癌患者的特点,很少被纳入临床研究,故治疗缺乏相应的证据及指南支持[2]。了解影响老年乳腺癌综合治疗选择的相关因素对临床评估及方案制定,建立我国老年乳腺癌个体化治疗策略有重要的临床意义。因此,本研究通过分析521例≥65岁老年乳腺癌患者的临床资料,探讨老年乳腺癌患者的治疗方式及影响因素,为建立老年乳腺癌的治疗前评估模型提供依据。
本研究为病例对照研究,回顾性纳入2009年1月至2015年12月北京协和医院院乳腺中心收治手术的≥65岁原发性乳腺癌患者521例,全部为女性,年龄65~90岁。(1)纳入标准:于本院初诊且接受手术治疗的≥65岁女性乳腺癌患者,经本院临床病理证实且具有完整的病例资料并接受随访观察。(2)排除标准:复发转移性乳腺癌;已于外院初诊手术难以获得完整病例资料者;不能接受长期随访观察者。本研究已获得北京协和医院伦理委员会审批(ZS-2682)。
521例患者按照年龄分为65~74岁组(353例)和≥75岁组(168例)。其中,浸润性导管癌362例(69.5%),浸润性小叶癌26例(5.0%),导管内癌91例(17.5%),黏液腺癌25例(4.8%),小管癌、化生性癌和髓样癌等其他类型癌17例(3.3%)。雌激素受体(ER)和(或)孕激素受体(PR)阳性(Luminal型)396例(76.0%),ER阴性、PR阴性和人表皮生长因子受体2(HER-2)阴性(三阴性型)78例(15.0%),ER阴性、PR阴性和HER-2阳性(HER-2阳性型)38例(7.3%)。有421例患者(80.8%)就诊时并发其他系统慢性疾病,其中仅并发高血压或冠状动脉粥样硬化性心脏病、糖尿病等其中1种合并症者139例(26.7%),同时并发2种慢性疾病者149例(26.7%),并发3种及3种以上慢性疾病者133例(20.3%)。
1.评价指标:选择美国东部肿瘤协作组(ECOG)评分和临床合并症作为评价指标。分析内容包括:老年乳腺癌患者的治疗方式包括改良根治术、保乳手术,接受术后辅助化疗的比例,接受术后放疗的比例,以及老年乳腺癌的化疗选择与患者年龄、手术方式、病理类型、肿瘤负荷、分子分型、功能状况和合并症等关系。临床疗效以老年乳腺癌患者的生存情况显示,包括5年无病生存率(DFS)、5年总生存率(OS)、乳腺癌特异性生存率(BCSS)。
2.临床分析:(1)对于老年乳腺癌患者是否如一般年龄人群选择辅助化疗及放疗,是临床尚存争议的问题,故对本研究中的老年乳腺癌患者选择化疗及放疗的影响因素进行单因素分析;(2)影响老年乳腺癌患者接受化疗及放疗的因素除疾病本身特征外,患者自身健康状况也是临床考虑因素,为了去除可能混杂因素的影响,在单因素分析基础上对合并症及ECOG在老年乳腺癌患者化疗和放疗选择中的影响做多因素分析;(3)对分析临床指标对5年DFS、5年OS、BCSS的影响。
3.统计学处理:采用R软件(4.0.3版本)进行统计学分析。涉及变量均为计数资料,用例(%)表示,采用χ2检验及Fisher精确概率检验比较两组间的差异。影响治疗方式的单因素及多因素分析采用logistic回归分析。用多变量Cox风险比例模型分析临床指标对5年DFS、5年OS、BCSS的影响。采用Kaplan-Meier法和Log rank检验进行生存分析。双侧检验,检验水准α=0.05。
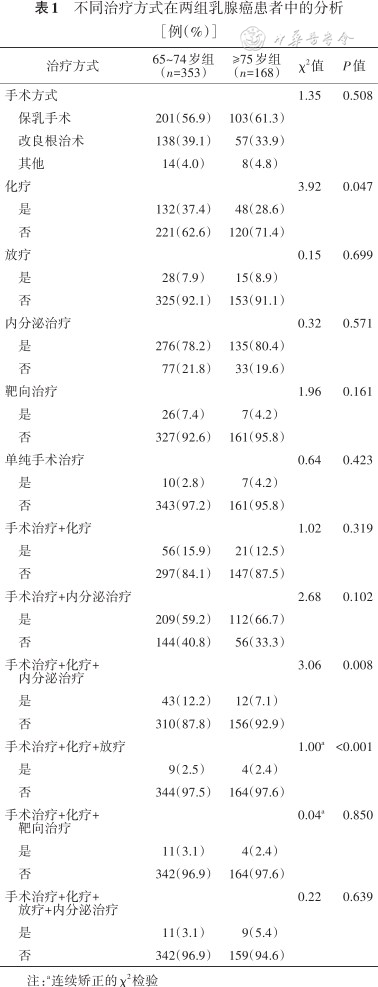
两组患者手术方式主要为改良根治术[分别为39.1%(138/353)和33.9%(57/168)]、保乳手术[(分别为56.9%(201/353)和61.3%(103/168)]。
接受术后辅助化疗的比例分别为37.4%(132/353)和28.6%(48/168);接受术后放疗的比例分别为7.9%(28/353)和8.9%(15/168);接受术后内分泌治疗的比例分别为78.2%(276/353)和80.4%(135/168)。除化疗外(P=0.047),两组间治疗选择差异均无统计学意义(均P>0.05)(表1)。
不同治疗方式在两组乳腺癌患者中的分析[例(%)]
不同治疗方式在两组乳腺癌患者中的分析[例(%)]
| 治疗方式 | 65~74岁组 (n=353) | ≥75岁组 (n=168) | χ2值 | P值 |
|---|---|---|---|---|
| 手术方式 | 1.35 | 0.508 | ||
保乳手术 | 201(56.9) | 103(61.3) | ||
改良根治术 | 138(39.1) | 57(33.9) | ||
其他 | 14(4.0) | 8(4.8) | ||
| 化疗 | 3.92 | 0.047 | ||
是 | 132(37.4) | 48(28.6) | ||
否 | 221(62.6) | 120(71.4) | ||
| 放疗 | 0.15 | 0.699 | ||
是 | 28(7.9) | 15(8.9) | ||
否 | 325(92.1) | 153(91.1) | ||
| 内分泌治疗 | 0.32 | 0.571 | ||
是 | 276(78.2) | 135(80.4) | ||
否 | 77(21.8) | 33(19.6) | ||
| 靶向治疗 | 1.96 | 0.161 | ||
是 | 26(7.4) | 7(4.2) | ||
否 | 327(92.6) | 161(95.8) | ||
| 单纯手术治疗 | 0.64 | 0.423 | ||
是 | 10(2.8) | 7(4.2) | ||
否 | 343(97.2) | 161(95.8) | ||
| 手术治疗+化疗 | 1.02 | 0.319 | ||
是 | 56(15.9) | 21(12.5) | ||
否 | 297(84.1) | 147(87.5) | ||
| 手术治疗+内分泌治疗 | 2.68 | 0.102 | ||
是 | 209(59.2) | 112(66.7) | ||
否 | 144(40.8) | 56(33.3) | ||
| 手术治疗+化疗+内分泌治疗 | 3.06 | 0.008 | ||
是 | 43(12.2) | 12(7.1) | ||
否 | 310(87.8) | 156(92.9) | ||
| 手术治疗+化疗+放疗 | 1.00a | <0.001 | ||
是 | 9(2.5) | 4(2.4) | ||
否 | 344(97.5) | 164(97.6) | ||
| 手术治疗+化疗+靶向治疗 | 0.04a | 0.850 | ||
是 | 11(3.1) | 4(2.4) | ||
否 | 342(96.9) | 164(97.6) | ||
| 手术治疗+化疗+放疗+内分泌治疗 | 0.22 | 0.639 | ||
是 | 11(3.1) | 9(5.4) | ||
否 | 342(96.9) | 159(94.6) |
注:a连续矫正的χ2检验
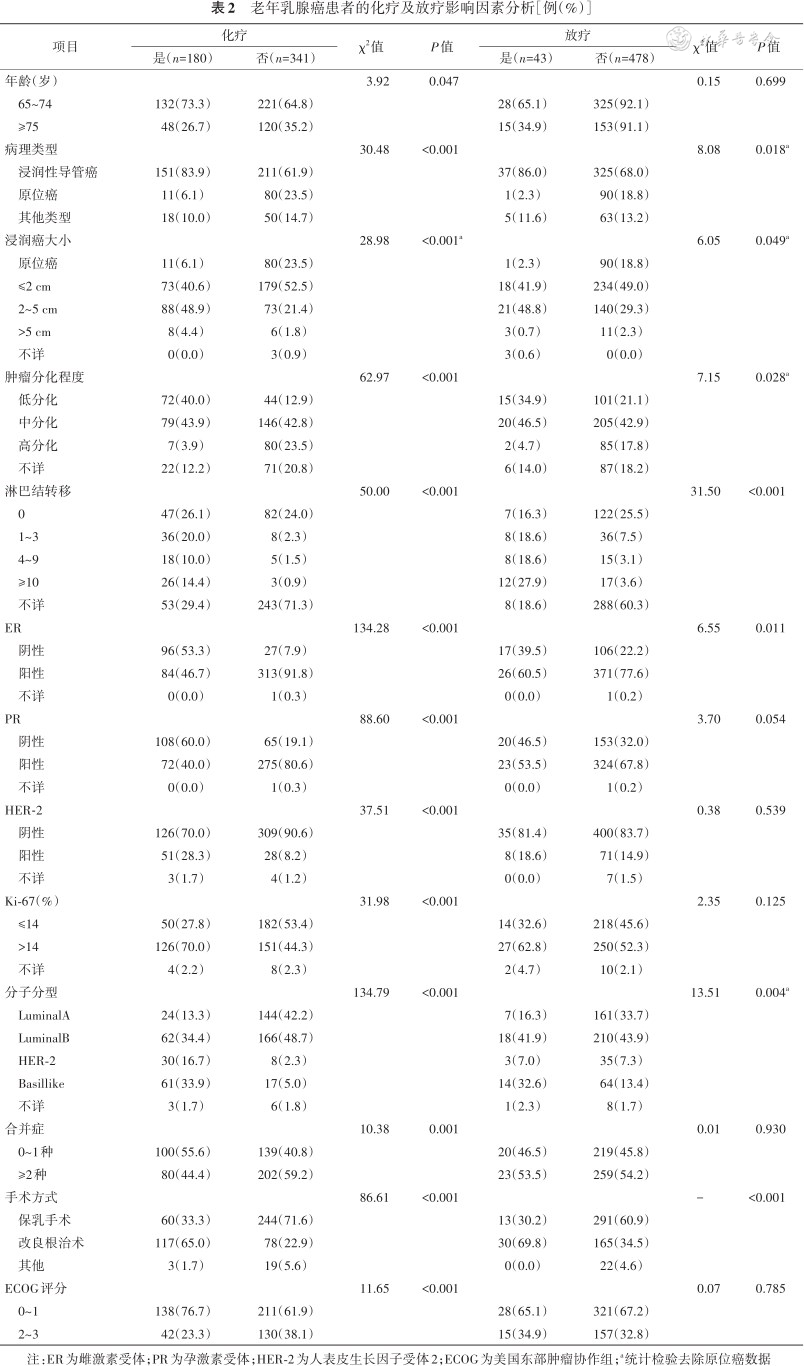
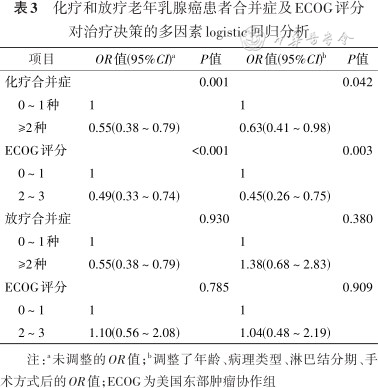
老年乳腺癌的化疗选择与患者年龄、手术方式、病理类型、肿瘤负荷、分子分型、功能状况以及合并症有关;老年乳腺癌的放疗选择与肿瘤负荷、手术方式、病理类型、分子分型有关(均P<0.05)(表2)。ECOG评分和合并症数量是影响老年乳腺癌化疗选择的独立影响因素[ECOG评分:调整后OR=0.45(95CI:0.26~0.75),合并症数量:调整后OR=0.63(95CI:0.41~0.98),均P<0.05],但并不是影响放疗选择的独立影响因素(均P>0.05)(表3)。
老年乳腺癌患者的化疗及放疗影响因素分析[例(%)]
老年乳腺癌患者的化疗及放疗影响因素分析[例(%)]
| 项目 | 化疗 | χ2值 | P值 | 放疗 | χ2值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|
| 是(n=180) | 否(n=341) | 是(n=43) | 否(n=478) | ||||||
| 年龄(岁) | 3.92 | 0.047 | 0.15 | 0.699 | |||||
65~74 | 132(73.3) | 221(64.8) | 28(65.1) | 325(92.1) | |||||
≥75 | 48(26.7) | 120(35.2) | 15(34.9) | 153(91.1) | |||||
| 病理类型 | 30.48 | <0.001 | 8.08 | 0.018a | |||||
浸润性导管癌 | 151(83.9) | 211(61.9) | 37(86.0) | 325(68.0) | |||||
原位癌 | 11(6.1) | 80(23.5) | 1(2.3) | 90(18.8) | |||||
其他类型 | 18(10.0) | 50(14.7) | 5(11.6) | 63(13.2) | |||||
| 浸润癌大小 | 28.98 | <0.001a | 6.05 | 0.049a | |||||
原位癌 | 11(6.1) | 80(23.5) | 1(2.3) | 90(18.8) | |||||
≤2 cm | 73(40.6) | 179(52.5) | 18(41.9) | 234(49.0) | |||||
2~5 cm | 88(48.9) | 73(21.4) | 21(48.8) | 140(29.3) | |||||
>5 cm | 8(4.4) | 6(1.8) | 3(0.7) | 11(2.3) | |||||
不详 | 0(0.0) | 3(0.9) | 3(0.6) | 0(0.0) | |||||
| 肿瘤分化程度 | 62.97 | <0.001 | 7.15 | 0.028a | |||||
低分化 | 72(40.0) | 44(12.9) | 15(34.9) | 101(21.1) | |||||
中分化 | 79(43.9) | 146(42.8) | 20(46.5) | 205(42.9) | |||||
高分化 | 7(3.9) | 80(23.5) | 2(4.7) | 85(17.8) | |||||
不详 | 22(12.2) | 71(20.8) | 6(14.0) | 87(18.2) | |||||
| 淋巴结转移 | 50.00 | <0.001 | 31.50 | <0.001 | |||||
0 | 47(26.1) | 82(24.0) | 7(16.3) | 122(25.5) | |||||
1~3 | 36(20.0) | 8(2.3) | 8(18.6) | 36(7.5) | |||||
4~9 | 18(10.0) | 5(1.5) | 8(18.6) | 15(3.1) | |||||
≥10 | 26(14.4) | 3(0.9) | 12(27.9) | 17(3.6) | |||||
不详 | 53(29.4) | 243(71.3) | 8(18.6) | 288(60.3) | |||||
| ER | 134.28 | <0.001 | 6.55 | 0.011 | |||||
阴性 | 96(53.3) | 27(7.9) | 17(39.5) | 106(22.2) | |||||
阳性 | 84(46.7) | 313(91.8) | 26(60.5) | 371(77.6) | |||||
不详 | 0(0.0) | 1(0.3) | 0(0.0) | 1(0.2) | |||||
| PR | 88.60 | <0.001 | 3.70 | 0.054 | |||||
阴性 | 108(60.0) | 65(19.1) | 20(46.5) | 153(32.0) | |||||
阳性 | 72(40.0) | 275(80.6) | 23(53.5) | 324(67.8) | |||||
不详 | 0(0.0) | 1(0.3) | 0(0.0) | 1(0.2) | |||||
| HER-2 | 37.51 | <0.001 | 0.38 | 0.539 | |||||
阴性 | 126(70.0) | 309(90.6) | 35(81.4) | 400(83.7) | |||||
阳性 | 51(28.3) | 28(8.2) | 8(18.6) | 71(14.9) | |||||
不详 | 3(1.7) | 4(1.2) | 0(0.0) | 7(1.5) | |||||
| Ki-67(%) | 31.98 | <0.001 | 2.35 | 0.125 | |||||
≤14 | 50(27.8) | 182(53.4) | 14(32.6) | 218(45.6) | |||||
>14 | 126(70.0) | 151(44.3) | 27(62.8) | 250(52.3) | |||||
不详 | 4(2.2) | 8(2.3) | 2(4.7) | 10(2.1) | |||||
| 分子分型 | 134.79 | <0.001 | 13.51 | 0.004a | |||||
LuminalA | 24(13.3) | 144(42.2) | 7(16.3) | 161(33.7) | |||||
LuminalB | 62(34.4) | 166(48.7) | 18(41.9) | 210(43.9) | |||||
HER-2 | 30(16.7) | 8(2.3) | 3(7.0) | 35(7.3) | |||||
Basillike | 61(33.9) | 17(5.0) | 14(32.6) | 64(13.4) | |||||
不详 | 3(1.7) | 6(1.8) | 1(2.3) | 8(1.7) | |||||
| 合并症 | 10.38 | 0.001 | 0.01 | 0.930 | |||||
0~1种 | 100(55.6) | 139(40.8) | 20(46.5) | 219(45.8) | |||||
≥2种 | 80(44.4) | 202(59.2) | 23(53.5) | 259(54.2) | |||||
| 手术方式 | 86.61 | <0.001 | - | <0.001 | |||||
保乳手术 | 60(33.3) | 244(71.6) | 13(30.2) | 291(60.9) | |||||
改良根治术 | 117(65.0) | 78(22.9) | 30(69.8) | 165(34.5) | |||||
其他 | 3(1.7) | 19(5.6) | 0(0.0) | 22(4.6) | |||||
| ECOG评分 | 11.65 | <0.001 | 0.07 | 0.785 | |||||
0~1 | 138(76.7) | 211(61.9) | 28(65.1) | 321(67.2) | |||||
2~3 | 42(23.3) | 130(38.1) | 15(34.9) | 157(32.8) | |||||
注:ER为雌激素受体;PR为孕激素受体;HER-2为人表皮生长因子受体2;ECOG为美国东部肿瘤协作组;a统计检验去除原位癌数据
化疗和放疗老年乳腺癌患者合并症及ECOG评分对治疗决策的多因素logistic回归分析
化疗和放疗老年乳腺癌患者合并症及ECOG评分对治疗决策的多因素logistic回归分析
| 项目 | OR值(95%CI)a | P值 | OR值(95%CI)b | P值 |
|---|---|---|---|---|
| 化疗合并症 | 0.001 | 0.042 | ||
0~1种 | 1 | 1 | ||
≥2种 | 0.55(0.38~0.79) | 0.63(0.41~0.98) | ||
| ECOG评分 | <0.001 | 0.003 | ||
0~1 | 1 | 1 | ||
2~3 | 0.49(0.33~0.74) | 0.45(0.26~0.75) | ||
| 放疗合并症 | 0.930 | 0.380 | ||
0~1种 | 1 | 1 | ||
≥2种 | 0.55(0.38~0.79) | 1.38(0.68~2.83) | ||
| ECOG评分 | 0.785 | 0.909 | ||
0~1 | 1 | 1 | ||
2~3 | 1.10(0.56~2.08) | 1.04(0.48~2.19) |
注:a未调整的OR值;b调整了年龄、病理类型、淋巴结分期、手术方式后的OR值;ECOG为美国东部肿瘤协作组
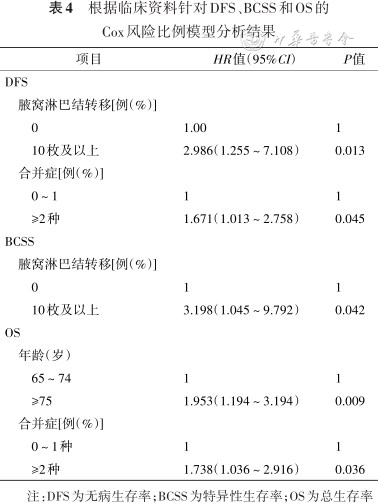
本研究中521例老年乳腺癌患者的5年DFS为86.3%,5年OS与BCSS分别为88.8%和94.3%。Cox风险比例模型分析显示DFS与腋窝淋巴结转移[HR=2.986(95%CI:1.255~7.108)]与合并症数量[HR=1.671(95%CI:1.013~2.750)]有关,BCSS与腋窝淋巴结转移有关[HR=3.198(95%CI:1.045~9.792)],OS与年龄[HR=1.953(95%CI:1.194~3.194)]及合并症数量有关[HR=1.738(95%CI:1.036~2.916)](均P<0.05)(表4)。
根据临床资料针对DFS、BCSS和OS的Cox风险比例模型分析结果
根据临床资料针对DFS、BCSS和OS的Cox风险比例模型分析结果
| 项目 | HR值(95%CI) | P值 | |
|---|---|---|---|
| DFS | |||
腋窝淋巴结转移[例(%)] | |||
| 0 | 1.00 | 1 | |
| 10枚及以上 | 2.986(1.255~7.108) | 0.013 | |
合并症[例(%)] | |||
| 0~1 | 1 | 1 | |
| ≥2种 | 1.671(1.013~2.758) | 0.045 | |
| BCSS | |||
腋窝淋巴结转移[例(%)] | |||
| 0 | 1 | 1 | |
| 10枚及以上 | 3.198(1.045~9.792) | 0.042 | |
| OS | |||
年龄(岁) | |||
| 65~74 | 1 | 1 | |
| ≥75 | 1.953(1.194~3.194) | 0.009 | |
合并症[例(%)] | |||
| 0~1种 | 1 | 1 | |
| ≥2种 | 1.738(1.036~2.916) | 0.036 | |
注:DFS为无病生存率;BCSS为特异性生存率;OS为总生存率
相对于年轻乳腺癌来说,65岁及以上老年乳腺癌患者存在年龄大、并发疾病多的特点,使得老年乳腺癌的治疗选择不仅要考虑疾病特点,还需要考虑年龄、合并症、功能状态等老年综合评估状况[3, 4]。2012年国际老年癌症学会(SIOG)和欧洲乳腺癌专家学会(EUSOMA)联合推出老年乳腺癌的治疗共识,提出年龄并不是影响老年乳腺癌综合治疗选择的独立影响因素[5]。本研究中,65~74岁组和≥75岁组患者的手术方式、放疗选择、内分泌治疗及靶向治疗的选择差异均无统计学意义,提示年龄并不是手术方式选择的影响因素,年龄也没有影响除化疗外的辅助治疗方式的选择。
化疗是乳腺癌综合治疗中的重要方法,是否选择化疗取决于对疾病复发风险的评估以及对机体耐受性的评估[6]。从整体来说,老年患者健康状态较年轻患者稍差,这就使得耐受性评估显得尤为重要[7, 8]。老年乳腺癌患者耐受性评估的具体内容尚无定论,国际癌症学会的治疗共识建议应借鉴老年综合评估(CGA)的内容适当简化修改,形成适合老年乳腺癌的简化版老年评估(aCGA),但aCGA的纳入条目也尚未达成共识[4]。但是,合并症数量和ECOG评分是影响老年肿瘤治疗选择的重要因素,这一认识是基本一致的[7]。本研究中,对可能影响化疗选择的肿瘤相关因素及合并症数量、ECOG评分做了单因素分析,结果显示化疗的选择除与肿瘤负荷、分子分型等肿瘤特点相关外,还与年龄、手术方式、ECOG评分以及合并症数量有关。进一步的多因素分析显示,ECOG评分和合并症数量是影响老年乳腺癌化疗选择的独立影响因素,提示合并症和功能活动状况对老年乳腺癌患者辅助化疗的选择有明确影响,这和既往研究一致[9, 10],也与其他实体肿瘤的相关研究一致[11, 12, 13, 14]。
对于接受保乳手术的老年乳腺癌患者来说,如果临床Ⅰ期且受体阳性则可以免除放疗,这是经过既往多个临床研究证实且已在临床广泛应用[15, 16]。同时,也有临床研究发现,对于腋窝临床阴性的老年乳腺癌患者保乳术后免除放疗并未增加乳腺癌相关死亡率[17, 18]。所以,总体来说老年乳腺癌群体中接受辅助放疗的比例比一般人群低[19]。在本研究中也得到了相似的结果,<75岁和≥75岁两组患者中,接受术后放疗的比例分别为7.9%和8.9%,且放疗的选择仅与肿瘤负荷、分子分型等疾病复发风险相关,而与年龄、ECOG评分、合并症等无关。原因可能是辅助放疗相对于化疗来说更容易耐受,所以受患者基础健康状况的影响不大[20]。相似的结果也在内分泌治疗、靶向治疗的组间分析中显现,这两种治疗方法的选择也仅与疾病的肿瘤特征相关。
相对于年轻乳腺癌来说,老年乳腺癌的总体病理特征表现为侵袭性较低、分子分型类型较好[21]。但是,老年乳腺癌的OS却并不高,在整体乳腺癌的生存分析比较中是比较差的年龄组,分析原因可能与合并症的存在以及预期寿命有限相关[21]。本研究中也有相似发现,总体老年乳腺癌的5年总生存率为88.8%,低于整体乳腺癌的5年生存率水平,但死亡病例中仅一半是乳腺癌相关死亡,另外一半源于并发疾病等其他原因。同时,多因素生存分析也显示两组老年患者的乳腺癌相关5年生存率(94.5%和94.0%)差异无统计学意义,且乳腺癌相关生存率与年龄、合并症、治疗选择无关,仅与淋巴结转移数量等疾病负荷相关。可见,本研究中对两个年龄组的老年乳腺癌患者采取的治疗方法差异无统计学意义,乳腺癌相关生存率也没有明显差异,年龄并未影响老年乳腺癌的治疗选择,也并不影响其生存获益。
总之,本研究发现老年乳腺癌患者的综合治疗方式不受年龄影响,但与肿瘤负荷、病理类型、分子分型、合并症及ECOG评分相关。其中,ECOG评分和合并症数量是影响术后辅助化疗选择的独立影响因素。提示在老年乳腺癌的综合治疗方案制定中,除充分考虑疾病复发风险外,也需要充分评估老年患者的功能状况及并发疾病,尤其面对化疗的治疗选择时。而年龄并不是影响老年乳腺癌综合治疗选择的独立影响因素,年龄也并不影响乳腺癌相关生存率。
所有作者均声明不存在利益冲突



























