
探讨重度阻塞性睡眠呼吸暂停(OSA)患儿睡眠脑电慢波活动(SWA)特征和腺样体与扁桃体切除后SWA的变化特点。
以2018年5月至2019年12月就诊于北京儿童医院睡眠中心且完成腺样体和扁桃体切除的24例重度OSA患儿,及按年龄、性别成组匹配且排除OSA的儿童26名(对照组)作为研究对象,完成整夜多导睡眠图(PSG)监测,计算睡眠脑电SWA强度。比较重度OSA组手术前和对照组,以及重度OSA组手术前后PSG指标和SWA强度的差异,并分析SWA强度与PSG指标的相关性。
重度OSA组手术前年龄为(6.1±1.7)岁,其中男性20例(83.3%),手术与随访的时间间隔M(Q1,Q3)为6.3(5.8,7.1)个月。对照组年龄为(6.2±1.1)岁,其中男性20名(76.9%)。重度OSA组手术后[M(Q1,Q3)]非快眼动睡眠1期(N1期)占总睡眠时间比例、阻塞性呼吸暂停低通气指数、氧减指数(ODI)和血氧饱和度(SpO2)<90% 的时间占总睡眠时间比例的分别为6.8%(5.6%,8.9%)、1.2(0.4,2.4)次/h、2.1(0.7,4.3)次/h和0(0,0),均低于手术前[分别为9.1%(7.5%,16.8%)、21.6(14.1,39.5)次/h、23.1(10.2,36.0)次/h和0.8%(0,3.9%)],非快眼动睡眠3期占总睡眠时间比例、快眼动睡眠占总睡眠时间比例和最低SpO2分别为(24.3±5.7)%、(19.1±3.7)%和91%(86%,94%),均高于手术前[分别为(19.0±5.3)%、(15.4±3.9)%和83%(70%,88%)](均P<0.05)。对N1期SWA强度的重复测量方差分析显示:OSA与睡眠时间进程间无交互作用(F=0.02,P=0.997),OSA的主效应具有统计学意义(F=5.12,P=0.040),重度OSA组N1期SWA强度高于对照组[SWA强度重度OSA组手术前-对照组(95%CI):0.379(0.020,0.739)],睡眠时间进程的主效应无统计学意义(F=1.66,P=0.191);腺样体和扁桃体切除术与睡眠时间进程间无交互作用(F=0.88,P=0.461),手术的主效应具有统计学意义(F=8.95,P=0.010),OSA患儿手术后N1期SWA强度低于手术前[SWA强度手术后-手术前(95%CI):-0.572(-0.982,-0.162)],睡眠时间进程的主效应具有统计学意义(F=6.33,P=0.001)。N1期第4睡眠循环的SWA强度与ODI呈正相关(r=0.299,P=0.048)。
OSA影响儿童N1期SWA强度,间歇低氧为其可能原因,腺样体和扁桃体切除术可明显降低患儿N1期SWA强度。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)发病率为1.2%~5.7%,腺样体和(或)扁桃体肥大为其最常见病因,该病导致患儿出现神经认知障碍等并发症,手术切除腺样体和(或)扁桃体可明显改善患儿病情[1, 2, 3, 4]。神经振荡活动异常是神经认知障碍的电生理机制之一[5, 6, 7],其中睡眠慢波活动(slow wave activity,SWA)强度与突触的修剪和重塑有关,可促进神经系统恢复[8, 9, 10],对儿童认知功能影响最为明显。既往研究报道OSA患者SWA强度明显增加[11, 12],但也有报道其非快眼动睡眠(non rapid eye movement,NREM)期和快眼动睡眠(rapid eye movement,REM)期SWA均低于单纯打鼾组[13],治疗后明显升高[14]。本研究以首都医科大学附属北京儿童医院睡眠中心收治的重度OSA患儿和社区健康儿童为对象,分析其SWA强度和重度OSA患儿治疗后SWA强度变化情况,为OSA致神经认知障碍的机制研究、早期发现和早期干预提供依据。
1. 对象:重度OSA患儿源自2018年5月10日至2019年12月31日首都医科大学附属北京儿童医院睡眠中心收治的患儿。纳入标准:(1)4~10岁;(2)打鼾或张口呼吸,经多导睡眠图(polysomnography,PSG)监测诊断为重度OSA;(3)完成了腺样体扁桃体切除术和随访。对照组源自北京市儿童睡眠情况调查人群,纳入标准:(1)来自北京社区;(2)年龄和性别与重度OSA患儿成组匹配;(3)无打鼾、张口呼吸,经PSG监测排除OSA[阻塞性呼吸暂停低通气指数(abstructive sleep apnea hypopnea index,OAHI)≤1次/h]。重度OSA组和对照组的排除标准:(1)颅面部畸形、神经肌肉疾病或遗传性疾病;(2)精神障碍病史或可导致异常脑电疾病史(如自闭症、抽动症或癫痫等);(3)早产或宫内发育迟缓病史;(4)急性感染或可能影响神经系统发育的慢性疾病;(5)已接受过腺样体和(或)扁桃体切除手术;(6)整夜总睡眠时间<5 h、睡眠周期<3个或PSG监测信号干扰较多而影响脑电能量分析。最终纳入重度OSA患儿24例,对照组26名。本研究通过了北京儿童医院伦理委员会的审查(2020-k-93),所有患儿的监护人均签署了知情同意书。
2. 方法:(1)体格检查:采用RGZ-120身高体重秤(常州市武进衡器有限公司)测量身高和体重(分别精确至0.1 kg和0.1 cm),并计算体质指数(body mass index,BMI);(2)PSG:分别采用E和Grael系列(澳大利亚Compumedics公司)、Alice 5和Alice 6系列(美国飞利浦公司)和V5系列(德国施曼诺公司)PSG仪对对象进行整夜PSG监测。监测时要求对象入睡前禁止服用咖啡、茶、可乐和镇静催眠药物等,于自然状态下入睡,监测时长不低于7 h;(3)随访:重度OSA组完成腺样体和扁桃体切除术3~12个月后复查PSG并进行脑电SWA强度分析。
3. 诊断标准和相关指标计算:(1)重度OSA:根据中国2020年儿童OSA诊疗指南[1]定义为:OAHI>10次/h;(2)OAHI:平均每小时发生阻塞性呼吸暂停、混合性呼吸暂停和低通气次数;(3)氧减指数(oxygenation desaturation index,ODI):睡眠中平均每小时经皮动脉血氧饱和度(oxygen scoturation,SpO2)下降≥3%的次数[15];(4)睡眠分期:将睡眠分为清醒期、非快眼动睡眠1期(N1期)、非快眼动睡眠2期(N2期)、非快眼动睡眠3期(N3期)和快眼动睡眠期(R期)[15];(5)睡眠循环:将N2或者N3期睡眠持续超过15 min,被≥30 s的R期或≥5 min的清醒期中断定义为一个睡眠循环[11];(6)SWA强度计算:将整夜PSG数据以欧洲数据格式导出,应用脑电能量分析程序对脑电进行预处理,采用快速傅里叶变换通过汉宁窗进行以2 s为最小周期的脑电频谱分析,计算各组在不同睡眠分期中央区的δ波平均能量,SWA强度=(0.5~4.0 Hz能量)/(0~45.0 Hz总能量)[12]。
4. 统计学分析:采用SPSS 23.0软件进行统计学描述和分析。年龄、总睡眠时间(total sleep time,TST)、睡眠效率(sleep efficiency,SE)、SWA强度、N2、N3和R期占总睡眠时间比例(分别为N2%、N3%和R%)均符合正态分布,以表示,组间比较采用独立样本t检验;手术前后比较采用配对样本t检验,采用重复测量方差分析比较组间以及重度OSA组手术前后SWA强度差异;性别以例(%)表示,组间比较采用χ²检验;以下参数均成非正态分布:BMI、N1期占总睡眠时间比例(N1%)、OAHI、ODI、平均SpO2、最低SpO2、SpO2<90%的时间占TST比例(T90)和随访时间,以M(Q1,Q3)表示,组间比较采用独立样本秩和检验,治疗前后比较采用配对样本秩和检验;觉醒指数(arousal indxe,ArI)与SWA强度的相关性采用Pearson相关分析,OAHI、ODI、最低SpO2与SWA强度的相关性采用Spearman相关分析。双侧检验,检验水准α=0.05。
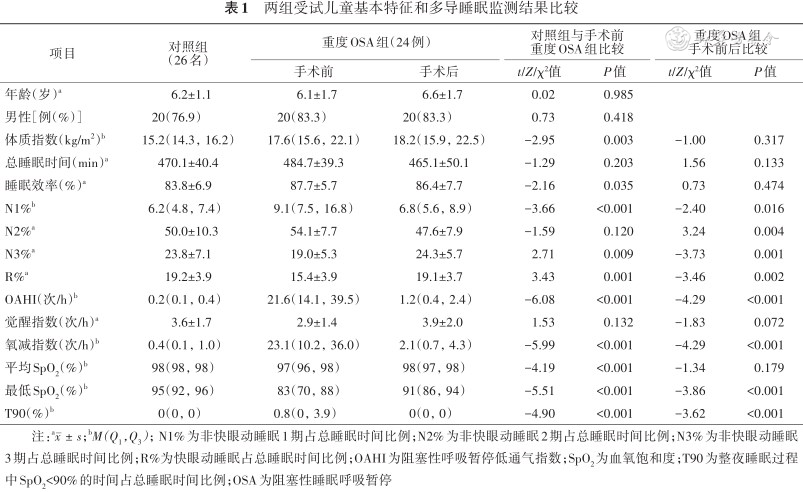
1. 基本情况:重度OSA组手术前年龄为(6.1±1.7)岁,其中男性20例(83.3%),手术与随访的时间间隔M(Q1,Q3)为6.3(5.8,7.1)个月。对照组年龄为(6.2±1.1)岁,其中男性20名(76.9%)。重度OSA组BMI高于健康对照组(P<0.05),年龄和性别与健康对照组的差异均无统计学意义(均P>0.05)(表1)。
两组受试儿童基本特征和多导睡眠监测结果比较
两组受试儿童基本特征和多导睡眠监测结果比较
| 项目 | 对照组 (26名) | 重度OSA组(24例) | 对照组与手术前 重度OSA组比较 | 重度OSA组 手术前后比较 | |||
|---|---|---|---|---|---|---|---|
| 手术前 | 手术后 | t/Z/χ²值 | P值 | t/Z/χ²值 | P值 | ||
| 年龄(岁)a | 6.2±1.1 | 6.1±1.7 | 6.6±1.7 | 0.02 | 0.985 | ||
| 男性[例(%)] | 20(76.9) | 20(83.3) | 20(83.3) | 0.73 | 0.418 | ||
| 体质指数(kg/m2)b | 15.2(14.3,16.2) | 17.6(15.6,22.1) | 18.2(15.9,22.5) | -2.95 | 0.003 | -1.00 | 0.317 |
| 总睡眠时间(min)a | 470.1±40.4 | 484.7±39.3 | 465.1±50.1 | -1.29 | 0.203 | 1.56 | 0.133 |
| 睡眠效率(%)a | 83.8±6.9 | 87.7±5.7 | 86.4±7.7 | -2.16 | 0.035 | 0.73 | 0.474 |
| N1%b | 6.2(4.8,7.4) | 9.1(7.5,16.8) | 6.8(5.6,8.9) | -3.66 | <0.001 | -2.40 | 0.016 |
| N2%a | 50.0±10.3 | 54.1±7.7 | 47.6±7.9 | -1.59 | 0.120 | 3.24 | 0.004 |
| N3%a | 23.8±7.1 | 19.0±5.3 | 24.3±5.7 | 2.71 | 0.009 | -3.73 | 0.001 |
| R%a | 19.2±3.9 | 15.4±3.9 | 19.1±3.7 | 3.43 | 0.001 | -3.46 | 0.002 |
| OAHI(次/h)b | 0.2(0.1,0.4) | 21.6(14.1,39.5) | 1.2(0.4,2.4) | -6.08 | <0.001 | -4.29 | <0.001 |
| 觉醒指数(次/h)a | 3.6±1.7 | 2.9±1.4 | 3.9±2.0 | 1.53 | 0.132 | -1.83 | 0.072 |
| 氧减指数(次/h)b | 0.4(0.1,1.0) | 23.1(10.2,36.0) | 2.1(0.7,4.3) | -5.99 | <0.001 | -4.29 | <0.001 |
| 平均SpO2(%)b | 98(98,98) | 97(96,98) | 98(97,98) | -4.19 | <0.001 | -1.34 | 0.179 |
| 最低SpO2(%)b | 95(92,96) | 83(70,88) | 91(86,94) | -5.51 | <0.001 | -3.86 | <0.001 |
| T90(%)b | 0(0,0) | 0.8(0,3.9) | 0(0,0) | -4.90 | <0.001 | -3.62 | <0.001 |
注:a;bM(Q1,Q3);N1%为非快眼动睡眠1期占总睡眠时间比例;N2%为非快眼动睡眠2期占总睡眠时间比例;N3%为非快眼动睡眠3期占总睡眠时间比例;R%为快眼动睡眠占总睡眠时间比例;OAHI为阻塞性呼吸暂停低通气指数;SpO2为血氧饱和度;T90为整夜睡眠过程中SpO2<90%的时间占总睡眠时间比例;OSA为阻塞性睡眠呼吸暂停
2. PSG指标:重度OSA组手术前SE、N1%、OAHI、ODI和T90均高于对照组,N3%、R%、平均和最低SpO2均低于对照组(均P<0.05),TST、N2%和ArI与对照组的差异无统计学意义(P值均>0.05)。重度OSA组手术后N1%、N2%、OAHI、ODI和T90低于手术前,N3%、R%和最低SpO2高于手术前(P值均<0.05),BMI、TST、SE、ArI和平均SpO2手术前后差异均无统计学意义(均P>0.05)(表1)。
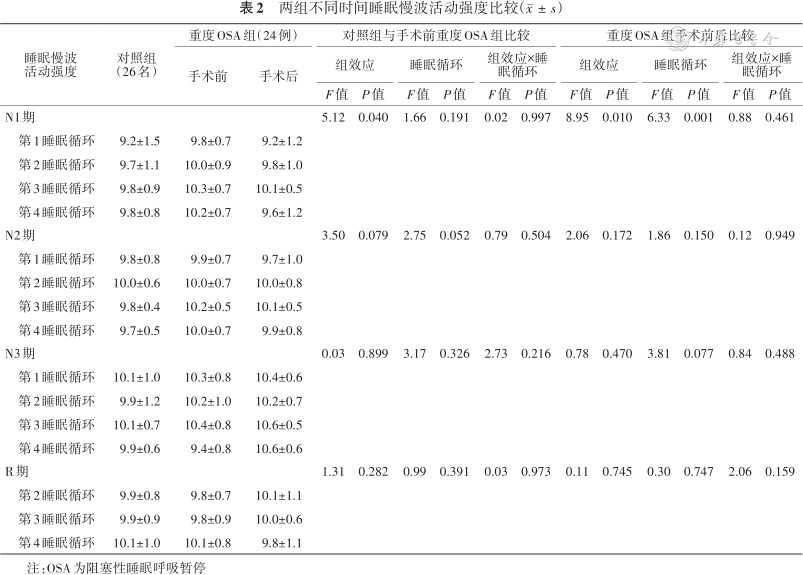
3. SWA强度:OSA与睡眠时间进程间无交互作用;OSA对N1期SWA强度的主效应具有统计学意义(P=0.040),重度OSA组N1期SWA强度高于对照组[SWA强度重度OSA组手术前-对照组(95%CI):0.379(0.020,0.739)];睡眠时间进程对N1期SWA强度的主效应无统计学意义(P=0.191)。OSA、睡眠时间进程对N2、N3和R期SWA强度的主效应均无统计学意义(P值均>0.05)(表2)。对重度OSA组手术前后N1期SWA强度的重复测量方差分析显示:手术与睡眠时间进程之间无交互作用;手术对N1期SWA强度的主效应具有统计学意义(P=0.010),OSA患儿手术后N1期SWA强度低于手术前[SWA强度手术后-手术前(95%CI):-0.572(-0.982,-0.162)];
两组不同时间睡眠慢波活动强度比较()
两组不同时间睡眠慢波活动强度比较()
睡眠慢波 活动强度 | 对照组(26名) | 重度OSA组(24例) | 对照组与手术前重度OSA组比较 | 重度OSA组手术前后比较 | |||||
|---|---|---|---|---|---|---|---|---|---|
| 手术前 | 手术后 | 组效应 | 睡眠循环 | 组效应×睡眠循环 | 组效应 | 睡眠循环 | 组效应×睡眠循环 | ||
| F值 P值 | F值 P值 | F值 P值 | F值 P值 | F值 P值 | F值 P值 | ||||
| N1期
第1睡眠循环 第2睡眠循环 第3睡眠循环 第4睡眠循环 | 9.2±1.5 9.7±1.1 9.8±0.9 9.8±0.8 | 9.8±0.7 10.0±0.9 10.3±0.7 10.2±0.7 | 9.2±1.2 9.8±1.0 10.1±0.5 9.6±1.2 | 5.12 0.040 | 1.66 0.191 | 0.02 0.997 | 8.95 0.010 | 6.33 0.001 | 0.88 0.461 |
| N2期
第1睡眠循环 第2睡眠循环 第3睡眠循环 第4睡眠循环 | 9.8±0.8 10.0±0.6 9.8±0.4 9.7±0.5 | 9.9±0.7 10.0±0.7 10.2±0.5 10.0±0.7 | 9.7±1.0 10.0±0.8 10.1±0.5 9.9±0.8 | 3.50 0.079 | 2.75 0.052 | 0.79 0.504 | 2.06 0.172 | 1.86 0.150 | 0.12 0.949 |
| N3期
第1睡眠循环 第2睡眠循环 第3睡眠循环 第4睡眠循环 | 10.1±1.0 9.9±1.2 10.1±0.7 9.9±0.6 | 10.3±0.8 10.2±1.0 10.4±0.8 9.4±0.8 | 10.4±0.6 10.2±0.7 10.6±0.5 10.6±0.6 | 0.03 0.899 | 3.17 0.326 | 2.73 0.216 | 0.78 0.470 | 3.81 0.077 | 0.84 0.488 |
| R期
第2睡眠循环 第3睡眠循环 第4睡眠循环 | 9.9±0.8 9.9±0.9 10.1±1.0 | 9.8±0.7 9.8±0.9 10.1±0.8 | 10.1±1.1 10.0±0.6 9.8±1.1 | 1.31 0.282 | 0.99 0.391 | 0.03 0.973 | 0.11 0.745 | 0.30 0.747 | 2.06 0.159 |
注:OSA为阻塞性睡眠呼吸暂停
睡眠时间进程对N1期SWA强度的主效应具有统计学意义(P=0.001)。第1睡眠循环SWA强度低于第3和第4睡眠循环,SWA强度差值(95%CI)分别为-0.773(-1.267,-0.279)和-0.606(-1.207,-0.004)。手术和睡眠时间进程对N2、N3和R期SWA强度的主效应无统计学意义(均P>0.05)(表2)。
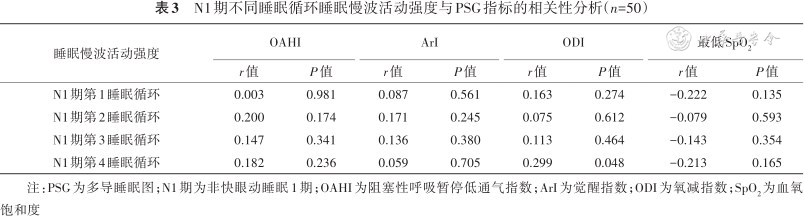
4. N1期SWA强度与PSG指标的相关性分析:N1期第4睡眠循环SWA强度与ODI呈正相关(P=0.048),与OAHI、ArI和最低SpO2均无相关性。N1期第1、第2和第3睡眠循环SWA强度与PSG指标均无相关性(均P>0.05)(表3)。
N1期不同睡眠循环睡眠慢波活动强度与PSG指标的相关性分析(n=50)
N1期不同睡眠循环睡眠慢波活动强度与PSG指标的相关性分析(n=50)
| 睡眠慢波活动强度 | OAHI | ArI | ODI | 最低SpO2 | ||||
|---|---|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| N1期第1睡眠循环 | 0.003 | 0.981 | 0.087 | 0.561 | 0.163 | 0.274 | -0.222 | 0.135 |
| N1期第2睡眠循环 | 0.200 | 0.174 | 0.171 | 0.245 | 0.075 | 0.612 | -0.079 | 0.593 |
| N1期第3睡眠循环 | 0.147 | 0.341 | 0.136 | 0.380 | 0.113 | 0.464 | -0.143 | 0.354 |
| N1期第4睡眠循环 | 0.182 | 0.236 | 0.059 | 0.705 | 0.299 | 0.048 | -0.213 | 0.165 |
注:PSG为多导睡眠图;N1期为非快眼动睡眠1期;OAHI为阻塞性呼吸暂停低通气指数;ArI为觉醒指数;ODI为氧减指数;SpO2为血氧饱和度
OSA是儿童最常见的睡眠呼吸疾病,神经振荡尤其是SWA是反映睡眠稳态的生理标志[11],近年来用于揭示OSA人群神经认知损伤领域[14,16]。本研究发现与健康儿童相比,重度OSA组N1期SWA强度升高,腺样体扁桃体切除术后得到改善。
既往报道OSA成年患者N1期和N3期中央区SWA强度明显升高[12],儿童患者SWA强度明显升高,改善睡眠呼吸障碍后明显降低且与患儿持续注意力的提高相关[11,17, 18]。但也有研究发现SWA强度与OSA负相关[13],Ben-Israel等[14]报道OSA患儿经腺样体扁桃体切除术后,整夜SWA强度明显升高,而未治疗的OSA患儿SWA强度无变化。本研究中的重度OSA组N1期SWA强度较对照组明显升高,这与既往研究认为OSA会造成睡眠状态下脑电振荡发生慢波化改变的结论一致[11, 12,17, 18],提示OSA儿童睡眠状态下慢波抑制机制减弱。
重度OSA组手术后随访发现:手术后OAHI中位数由手术前的21.6次/h降至1.2次/h,最低SpO2中位数由手术前的83%升高至91%。N1期SWA强度较手术前明显降低,提示腺样体扁桃体切除术对睡眠微观结构的改善效果,也从神经电生理角度解释了OSA患儿不出现日间嗜睡的“矛盾现象”。与OSA成人患者不同,OSA患儿日间较少发生嗜睡,更多表现为多动和兴奋[19]。本研究提示:OSA儿童日间多动和兴奋可能是其对抗嗜睡的自我调节,而这种自我调节是以牺牲脑电慢-快振荡平衡为基础的,OSA患儿日间积累了更多的睡眠压力,一旦从清醒状态转换至睡眠状态(N1期),其慢波活动出现代偿性增加。因此,相对PSG的传统睡眠指标,脑电能量可以更深入地了解睡眠期间的大脑活动,为解释不同群体间临床症状差异性提供理论依据。
本研究还发现N1期第4循环SWA强度与ODI呈正相关,提示OSA患儿夜间间歇低氧可能通过化学机制导致脑细胞损伤[20],进而影响脑细胞的电生理活动,表现为神经振荡异常,这可能是神经认知受损的机制之一。
本研究的局限性包括:(1)样本量相对较小;(2)未对儿童进行神经认知评估,无法确证SWA强度是否与OSA患儿神经认知受损相关;(3)仅纳入了重度OSA组,影响结论的外推。
所有作者均声明不存在利益冲突



























