
抗体介导的排斥反应(AMR)是影响移植肾长期存活的关键因素,供者特异性抗体(DSA)是AMR的病因,而产生DSA的主要原因是供受者之间人类白细胞抗原(HLA)的错配。因此HLA分型和抗体的检测是目前肾移植临床关注的重点。本共识系统梳理了HLA分型和抗体检测的不同方法及各自的特点,介绍了如何应用上述检测结果评估肾移植受者同种异体免疫记忆和初始免疫反应风险,并给出了相关的专家推荐意见供同行参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植是终末期肾病最有效的治疗方法,目前短期存活理想,但移植肾10年存活率不足50%[1]。有研究提示,接近60%的移植肾失功归因于供者特异性抗体(donor specific antibody,DSA)介导的排斥反应[2]。DSA的主要成分是抗供者人类白细胞抗原(human leucocyte antigen,HLA)的抗体[3],近来非HLA抗体和抗体介导排斥反应(antibody mediated rejection,AMR)的关系也日益受到重视[4],但因其尚缺乏成熟的检测手段,本共识中的DSA如无特殊说明专指抗供者HLA抗体。
移植受者HLA抗体的产生来源于对供者器官(或其他来源,如输血、妊娠等)同种异体HLA产生的免疫应答。因此供受者HLA的分型、受者HLA抗体的检测和特异性分析对于DSA的判别、排斥风险的评估和分层以及指导AMR的预防和治疗具有基础性的重要作用[5]。近年来,实验室HLA分型和HLA抗体固相检测技术快速进步,为肾移植AMR精准医疗创造了有利条件。由于这些技术和方法在快速发展过程中,各实验室检测体系和评判标准不一,临床医师对检测结果的临床意义理解存在差异,亟需对相关问题形成共识。实体器官移植领域HLA分型和抗体检测的相关研究结果存在显著的人口学差异,因而不能完全参考国外研究的临床证据。鉴于此,上海市肾脏移植质量控制中心专家委员会系统梳理了相关核心问题并提出共识提纲,由中国医药生物技术协会移植技术分会约请分会对口专家撰写共识初稿,而后联合召开审稿会,广泛听取审稿专家修改意见后由统稿专家完成共识。本共识推荐的相关建议因国内目前尚缺乏全面的临床观察数据,所以暂时未给出推荐等级。
编码HLA的基因位于人类第6号染色体短臂21.31亚带,包括:(1)HLA-Ⅰ类基因区,含经典基因A、B、C和非经典基因E、F、G,以及主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类链相关基因A/B(MHC classⅠ-related genes A/B,MICA/B);(2)HLA-Ⅱ类基因区,含经典基因DR、DP、DQ;(3)HLA-Ⅲ类基因区,含如C2、C4血清补体成分编码基因等。HLA具有极为复杂的等位基因多态性和抗原表型,至2021年4月,最新的国际免疫遗传学(the International ImMunoGeneTics,IMGT)数据库(3.44版)[6]报道不同HLA的抗原数及等位基因数见表1。

IMGT数据库3.44版本中报道的HLA多态性[6]
IMGT数据库3.44版本中报道的HLA多态性[6]
| HLA基因座 | 等位基因数 | 抗原数 |
|---|---|---|
| A | 6 766 | 4 064 |
| B | 7 967 | 4 962 |
| C | 6 621 | 3 831 |
| DRB1 | 3 701 | 2 557 |
| DQB1 | 1 997 | 1 303 |
| DPB1 | 1 749 | 1 106 |
注:IMGT为国际免疫遗传学;HLA为人类白细胞抗原
目前国内外肾移植中心常采用不同的实验方法进行供受者的HLA基因分型,包括低分辨水平的序列特异性引物(sequence specific primer,SSP)法、中分辨水平的序列特异性寡核苷酸探针(sequence specific oligonucleotide probes,SSOP)法、高分辨水平的基于测序分型(sequencing based typing,SBT)法以及等位基因水平的二代测序(next generation sequencing,NGS)法。这些技术平台所使用的部分试剂和仪器已在中国获得注册证,能够满足临床肾移植中心开展HLA基因分型的需求。常用HLA基因分型方法和结果的比较见表2。

常用HLA基因分型方法及分型结果的比较
常用HLA基因分型方法及分型结果的比较
实验 方法 | 分辨率 | 技术特色 | 报告时间 | 举例HLA-DRB1位点分型结果 | |
|---|---|---|---|---|---|
| 优点 | 缺点 | ||||
| SSP | 以低分辨水平结果 为主 | 操作简便 | 随等位基因增多需设计大量序列特异性引物 | 时间短,4~6 h完成检测 | 低分辨DRB1*15:XX |
| SSOP | 以低分辨和中分辨 水平结果为主 | 简便、快速 | 易产生模棱两可的结果多 | 时间短,4~6 h完成检测 | 低分辨DRB1*15:XX;或中分辨DRB1*15:BMHFC(Code码) |
| SBT | 以高分辨水平结果 为主 | 金标准 | 操作繁琐、补充实验多 | 最快8 h完成实验,12~16 h出具报告 | 高分辨DRB1*15:02;或DRB1*15:02:01G(G版本) |
| NGS | 以等位基因分辨水 平结果为主 | 一次反应得到更多位点结果 | 操作繁琐、数据分析要求高 | 时间长,4 d完成检测和报告 | 高分辨DRB1*15:02唯一等位基因 |
注:HLA为人类白细胞抗原;SSP为序列特异性引物;SSOP为序列特异性寡核苷酸探针;SBT为基于测序分型;NGS为二代测序;低分辨分型为血清型结果(DRB1*15:XX);中分辨分型为一组Code码结果(DRB1*15:BMHFC,Code 码表示除DRB1*15:02最常见外,包含15:105/15:126/15:140/15:149/15:154N一组等位基因结果);高分辨分型以DRB1*15:02高分辨结果为主,或DRB1*15:02:01G(G版本表示除DRB1*15:02最常见外,包含15:140/15:149/15:154N同一G版本等位基因结果);等位基因水平分型是唯一等位基因结果
1. SSP法的原理是根据已知HLA序列设计特异性引物进行聚合酶链(polymerase chain reaction,PCR)反应,通过特异性引物与模板DNA互补合成的PCR产物片段大小,判断HLA各位点的基因型。实验操作相对较简便,结果需要人工判断,常为低分辨率水平(血清型)。
2. SSOP法的原理是在微珠上包被基于已知HLA序列设计的寡核苷酸探针,再将标记上荧光信号的待检DNA片段反向与探针杂交,通过红绿激光荧光类型和强度来确定其分型。实验操作相对简便,分析数据时间较短,约6 h内完成。但该方法结果为低或中分辨率水平,在判断时存在较多模棱两可等位基因组合的问题。
上述两种方法因分辨率低已逐渐不能满足临床肾移植精准医疗的需要,但是在目前的器官捐献条件下,大多数移植配型实验室受时间、人员和设备条件的限制仍在用其进行供者HLA分型,在分配器官前将结果上传中国人体器官分配与共享计算机系统(China Organ Transplant Response System,COTRS)。
3. SBT法的原理为双脱氧终止法(又称Sanger测序法),是HLA分型检测的金标准,其针对HLA不同位点关键外显子区域进行DNA片段扩增,扩增后的产物进行测序,得到高分辨率水平的分型结果。该方法实验操作复杂,约16 h内完成,适用于肾移植等待者、非紧急状态下器官供者进行HLA-A、B、C、DRB1/3/4/5、DQB1、DQA1、DPB1、DPA1位点的基因分型,可准确反映上述位点关键氨基酸序列。
4. NGS法的原理为大规模平行覆盖数百万个DNA片段进行全外显子测序,需要4~5 d完成整个实验步骤,具有分辨率高、分型准确、覆盖位点更广的优势。除可检测经典HLA-A、B、C、DRB1/3/4/5、DQB1、DPB1、DPA1、DQA1位点外,还可以检测非经典HLA-E、F、G、H位点,以及MICA、MICB位点的等位基因分型结果,结果为该位点唯一核苷酸序列的等位基因型。适用于肾移植等待者和活体亲属供者及样本量大的中心开展HLA基因分型。
美国组织相容性和免疫遗传学会(American Society of Histocompatibility and Immunogenetics,ASHI)在2020年版标准中明确提出对于器官供者HLA分型的要求[7]:(1)对于潜在活体供肾者必须检测HLA-A、B(Bw4/Bw6)、DRB1分型,推荐进行HLA-C、DRB3/4/5、DQA1、DQB1、DPA1、DPB1分型,其中Bw4/Bw6需要根据B位点结果进行分析,并在HLA基因分型报告中注明;(2)对于尸体供者必须检测HLA-A、B(Bw4/Bw6)、C、DR(DR51/52/53)、DQA1、DQB1、DPB1基因分型,并在报告中标明抗原型,其中Bw4/Bw6、DR51/52/53需要根据B和DR位点结果进行分析;(3)所有供者HLA分型结果需要上传器官分配系统,以此判断受者和供者HLA的相合度。
下面以HLA-A*02:101:01举例说明HLA-A、B、C、DRB1/3/4/5、DQB1、DQA1、DPB1、DPA1各位点等位基因的命名规则:A表示基因位点;*后的2位数字代表等位基因名称;*后第1个冒号后的编号是指HLA蛋白特异性氨基酸序列;第2个冒号后面的编号是指DNA编码区的无义突变。如果HLA位点*后2位数字相同,但*后第一个冒号后数字不同,表明等位基因表达的特异性氨基酸序列不同。故只有采用SBT或NGS方法进行高分辨率基因分型,才能明确供受者HLA蛋白质结构是否相同或不同。为了便于理解基因型、血清型、抗原特异性和交叉反应组之间的对应关系,表3选择HLA-A、B、C、DRB1、DQB1位点中具有代表性的抗原予对照说明。
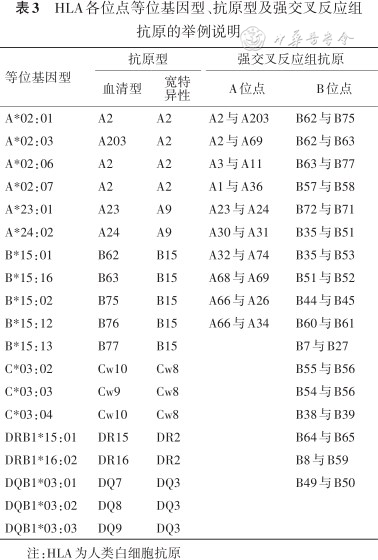
HLA各位点等位基因型、抗原型及强交叉反应组抗原的举例说明
HLA各位点等位基因型、抗原型及强交叉反应组抗原的举例说明
| 等位基因型 | 抗原型 | 强交叉反应组抗原 | ||
|---|---|---|---|---|
| 血清型 | 宽特 异性 | A位点 | B位点 | |
| A*02:01 | A2 | A2 | A2与A203 | B62与B75 |
| A*02:03 | A203 | A2 | A2与A69 | B62与B63 |
| A*02:06 | A2 | A2 | A3与A11 | B63与B77 |
| A*02:07 | A2 | A2 | A1与A36 | B57与B58 |
| A*23:01 | A23 | A9 | A23与A24 | B72与B71 |
| A*24:02 | A24 | A9 | A30与A31 | B35与B51 |
| B*15:01 | B62 | B15 | A32与A74 | B35与B53 |
| B*15:16 | B63 | B15 | A68与A69 | B51与B52 |
| B*15:02 | B75 | B15 | A66与A26 | B44与B45 |
| B*15:12 | B76 | B15 | A66与A34 | B60与B61 |
| B*15:13 | B77 | B15 | B7与B27 | |
| C*03:02 | Cw10 | Cw8 | B55与B56 | |
| C*03:03 | Cw9 | Cw8 | B54与B56 | |
| C*03:04 | Cw10 | Cw8 | B38与B39 | |
| DRB1*15:01 | DR15 | DR2 | B64与B65 | |
| DRB1*16:02 | DR16 | DR2 | B8与B59 | |
| DQB1*03:01 | DQ7 | DQ3 | B49与B50 | |
| DQB1*03:02 | DQ8 | DQ3 | ||
| DQB1*03:03 | DQ9 | DQ3 | ||
注:HLA为人类白细胞抗原
1. CWD的定义和等位基因频率:按照国际CWD判断原则:Common(C)基因,即常见基因,是频率≥0.001(0.1%)的等位基因;Well-documented(WD)基因,即明确证实的基因,是应用SBT方法,在不相关个体中检测到≥5次,或在特定单倍型中检测到≥3次的等位基因;Rare(R)基因:CWD以外的罕见等位基因。参照中国造血干细胞捐献者管理中心资料库(简称中华骨髓库)HLA专家组牵头制定的CWD数据(更新2.4版本),表4汇总了中国人CWD基因种类和频率占比。
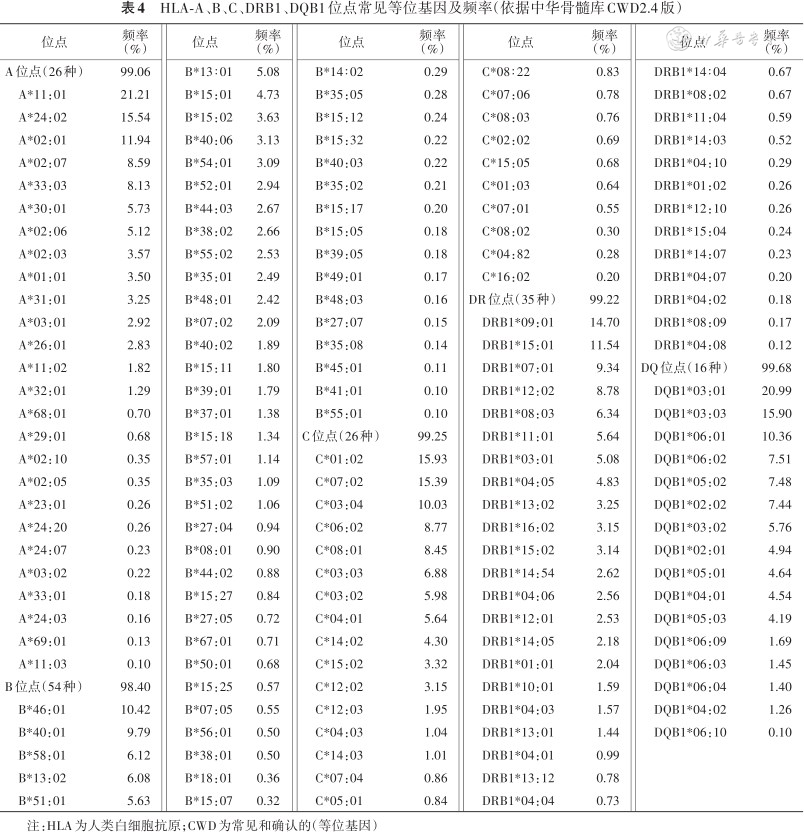
HLA-A、B、C、DRB1、DQB1位点常见等位基因及频率(依据中华骨髓库CWD2.4版)
HLA-A、B、C、DRB1、DQB1位点常见等位基因及频率(依据中华骨髓库CWD2.4版)
| 位点 | 频率(%) | 位点 | 频率(%) | 位点 | 频率(%) | 位点 | 频率(%) | 位点 | 频率(%) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
A位点(26种) | 99.06 | B*13∶01 | 5.08 | B*14∶02 | 0.29 | C*08∶22 | 0.83 | DRB1*14∶04 | 0.67 | ||||
A*11:01 | 21.21 | B*15:01 | 4.73 | B*35:05 | 0.28 | C*07:06 | 0.78 | DRB1*08:02 | 0.67 | ||||
A*24:02 | 15.54 | B*15:02 | 3.63 | B*15:12 | 0.24 | C*08:03 | 0.76 | DRB1*11:04 | 0.59 | ||||
A*02:01 | 11.94 | B*40:06 | 3.13 | B*15:32 | 0.22 | C*02:02 | 0.69 | DRB1*14:03 | 0.52 | ||||
A*02:07 | 8.59 | B*54:01 | 3.09 | B*40:03 | 0.22 | C*15:05 | 0.68 | DRB1*04:10 | 0.29 | ||||
A*33:03 | 8.13 | B*52:01 | 2.94 | B*35:02 | 0.21 | C*01:03 | 0.64 | DRB1*01:02 | 0.26 | ||||
A*30:01 | 5.73 | B*44:03 | 2.67 | B*15:17 | 0.20 | C*07:01 | 0.55 | DRB1*12:10 | 0.26 | ||||
A*02:06 | 5.12 | B*38:02 | 2.66 | B*15:05 | 0.18 | C*08:02 | 0.30 | DRB1*15:04 | 0.24 | ||||
A*02:03 | 3.57 | B*55:02 | 2.53 | B*39:05 | 0.18 | C*04:82 | 0.28 | DRB1*14:07 | 0.23 | ||||
A*01:01 | 3.50 | B*35:01 | 2.49 | B*49:01 | 0.17 | C*16:02 | 0.20 | DRB1*04:07 | 0.20 | ||||
A*31:01 | 3.25 | B*48:01 | 2.42 | B*48:03 | 0.16 | DR位点(35种) | 99.22 | DRB1*04:02 | 0.18 | ||||
A*03:01 | 2.92 | B*07:02 | 2.09 | B*27:07 | 0.15 | DRB1*09:01 | 14.70 | DRB1*08:09 | 0.17 | ||||
A*26:01 | 2.83 | B*40:02 | 1.89 | B*35:08 | 0.14 | DRB1*15:01 | 11.54 | DRB1*04:08 | 0.12 | ||||
A*11:02 | 1.82 | B*15:11 | 1.80 | B*45:01 | 0.11 | DRB1*07:01 | 9.34 | DQ位点(16种) | 99.68 | ||||
A*32:01 | 1.29 | B*39:01 | 1.79 | B*41:01 | 0.10 | DRB1*12:02 | 8.78 | DQB1*03:01 | 20.99 | ||||
A*68:01 | 0.70 | B*37:01 | 1.38 | B*55:01 | 0.10 | DRB1*08:03 | 6.34 | DQB1*03:03 | 15.90 | ||||
A*29:01 | 0.68 | B*15:18 | 1.34 | C位点(26种) | 99.25 | DRB1*11:01 | 5.64 | DQB1*06:01 | 10.36 | ||||
A*02:10 | 0.35 | B*57:01 | 1.14 | C*01:02 | 15.93 | DRB1*03:01 | 5.08 | DQB1*06:02 | 7.51 | ||||
A*02:05 | 0.35 | B*35:03 | 1.09 | C*07:02 | 15.39 | DRB1*04:05 | 4.83 | DQB1*05:02 | 7.48 | ||||
A*23:01 | 0.26 | B*51:02 | 1.06 | C*03:04 | 10.03 | DRB1*13:02 | 3.25 | DQB1*02:02 | 7.44 | ||||
A*24:20 | 0.26 | B*27:04 | 0.94 | C*06:02 | 8.77 | DRB1*16:02 | 3.15 | DQB1*03:02 | 5.76 | ||||
A*24:07 | 0.23 | B*08:01 | 0.90 | C*08:01 | 8.45 | DRB1*15:02 | 3.14 | DQB1*02:01 | 4.94 | ||||
A*03:02 | 0.22 | B*44:02 | 0.88 | C*03:03 | 6.88 | DRB1*14:54 | 2.62 | DQB1*05:01 | 4.64 | ||||
A*33:01 | 0.18 | B*15:27 | 0.84 | C*03:02 | 5.98 | DRB1*04:06 | 2.56 | DQB1*04:01 | 4.54 | ||||
A*24:03 | 0.16 | B*27:05 | 0.72 | C*04:01 | 5.64 | DRB1*12:01 | 2.53 | DQB1*05:03 | 4.19 | ||||
A*69:01 | 0.13 | B*67:01 | 0.71 | C*14:02 | 4.30 | DRB1*14:05 | 2.18 | DQB1*06:09 | 1.69 | ||||
A*11:03 | 0.10 | B*50:01 | 0.68 | C*15:02 | 3.32 | DRB1*01:01 | 2.04 | DQB1*06:03 | 1.45 | ||||
| B位点(54种) | 98.40 | B*15:25 | 0.57 | C*12:02 | 3.15 | DRB1*10:01 | 1.59 | DQB1*06:04 | 1.40 | ||||
B*46:01 | 10.42 | B*07:05 | 0.55 | C*12:03 | 1.95 | DRB1*04:03 | 1.57 | DQB1*04:02 | 1.26 | ||||
B*40:01 | 9.79 | B*56:01 | 0.50 | C*04:03 | 1.04 | DRB1*13:01 | 1.44 | DQB1*06:10 | 0.10 | ||||
B*58:01 | 6.12 | B*38:01 | 0.50 | C*14:03 | 1.01 | DRB1*04:01 | 0.99 | ||||||
B*13:02 | 6.08 | B*18:01 | 0.36 | C*07:04 | 0.86 | DRB1*13:12 | 0.78 | ||||||
B*51:01 | 5.63 | B*15:07 | 0.32 | C*05:01 | 0.84 | DRB1*04:04 | 0.73 |
注:HLA为人类白细胞抗原;CWD为常见和确认的(等位基因)
国内外研究表明,HLA各位点上等位基因频率的分布存在显著的人群差异。表5统计了中国人HLA-A、B、C、DRB1、DQB1各位点频率>0.1%的常见等位基因型类型,分别有26、54、26、35、16种。而ASHI[7]推荐的HLA抗体的检测试剂(LAB Screen single antigen)包含的HLA-A、B、C、DRB1、DQB1抗原种类分别为21、43、15、18、7种。二者相比,中国人群的常见HLA等位基因类型多。因此,中国人群HLA-CWD数据库不仅在移植受者和供者选择中具有非常重要的参考价值,而且还可为制备HLA抗体检测试剂时选择符合中国人群特点的抗原谱做参考。
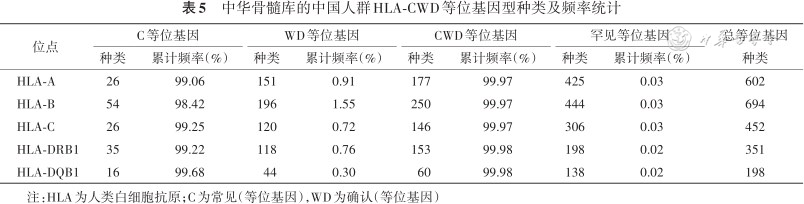
中华骨髓库的中国人群HLA-CWD等位基因型种类及频率统计
中华骨髓库的中国人群HLA-CWD等位基因型种类及频率统计
| 位点 | C等位基因 | WD等位基因 | CWD等位基因 | 罕见等位基因 | 总等位基因 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 种类 | 累计频率(%) | 种类 | 累计频率(%) | 种类 | 累计频率(%) | 种类 | 累计频率(%) | 种类 | |
| HLA-A | 26 | 99.06 | 151 | 0.91 | 177 | 99.97 | 425 | 0.03 | 602 |
| HLA-B | 54 | 98.42 | 196 | 1.55 | 250 | 99.97 | 444 | 0.03 | 694 |
| HLA-C | 26 | 99.25 | 120 | 0.72 | 146 | 99.97 | 306 | 0.03 | 452 |
| HLA-DRB1 | 35 | 99.22 | 118 | 0.76 | 153 | 99.98 | 198 | 0.02 | 351 |
| HLA-DQB1 | 16 | 99.68 | 44 | 0.30 | 60 | 99.98 | 138 | 0.02 | 198 |
注:HLA为人类白细胞抗原;C为常见(等位基因),WD为确认(等位基因)
2. HLA等位基因型和单倍型的相关性:由于HLA各位点的等位基因存在不同的基因频率及显著的连锁不平衡现象,并且在地区分布和种族间也存在一定的差异性,中国人群大样本报道的HLA-A、B、C、DRB1、DQB1位点等位基因连锁的单倍型中频率≥1%的7种见表6[8]。

中国人群中频率≥1%的HLA-A、B、C、DRB1、DQB1位点等位基因连锁的单倍型及其频率(%)
中国人群中频率≥1%的HLA-A、B、C、DRB1、DQB1位点等位基因连锁的单倍型及其频率(%)
| 单倍型 | 在人群中的频率 |
|---|---|
| A*30:01-B*13:02-C*06:02-DRB1*07:01-DQB1*02:02 | 5.06 |
| A*02:07-B*46:01-C*01:02:01G-DRB1*09:01-DQB1*03:03 | 3.32 |
| A*33:03-B*58:01-C*03:02-DRB1*03:01-DQB1*02:01 | 2.94 |
| A*33:03-B*58:01-C*03:02-DRB1*13:02-DQB1*06:09 | 1.37 |
| A*11:01-B*15:02-C*08:01:01G-DRB1*12:02-DQB1*03:01 | 1.06 |
| A*02:07-B*46:01-C*01:02:01G-DRB1*08:03-DQB1*06:01 | 1.01 |
| A*33:03-B*44:03-C*14:03-DRB1*13:02-DQB1*06:04 | 1.01 |
注:HLA为人类白细胞抗原
通过与中国人群常见HLA单倍型连锁的比对,常可用于验证或补充单倍型中CWD和罕见等位基因的分型结果。特别是供受者HLA位点分型结果不完整,缺少如C、DQB1等位点分型结果而又无条件重新检测HLA分型时,可通过HLA-A、B、DRB1等位基因型和单倍型连锁规律,推测C、DQB1、DPB1等位点可能的分型结果,分析供受者未检测位点的HLA等位基因匹配度及推测移植后新生HLA抗体是否为DSA。
推荐意见:
1. 对于等待肾移植受者建议采用SBT法进行HLA-A、B、C、DRB1、DQB1、DPB1位点基因分型,同时在结果中需要分析Bw4/Bw6和DR51/52/53抗原型,并在HLA基因分型报告中注明。有条件的实验室推荐采用NGS法进行HLA-A、B、C、DRB1、DQB1、DPB1、DRB3/4/5、DQA1、DPA1基因分型,以及MICA、MICB和非经典HLA-E、F、G位点基因分型。
2. 在实验室一般现有条件下,对于死亡后器官供者推荐首先采用SSOP法进行HLA-A、B、DR初筛分型,然后争取采用NGS或SBT方法进行HLA-A、B、C、DRB1、DQB1等位点的基因分型,尽量以检测更多位点为原则。
3. 条件先进的实验室,推荐对于潜在器官捐献者尽可能提前采集血液样本进行HLA高分辨基因分型,而对于突发器官捐献推荐采用SSOP方法加急检测HLA-A、B、DRB1、DQB1(至少HLA-A、B、DRB1)位点基因分型,后续再采用NGS或SBT法完善HLA高分辨分型结果。
4. 肾移植受者与捐献者HLA匹配要求:首先考虑DQB1、DRB1位点中有一个或以上的等位基因或抗原相合,其他HLA-A、B、C、DPB1位点等位基因相合尽可能多;其次考虑与可接受错配HLA的基因型或抗原型相同。
5. 对于活体亲属器官供者,推荐采用NGS或SBT法进行HLA-A、B、C、DRB1、DQB1、DPB1、DQA1、DPA1基因分型,可明确移植肾的单倍体来源于父系还是母系,还可以判断单倍型是否相合。
1. HLA抗体:是移植受者产生的、针对具有人群多态性HLA抗原的抗体,是最早被发现的AMR的原发病因。根据HLA类型的不同,相应的抗体主要包括HLA-Ⅰ类抗体(A、B、C)和HLA-Ⅱ类抗体(DR、DP、DQ)。另外,MICA/B的表型也是一类多态性的同种异体抗原,相应的抗体也可以引起AMR。
2. 非HLA抗体:非HLA抗体涵盖范围比较广泛,根据其针对的抗原类型是否具有多态性,可以分为以下两类:
(1)非HLA同种异体抗体:这类抗体所针对的抗原具有人群多态性的抗原,并在移植物细胞表面表达。当移植供受者携带不同的该类抗原时,移植后供者所特有的非HLA同种异体抗原可以激活受者的免疫应答产生抗体。此类非HLA抗体和HLA抗体一样,可以引起原发性内皮细胞损伤。尽管目前还无法明确获知和AMR相关的非HLA同种异体抗原的种类和数量,但是可以通过细胞学的检测技术检测到。根据欧洲和美国器官移植数据库中HLA全相合的兄弟姊妹之间的活体移植资料显示,在移植前的血清样本中此类非HLA抗体的阳性率超过了20%。由于可以排除HLA抗体的干扰,可以评估这些预存的非HLA同种异体抗体对移植1年后移植物失功的影响,结果甚至超过了对照组HLA抗体的作用[9, 10]。而在对HLA存在错配的供受者之间进行非HLA抗体研究时,目前尚无办法区分HLA和非HLA抗体的作用。因此,此类研究的深入有待更为精准的检测方法。
(2)非HLA自身抗体:自身抗体的产生,通常继发于移植物组织损伤。组织损伤的原因包括针对供者同种异体HLA或非HLA的抗体引起的AMR、细胞介导的排斥反应(cell mediated rejection,CMR)以及缺血再灌注损伤等。在实体器官移植中,自身抗体的靶抗原主要包括:血管内皮细胞受损后,细胞表面变性的自身抗原、细胞内骨架结构抗原、胞浆组分抗原、核内组分抗原,还包括内皮下基底膜、内皮下层、血管弹性层、肌层等结构组分的抗原。有些自身抗体,比如胞浆内、核内组分抗原的自身抗体,只是组织损伤的标志物,并不参与AMR病理损伤过程;但另一些自身抗体,如内皮下基底膜、内皮下层、血管弹性膜、肌层结构的组分抗原的自身抗体,可能参与了原发性内皮细胞受损后的继发性AMR的病理损伤过程,但它们尚不能被判定为AMR的原发病因[11]。
根据检测抗体所用的HLA抗原载体不同,可以分为细胞学和纯化抗原两大类检测法:
1. 细胞学检测法:是使用来源于供者的或代表潜在供者人群的细胞组合,作为抗原载体,与受者的血清(抗体)孵育,以产生的抗原抗体结合反应来检测受者血液样本中相应的抗体。细胞学检测法所检出的抗体包括HLA和非HLA同种异体抗体[12]。根据所用靶细胞的来源不同,细胞学检测法分为在供者细胞和受者血清之间进行的交叉反应(cross-match,XM)法,以及在潜在供者人群细胞组合和受者血清之间进行的群体反应性抗体(panel reactive antibody,PRA)法。
(1)XM检测法:是用供者细胞作为靶细胞,检测受者体内是否存在DSA,是一种最直接而精准的、用于判定受者在接受供者移植物后是否会发生AMR的方法。理论上,XM检测法是在供者组织细胞可获得情况下的最佳的、最直接的检测方法。
(2)PRA检测法:是在供者细胞不可获得的情况下,采用潜在供者人群中有足够代表性的部分个体的细胞组合作为抗原载体,来模拟整个潜在供者人群的抗原谱,检测受者体内是否存在相应抗体。根据阳性反应细胞在总靶细胞组合中所占的比例,来粗略预估受者体内预存的抗体对随机供者产生AMR的可能概率,是对可能导致排斥抗体的一种间接的检测方法。PRA检测法对潜在排斥反应的预测作用受到用于检测的细胞组合的人群代表性的影响,其敏感性和特异性远低XM反应法[13]。
以细胞为基础的XM检测法和PRA检测法的结果判读有以下两种方法:
(1)补体依赖性细胞毒反应(complement-dependent cytotoxicity,CDC):是把受者的血清和抗原载体细胞放在一起孵育,并添加补体。假如血清中存在针对载体细胞表面抗原的具有补体激活能力的抗体,抗原载体细胞就会被补体杀伤,对死细胞染色后,可对细胞培养板或通过流式细胞仪进行计数来判读结果[13, 14]。CDC实验检出的抗体是可以激活补体的抗体。
(2)流式细胞仪检测(flow cytometry,FC):抗原载体细胞和受者血清孵育后清洗,再与荧光素标记的二抗反应,假如受者体内存在针对载体细胞表面抗原的抗体,结合到细胞表面的抗体就可以被荧光二抗标记[15]。FC实验检出的抗体是所有能与靶细胞表面抗原发生结合反应的抗体,既包括能激活补体的抗体,也包括不能激活补体的抗体。结果的判读根据靶细胞表面是否有荧光二抗的结合及荧光强度决定。
2. 纯化抗原检测法:不使用活细胞而用纯化的HLA作为抗原载体,直接与受者血清反应,检测相应抗体。相较于细胞学检测法,纯化抗原法的优点是敏感度高,可操作性好;缺点是检测结果解读时,混杂因素较多,假阳性比例较高,也存在一定的漏检可能性(取决于选用的HLA抗原种类对目标人群的覆盖率)。纯化抗原检测法根据抗原的组合类型可分为以下三类:
(1)HLA抗体筛检法:是从潜在供者人群中,选取一组HLA抗原表达有代表性的人作为志愿者,获取组织细胞,体外扩增培养,并从细胞中纯化出HLA抗原,按照尽可能覆盖更多抗原类型的原则,形成检测用抗原组合,用于筛查受者血液样本中的HLA抗体。筛检法所用的抗原通常是从细胞表面纯化而得的HLA-Ⅰ类和Ⅱ类的混合抗原。
(2)HLA-PRA检测法:来源同上的纯化HLA抗原,按照尽可能模拟HLA抗原在潜在供者人群的出现频率的原则,形成检测用抗原组合,最大程度模拟细胞学PRA法,检测受者样本中的针对HLA的PRA。
HLA抗体筛检法和HLA-PRA检测法的结果判读方法包括ELISA、流式细胞术和流式点阵仪等。
(3)HLA-DSA检测法:又称HLA单抗原检测法,通过基因重组技术体外表达各种纯化的HLA抗原,每种抗原单独包被于一种固定相介质,比如微球、平板孔等[目前最常用的是单抗原微球(single antigen beads,SAB)],按尽可能覆盖人群常见抗原类型的原则,将包被不同抗原的介质形成一个组合,用于检测受者样本中针对不同HLA纯化抗原的抗体。当抗体类别与供者HLA抗原类别相合时,即判定为DSA。
表7对实验室常用的抗体检测方法的特点及优缺点做了简要总结。

HLA抗体细胞学和纯化抗原检测法的比较
HLA抗体细胞学和纯化抗原检测法的比较
| 项目 | 细胞学检测法 | 纯化抗原检测法(HLA为例) | |||
|---|---|---|---|---|---|
| XM检测法 | PRA检测法 | HLA抗体筛检法 | HLA-PRA检测法 | HLA-DSA检测法 | |
| 检测平台 | 细胞毒、流式细胞术等 | ELISA,流式细胞术、流式点阵仪等 | |||
| 抗原来源 | 供者细胞 | 人群细胞的组合 | 人群细胞 | 人群细胞 | 真核或原核细胞 |
| 抗原品种 | 细胞表面HLA、非HLA抗原 | 细胞表面HLA、非HLA抗原的组合 | 纯化的HLA混合抗原的组合 | 纯化的HLA混合抗原的组合 | 重组表达的HLA单一抗原 |
| 抗原特点 | 天然抗原,变性抗原极少 | 天然抗原,变性抗原极少 | 天然抗原,会有变性抗原 | 天然抗原,会有变性抗原 | 非天然抗原,会有变性抗原 |
| 检出抗体种类 | HLA和(或)非 HLA-DSA | HLA和(或)非HLA-PRA | HLA混合抗体 | HLA-PRA | HLA-特异性抗体,含DSA |
| 检出抗体特点 | 真实DSA | 真实PRA | 仿真度高,但有变性干扰 | 仿真度高,但有变性干扰 | 仿真度不一,有变性干扰 |
| 检测技术要求 | 活细胞比例要求高,否则影响结果 | 活细胞比例要求高,否则影响结果 | 检测技术程式化、操作简便 | 检测技术程式化、操作简便 | 检测技术程式化、操作简便 |
| 缺点 | 无法区分DSA是HLA或非HLA抗体 | 无法区分PRA是HLA或非HLA抗体 | 只能检测HLA混合抗体 | 只能检测HLA-PRA | 只能检测HLA-DSA |
| CDC-XM检测法受人员、试剂质量等因素影响大 | 细胞组合的人群覆盖率直接影响PRA检测的敏感度,容易漏检 | 抗原组合的人群覆盖率直接影响抗体筛查的敏感度,容易漏检 | 抗原组合的人群覆盖率直接影响PRA检测的敏感度,容易漏检 | 抗原组合的人群覆盖率直接影响DSA检测的敏感度,容易漏检 | |
注:HLA为人类白细胞抗原;XM为交叉反应;PRA为群体反应性抗体;DSA为供者特异性抗体;ELISA为酶联免疫吸附试验;CDC-XM为补体依赖细胞毒交叉反应
1. 细胞学检测法的重要性被忽视:近年来随着HLA纯化抗原检测法的广泛推行,经典的细胞学检测法有被逐渐边缘化的趋势。然而,细胞学检测法的诸多优点,如细胞表面抗原的天然完整性、细胞表面包含的同种异体抗原的多样性(HLA和非HLA同种异体抗原)等,决定其具备了纯化抗原检测法所不可替代的独特优势。1964年Terasaki和Mcclelland[13]报道了补体依赖性细胞毒交叉反应(complement-dependent cytotoxicity cross-match,CDC-XM)对移植后发生AMR的预测作用,而且其预测作用明显高于CDC-PRA检测法。在供者细胞可获取的情况下,移植前细胞学XM检测法是预测AMR风险的首选方法。
2. CDC-XM实验的必要性以及改良或替代方法:目前很多中心的实践结果显示移植前CDC-XM的阳性检出率很低,绝大多数低于5%,甚至有的中心从未检出阳性结果。CDC-XM阳性检出率低有两种可能性:其一,预致敏导致的抗体不一定都是具有CDC作用的抗体[16],因而通过CDC检测技术不一定能检测到所有预致敏抗体;其二,CDC检测技术中所用的关键试剂-补体经过长期保存或者多次冻融,非常容易失活,导致假阴性。解决的办法有三个:首先,可以考虑完善CDC-XM技术,比如实验室试剂应当分装冻存,尽量避免反复冻融,实验设计中要有可靠的阳性对照以确保补体活性;其次,可选用抗人球蛋白抗体(anti-human globulin,AHG)改良CDC-XM以提高阳性检出率。AHG-CDC-XM是对经典CDC-CM的改进。供者外周血淋巴细胞与受者血清共同孵育后,加入AHG这一“抗-抗体层”放大了补体活化信号,从而增加了CDC-XM的敏感性[17]。另外,可用流式细胞术交叉反应(flow cytometry crossmatch,FCXM)的方法替代CDC-XM,提高阳性检出率,因为FCXM检测法可以检出所有与供者抗原起结合作用的抗体,包括有CDC作用的抗体,以及能引发抗体依赖的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)的抗体,因此对这两类抗体引起的AMR都会有较好的预测作用[12,16]。
3. 纯化HLA抗原检测法的漏检和假阳性问题:由于纯化HLA检测法较细胞学检测法而言,具有不需要活细胞、操作简单、可重复性好等优点,近年来在临床上得到了广泛的应用,大有取代细胞学检测法的趋势。但是,由于HLA数量巨大、纯化抗原的完整性难以保证等客观原因,纯化HLA检测法也有以下缺点。
(1)漏检问题:首先,纯化抗原检测法只能检出HLA抗体,和细胞学检测法比较,会漏检所有非HLA同种异体抗原的抗体。其次,纯化抗原检测法会因为靶标抗原组合选取的代表性和完整性不足,导致漏检HLA抗体,尤其是DSA。由于HLA是目前为止最具多态性的抗原,其种类过万,而目前商品化的检测试剂所包括的HLA-Ⅰ类或Ⅱ类抗原一般在百种以下,因此HLA纯化抗原检测法会出现漏检现象。此外HLA的类型存在人群差异,假如试剂盒最初设计使用时有预设的靶向人群,在其他人群中使用时就会出现更为严重的漏检现象。
(2)假阳性问题:原因主要是抗原在纯化、包被过程中发生结构变性,或者是纯化的抗原是在非人源细胞表达系统表达纯化而来。HLA抗体筛检法和HLA-PRA检测法所使用的抗原通常是来自于人源细胞的天然抗原,而HLA-DSA检测法所使用的抗原是通过基因重组表达的抗原,抗原蛋白表达系统可以是哺乳动物(包括人源细胞)、昆虫、酵母、细菌、藻类和无细胞系统,不同系统表达的蛋白在三维构象和表达后修饰会有很大的不同。因此,HLA-DSA检测法所用的抗原是人工合成的蛋白抗原,在模拟细胞表面天然HLA的结构时,会因为表达系统的变化而可能产生较大的差异。以往研究曾发现,流式点阵仪微球法(如Luminex)检测到的HLA抗体中包含变性HLA特异性的抗体,而这些抗体和排斥反应并没有显著相关关系[18]。
推荐意见:
1. 能够引起AMR的抗体包括同种异体HLA和非HLA抗体。
2. 非HLA自身抗体不能作为AMR的诊断参考。
3. 细胞学抗体检测技术可以检测与AMR相关的HLA抗体和非HLA同种异体抗体,最能直接预测AMR风险。建议采取AHG-CDC-XM技术或FCXM法,以提高敏感性。
4. HLA纯化抗原检测技术具有敏感度高、操作简单等优点,但需注意因抗原变性导致假阳性,因抗原组合无法完全覆盖人群抗原引起漏检等问题。
肾移植供受者HLA分型和受者HLA抗体检测的结果是对移植受者免疫风险评估的主要依据,结合HLA致敏史(如妊娠、既往移植、输血等)是对移植受者进行免疫记忆和初始同种异体免疫反应进行风险分层和个体化免疫抑制治疗的重要参考(表8)。
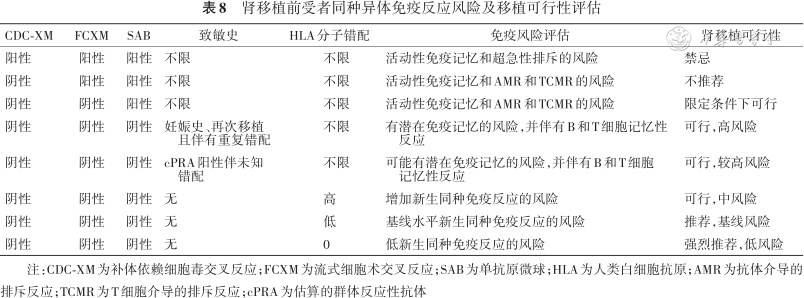
肾移植前受者同种异体免疫反应风险及移植可行性评估
肾移植前受者同种异体免疫反应风险及移植可行性评估
| CDC-XM | FCXM | SAB | 致敏史 | HLA分子错配 | 免疫风险评估 | 肾移植可行性 |
|---|---|---|---|---|---|---|
| 阳性 | 阳性 | 阳性 | 不限 | 不限 | 活动性免疫记忆和超急性排斥的风险 | 禁忌 |
| 阴性 | 阳性 | 阳性 | 不限 | 不限 | 活动性免疫记忆和AMR和TCMR的风险 | 不推荐 |
| 阴性 | 阴性 | 阳性 | 不限 | 不限 | 活动性免疫记忆和AMR和TCMR的风险 | 限定条件下可行 |
| 阴性 | 阴性 | 阴性 | 妊娠史、再次移植 且伴有重复错配 | 不限 | 有潜在免疫记忆的风险,并伴有B和T细胞记忆性 反应 | 可行,高风险 |
| 阴性 | 阴性 | 阴性 | cPRA阳性伴未知 错配 | 不限 | 可能有潜在免疫记忆的风险,并伴有B和T细胞 记忆性反应 | 可行,较高风险 |
| 阴性 | 阴性 | 阴性 | 无 | 高 | 增加新生同种免疫反应的风险 | 可行,中风险 |
| 阴性 | 阴性 | 阴性 | 无 | 低 | 基线水平新生同种免疫反应的风险 | 推荐,基线风险 |
| 阴性 | 阴性 | 阴性 | 无 | 0 | 低新生同种免疫反应的风险 | 强烈推荐,低风险 |
注:CDC-XM为补体依赖细胞毒交叉反应;FCXM为流式细胞术交叉反应;SAB为单抗原微球;HLA为人类白细胞抗原;AMR为抗体介导的排斥反应;TCMR为T细胞介导的排斥反应;cPRA为估算的群体反应性抗体
受者在器官移植以前,如有接触非己HLA的历史,就有可能产生免疫反应,即有HLA预致敏史。受者HLA抗体检测阳性是HLA预致敏的证据(需注意,阴性结果不能完全排除预致敏)。如此次移植物携带有与既往致敏史共同的HLA抗原表位,即可能产生两个临床后果,一是预存抗体可直接攻击移植物产生超急或急性AMR,二是激发免疫记忆产生新生抗体和效应T细胞,诱发AMR和T细胞介导的排斥反应(T cell mediated rejection,TCMR)。
目前临床最常用的抗体检测方法有:CDC-XM、FCXM和基于Luminex技术的HLA纯化抗原检测法[19]。不同HLA抗体检测方法的阳性结果的临床意义不同。
1. CDC-XM:根据淋巴细胞死亡百分比判断结果,并采取相应的临床决策(表9)。此方法要求淋巴细胞的活性在80%以上,灵敏度不高,对于低抗体滴度的HLA抗体容易出现假阴性。
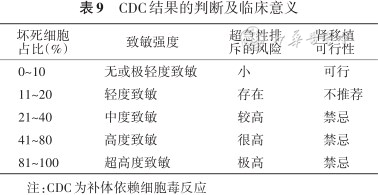
CDC结果的判断及临床意义
CDC结果的判断及临床意义
坏死细胞 占比(%) | 致敏强度 | 超急性排 斥的风险 | 肾移植 可行性 |
|---|---|---|---|
| 0~10 | 无或极轻度致敏 | 小 | 可行 |
| 11~20 | 轻度致敏 | 存在 | 不推荐 |
| 21~40 | 中度致敏 | 较高 | 禁忌 |
| 41~80 | 高度致敏 | 很高 | 禁忌 |
| 81~100 | 超高度致敏 | 极高 | 禁忌 |
注:CDC为补体依赖细胞毒反应
AHG-CDC-XM对经典CDC-XM进行了改进,增强了补体激活,增加了CDC-XM的敏感性[17]。然而,这一方法的缺点是由于增加了AHG孵育步骤,可能增加淋巴细胞损伤的数量,从而产生更高的干扰背景。
2. FCXM:目前国内开展的实验室较少,大多数国外实验室使用标准三色FCXM。受者血清与供者外周血淋巴细胞混合孵育后,通过细胞表面标志物荧光抗体(如:抗IgG-FITC,抗CD3-PerCP以及抗CD19-PE)对结合和未结合受者血清抗体的供者T/B淋巴细胞进行标记,流式细胞仪获取结果。分别结合供者T/B细胞的HLA抗体,无论其是否激活补体都可被检测到,敏感性高于CDC-XM。检测样本平均荧光强度位移超过阴性对照30%,被判定为FCXM阳性,T细胞FCXM阳性,提示HLAⅠ类抗体阳性;B细胞FCXM阳性,表示HLAⅡ和(或)Ⅰ类抗体阳性[20]。FCXM阳性时不推荐行肾移植。
3. 基于Luminex技术的HLA纯化抗原检测法:临床常将HLA抗体筛检法和SAB法组合使用。筛检法所用的抗原通常是从细胞表面纯化而得的HLA-Ⅰ类和Ⅱ类的混合抗原。可以对受者血液样本中是否有HLA抗体进行定性判断。如HLA筛检法结果阳性,再以SAB法检测HLA抗体所针对的特异性抗原的基因型,与供者HLA基因型对照,如型别一致或具有共同的抗原表位,可以判定为DSA,结合平均荧光强度(mean fluorescence intensity,MFI)和既往致敏史可判断供者错配抗原是否为不可接受错配抗原。
目前对于SAB检测的HLA抗体结果,没有统一的阳性阈值标准,MFI值范围从500到10 000不等,取决于HLA分子类别、位点及抗原特异性。许多存在抗原共享表位的HLA抗体,可能在SAB中会产生较低的MFI值,因此单个抗原的MFI不足以代表该基因型抗原的抗体总量。除此之外,MFI阈值还受到实验平台的测试方案、技术人员的经验和各移植中心临床实践中不同的接受标准等因素的影响[21]。因此,目前MFI没有得到许可作为定量分析指标。DSA MFI阈值在大多数情况下是由移植中心自行决定。虽然SAB检测的DSA MFI是半定量,但DSA初始MFI具有一定的预警价值。目前文献报道最多的DSA MFI阈值标准为1 000或2 000,MFI值越高发生AMR的风险越高,尤其是在3 000以上时,相对风险达到65.3倍,6 000以上时相对风险达到156.8倍[22]。
需要指出的是,如SAB检测到受者预存HLA抗体针对上一次移植物的HLA,与本次潜在供者错配HLA有重复时,即使其MFI值较低,也明确提示受者对该HLA位点存在免疫记忆,发生强烈免疫记忆反应风险很大,应尽量避免,或采取足够的预防措施。
4. 虚拟交叉配型(virtual crossmatch,VXM):不需要检测存活的供者细胞与受者血清的真实反应,而是基于供者HLA高分分型和受者当前或既往的抗体SAB检测结果,分析评估供受者免疫相容性,因此称为VXM。由于SAB方法增强了HLA抗体检测能力,VXM的概念逐渐被接受,用以判断拟接受器官移植受者体内是否存在DSA。与实际交叉配型相比,VXM考虑了特定接受者针对特定供者所具有的当前和历史抗体,而实际交叉配型仅对受者移植前一个时间点的抗体进行检测。因此,VXM是一种基于患者更全面的同种抗体谱的免疫相容性评估。由于VXM增强了识别DSA的能力,减少了不必要的实际交叉配型,提高了致敏患者找到兼容供者的可能性,因此在供肾选择时VXM比CDC-XM或FCXM具有更显著的优势[23]。
受者对移植物初始免疫反应的本质是对供者错配同种异体抗原的免疫应答,目前认识最清楚的同种异体抗原是HLA系统,我们将供受者HLA差异的大小定义为“错配负荷”(mismatch load,ML)。ML与排斥反应的风险正相关。供受者HLA分型是评估分析ML的基础。
1. 以HLA血清学分型评估ML和排斥风险:HLA具有高度多态性,最早是以血清学方法进行分型。这种方法的关键是收集和鉴定与各种不同的HLA抗原特异性结合的抗体血清[24],与不同抗体血清反应的抗原即以不同的编号命名。
以血清学分型为基础的术前供受者配型方法是:比较同一个基因座位上HLA编号的异同,不同HLA的数量总和即“错配数”,以此反映供受者间ML的大小。这种评估方法长期广泛应用于移植临床,是移植器官分配的重要依据,积极作用毋庸置疑[25]。对美国在1987年至2013年首次接受肾移植的189 141成人受者的预后分析发现,在HLA的A、B、DR六个位点中每增加1个位点错配,风险增加13%,6个位点错配,风险增加64%[26]。
尽管如此,血清学分型越来越不能满足临床的需要。首先由于缺少相应的抗体血清,血清学分型不能有效区分HLA-C、DQ、DP抗原。第二,也是更重要的,HLA各个位点的免疫原性是不同的,同一个位点各个血清型间的差异也很大[27],血清学分型不能有效区分这些差异。
因此,从大样本统计学角度,确实有血清型错配数越多ML越大的趋势,但是这仅能表现出HLA抗原蛋白质大分子水平上的不同,而不能反映出这种差异的大小,即不能准确反映具体供受者之间的ML,对评估受者对移植物初始同种异体免疫反应的风险作用有限。
2. 以HLA高分基因型为基础的分子配型评估ML和排斥风险:HLA高分辨分型解码了其核苷酸序列[28],从而精确解析出HLA分子的氨基酸序列,奠定了HLA分子分型技术的基础。相较血清学分型,HLA分子分型可反应出不同HLA分子在氨基酸序列水平的差异,有利于评估ML。目前已有数种分析方法利用计算机评估ML。移植致敏风险评估工作组[Sensitization in transplantation:Assessment of risk(STAR)]2019年的报告中介绍并简述了其中最常见的4种,分别是HLA功能表位(eplet)分析、预测受体HLA间接递呈并可识别的供者HLA表位(predicted indirectly recognizable HLA epitopes presented by recipient HLA,PIRCHE)评分、氨基酸错配(amino-acid mismatch score,AMS)评分和静电荷错配(electrostatic mismatch score,EMS)评分[29]。
Eplet分析是第一个也是发展时间最长的HLA分子配型技术,它从抗原抗体结合的原理出发,临床应用报道最多。HLA分子与抗体的反应界面只由少数氨基酸组成,称为抗原表位[30],其中核心区域的关键氨基酸残基组合决定了抗原的特异性。Duquesnoy研究组模拟计算出已知人类HLA分子所有可能的关键氨基酸残基组合,它们位于HLA分子表面,能够与抗体的中央核心互补决定区(complementarity-determining region,CDR)特异性结合,大小约3平方埃,通常含有2~5个氨基酸,将其命名为eplet[31]。目前发现的eplet总数有513个,其中HLAⅠ类抗原包含224个,HLAⅡ类289个,目前已经确认有特异性抗体产生的分别有72个和79个[32, 33]。
基于eplet是抗体特异性识别的基本结构单位的认识,理论上推测供受者eplet错配数比血清型错配数更能精确反映ML。目前多项临床研究证实,eplet错配数与受者术后新生DSA、移植物肾小球病、抗体介导排斥反应等有明显的相关性,能够更加精确地反映同种异体免疫反应风险[34]。供受者间HLAⅡ类抗原eplet错配数与患者术后新生DSA明显相关[34, 35, 36, 37],而与血清学分型则没有相关性[38]。因此供受者eplet错配数可准确评估受者对移植物初始同种异体免疫反应风险,指导术后免疫抑制治疗强度[39]。在为患者选择供肾时,选择eplet错配数特别是HLAⅡ类eplet错配数少的供肾,有利于减少移植后排斥风险并提高受者的长期存活。
肾移植术后受者体内产生的HLA抗体包括DSA和非供者特异性抗体(non donor-specific antibody,NDSA)。DSA是受者针对移植物同种异体抗原发生免疫反应的重要监测指标,已经成为预测AMR的一个确定的生物标志物[40, 41],与蛋白尿、较差的移植物功能和存活率显著相关[42]。
DSA按产生时间分两种。移植前预致敏患者体内的预存DSA(preformed DSA,pfDSA)可诱发超急性排斥反应、加速急性排斥反应和早期活动性抗体介导的排斥反应(active AMR,aAMR);移植后新生DSA(denovo DSA,dnDSA)与晚期AMR、慢性活动性抗体介导的排斥反应(chronic active AMR,caAMR)和移植肾肾小球病变相关。DSA的及时发现,依赖于受者常规程序性的SAB监测,对肾移植受者免疫抑制方案的选择和调整具有非常重要的指导作用。DSA的抗体特征如所针对的HLA类别、特异性、抗体强度、IgG亚类别和补体结合能力等显著影响AMR的排斥类型和机制。对于pfDSA和dnDSA MFI值-时间的动态监测,可粗略反映抗体数量的改变,对判断AMR风险有参考意义。另外,能与补体C1q结合的DSA与aAMR、更严重的移植物损伤和早期移植物衰竭密切相关,而非C1q结合的DSA与亚临床或caAMR和晚期移植物丢失相关[43]。HLA抗体不同的IgG亚型具有不同的激活补体和招募效应细胞的能力。可与补体结合的IgG3型DSA常与aAMR和严重的移植物损伤相关,而非补体结合的IgG4型DSA则与亚临床或caAMR和移植肾肾小球病变相关[44]。对DSA特征的深入了解有助于肾移植受者的免疫风险分层,预测AMR的不同类型,并有望指导临床治疗方案以改善移植结果。
HLA及其抗体检测涉及很多专业术语,其中一些术语在文献交流中存在混淆和误用的现象。明确这些术语的概念并且正确地使用,有利于临床研究结果之间进行比较、归纳和总结。下面就几个常见易混淆的术语进行说明。
1. HLA抗原表位≠eplet:HLA抗原表位是指HLA抗体和HLA抗原分子之间的完整接触区域,由15~25种氨基酸组成。eplet是抗原表位的核心部分,由2~5个氨基酸组成的集群,是理论上构成抗体免疫球蛋白可变区重链(CDR H3)的结合位点,决定抗原抗体的特异性结合[45]。目前,只有一部分eplet被证明具有抗原性。
2. 抗体MFI≠抗体滴度:一些MFI值相对较高的HLA抗体通过稀释,MFI值可能很快下降,因此不是高滴度抗体。目前,HLA抗体MFI值还没有得到FDA的许可作为定量分析指标。
3. PRA阴性≠HLA抗原未致敏状态:等待移植受者可能通过妊娠或输血暴露于同种HLA抗原,并对其产生应答,但完全有可能在当前的血清中检测不到HLA抗体。因此,没有检测到HLA抗体并不意味等待移植受者对HLA抗原处于未致敏状态。
4. 避开“不可接受错配HLA”≠未致敏状态:等待移植受者SAB检测提示DSA阳性时,其所针对的抗原,用“不可接受错配HLA”一词描述,提醒临床避开免疫记忆反应以预防移植失败。有临床医生认为,选择供者时避开不可接受错配HLA,受者就没有HLA免疫记忆或体内没有HLA特异性抗体。但是,在许多情况下DSA MFI低于阈值并不意味着HLA抗体不存在,或受者对这种HLA错配是未致敏状态,还需要结合受者致敏史综合判断。
5. 移植前DSA低MFI≠移植后免疫记忆反应低风险:通常认为移植前HLA抗体的MFI可以粗略预测移植后免疫记忆反应的风险和强度。但是目前还没有有效的方法来预测低MFI的HLA抗体在移植后是否会迅速升高。
6. 体外补体结合活性≠体内补体结合活性:补体激活很大程度上是高浓度DSA的结果。已经证明C1q的激活需要6个抗体分子的近距离存在。然而,血清中C1q-DSA+的患者经常会出现C4d+AMR,这表明C1q检测阴性并不意味着DSA不能在体内激活补体[46]。因此,虽然研究发现C1q+DAS+是移植物不良结局的潜在风险,但还需要更多的临床研究验证。
推荐意见:
1. 肾移植等待者术前推荐至少一次HLA抗体筛查检测和HLA-DSA检测(SAB法)。等待移植期间建议每3~6个月进行一次HLA抗体筛查检测,如果出现阳性,建议每3个月进行一次HLA-DSA检测(SAB法)。
2. HLA抗体SAB检测的结果,结合HLA致敏史和潜在供者HLA高分结果是对肾移植等待者进行免疫记忆风险评估的重要依据。
3. 致敏等待者用SAB判定不可接受错配HLA的MFI阈值,取决于HLA分子类别、位点及抗原特异性,文献报道500到10 000不等,各器官移植中心可根据本单位经验而定。对于HLA常见抗原位点建议MFI不高于5 000。
4. 致敏等待者选择供肾时VXM具有比CDC-XM或FCXM更显著的优势。最终决定是否移植需参考CDC-XM或FCXM的结果。
5. ML与排斥反应的风险正相关。基于供受者HLA高分结果的eplet错配数相对于HLA血清型错配数可以更加准确地评估受者对移植物产生初始同种异体免疫反应的风险。
6. DSA是受者术后重要监测指标和预测AMR的生物标志物。DSA的及时发现依赖于受者程序性SAB监测。DSA的抗体特征对受者免疫抑制方案的选择和调整具有重要指导作用。
目前HLA分型和抗体检测技术取得了长足的进展,在计算机分析辅助下,可以提供重要的信息。肾移植临床医生了解这些技术方法的优势和不足并选择应用,可以获得评估受者排斥风险的有益参考。肾移植AMR处理中有两个核心难题,一是预致敏受者肾移植和晚期AMR的诊治,二是如何合理应用这些工具制定应对策略,二者将是后续探讨的重点。
共识专家组(按姓名汉语拼音排序):陈刚(华中科技大学同济医学院附属同济医院);崔瑜(浙江大学附属第一医院);傅茜(中山大学附属第一医院);郭晖(华中科技大学同济医学院附属同济医院);林涛(四川大学华西医院);刘龙山(中山大学附属第一医院);邱建新(上海第一人民医院);田普训(西安交通大学第一附属医院);王长希(中山大学附属第一医院);吴建永(浙江大学附属第一医院);肖漓(解放军总医院第八医学中心);朱兰(华中科技大学同济医学院附属同济医院);朱有华(海军军医大学长海医院);朱同玉(复旦大学附属中山医院);曾力(海军军医大学长海医院);张更(空军军医大学西京医院);张明(上海交通大学附属仁济医院);张明(复旦大学附属华山医院)
执笔专家(按章节顺序):何军(苏州大学附属第一医院);蔡俊超(苏州才博医学研究所);郑瑾(西安交通大学第一附属医院)
海军军医大学长海医院器官移植中心陈慧俊女士为本共识做了大量文字整理工作
蔡俊超为苏州才博医学研究所首席科学家,研究所致力于开发符合中国人群特点的HLA和非HLA抗体检测试剂与方法;其他作者均声明不存在利益冲突



























