
探究加速康复外科(ERAS)对胃癌合并2型糖尿病患者手术应激反应的影响。
回顾性分析2020年1至12月江苏大学附属医院胃肠外科收治的49例行胃癌根治术的2型糖尿病患者的临床资料,依据围手术期不同的处理措施分为试验组[23例,男17例,女6例,年龄(67.6±8.7)岁)]与对照组[26例,男17例,女9例,年龄(66.2±8.4)岁]。对比两组患者围手术期的C反应蛋白(CRP)、白细胞(WBC)、白细胞介素-6(IL-6)、胰岛素抵抗水平(HOMA-IR)、血糖波动状况以及术后恢复情况。
最终共有49例患者纳入研究。术后试验组的应激反应程度较对照组轻,CRP水平在术后第5天[(17.3±9.2)比(28.7±18.0)mg/L,P=0.009]、第7天[(6.7±4.3)比(15.5±11.1)mg/L,P=0.001)差异均有统计学意义;两组IL-6在术后第1天[(28.0±10.0)与(35.7±15.5)ng/L,P=0.047]、第3天[(14.6±8.6)与(26.4±10.8)ng/L,P<0.001]、第5天[(10.8±7.1)与(21.6±12.2)ng/L,P<0.001]、第7天[(9.6±7.2)与(14.3±8.2)ng/L,P=0.039]差异均有统计学意义;术后第1天两组WBC、HOMA-IR差异均有统计学意义(均P<0.05),其中试验组的HOMA-IR、血糖的整体变化趋势较对照组的更为平缓。试验组术后肛门首次排气时间、引流管留置时间、鼻肠管留置时间、术后住院时间等均较对照组明显缩短,差异均有统计学意义(均P<0.05)。
ERAS可减轻胃癌合并2型糖尿病患者手术的炎症应激程度,降低术后HOMA-IR水平,促进早期康复。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是常见消化道恶性肿瘤之一,最新数据显示其发病率与死亡率在全球范围内分别位于第5和第3,其中东亚地区的发病率明显升高[1, 2]。2型糖尿病作为一种慢性代谢性疾病已被证明与胃癌的发生发展和预后密切相关[3],尤其是对于需要进行手术治疗的胃癌患者,手术应激往往会加剧糖尿病患者本身的代谢紊乱进而使机体呈现负氮平衡,带来并发症多、恢复慢等一系列负面影响[4]。加速康复外科(enhanced recovery after surgery,ERAS)自提出以来,其相较于传统围手术期处理的优势作用在多个学科领域得到证实[5]。目前大多数研究肯定了ERAS在胃癌患者手术治疗中的作用[6],但由于ERAS主张术前口服碳水化合物,糖尿病患者往往并未纳入研究,胃癌合并2型糖尿病患者能否从ERAS中获益尚无明确定论,本研究旨在探讨ERAS对胃癌合并2型糖尿病患者手术的应激反应影响。
1. 本研究为回顾性病例对照研究,分析了2020年1至12月期间江苏大学附属医院胃肠外科收治的49例择期行胃癌D2根治术的胃癌合并2型糖尿病患者的病例资料,按照不同的围手术期处理措施分为ERAS组(试验组)[23例,男17例,女6例,年龄(67.6±8.7)岁)]与传统手术组(对照组)[26例,男17例,女9例,年龄(66.2±8.4)岁]。
2. 纳入标准:(1)病理明确诊断的胃癌患者;(2)根据2016年世界卫生组织制定的糖尿病诊断标准确诊为2型糖尿病且入院时糖化血红蛋白≤10%;(3)18岁<年龄<80岁。
3. 排除标准:(1)曾接受过腹部手术治疗或放化疗的患者;(2)合并穿孔、出血等严重并发症需急诊或姑息手术者;(3)合并远处转移者;(4)有严重心、肺、脑等功能障碍或糖尿病并发症无法耐受手术者;(5)其他类型糖尿病患者或由药物等引起血糖升高者;(6)体质指数(body mass index,BMI)>30 kg/m2或<15 kg/m2、NRS2002营养评分>5分、美国麻醉医师协会(ASA)分级>Ⅲ级者。本研究已通过江苏大学附属医院伦理委员会审批和患者的知情同意。
1. 围手术期处理措施:试验组患者实施ERAS措施,对照组则采用传统措施,具体见表1, 2, 3。

胃癌D2根治术术前处理措施
胃癌D2根治术术前处理措施
| 项目 | 试验组 | 对照组 |
|---|---|---|
| 术前宣教 | 个体化介绍围手术期诊疗过程,得到患者及家属的理解与配合,缓解忧虑和紧张 | 常规签署术前沟通谈话,履行传统告知义务 |
| 肠道准备 | 功能性肠道准备,术前2 d无渣饮食,不行传统机械式肠道准备 | 常规机械性肠道准备,必要时术日晨灌肠 |
| 禁食禁饮 | 术前禁食6 h、禁饮2 h,于术前晚和术前2 h分别饮用“乐赋”(特殊医学用途电解质配方食品)350 ml和200 ml | 术前禁食12 h、禁饮8 h |
| 麻醉准备 | 术前疼痛宣教;术前1 d完成胃超声评估,入室时完成胃窦部超声测量,并予以超声引导下行腹横肌平面阻滞 | 传统麻醉访视,术前麻醉风险评估并签字谈话 |

胃癌D2根治术术中处理措施
胃癌D2根治术术中处理措施
| 项目 | 试验组 | 对照组 |
|---|---|---|
| 麻醉优化 | 采取胸段硬膜外麻醉联合全身静脉麻醉,深度肌松并监测, 避免使用长效肌松药物 | 常规全身麻醉 |
| 导尿管 | 麻醉生效后放置,术后1~2 d拔除 | 麻醉生效后放置,根据具体情况拔除,一般3~7 d左右 |
| 体温管理 | 采用空气保温毯进行保温,用深部体温探头监测,控制核心 体温在36 ℃~37 ℃ | 无特殊措施 |
| 液体控制 | 采用目标导向性液体治疗(补液3~6 ml·kg-1·h-1,尿量 2 ml·kg-1·h-1),术中补液量≤3 000 ml | 不刻意控制输液量 |
| 腹腔引流管 | 不常规放置,如需留置,则在无特殊情况下术后2~3 d内拔除 | 常规放置,术后视情况拔除(24 h内引流量<100 ml) |
| 鼻肠管 | 不常规使用,如需放置,术后应尽早拔除(建议24 h内) | 常规放置,患者进食后拔除 |

胃癌D2根治术术后处理措施
胃癌D2根治术术后处理措施
| 项目 | 试验组 | 对照组 |
|---|---|---|
| 疼痛管理 | 多模式镇痛,腹横肌平面阻滞镇痛联合经静脉患者自控 镇痛(PICA),减少阿片类药物使用 | 疼痛时予肌内注射阿片类药物 |
| 恶心呕吐防治 | 采用多种围手术期策略联合术后静滴5-羟色胺受体拮抗剂, 必要时肌注甲氧氯普胺 | 恶心呕吐时予肌内注射或静脉滴注甲氧氯普胺 |
| 进食时间 | 术后清醒即可少量饮水,术后6 h可饮用少量“乐赋” (<150 ml),术后第1天流食,逐渐过渡 | 肛门排气后可少量饮水,逐渐过渡 |
| 早期活动 | 鼓励患者尽早下床,并制定每日活动目标,术后第1天在指导 下由家属协助尽量走动60 m,后逐渐延长活动距离 | 鼓励患者早期下床,待其自愿后搀扶患者进行适量行走 |
2. 围手术期血糖控制策略:试验组和对照组患者采用相同的血糖控制策略及控制目标,具体见表4。

胃癌D2根治术血糖控制策略及目标
胃癌D2根治术血糖控制策略及目标
| 时间 | 控制策略 | 控制目标 |
|---|---|---|
| 术前 | 完善术前准备,监测患者血糖水平(空腹及三餐前后);继续平时降糖方案, 根据血糖水平额外注射胰岛素;术日晨,药物控制血糖者暂停用药,胰岛素 控制血糖者,根据血糖水平调整剂量 | 空腹血糖≤7.8 mmol/L; 餐后2 h血糖≤10.0 mmol/L; 血糖>13.9 mmol/L时额外皮下注射胰岛素 (谨防血糖低于4 mmol/L) |
| 术中 | 术中严密监测患者血糖(每1小时,补液速度和胰岛素用量由术中血糖水平决定) | 7.8~10.0 mmol/L |
| 术后 | 采用静脉滴注+胰岛素额外注射联合控制,根据患者术后血糖变化(监测血糖每4小时及时调整胰岛素剂量,注意防止糖尿病酮症和低血糖的发生) | 正常饮食前:7.8~10.0 mmol/L 正常饮食后:空腹血糖≤7.8 mmol/L 随机血糖≤13.9 mmol/L (谨防血糖低于4 mmol/L) |
3. 观察指标:(1)术前一般资料与糖尿病相关指标:年龄、性别、BMI、ASA评分、NRS2002评分、糖尿病病程及控制方法、入院时糖化血红蛋白(HbA1C)、术前1 d空腹血糖(FPG)与胰岛素(insulin,INS);(2)围手术期应激相关指标:术前1 d和术后第1、3、5、7天晨外周血C反应蛋白(CRP)、白细胞(WBC)、白细胞介素-6(IL-6)、胰岛素抵抗水平(HOMA-IR),采用HOMA稳态模式评估法评价,计算公式为:HOMA-IR=FPG(mmol/L)×INS(μU/ml)/22.5;(3)围手术期血糖变化情况:术前3 d每日FPG情况,以及术后1周每日1∶00、5∶00、9∶00、13∶00、17∶00、21∶00血糖情况;(4)术后恢复情况:术后首次排气时间、腹腔引流管及鼻肠管留置时间(未放置者时间记为0)、术后住院时间。
4.统计学处理:采用SPSS 26.0软件进行统计分析,Graphpad prism 7.0软件绘图。正态分布计量资料以表示,组间比较依条件采用两独立样本t检验或t′检验;非正态分布计量资料用M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验;计数资料用频数、构成比(%)表示,组间比较采用χ2检验或Fisher确切概率法;重复测量的数据采用方差分析(F)进行组间对比;双侧检验,检验水准α=0.05。
1.术前一般资料和糖尿病相关指标:最终49例患者纳入研究,其中试验组23例,对照组26例。两组患者术前一般资料和糖尿病相关指标对比差异均无统计学意义(均P>0.05),具体见表5、6。
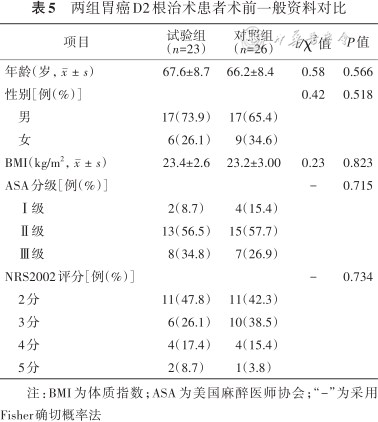
两组胃癌D2根治术患者术前一般资料对比
两组胃癌D2根治术患者术前一般资料对比
| 项目 | 试验组 (n=23) | 对照组 (n=26) | t/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 67.6±8.7 | 66.2±8.4 | 0.58 | 0.566 |
| 性别[例(%)] | 0.42 | 0.518 | ||
男 | 17(73.9) | 17(65.4) | ||
女 | 6(26.1) | 9(34.6) | ||
| BMI(kg/m2,) | 23.4±2.6 | 23.2±3.00 | 0.23 | 0.823 |
| ASA分级[例(%)] | - | 0.715 | ||
Ⅰ级 | 2(8.7) | 4(15.4) | ||
Ⅱ级 | 13(56.5) | 15(57.7) | ||
Ⅲ级 | 8(34.8) | 7(26.9) | ||
| NRS2002评分[例(%)] | - | 0.734 | ||
2分 | 11(47.8) | 11(42.3) | ||
3分 | 6(26.1) | 10(38.5) | ||
4分 | 4(17.4) | 4(15.4) | ||
5分 | 2(8.7) | 1(3.8) |
注:BMI为体质指数;ASA为美国麻醉医师协会;“-”为采用Fisher确切概率法
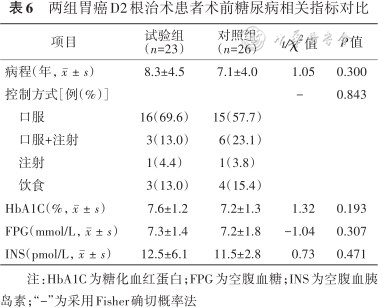
两组胃癌D2根治术患者术前糖尿病相关指标对比
两组胃癌D2根治术患者术前糖尿病相关指标对比
| 项目 | 试验组 (n=23) | 对照组 (n=26) | t/χ2值 | P值 |
|---|---|---|---|---|
| 病程(年,) | 8.3±4.5 | 7.1±4.0 | 1.05 | 0.300 |
| 控制方式[例(%)] | - | 0.843 | ||
口服 | 16(69.6) | 15(57.7) | ||
口服+注射 | 3(13.0) | 6(23.1) | ||
注射 | 1(4.4) | 1(3.8) | ||
饮食 | 3(13.0) | 4(15.4) | ||
| HbA1C(%,) | 7.6±1.2 | 7.2±1.3 | 1.32 | 0.193 |
| FPG(mmol/L,) | 7.3±1.4 | 7.2±1.8 | -1.04 | 0.307 |
| INS(pmol/L,) | 12.5±6.1 | 11.5±2.8 | 0.73 | 0.471 |
注:HbA1C为糖化血红蛋白;FPG为空腹血糖;INS为空腹血胰岛素;“-”为采用Fisher确切概率法
2.围手术期应激相关指标:两组患者术前的CRP、IL-6、WBC、HOMA-IR差异均无统计学意义(均P>0.05)。两组患者的上述指标均在术后第1天上升至顶峰,随后逐渐下降,但试验组的整体应激反应程度较对照组轻。两组CRP水平在术后第5、7天差异均有统计学意义(均P<0.05),IL-6在术后第1、3、5、7天差异均有统计学意义(均P<0.05),WBC、HOMA-IR在术后第1天差异均有统计学意义(均P<0.05)。而在总体变化趋势方面,仅试验组的HOMA-IR整体变化趋势较对照组更为平缓,差异有统计学意义(F=6.906,P<0.05)。具体见表7。
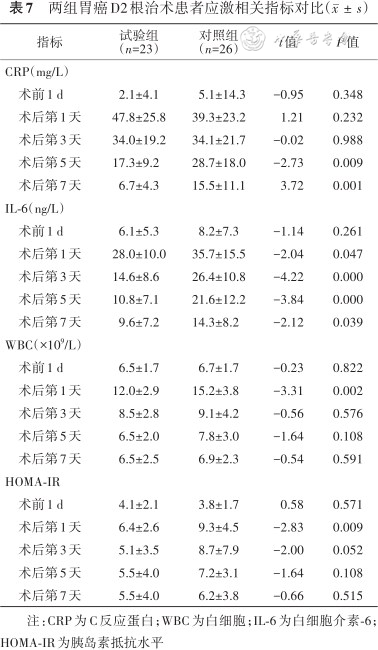
两组胃癌D2根治术患者应激相关指标对比()
两组胃癌D2根治术患者应激相关指标对比()
| 指标 | 试验组 (n=23) | 对照组 (n=26) | t值 | P值 |
|---|---|---|---|---|
| CRP(mg/L) | ||||
术前1 d | 2.1±4.1 | 5.1±14.3 | -0.95 | 0.348 |
术后第1天 | 47.8±25.8 | 39.3±23.2 | 1.21 | 0.232 |
术后第3天 | 34.0±19.2 | 34.1±21.7 | -0.02 | 0.988 |
术后第5天 | 17.3±9.2 | 28.7±18.0 | -2.73 | 0.009 |
术后第7天 | 6.7±4.3 | 15.5±11.1 | 3.72 | 0.001 |
| IL-6(ng/L) | ||||
术前1 d | 6.1±5.3 | 8.2±7.3 | -1.14 | 0.261 |
术后第1天 | 28.0±10.0 | 35.7±15.5 | -2.04 | 0.047 |
术后第3天 | 14.6±8.6 | 26.4±10.8 | -4.22 | 0.000 |
术后第5天 | 10.8±7.1 | 21.6±12.2 | -3.84 | 0.000 |
术后第7天 | 9.6±7.2 | 14.3±8.2 | -2.12 | 0.039 |
| WBC(×109/L) | ||||
术前1 d | 6.5±1.7 | 6.7±1.7 | -0.23 | 0.822 |
术后第1天 | 12.0±2.9 | 15.2±3.8 | -3.31 | 0.002 |
术后第3天 | 8.5±2.8 | 9.1±4.2 | -0.56 | 0.576 |
术后第5天 | 6.5±2.0 | 7.8±3.0 | -1.64 | 0.108 |
术后第7天 | 6.5±2.5 | 6.9±2.3 | -0.54 | 0.591 |
| HOMA-IR | ||||
术前1 d | 4.1±2.1 | 3.8±1.7 | 0.58 | 0.571 |
术后第1天 | 6.4±2.6 | 9.3±4.5 | -2.83 | 0.009 |
术后第3天 | 5.1±3.5 | 8.7±7.9 | -2.00 | 0.052 |
术后第5天 | 5.5±4.0 | 7.2±3.1 | -1.64 | 0.108 |
术后第7天 | 5.5±4.0 | 6.2±3.8 | -0.66 | 0.515 |
注:CRP为C反应蛋白;WBC为白细胞;IL-6为白细胞介素-6;HOMA-IR为胰岛素抵抗水平
3.围手术期血糖变化情况:两组患者术前血糖差异均无统计学意义(P>0.05)。总体而言,两组患者术后血糖水平随时间波动的趋势相同,差异无统计学意义(F=0.846,P>0.05);而试验组的波动趋势较对照组平缓,差异有统计学意义(F=4.15,P<0.05)。
4.术后恢复情况:相比对照组,试验组患者术后首次排气时间、鼻肠管留置时间、引流管留置时间、术后住院时间均缩短,差异有统计学意义(P<0.05)。具体见表8。
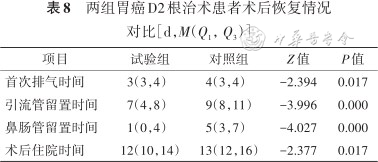
两组胃癌D2根治术患者术后恢复情况对比[d,M(Q1,Q3)]
两组胃癌D2根治术患者术后恢复情况对比[d,M(Q1,Q3)]
| 项目 | 试验组 | 对照组 | Z值 | P值 |
|---|---|---|---|---|
| 首次排气时间 | 3(3,4) | 4(3,4) | -2.394 | 0.017 |
| 引流管留置时间 | 7(4,8) | 9(8,11) | -3.996 | 0.000 |
| 鼻肠管留置时间 | 1(0,4) | 5(3,7) | -4.027 | 0.000 |
| 术后住院时间 | 12(10,14) | 13(12,16) | -2.377 | 0.017 |
越来越多的研究证明,2型糖尿病患者的胃癌发病率明显增加[7, 8]。对于胃癌合并2型糖尿病患者的手术患者而言,需要重点关注的是手术风险大、术后并发症的发生率高和病死率高的问题[9]。一方面,2型糖尿病患者因慢性内分泌代谢障碍使血糖增高,再加上术前焦虑、疼痛、手术与创伤应激等多方面作用激活人体内神经内分泌系统与炎症应激系统使血糖进一步增高,从而增加了术后切口感染、吻合口瘘、愈合延迟、心肌梗死等并发症的发生率,造成预后不良[4,10];另一方面,2型糖尿病患者长期慢性高血糖往往会引发周围神经功能障碍和自主神经病变,引起胃肠收缩功能减弱、胃窦功能低下和幽门痉挛,主要表现为胃轻瘫,即进食后胃排空延迟而无机械性梗阻[11]。这会使术中反流误吸和吸入性肺炎的发生率大大提高,增加了手术风险。但需要说明的一点是,目前已有研究证明2型糖尿病患者是可以耐受术前口服碳水化合物,而并不增加胰岛素需求、血糖水平及并发症发生率[12],且术前过长时间禁饮禁食反而增加了胃排空延迟的风险[13],这也是本研究得以开展的理论基础之一。因此,减轻手术应激反应对胃癌合并2型糖尿病患者来说至关重要。
手术应激时的主要特征单核/巨噬细胞系统被激活,机体内WBC、CRP等水平升高,同时产生IL-6、肿瘤坏死因子(TNF)-α等细胞因子参与炎症反应与免疫应答[14]。因此,本研究通过测量WBC、CRP、IL-6等应激相关炎症指标来了解两组患者应激反应程度的变化。本研究显示其中试验组的应激相关炎症指标变化较对照组小,试验组WBC在术后第1天低于对照组,试验组CRP在术后第5、7天低于对照组,试验组IL-6在术后第1、3、5、7天均低于对照组,差异有统计学意义。此结果证明ERAS理念可以减轻胃癌合并2型糖尿病患者术后应激程度,降低炎症水平,有利于患者的康复。
此外,作为应激时的主要表现之一,高血糖的发生主要有以下两方面原因:第一,应激时人体内两条重要的应激轴,即下丘脑-交感-肾上腺皮质轴与蓝斑-交感神经-肾上腺髓质轴被激活,释放皮质醇、生长激素、儿茶酚胺类激素等胰岛素拮抗激素协同胰高血糖素使血糖增高[15];第二,应激产生的炎症相关细胞因子——CRP、IL-6、TNF-α等可以干扰多种胰岛素信号传导通路(PI3K信号通路、Ras-MAPK信号通路、PTP1B信号通路等)、抑制胰岛素受体底物-1的磷酸化从而引发胰岛素抵抗(IR)[16]。
本研究结果显示,术后试验组的HOMA-IR的总体变化趋势较对照组更为平缓,尤其在术后第1天,试验组HOMA-IR水平较对照组显著降低。在术后连续7 d的血糖监测中,试验组的血糖波动情况也比对照组小,上述差异均有统计学意义。本结果证明了ERAS方案可以改善胃癌合并2型糖尿病患者术后IR,维持血糖稳定。
对于胃癌合并2型糖尿病的患者而言,手术的方式在根治胃癌的同时还能帮助控制患者体重及血糖水平,改善胰岛β细胞功能,降低IR。有研究指出其机制可能是胃切除后消化道重建时改变了肠-胰岛轴,增加肠促胰岛素的分泌,提高了胰岛素敏感性[17, 18]。但对于ERAS理念能维持血糖稳定、减轻术后胰岛素抵抗的具体机制仍有争议,主要集中在以下几点:(1)ERAS理念中的术前宣教让患者充分理解治疗方案有利于缓解焦虑、紧张的情绪,从而减少心理应激,保持血糖平稳[19];(2)手术麻醉除了传统全麻外,ERAS处理的患者还联合了胸段硬膜外麻醉,Uchida等[20]的研究证明了胸段硬膜外麻醉,尤其是胸8以上的高位节段麻醉可以使术后IR降低40%;(3)术后早期进食或肠内营养能加速新陈代谢,促进肠道蠕动,改善肠道屏障功能,进而维持血糖稳定,降低术后IR[21];(4)术后早期运动的践行在符合2型糖尿病患者提倡的运动疗法基础上,还会让下肢运动肌肉增加50%的葡萄糖摄取率,帮助缓解术后IR[22];(5)术前减少禁食禁饮时间并口服碳水化合物是目前公认改善术后IR、维持血糖稳定最主要的原因。胃癌合并2型糖尿病患者长期处于不同程度的免疫功能低下或营养不良状态,术前过长时间禁食禁饮不仅使胃排空延迟的风险增加,还会破坏机体原先相对平衡稳定的状态,使IR程度在术后进一步加重,不利于患者的康复。而术前口服碳水化合物恰恰能促进胰岛素、肠促胰岛素、胃泌素等早期分泌,增加糖原储备,协助改善术后IR[23]。此外,术前口服碳水化合物还可以通过减轻氧化应激或改善胰岛素信号传导通路来改善术后IR[24]。
综上所述,ERAS理念以患者为中心,多学科协作制定个体化治疗方案,可以减轻胃癌合并2型糖尿病患者手术的炎症应激程度,降低术后IR水平,促进患者的早期康复。但本研究所纳入的样本量较小,结果存在一定局限性,且减轻炎症应激程度与降低术后IR所涉及的具体机制以及两者之间的内在联系还亟待进一步研究证实。
所有作者均声明不存在利益冲突



























