
探讨F框/WD-40域蛋白7(FBXW7)基因突变对非小细胞肺癌(NSCLC)患者免疫治疗预后的影响。
(1)选取2019年1月至2021年6月南京医科大学第一附属医院肿瘤科接受免疫检查点抑制剂治疗的晚期NSCLC患者125例,男70例,女55例,年龄[M(Q1,Q3)]为64(57,70)岁;收集其临床治疗及预后资料,分析FBXW7突变与免疫治疗疗效及预后的关系。(2)在cBioPortal数据库检索与免疫治疗相关的NSCLC数据集,共261例患者纳入研究,作为免疫治疗队列,男120例,女141例,年龄66(57,73)岁;其临床数据及基因突变数据均从cBioPortal数据库下载,分析FBXW7突变与NSCLC患者临床特征和免疫治疗预后的关系。(3)在癌症基因组图谱(TCGA)数据库下载1 030例NSCLC患者转录组和基因突变数据进行后续分析,作为TCGA队列,男633例,女397例,年龄为67(60,73)岁;分析FBXW7突变对免疫治疗疗效的影响,以及其影响NSCLC免疫治疗疗效的关键分子及其生物学功能。
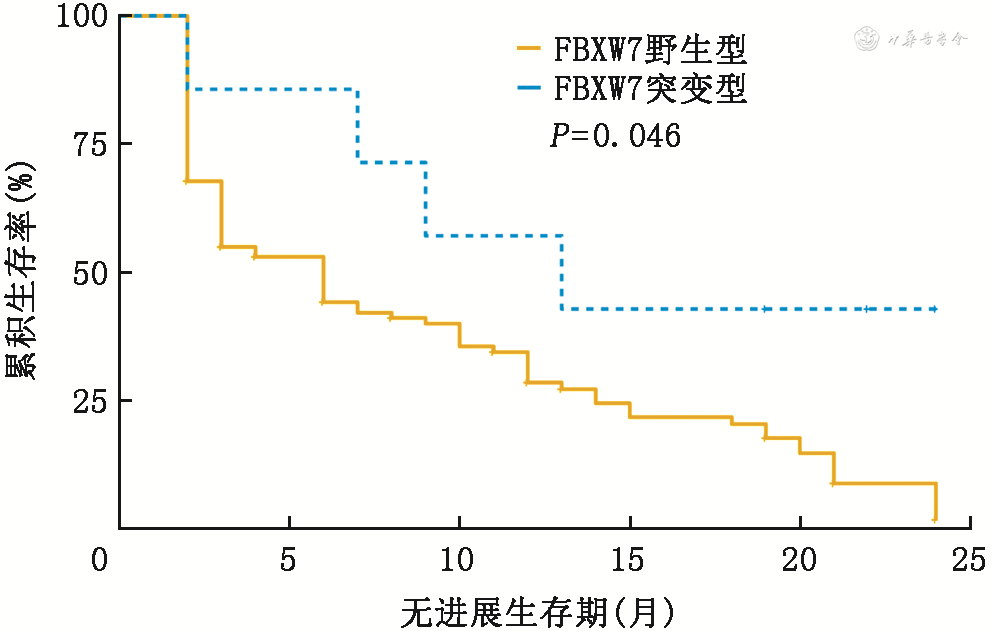
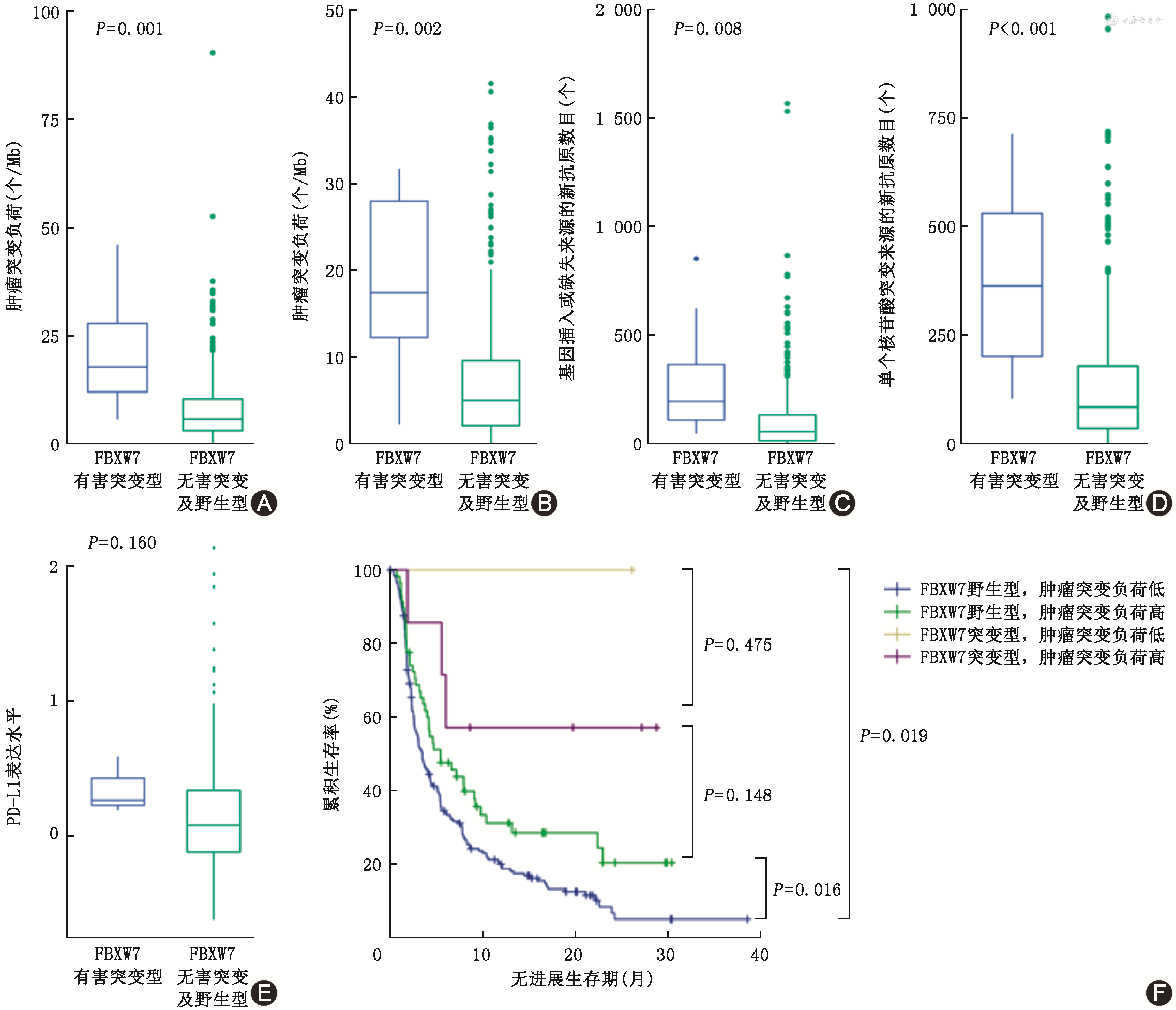
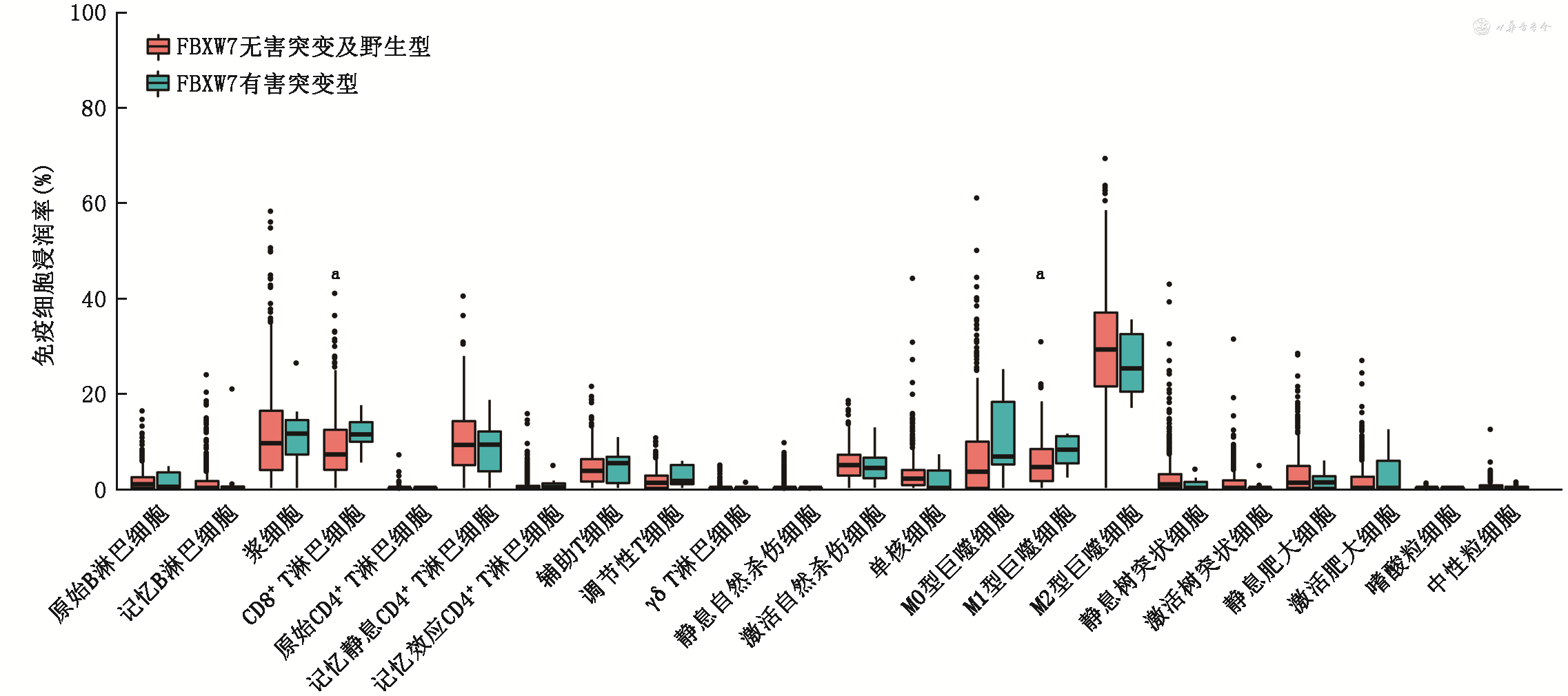
125例NSCLC患者中,FBXW7突变率为5.6%(7/125);7例患者的FBXW7突变类型均为截断突变,在接受免疫治疗后,部分缓解4例,疾病稳定2例,疾病进展 1例,客观缓解率(ORR)为4/7,疾病控制率(DCR)为6/7。FBXW7突变患者中位无进展生存期(PFS)为13.0个月(95%CI:7.0~22.0个月),优于FBXW7野生型患者的4.0个月(95%CI:2.0~11.5个月)(P=0.046)。生物信息学分析显示,FBXW7突变型患者接受免疫治疗后临床获益更高。免疫治疗队列中FBXW7突变型患者的肿瘤突变负荷[M(Q1,Q3)]为17.8(11.5,29.3)个/Mb,高于FBXW7野生型患者[5.7(3.0,10.4)个/Mb,P=0.001]。TCGA队列中,FBXW7突变型患者的肿瘤突变负荷为15.9(4.2,28.1)个/Mb,基因插入或缺失来源的肿瘤新抗原为192.5(70.8,535.0)个,单核苷酸突变来源的肿瘤新抗原为363.0(194.8,534.8)个,均高于FBXW7野生型患者的5.6(3.2,8.9)个/Mb、53.0(12.0,131.0)个、83.5(34.0,178.0)个(P=0.002、0.008、P<0.001),表明FBXW7突变型肿瘤具有更强的免疫原性,可能产生强大的抗肿瘤免疫。FBXW7突变与T淋巴细胞的激活有关,表现为T淋巴细胞受体复合物与信号传导的激活。进一步对肿瘤免疫细胞浸润程度分析发现,FBXW7突变型肿瘤的CD8+T淋巴细胞和M1型巨噬细胞浸润率分别为10%(8%,14%)、8%(4%,11%),均高于FBXW7野生型肿瘤的7%(4%,12%)、4%(1%,8%)(P=0.049、0.046)。
FBXW7突变型NSCLC患者接受免疫治疗后临床获益更高,FBXW7基因突变具有作为NSCLC患者免疫治疗疗效预测标志物的可能性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌作为我国目前发病率和死亡率最常见的肿瘤之一,已成为影响公共健康的热点问题,而非小细胞肺癌(non-small cell lung cancer,NSCLC)是其中最常见的病理类型[1]。程序性细胞死亡受体1(programmed cell death receptor 1,PD-1)、程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)及细胞毒性T淋巴细胞相关抗原(cytotoxic T lymphocyte-associated antigen4,CTLA-4)在内的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的出现,已经改变了驱动基因阴性晚期NSCLC患者治疗的模式,为患者提供了长期生存的希望[2]。ICIs与相应配体结合后,可以重新启动T淋巴细胞杀伤肿瘤细胞的作用。与传统化疗相比,大多数患者对免疫治疗的耐受性更好,且疗效更加持久[3]。然而,并非所有患者都能从免疫治疗中获益,部分接受ICIs治疗的患者甚至会发生快速进展。因此,寻找有效的免疫治疗疗效预测指标已成为临床上亟待解决的问题。
目前,已有多种基于组织的生物标志物被用于预测NSCLC免疫治疗的疗效。其中获得较高级别证据支持的是肿瘤组织PD-L1表达水平和肿瘤突变负荷(tumor mutational burden,TMB)。但是这些已有的生物标志物在预测免疫治疗的疗效方面还存在一定的争议,因此寻找更加特异的预测指标,提早筛选出免疫治疗的优势人群是实现精准治疗的关键。近年来基因测序技术日益成熟,并广泛用于抗肿瘤药物的疗效预测。免疫治疗持续获益的患者与未获益的患者间的基因突变谱特征是否存在差异,这些差异基因突变谱能否成为预测ICIs疗效的新的生物标志物,值得进一步深入研究。
F框/WD-40域蛋白7(F-box and WD-40 domain protein 7,FBXW7)是一种抑癌基因,它在肺癌等多种不同类型的肿瘤中是突变或缺失的[4],在NSCLC中的发生频率较高[5],且这种突变、缺失与NSCLC的预后不良相关[6]。有研究表明,FBXW7与NSCLC耐药也有关,它可以通过减少Snail蛋白的泛素化降解,促进上皮-间充质转化(epithelial-to-mesenchymal transition,EMT)导致NSCLC对铂类药物产生耐药[7]。此外,FBXW7也可以通过抑制雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)来调控EMT,从而影响NSCLC对分子靶向药物吉非替尼的敏感性[8]。而FBXW7能否影响ICIs疗效目前尚未见报道。本研究旨在探讨FBXW7是否可以作为NSCLC患者ICIs疗效预测指标及其潜在的机制。
1.NSCLC患者:本研究已通过南京医科大学第一附属医院伦理委员会审批(审批文件号:ANPD1-001),所有患者均签署知情同意书。纳入2019年1月至2021年6月在南京医科大学第一附属医院肿瘤科接受PD-1单抗联合化疗的晚期NSCLC患者共125例,男70例,女55例,年龄64(57~70)岁。所有患者治疗前均接受肿瘤组织高通量测序技术(next-generation sequencing technology,NGS)检测。(1)化疗方案:卡铂+培美曲塞(非鳞癌),卡铂+白蛋白紫杉醇(鳞癌);选用的PD-1单抗包括:纳武利尤单抗:第1天3 mg/kg,14 d为1个周期;帕博利珠单抗:第1天200 mg,21 d为1个周期。(2)疗效评估:采用免疫反应相关评价标准(immune-related response evaluation criteria in solid tumors,ir-RECIST)进行疗效评估,包括完全缓解、部分缓解、疾病稳定和疾病进展;客观缓解率(objective response,ORR)=(完全缓解例数+部分缓解例数)/可评估患者例数×100%,疾病控制率(disease control rate,DCR)=(完全缓解例数+部分缓解例数+疾病稳定例数)/可评估患者例数×100%。
2. 免疫治疗队列:在cBioPortal数据库(cBioPortal for Cancer Genomics)检索与免疫治疗相关的NSCLC数据集,共筛选到两个数据集,共261例患者纳入研究,称为免疫治疗队列,男120例,女141例,年龄66(57~73)岁;临床数据及基因突变数据均从cBioPortal数据库下载。(1)斯隆·凯特琳癌症研究中心(Memorial Sloan Kettering Cancer Center,MSKCC,J Clin Oncol 2018)数据集:共纳入186例NSCLC患者,其中24例患者接受PD-1/PD-L1抑制剂联合CTLA-4抑制剂治疗,162例接受PD-1/PD-L1抑制剂单药治疗;(2)斯隆·凯特琳癌症研究中心(Memorial Sloan Kettering Cancer Center,MSK,Cancer Cell 2018)数据集:共纳入75例接受PD-1/PD-L1抑制剂联合CTLA-4抑制剂治疗的NSCLC患者。
3. 癌症基因组图谱(the cancer genome atlas,TCGA)队列:为了进一步探索FBXW7突变与免疫激活的关系,在TCGA数据库下载NSCLC患者转录组和基因突变数据进行后续分析,称为TCGA队列,共1 030例患者,男633例,女397例,年龄67(60~73)岁。
1.疗效评价指标:在免疫治疗队列中,无进展生存期(progression-free survival,PFS)指肺腺癌患者从接受免疫治疗开始,到观察到疾病进展的时间。在TCGA队列中,PFS从首次诊断之日起进行评估。总生存期(overall survival,OS)指从诊断之日开始至因任何原因引起死亡的时间。无疾病进展的患者采用最后一次影像学检查日期作为PFS终点。对于仍存活的患者,OS终点为最后一次随访的日期。
2.生存分析:接受免疫治疗后,患者PFS超过6个月为持久临床获益(durable clinical benefit,DCB);反之定义为非持久临床获益(non-durable clinical benefit,NDCB)。
3.基因突变对蛋白功能影响的预测:采用PROVEAN在线工具(http://provean.jcvi.org)预测非同义突变对蛋白质的生物功能是否有影响。预测结果分值范围为-14~14分,分值≤-2.5分定义为有害,即该突变对蛋白功能有害;分值>-2.5分定义为中性,即该突变对蛋白功能无害。
4. TMB与肿瘤新抗原负荷(neoantigen load,NAL)分析:(1)TCGA队列样本:使用全外显子测序,TMB定义为非同义突变总数除以外显子长度(38 Mb)。(2)免疫治疗队列样本:均使用MSK-IMPACT平台测序,TMB定义为非同义突变总数除以MSK-IMPACT平台的外显子覆盖长度,平台共有468、410和341个基因检测数目,所覆盖的外显子长度分别为1.22、1.06、0.98 Mb。
NAL指标来自Thorsson等[9]进行的癌症免疫图谱研究。单核苷酸变异(single nucleotide variants,SNV)新抗原预测是通过OptiType工具v1.2、NetMHCpan v3.0和panccancer MC3 Consortium进行的。插入缺失(Indel)新抗原预测使用VEP v87(Ensembl变异效应预测器)、pVAC-Seq v4.0.8管道、NetMHCpan v3.0进行。
5.基因富集分析(gene set enrichment analysis,GSEA):利用R包ClusterProfiler 进行GSEA。归一化富集评分(normalized enrichment score,NES)是检测基因富集结果的主要统计指标。P值用于评估富集分数的统计学意义。P<0.05表示基因在该通路中显著富集。
6.肿瘤免疫细胞浸润评估分析:CIBERSORT是一种基于基因表达的反卷积算法,使用支持向量回归来推断细胞类型的比例。基于基因表达数据,采用CIBERSORT算法计算22种免疫浸润细胞比例(中性粒细胞、嗜酸粒细胞、激活肥大细胞、静息肥大细胞、激活树突状细胞、静息树突状细胞、M2型巨噬细胞、M1型巨噬细胞、M0型巨噬细胞、单核细胞、激活自然杀伤细胞、静息自然杀伤细胞、γδ T淋巴细胞、调节性T淋巴细胞、T淋巴细胞滤泡助手、记忆效应CD4+T淋巴细胞、记忆休息CD4+T淋巴细胞、原始CD4+T淋巴细胞、CD8+T淋巴细胞、浆细胞、记忆B淋巴细胞和原始B淋巴细胞)。
应用SPSS 24.0和R v.3.6.0进行统计分析。偏态分布计量资料采用M(Q1,Q3)表示,两组间比较采用Wilcoxon检验;计数资料以例数和百分比表示,两组间比较采用χ²检验。采用Kaplan-Meier生存曲线进行生存率分析。双侧检验,检验水准α=0.05。
125例NSCLC患者中,FBXW7突变率为5.6%(7/125),7例FBXW7突变患者中,男6例,女1例,年龄63(52~72)岁;4例有吸烟史;4例为鳞癌,3例为腺癌;2例患者接受治疗前为ⅢB期,5例为Ⅳ期。7例患者的FBXW7突变类型均为截断突变,在接受免疫治疗后,部分缓解4例,疾病稳定2例,疾病进展1例,ORR为4/7,DCR为6/7。FBXW7突变患者中位PFS为13.0个月(95%CI:7.0~22.0个月),优于FBXW7野生型患者的4.0个月(95%CI:2.0~11.5个月)(P=0.046),见图1。FBXW7突变的NSCLC患者接受免疫治疗具有较高的中位PFS、DCR及ORR。基于此,初步认为FBXW7在预测NSCLC免疫治疗疗效方面有一定的应用价值。

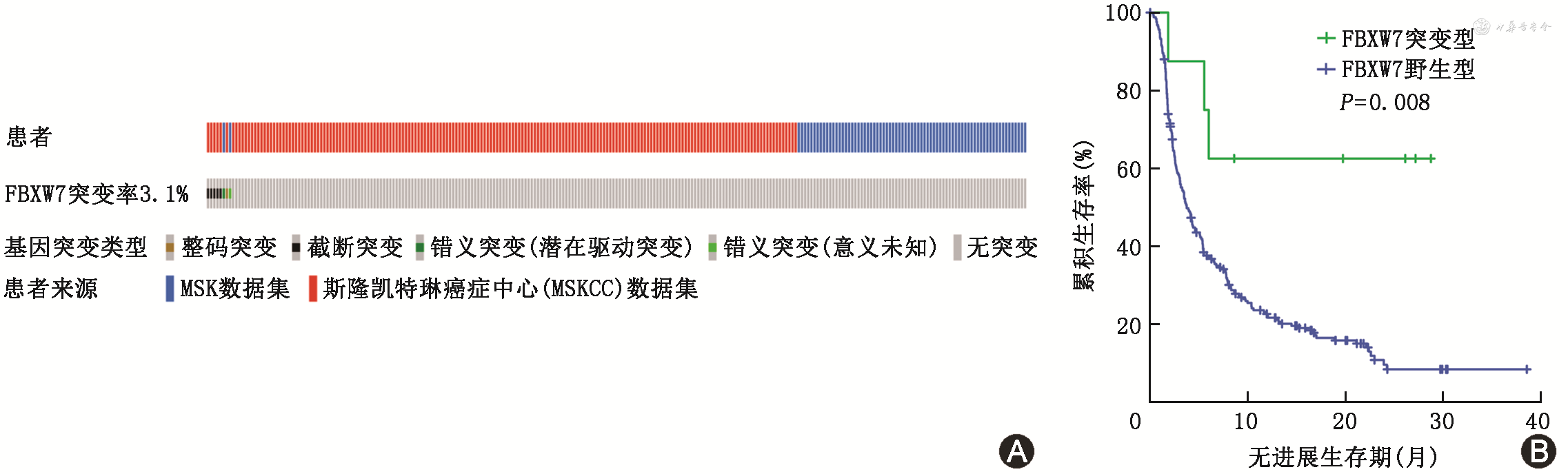
通过对公共数据库分析,免疫治疗队列的患者突变图谱如图2A所示,其中FBXW7突变率为3.1%(8/261)。基线特征分析显示,FBXW7突变型患者与野生型患者在年龄、性别、吸烟病史等方面差异均无统计学意义(表1)。FBXW7突变患者临床缓解率为6/8,高于野生型患者的34.0%(86/253),差异有统计学意义(χ²=5.71,P=0.024)。此外,FBXW7突变型患者免疫治疗后的PFS明显优于FBXW7野生型患者,见图2B。以上结果表明FBXW7可能是一个免疫疗效正向预测因子,FBXW7突变型NSCLC患者比FBXW7野生型患者更能从免疫治疗中获益。

公共数据库免疫治疗队列中FBXW7突变型与野生型非小细胞肺癌患者基线特征比较[例(%)]
公共数据库免疫治疗队列中FBXW7突变型与野生型非小细胞肺癌患者基线特征比较[例(%)]
| 项目 | FBXW7 突变型 (n=8) | FBXW7 野生型 (n=253) | χ²值 | P值 |
|---|---|---|---|---|
| 年龄 | 0.62 | 0.471 | ||
<60岁 | 4(4.2) | 92(95.8) | ||
≥60岁 | 4(2.4) | 161(97.6) | ||
| 性别 | 2.80 | 0.149 | ||
男 | 6(8.6) | 114(91.4) | ||
女 | 2(6.5) | 139(93.5) | ||
| 吸烟史 | 2.25 | 0.208 | ||
是 | 8(3.9) | 197(96.1) | ||
否 | 0(0) | 56(100) | ||
| 治疗线数 | 0.53 | 0.083 | ||
1线 | 2(5.1) | 37(94.9) | ||
2线 | 1(1.1) | 91(98.9) | ||
≥3线 | 2(3.7) | 52(96.3) | ||
未知 | 3(3.9) | 73(96.1) | ||
| 药物 | 0.01 | 1.000 | ||
PD-1/PD-L1/CTLA-4 | 5(3.2) | 154(96.8) | ||
PD-1/PD-L1+CTLA-4 | 3(3.0) | 99(97.0) | ||
| 疗效评估 | 5.71 | 0.024 | ||
DCB | 6(6.5) | 86(93.5) | ||
NDCB | 2(1.2) | 167(98.8) |
注:PD-1为程序性细胞死亡受体1;PD-L1为程序性细胞死亡配体1;CTLA-4为细胞毒性T淋巴细胞相关抗原;DCB为持久临床获益;NDCB为非持久临床获益
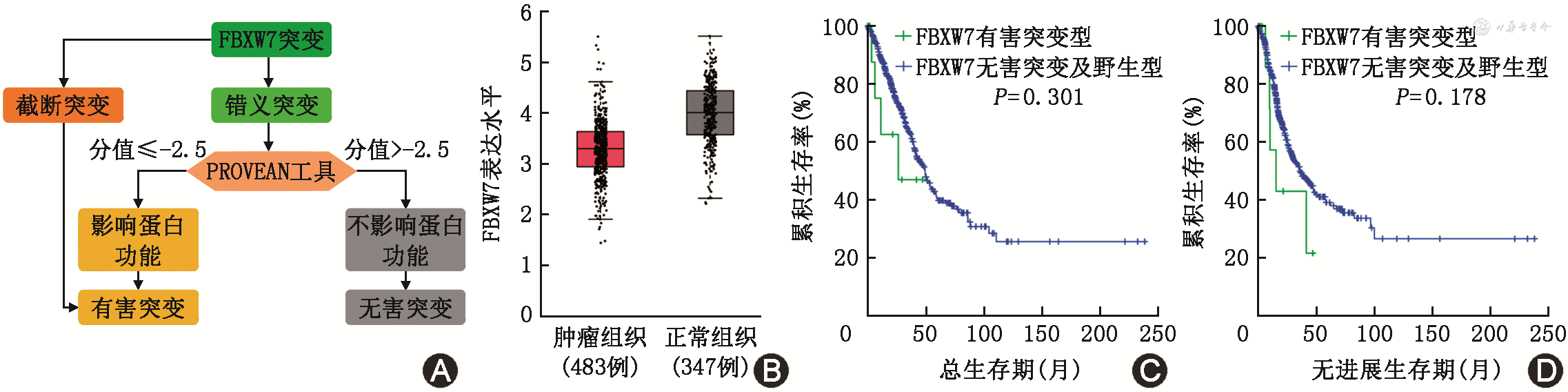
本研究发现,在真实世界队列和公共数据队列中,FBXW7突变主要为截断和错义突变。不同于截断突变通过基因表达缺失影响肿瘤细胞功能,错义突变是有害亦或是有益的,取决于它对蛋白质结构的影响。通过PROVEAN工具发现,免疫治疗队列中的FBXW7突变均为影响生物学功能的突变,工作流程见图3A。因此,接下来重点研究FBXW7有害突变与免疫治疗疗效的关系。对TCGA队列中所有FBXW7突变进行功能预测,最终将截断突变与影响蛋白功能的错义突变共同定义为del-FBXW7mut。采用GEPIA在线工具分析发现,FBXW7在肿瘤中的表达低于正常组织,提示FBXW7低表达可能促进肿瘤的发生,见图3B。TCGA队列的生存分析显示,del-FBXW7mut患者的总生存率、无进展生存率与FBXW7无害突变以及FBXW7野生型患者相比,差异均无统计学意义,见图3C、3D。说明del-FBXW7mut并不是肺癌的预后指标,更强调了其对于免疫治疗疗效的预测价值。

为了探索FBXW7基因突变影响NSCLC免疫治疗疗效的潜在机制,本研究分析了del-FBXW7mut与TMB和NAL的关系。有研究表明,TMB是免疫治疗反应的生物标志物。高水平的TMB和NAL与更好的免疫治疗反应相关[10, 11]。在免疫治疗队列中,del-FBXW7mut肿瘤比FBXW7无害突变及野生型肿瘤具有更高水平的TMB,见图4A;在TCGA队列中也发现同样的结果,见图4B。根据之前的一项研究,本研究获取了TCGA队列中的NAL数据。与FBXW7无害突变及野生型肿瘤相比,del-FBXW7mut肿瘤具有更多的新抗原负荷(包括SNV 新抗原和Indel新抗原),见图4C、4D。这表明del-FBXW7mut肿瘤具有更强的免疫原性,继而可能产生强大的抗肿瘤免疫。TMB及PD-L1是目前普遍认可的免疫治疗反应的生物标志物。本研究发现,del-FBXW7mut肿瘤比FBXW7无害突变及野生型肿瘤具有更高水平的TMB。从TCPA下载蛋白表达数据,不同FBXW7突变状态患者的PD-L1表达水平差异无统计学意义,见图4E。另外,在高TMB患者中,del-FBXW7mut提示更好的PFS,在低TMB患者中也有同样的现象。同时,存在del-FBXW7mut且TMB较低的患者具有更好的生存率,见图4F。以上结果表明,通过FBXW7突变状态及TMB指标的有效结合进行患者分型,可以更加准确、全面地预测患者的ICIs治疗疗效。

上文提到del-FBXW7mut肿瘤具有高免疫原性,因此推测del-FBXW7mut肿瘤更容易被抗原提呈细胞识别继而递呈给T淋巴细胞,从而激活T淋巴细胞杀伤肿瘤细胞。为了研究del-FBXW7mut是否会激活抗肿瘤免疫通路,本研究进行了GSEA。结果显示,del-FBXW7mut与T淋巴细胞的激活有关,具体表现为T淋巴细胞受体复合物与信号传导的激活。此外,通过Cibersort评估免疫细胞浸润程度,发现del-FBXW7mut肿瘤具有更高的CD8+T淋巴细胞和M1型巨噬细胞浸润率,因此会产生更强的抗肿瘤免疫,见图5。

注:aP<0.05
免疫治疗主要通过激活人体自身抗肿瘤的免疫功能来杀伤肿瘤细胞,具有疗效更持久、不良反应较小等特点。与此同时,如何筛选免疫治疗的优势人群也成为了一个棘手的临床问题。PD-L1表达或TMB水平仍不足以准确预测个体疗效,到目前为止仍未有一个生物标志物能实现准确、有效地评估NSCLC患者ICIs的治疗疗效[12, 13, 14]。
在如今二代测序广泛应用的背景下,探索新型免疫治疗疗效预测标记物的研究已成为热点。FBXW7作为F-box蛋白家族的一员,其在多种肿瘤中表现为突变和等位基因的缺失[15]。FBXW7的缺失会抑制细胞分裂和干细胞分化,增强染色体不稳定性,并能导致造血细胞癌变[16, 17, 18, 19]。在NSCLC中,FBXW7的缺失与靶向治疗耐药有关[20]。然而目前尚无FBXW7与免疫治疗的相关研究,因此值得进一步探索。
本研究发现FBXW7突变晚期NSCLC患者接受免疫治疗时,具有较高的PFS、DCR及ORR。此外,从公共数据库收集的免疫治疗NSCLC患者,通过生物信息学分析发现del-FBXW7mut与免疫治疗临床获益相关。进一步对TMB、NAL、免疫细胞浸润分析发现del-FBXW7mut 会增加TMB、NAL的水平,激活T淋巴细胞抗肿瘤效应。并且,具有del-FBXW7mut 的肿瘤微环境内有更多的CD8+T淋巴细胞和M1型巨噬细胞的浸润。因此,本研究认为del-FBXW7mut 可以作为一个新的免疫治疗疗效预测标志物。此外,在高TMB患者中,del-FBXW7mut提示更好的PFS,FBXW7可与现有的预测指标相互补充,以利于更加准确、全面地预测NSCLC患者ICIs治疗疗效。
虽然本研究整合了多个数据库及真实世界的数据进行分析,但样本量的不足是主要缺点。此外,既往研究表示FBXW7的缺失与不良预后相关,但本研究发现del-FBXW7mut与预后无统计学关联。原因可能在于del-FBXW7mut触发了突变相关NAL的增多和免疫浸润的增强,具有肿瘤抑制作用,一定程度上逆转了FBXW7功能缺失所导致的肿瘤促进作用。未来仍需要更多的FBXW7突变的临床样本及免疫治疗预后信息来验证其预测价值。此外,虽然本研究发现FBXW7突变与免疫激活有关,但其具体机制仍不清楚,需要进一步探索。
所有作者均声明不存在利益冲突



























