
探讨急性呼吸窘迫综合征(ARDS)患者肺泡灌洗液(BALF)和血浆中外泌体含量与肺损伤严重程度及其预后的相关性。
选取从2020年8月至2021年4月在东南大学附属中大医院重症医学科就诊并接受有创机械通气的患者,根据其是否是ARDS分为ARDS组和非ARDS组。最终纳入ARDS患者33例,男18例,女15例,年龄(65.5±15.5)岁;非ARDS患者10例,男8例,女2例,年龄(57.2±15.3)岁。分别采集两组患者纳入后24 h内的BALF和血浆并利用超速离心获取标本的总外泌体,利用纳米颗粒跟踪分析(NTA)检测并比较两组的外泌体含量差异,分析外泌体含量与ARDS患者肺损伤严重程度和预后的相关性。
ARDS组与非ARDS组间性别、年龄差异均无统计学意义(均P>0.05)。ARDS组血浆中外泌体含量明显高于非ARDS组[(25.3±1.2)个/ml比(24.2±1.6)个/ml,P=0.031],而ARDS组BALF中外泌体含量同样高于非ARDS组[(26.5±1.6)个/ml比(24.6±1.1)个/ml,P=0.001]。肺内原因导致的ARDS患者BALF中外泌体含量高于肺外原因导致的ARDS组[(26.9±1.5)个/ml比(25.2±0.9)个/ml,P=0.01],而细菌性感染是其BALF中外泌体含量最高的亚组。轻度ARDS组比重度ARDS组BALF中的外泌体含量明显更低[(25.7±1.3)个/ml比(27.2±1.5)个/ml,P=0.038];ARDS患者BALF中外泌体的含量与P/F呈负相关性(r=-0.38,P=0.03);与Murray肺损伤评分水平呈正相关性(r=0.47,P=0.01);与驱动压水平、静态顺应性水平、住院时间、机械通气时间和28 d预后均无相关性(均P>0.05)。
与非ARDS患者相比,ARDS患者BALF和血浆中外泌体含量明显增高;BALF来源的外泌体与ARDS肺损伤严重程度存在一定相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是重症监护病房(intensive care unit,ICU)常见的急性呼吸衰竭。近年来流行病学调查显示ARDS患者病死率仍高达40%[1],2020年初新型冠状病毒感染导致ARDS患者病死率高达61%[2]。外泌体是由细胞自然释放的粒径为30~150 nm的微小细胞器结构,在细胞生理状态下、损伤/激活和凋亡期间都可以释放外泌体。不同细胞来源的外泌体是传递细胞间物质信息交流的重要桥梁[3],目前关于外泌体与急性肺损伤机制多在动物模型验证[4],缺乏临床相关证据。由于ARDS发生发展中多种细胞发挥作用,临床标本中单独细胞来源的外泌体的难以分选,本研究目的是比较早期ARDS患者与非ARDS患者肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和血浆中总外泌体水平的差异,分析其水平与ARDS的病因以及肺损伤严重程度间的关系,为进一步研究外泌体作为ARDS潜在的生物标志物或治疗调节靶点的价值提供进一步的依据。
纳入2020年8月至2021年4月东南大学附属中大医院重症医学科收治的接受有创机械通气的患者。纳入标准:(1)年龄18~85岁;(2)已建立人工气道(气管插管、气管切开);(3)需要进行纤维支气管镜检查或者治疗;(4)签署知情同意。排除标准:(1)妊娠患者;(2)肿瘤患者(包括实体肿瘤以及血液肿瘤等);(3)急慢性肝炎、肝硬化、慢性阻塞性肺疾病(COPD)、慢性肾功能不全等慢性基础疾病患者;(4)有免疫功能缺陷疾病;入院前6个月大量使用糖皮质激素(等效剂量>泼尼松10 mg/d)或免疫抑制剂的患者;(5)外院长期住院的患者(≥7 d);(6)有吸烟史者;(7)预计生存时间<24 h;(8)30 d内参与了其他研究的患者。ARDS定义为2012年柏林标准[5]。为减少临床干预和其他混杂因素影响(如呼吸机相关肺损伤等),ARDS患者发病到入组时间控制在24 h内。同时为减少原发肺部疾病对于本研究的影响,研究非ARDS组纳入对象多为神经外科、耳鼻喉科等术后患者。本研究经东南大学附属中大医院医学伦理委员会审核及批准(伦理批件号:2020ZDSYLL058-P01),所有被试均知情同意,知情同意书由患者授权委托人签订。
1. 一般信息收集:收集ARDS患者和肺ARDS患者基础信息,如性别、年龄、身高、体重、初步诊断、生命体征、ARDS诱因、急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation,APACHEⅡ)、序贯器官功能障碍评分(sequential organ failure assessment,SOFA)、基础疾病情况、入组时的感染指标和生化指标等实验室检查。收集两组患者的机械通气时间、ICU住院时间、总住院时间、28 d病死率及住院总费用等作为预后指标,评估BALF和(或)血浆中的外泌体含量与预后的相关性。根据临床信息对ARDS组依照其直接诱因分为肺外原因组和肺内原因组。肺内原因依照其病原微生物分为细菌性感染、病毒性感染和未知病原体感染亚组。根据收集患者28 d病死率的结果将患者分为存活组与死亡组,回顾分析患者临床评分、肺损伤程度和BALF以及血浆中外泌体含量是否作为暴露因素与28 d预后相关。根据文献,可以得到相对于正常/对照组,损伤/实验组的外泌体分泌更多,其OR值报道5~10不等[5],因此按照1∶2~1∶4匹配后计算出的总样本量需求为30~50例。
2. 肺损伤严重程度的评估:记录ARDS患者入组当天动脉血气分析中氧合指数,根据吸气屏气法测量ARDS患者入组当天驱动压及静态顺应性。记录入组当天Murray肺损伤评分,为减少研究者偏倚,由另外两位研究者进行肺损伤评分,二者的平均值作为最后的结果。依照ARDS诊断标准将其分为轻度、中度和重度亚组,评估BALF和(或)血浆中的外泌体含量与肺损伤严重程度的相关性。
3. 临床样本收集与鉴定:在入组后的24 h内收集两组患者的BALF和血浆。BALF和血浆收集方法按照临床标准流程,记录收集患者至少10 ml BALF和6 ml外周血。利用超速离心机(美国贝克曼公司制造)(120 000 g×2 h)分离BALF和血浆中的总外泌体。根据国际细胞外囊泡学会(International Society for Extracellular Vesicles,ISEV)提出,外泌体鉴定分为3个层面:电镜鉴定形态学特征、纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)鉴定粒径和浓度、利用Western蛋白印迹法检测外泌体标志性蛋白CD9、CD81、CD63和TSG101等。NTA是利用光散射和布朗运动的特性获得液体悬浮液中的样本粒度分布,利用其对悬浮物中纳米材料的粒径分布进行测量目前是国际共识。外泌体含量与样本的体积相关,用体积校正后即外泌体含量=NTA测量的总外泌体浓度/样本体积(单位:个/ml)。由于外泌体含量数据绝对值较大,为方便计算和比较取其自然对数值。
采用SPSS 25.0软件进行统计分析,采用GraphPad Prism 7统计软件进行统计制图分析。符合正态分布的数据,采用表示,组间比较采用独立样本t检验;非正态分布的数据采用M(Q1,Q3)表示,组间比较采用Mann-Whitney U非参数检验。计量资料采用例(%)表示,组间比较采用χ²检验。采用简单线性回归分析外泌体含量与肺损伤严重程度和预后之间的相关性。双侧检验,取α=0.05。
纳入符合入组标准的患者128例,其中ARDS的患者80例。ARDS患者中41例被排除,研究过程中有6例退出研究,最终共纳入研究ARDS患者33例,其中男18例,女15例,年龄(65.5±15.5)岁。非ARDS患者一共48例,其中38例被排除,最终纳入10例,其中男8例,女2例,年龄(57.2±15.3)岁,两组患者的年龄、性别、身高以及体重等基础资料差异无统计学意义,具有可比性(均P>0.05)。入组流程图见图1。
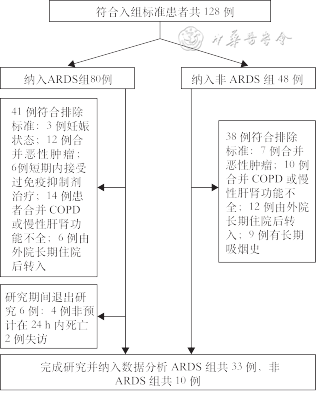

注:ARDS为急性呼吸窘迫综合征;COPD为慢性阻塞性肺疾病
入组时,ARDS组APACHEⅡ评分明显高于非ARDS组[(22.8±7.4)分比(16.4±5.6)分,t=2.67,P=0.016];ARDS组SOFA评分也明显高于非ARDS组[(9.2±5.1)分比(3.3±1.9)分,t=3.54,P=0.001];ARDS组血降钙素原水平、Murray肺损伤评分、机械通气时间、ICU住院费用等均明显高于非ARDS组(均P<0.05)。两组患者的28 d病死率差异无统计学意义(χ²=2.07,P=0.15),其他资料比较具体见表1。
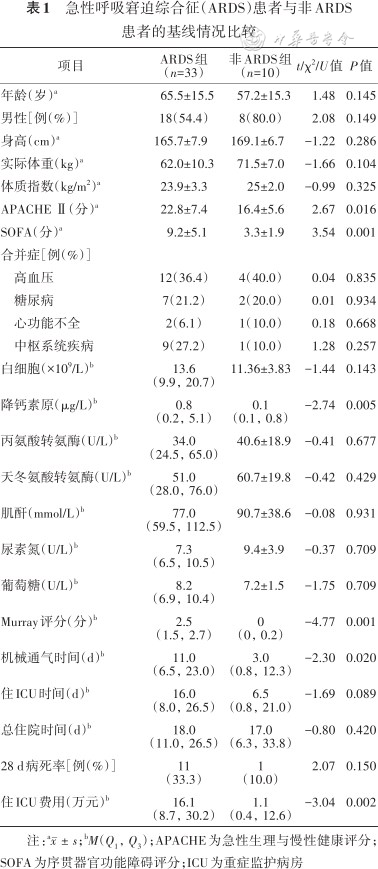
急性呼吸窘迫综合征(ARDS)患者与非ARDS患者的基线情况比较
急性呼吸窘迫综合征(ARDS)患者与非ARDS患者的基线情况比较
| 项目 | ARDS组 (n=33) | 非ARDS组 (n=10) | t/χ2/U值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 65.5±15.5 | 57.2±15.3 | 1.48 | 0.145 |
| 男性[例(%)] | 18(54.4) | 8(80.0) | 2.08 | 0.149 |
| 身高(cm)a | 165.7±7.9 | 169.1±6.7 | -1.22 | 0.286 |
| 实际体重(kg)a | 62.0±10.3 | 71.5±7.0 | -1.66 | 0.104 |
| 体质指数(kg/m2)a | 23.9±3.3 | 25±2.0 | -0.99 | 0.325 |
| APACHE Ⅱ(分)a | 22.8±7.4 | 16.4±5.6 | 2.67 | 0.016 |
| SOFA(分)a | 9.2±5.1 | 3.3±1.9 | 3.54 | 0.001 |
| 合并症[例(%)] | ||||
高血压 | 12(36.4) | 4(40.0) | 0.04 | 0.835 |
糖尿病 | 7(21.2) | 2(20.0) | 0.01 | 0.934 |
心功能不全 | 2(6.1) | 1(10.0) | 0.18 | 0.668 |
中枢系统疾病 | 9(27.2) | 1(10.0) | 1.28 | 0.257 |
| 白细胞(×109/L)b | 13.6 (9.9,20.7) | 11.36±3.83 | -1.44 | 0.143 |
| 降钙素原(μg/L)b | 0.8 (0.2,5.1) | 0.1 (0.1,0.8) | -2.74 | 0.005 |
| 丙氨酸转氨酶(U/L)b | 34.0 (24.5,65.0) | 40.6±18.9 | -0.41 | 0.677 |
| 天冬氨酸转氨酶(U/L)b | 51.0 (28.0,76.0) | 60.7±19.8 | -0.42 | 0.429 |
| 肌酐(mmol/L)b | 77.0 (59.5,112.5) | 90.7±38.6 | -0.08 | 0.931 |
| 尿素氮(U/L)b | 7.3 (6.5,10.5) | 9.4±3.9 | -0.37 | 0.709 |
| 葡萄糖(U/L)b | 8.2 (6.9,10.4) | 7.2±1.5 | -1.75 | 0.709 |
| Murray评分(分)b | 2.5 (1.5,2.7) | 0 (0,0.2) | -4.77 | 0.001 |
| 机械通气时间(d)b | 11.0 (6.5,23.0) | 3.0 (0.8,12.3) | -2.30 | 0.020 |
| 住ICU时间(d)b | 16.0 (8.0,26.5) | 6.5 (0.8,21.0) | -1.69 | 0.089 |
| 总住院时间(d)b | 18.0 (11.0,26.5) | 17.0 (6.3,33.8) | -0.80 | 0.420 |
| 28 d病死率[例(%)] | 11 (33.3) | 1 (10.0) | 2.07 | 0.150 |
| 住ICU费用(万元)b | 16.1 (8.7,30.2) | 1.1 (0.4,12.6) | -3.04 | 0.002 |
注:a;bM(Q1,Q3);APACHE为急性生理与慢性健康评分;SOFA为序贯器官功能障碍评分;ICU为重症监护病房
ARDS组BALF和血浆中的外泌体含量均明显高于非ARDS组[(26.5±1.3)个/ml比(24.6±1.1)个/ml、(25.3±1.2)个/ml比(24.3±1.6)个/ml,t=3.55、2.23,均P<0.05]。对ARDS组根据病因进行分类发现肺内原因组BALF中外泌体含量明显高于肺外原因组(P=0.01),而两组血浆中的外泌体含量差异无统计学意义(P>0.05)。对肺内原因导致ARDS组的患者亚组分析发现,细菌性感染导致ARDS患者BALF中外泌体水平高于病毒性感染导致的ARDS(P=0.03),而各亚组的血浆中外泌体含量差异无统计学意义(均P>0.05,表2)。
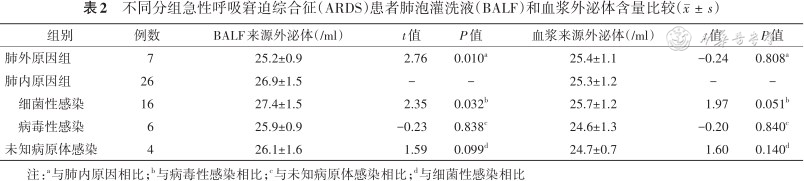
不同分组急性呼吸窘迫综合征(ARDS)患者肺泡灌洗液(BALF)和血浆外泌体含量比较()
不同分组急性呼吸窘迫综合征(ARDS)患者肺泡灌洗液(BALF)和血浆外泌体含量比较()
| 组别 | 例数 | BALF来源外泌体(/ml) | t值 | P值 | 血浆来源外泌体(/ml) | t值 | P值 |
|---|---|---|---|---|---|---|---|
| 肺外原因组 | 7 | 25.2±0.9 | 2.76 | 0.010a | 25.4±1.1 | -0.24 | 0.808a |
| 肺内原因组 | 26 | 26.9±1.5 | - | - | 25.3±1.2 | - | - |
细菌性感染 | 16 | 27.4±1.5 | 2.35 | 0.032b | 25.7±1.2 | 1.97 | 0.051b |
病毒性感染 | 6 | 25.9±0.9 | -0.23 | 0.838c | 24.6±1.3 | -0.20 | 0.840c |
| 未知病原体感染 | 4 | 26.1±1.6 | 1.59 | 0.099d | 24.7±0.7 | 1.60 | 0.140d |
注:a与肺内原因相比;b与病毒性感染相比;c与未知病原体感染相比;d与细菌性感染相比
根据柏林标准中氧合指数将ARDS患者分为轻度、中度和重度三组,轻度ARDS组BALF中外泌体水平与中度ARDS组差异无统计学意义[(25.7±1.3)个/ml比(26.6±1.6)个/ml,t=1.518,P=0.14],中度ARDS组与重度ARDS组BALF中外泌体对比差异无统计学意义[(26.6±1.6)个/ml比(27.2±1.5)个/ml,t=0.95,P=0.35],而轻度ARDS组BALF中总外泌体明显少于重度ARDS组[(25.7±1.3)个/ml比(27.2±1.5)个/ml,t=3.01,P=0.038]。轻、中和重度ARDS组间血浆中外泌体含量差异均无统计学意义[(25.5±0.9)个/ml、(25.2±1.4)个/ml和(25.2±1.1)个/ml,均P>0.05)]。
ARDS患者BALF中总外泌体的含量与氧合指数呈负相关(r=-0.38,P=0.03);而BALF来源的总外泌体的含量与Murray肺损伤评分水平呈正相关性(r=0.47,P=0.01);与驱动压水平(r=0.08)、静态顺应性水平(r=-0.23)、住院时间(r=0.07)和机械通气时间(r=0.01)无相关性(均P>0.05,图2)。ARDS患者血浆中外泌体含量与上述氧合指数、Murray肺损伤评分、驱动压水平、静态顺应性水平、住院时间以及机械通气时间无显著相关。根据28 d患者预后分为存活组和死亡组,比较影响预后的危险因素,BALF和血浆来源的外泌体含量均不是显著影响因素(表3)。
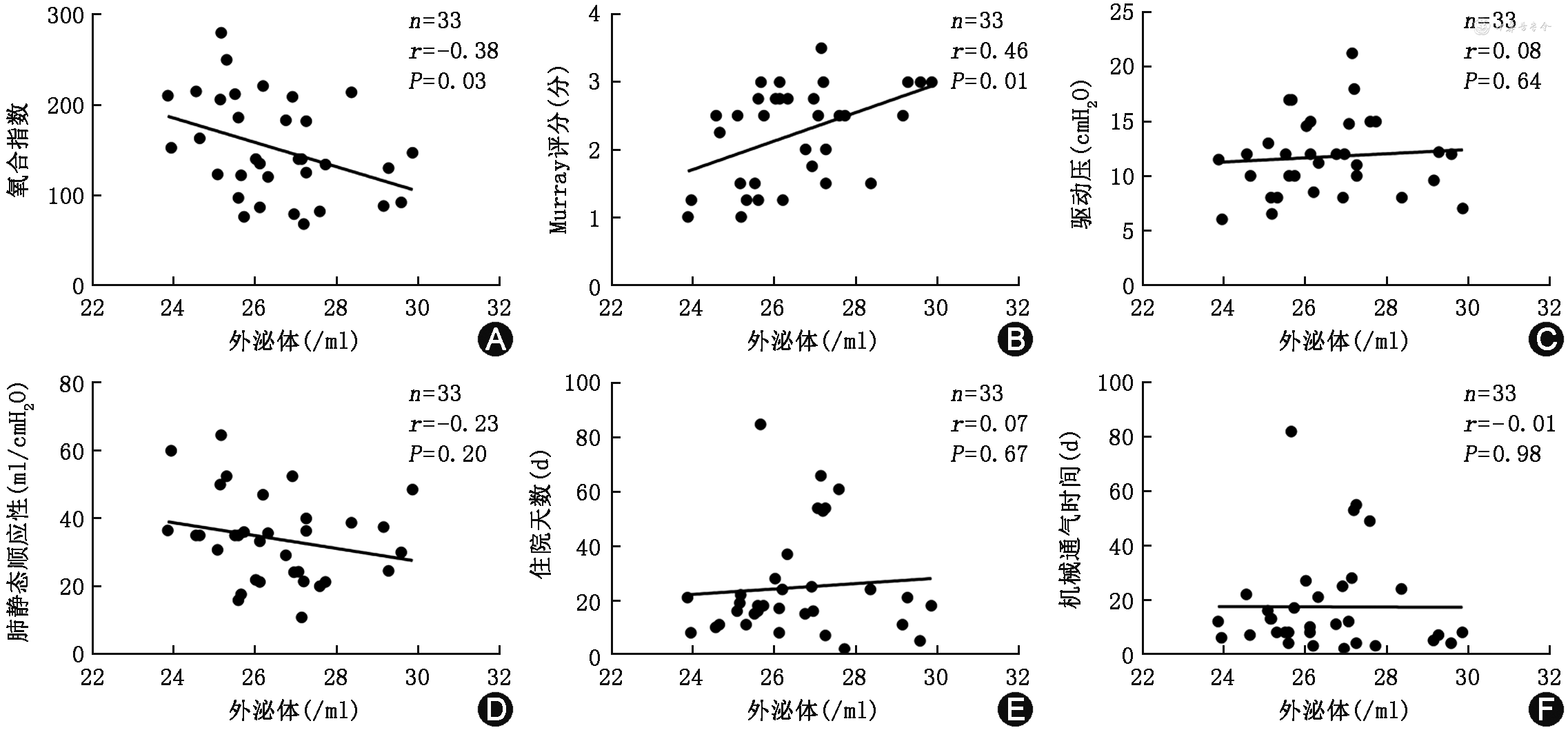

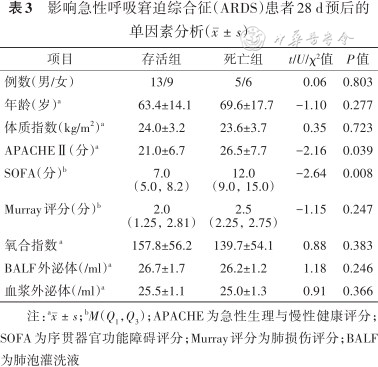
影响急性呼吸窘迫综合征(ARDS)患者28 d预后的单因素分析()
影响急性呼吸窘迫综合征(ARDS)患者28 d预后的单因素分析()
| 项目 | 存活组 | 死亡组 | t/U/χ²值 | P值 |
|---|---|---|---|---|
| 例数(男/女) | 13/9 | 5/6 | 0.06 | 0.803 |
| 年龄(岁)a | 63.4±14.1 | 69.6±17.7 | -1.10 | 0.277 |
| 体质指数(kg/m2)a | 24.0±3.2 | 23.6±3.7 | 0.35 | 0.723 |
| APACHEⅡ(分)a | 21.0±6.7 | 26.5±7.7 | -2.16 | 0.039 |
| SOFA(分)b | 7.0 (5.0,8.2) | 12.0 (9.0,15.0) | -2.64 | 0.008 |
| Murray评分(分)b | 2.0 (1.25,2.81) | 2.5 (2.25,2.75) | -1.15 | 0.247 |
| 氧合指数a | 157.8±56.2 | 139.7±54.1 | 0.88 | 0.383 |
| BALF外泌体(/ml)a | 26.7±1.7 | 26.2±1.2 | 1.18 | 0.246 |
| 血浆外泌体(/ml)a | 25.5±1.1 | 25.0±1.3 | 0.91 | 0.366 |
注:a;bM(Q1,Q3);APACHE为急性生理与慢性健康评分;SOFA为序贯器官功能障碍评分;Murray评分为肺损伤评分;BALF为肺泡灌洗液
ARDS是由肺内或肺外多种诱发因素的作用下发生的、以进行性低氧血症以及呼吸衰竭为特征的临床综合征。近年来流行病学调查显示ARDS患者病死率仍高达40%[6]。本研究同样发现ARDS患者的28 d病死率为33.3%,这与ARDS的流行病学结果基本相符。ARDS的主要病理生理改变是由肺内、肺外多种原因导致肺泡上皮细胞和肺微血管内皮细胞广泛损伤,最终导致肺泡屏障破坏及肺间质水肿[7, 8]。目前ARDS的治疗依然主要集中在呼吸支持层面,仍无有效的药物可用于ARDS患者[9]。
近年的研究发现外泌体在ARDS中有广泛的潜在临床应用前景,阻断致病性外泌体例如内皮细胞和巨噬细胞源性外泌体可能是ARDS治疗的新方法[10, 11, 12];而间充质干细胞外泌体,可靶向修饰作为包装特定药物或者保护RNA的载体[13, 14, 15]。既往研究证实ARDS患者BALF中的巨噬细胞源性外泌体含量与ARDS患者的氧合指数相关[16]。本研究发现无论是BALF还是血浆中外泌体含量ARDS组患者明显高于非ARDS组,该结果与Kim等[5]在近期从ARDS患者BALF分离外泌体的研究结果相一致。
本研究中患者BALF来源的外泌体含量的变化随着ARDS严重程度的加重呈现逐渐升高的趋势,如氧合指数和Murray肺损伤评分与BALF来源的外泌体含量相关。值得注意的是本研究的相关系数普遍较低,数据较为分散的原因可能与样本量和临床患者的异质性有关,但仍能发现其与肺损伤严重程度整体相关。同期血浆来源的外泌体含量没有表现出显著相关性,这可能与ARDS时患者肺微血管内皮细胞、上皮细胞等释放的外泌体仍较局限于肺组织而并非完全进入血液循环,这可能解释了ARDS患者突出的肺微血管内皮损伤而非其他器官血管内皮损伤的现象。肺内原因导致的ARDS患者BALF中外泌体含量明显高于肺外原因,这与基础实验研究得到的结果也基本符合[11]。细菌性感染导致的ARDS患者BALF中外泌体含量高于其他病原微生物感染,需要讨论的是该呼吸系统细菌感染的情况下外泌体含量是否存在细菌来源,该比例增加使得外泌体含量的升高。血浆中的外泌体含量与肺损伤严重程度的各项指标并无显著相关性,这可能与循环中不同细胞所释放的外泌体功能不同有关。
本研究发现ARDS患者BALF和血浆中外泌体含量与预后无明显相关。首先是患者整体预后的临床复杂性难以用单一的外泌体含量所解释,其次可能是因为BALF和血浆中的外泌体由多种细胞来源构成,其中包括损伤性和保护性的外泌体来源。已经有内源性外泌体的致病机制被不断证实,如近期发表的炎症性外泌体可能导致免疫微环境的紊乱等[17],而部分基础研究显示中性粒细胞外泌体也可能介导清除炎症介质等保护性作用[18]。对于本研究所获得的外泌体进一步溯源,并通过基础实验分析其致病机制,是明确外泌体在ARDS发病机制中作用的重要方向。
本研究存在一定的局限性:(1)作为单中心的前瞻性观察性研究,纳入的实验组以及对照组的样本数仍然较少,仍需多中心、更大规模的研究进一步论证BALF中外泌体与ARDS患者预后的相关性;(2)由于病因的样本例数有限,部分原因导致的ARDS所测的外泌体数值可能无显著的代表性,这可能造成一定的偏倚;(3)已有研究表明了不同实验方案提取外泌体的差异性对比,包括试剂盒以及色谱柱等单独或者联合使用,本研究初期使用了色谱柱与超速离心方法做对比,研究发现两者的外泌体粒径、含量以及表达未见明显差异,而权衡其实验成本、时间和设施,笔者选择了超速离心方法批量处理样本,存在客观的方法学局限;(4)该研究未设立完全的空白对照,实验对照组纳入最常见的如骨科及神经外科术后的患者。因为经纤维支气管镜收集BALF属于临床有创操作,根据医学伦理的要求纳入了病例对照而非健康志愿者进行研究,可能与健康受试者的结果不会完全相同。
综上,本研究发现ARDS患者早期BALF和血浆中的外泌体含量相比于非ARDS组明显升高。ARDS患者BALF来源的外泌体含量与肺损伤严重程度相关,BALF和血浆中外泌体含量与ARDS患者预后无关。利用BALF中外泌体含量可评估ARDS患者肺损伤严重程度,具有一定的临床指导意义。不同来源外泌体通过何种机制介导ARDS肺损伤,仍需进一步的基础实验进行探讨。
所有作者均声明不存在利益冲突



























