
选择2013年1月至2021年1月就诊于徐州医科大学附属医院,临床诊断为桥小脑角区胆脂瘤患者49例。所有患者均在术前进行MRI扫描评估,经乙状窦后入路显微镜下行肿瘤切除术,然后在0°和30°硬性神经内镜辅助下寻找残余肿瘤,继续切除肿瘤。38例常规显微手术后,在神经内镜下发现残留肿瘤并在神经内镜下切除。全切除44例,次全切除5例。术后并发症包括无菌性脑膜炎(8例)、脑脊液漏(1例)和颅内血肿(2例)。所有患者均获得随访,随访时间6~72(42±3)个月,无手术死亡病例。术后随访45例(91.8%)患者卡氏功能状态(KPS)评分≥80分。神经内镜辅助显微手术切除桥小脑角胆脂瘤,可提高全切除率,降低手术风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
桥小脑角胆脂瘤并不常见,仅占该部位肿瘤的 3.7%[1],在徐州医科大学附属医院颅内肿瘤的病例中约占1.2%。由于生长缓慢,桥小脑角胆脂瘤在临床上可长期存在而不被发现。随着胆固醇和角蛋白在肿瘤内积累,肿瘤体积不断增大,当病变累及脑沟和脑池内的神经和血管,压迫脑组织时才能作出诊断[2]。桥小脑角胆脂瘤虽然在组织学上是良性肿瘤,但其手术治疗具有一定的挑战性。手术的复杂性在于肿瘤生长广泛、常规显微手术存在盲区和部分区域手术器械无法触及。由于这些难点的存在,显微切除桥小脑角胆脂瘤常残余肿瘤组织,从而导致肿瘤复发和延迟性颅内出血。神经内镜提供了优越的照明和更好的放大倍数,使软性的胆脂瘤很容易被吸出并且很少出血,但由于使用大角度神经内镜,对操作者的技能要求很高。研究发现神经内镜在功能性垂体瘤[3]及颅内血肿[4]等疾病中有显著的治疗作用[5],本研究采用神经内镜辅助显微手术治疗桥小脑角胆脂瘤患者,旨在探讨神经内镜技术的发展对这些特定肿瘤治疗的影响。
1.对象:回顾性分析2013年1月至2021年1月徐州医科大学附属医院神经外科收治的49例桥小脑角胆脂瘤患者,男27例,女22例。患者年龄12.0~71.0(44.2±1.8)岁,单侧听力下降20例,耳鸣14例,头晕或平衡障碍16例,慢性头痛26例,单侧面部麻木或面部疼痛9例,眼睑痉挛7例,面神经功能House-Brackmann Ⅰ/Ⅱ级38例,Ⅲ/Ⅳ级11例[6]。症状持续时间6~120(17.9±3.4)个月。磁共振成像(MRI)是首选的诊断方法,因为它清楚地显示了肿瘤的位置及其与周围组织的关系[7, 8]。49例患者均进行了MRI扫描,肿瘤在 T1 加权像上为低信号,在 T2 加权像上为高信号,DWI序列呈高信号,增强扫描未发现明显强化[7]。肿瘤大小3.0~7.5(4.1±0.1)cm。11例患者肿瘤向颅中窝扩展;5例患者的肿瘤穿过中线进入对侧;28例患者Ⅴ至Ⅸ颅神经受累,其中1例肿瘤侵及第Ⅹ和 Ⅺ颅神经;12例肿瘤压迫脑干;5例与基底动脉关系密切。本研究符合《赫尔辛基宣言》对伦理的要求,所有患者或其法定代理人均书面签署知情同意研究方案。
2.手术方法:手术均采取侧卧位,三钉头架固定予以乙状窦后入路直切口,具体入路及切口由肿瘤的部位及大小决定。切开皮肤,游离骨窗,上方临近横窦,外侧至乙状窦,打开枕大池释放脑脊液降低颅内压。用自动脑压板牵开小脑组织,可见实质部分呈白色油膏样胆脂瘤,暴露面神经、岩静脉、三叉神经,用显微器械分块切除肿瘤,然后在0°和30°硬性神经内镜辅助下寻找残余肿瘤,继续予以弯头剥离子、吸引器予以吸除,暴露出滑车、外展及基底动脉、大脑后动脉等结构,予以彻底清除肿瘤,创面彻底止血,地塞米松生理盐水从深到浅冲洗手术野及邻近脑池,逐层缝合硬脑膜、肌肉、筋膜及头皮。
3.术后管理:自主呼吸功能恢复差的患者术后被送往重症监护室插管呼吸支持至少12 h,术后第2天出现咳嗽和呕吐反射后拔除气管插管。对于容易发生严重吸入性肺炎或呼吸困难的患者,进行气管切开术以防止呼吸障碍。吞咽困难患者通过鼻胃管喂养提供营养支持。术后常规皮质醇类药物预防性给药,所有患者在术后7 d内均使用地塞米松(10~20 mg/d)及进行脱水治疗。
4.随访方法:本研究的长期随访基于门诊档案,少数患者基于电话或家访。术后3个月和6个月进行临床检查和MRI扫描,予以面神经功能House-Brackmann评分及术后卡氏功能状态(Kar-nofsky performance status,KPS)评分作为患者预后评价指标。House-Brackmann Ⅰ/Ⅱ级为面神经功能良好,Ⅲ/Ⅳ级为面神经功能较差。KPS评分≥80分为恢复良好,<80分为恢复不佳。
1.手术结果:49例患者均行显微手术切除肿瘤,38例在神经内镜下发现残留肿瘤,并在内镜辅助下进行二次切除,其中仍有5例未全切除。49例患者共全切除44例,次全切除5例。典型病例见图1。
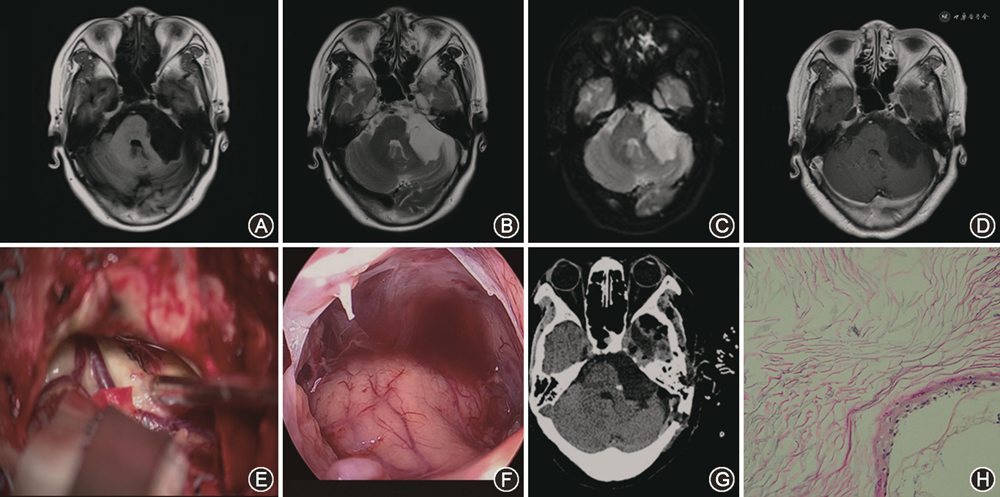

2.面神经功能:术前面神经功能House-Brackmann Ⅰ/Ⅱ级38例(77.6%),Ⅲ/Ⅳ级11例(22.4%);术后面神经功能House-Brackmann Ⅰ/Ⅱ级42例(85.7%),Ⅲ/Ⅳ级7例(14.3%)。本组病例中术后面神经功能Ⅲ/Ⅳ级的7例患者的肿瘤均≥4.5 cm,且术前均表现出面神经症状。
3.并发症:该组发生的并发症包括无菌性脑膜炎(8例)、脑脊液漏(1例)和颅内血肿(2例)。所有并发症均治愈。
4.随访:对49例患者进行随访,随访时间6~72(42±3)个月,没有患者出现复发。术后KPS 为(90±10)分。随访的 49例患者头痛头晕及耳鸣等症状有不同程度的减轻,术前38例(77.6%)患者KPS评分≥80分,术后45例患者(91.84%)KPS≥80分。
桥小脑角是指位于脑干和小脑之间的间隙,有一定的空间供肿瘤生长,在肿瘤的早期往往没有症状,但桥小脑角结构复杂,包括Ⅶ/Ⅷ/Ⅸ/Ⅹ脑神经、脑干、小脑等重要结构,肿瘤进展出现临床症状时,肿瘤已对周围神经造成压迫,增加了手术难度。近年来,随着新技术,特别是神经内镜发展,让术者有机会近距离观察桥小脑角肿瘤。颅内胆脂瘤最常见于桥小脑角,目前手术方式采用显微镜大部切除,神经内镜辅助全切。本研究回顾了49例桥小脑角胆脂瘤患者,神经内镜辅助显微手术能够提高全切除率,降低术后并发症,以下总结一些经验和不足。
1. 手术入路及手术:乙状窦后[9]、中颅窝[10]和迷路入路[11]是切除桥小脑角肿瘤的三种基本入路,选择哪一种取决于操作者的熟练程度、肿瘤位置、附近的结构等因素。乙状窦后入路相对于其他入路,适合范围广泛,尤其是累及内听道和后组颅神经者[12]。在本组病例中,乙状窦后入路可以暴露大部分胆脂瘤。其中出现在天幕上方的2例胆脂瘤,乙状窦后入路不能通过显微镜和神经内窥镜充分显露而次全切除,3例与脑干紧密相连也不能完全切除。手术过程均在3个潜在解剖间隙(小脑幕和三叉神经、三叉神经和面神经、面神经和低位颅神经)内完成。与显微镜不同,内窥镜下只能观察镜片前方的结构,无法看到整体的手术视野。因此,操作时要注意使内镜和器械沿垂直轴移动,以免损坏视野外的结构。
2. 神经及血管的保护:血管不仅供应肿瘤,而且供应临近肿瘤组织的脑组织。有时,脑神经与肿瘤之间仅间隔蛛网膜,而蛛网膜中含有许多脑神经的营养毛细血管。将血管和颅神经从肿瘤中成功分离是该手术最重要的过程,为了保护血管和脑神经,分离必须遵循锐性分离和钝性分离相结合的原则。神经内镜使手术视野更深入,但神经内镜下无法观察到完整的手术区结构,只能看到内镜前端的视野范围内的血管、神经和脑组织。在手术中,常使用有角度的吸引器和剥离子进行肿瘤切除,所以在使用角度内镜和弯曲手术器械时,应注意内镜本体和器械可能损伤神经和血管。内镜既可以减少患者出血风险,也可增加出血风险,因此,需要术者对内镜熟练应用。
3. 并发症的预防和治疗:无菌性脑膜炎的典型脑脊液表现为白细胞相对较低且主要为淋巴细胞增多,糖水平正常,蛋白质水平正常或轻微升高。术后无菌性脑膜炎的发病率高达10%~40%[13],多是由于上皮样碎屑流入蛛网膜下腔引起的,本研究有8例患者发生了无菌性脑膜炎,主要发生在手术早期,由于经内镜辅助显微镜手术,肿瘤全切除率的提高以及近年来术中用地塞米松生理盐水从深到浅冲洗手术野及邻近脑池[14]明显减少了无菌性脑膜炎发生率。术后脑脊液漏会增加脑膜炎风险,但脑脊液漏往往与去除颅骨骨瓣和接受第二次手术有关[15],本组病例1例脑脊液切口漏患者也是二次手术病例,随着肿瘤全切除率的提高,复发率的降低,脑脊液漏发生率将明显降低。胆脂瘤细胞可以表达、产生多种炎症相关物质,参与炎症反应,本组2例颅内血肿病例均为术区出血,其中1例因肿瘤与脑干紧密相连导致肿瘤残留所致,另外1例考虑肿瘤破坏或者手术损伤的基础上,炎症介质对损伤血管进一步破坏引起。因此,应争取全切除肿瘤,充分冲洗术野,减少肿瘤内容物和炎症因子的残留,术后常规动态检查头颅CT,警惕颅内血肿的发生。
本研究选取的样本量较以往研究大,但为回顾性研究且均为使用内镜辅助显微手术切除肿瘤的病例,可以选择单纯显微手术病例进行前瞻性研究进一步证明内镜的优势。手术方面正确的体位不仅对患者很重要,对外科医生也很重要,采用侧卧位,术中配合手术床的旋转或者采取仰卧位可使小脑在重力的作用下自然下垂,减少牵拉[16]。
手术是桥小脑角胆脂瘤患者的最佳选择。虽然体积大的肿瘤可能出现一过性手术并发症,但神经内镜辅助显微手术切除桥小脑角胆脂瘤有助于提高全切除率,降低手术风险。
所有作者均声明不存在利益冲突



























