
非小细胞肺癌(NSCLC)约占全部肺癌患者的80%~85%。针对NSCLC发生、发展过程中最常见的驱动基因表皮生长因子受体(EGFR)基因突变及间变性淋巴瘤激酶(ALK)融合基因阳性人群靶向药物的研发显著提高了这部分患者的生存期。近些年研究者们发现了NSCLC中除EGFR及ALK外越来越多的非常见基因突变,如c-ros原癌基因1(ROS1)、BRAF V600E、神经营养因子受体络氨酸激酶1(NTRK1)、人类表皮生长因子受体2(HER2)、间充质上皮转移因子(MET)、原癌基因(RET)、EGFR 20外显子插入以及鼠类肉瘤病毒癌基因(Kras)G12C突变等。针对这些非常见突变的多种靶向药物得以研发并投入临床应用,其中很多药物已取得了显著的疗效。建议在初诊时对局部晚期或转移性NSCLC患者,尤其是非鳞NSCLC患者进行可以涵盖非常见突变的基因检测,对于非常见突变患者采取个体化治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌在全球范围内是所有恶性肿瘤中死亡率最高的肿瘤,发病率仅次于乳腺癌,位居第2位。2020年肺癌新发患者约占全球肿瘤新发患者的11.7%,死亡患者约占全部肿瘤死亡患者的18%[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占全部肺癌患者的80%~85%。晚期NSCLC患者预后仍然较差,5年总生存率不超过5%。近30年来,针对NSCLC发生、发展过程中的驱动基因采取特异的靶向治疗显著延长了驱动基因阳性晚期NSCLC患者的生存期。NSCLC中最常见的驱动基因突变为表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合基因阳性。近些年研究者们发现了NSCLC中除EGFR及ALK外越来越多的驱动基因,但这些驱动基因在NSCLC中突变率通常<5%,也被称为NSCLC的非常见突变,如c-ros原癌基因1(ROS proto-oncogene 1,ROS1)、B-raf 原癌蛋白(B-raf proto-oncoprotein,BRAF)V600E、神经营养因子受体络氨酸激酶1(neurotrophic tropomyosin receptor kinase,NTRK1)、人类表皮生长因子受体2(human epidermal growth factor receptor,HER2)、间充质上皮转移因子(mesenchymal-to-epithelial transition,MET)、原癌基因(rearranged during transfection,RET)、EGFR 20外显子插入以及鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,Kras)G12C突变等,针对NSCLC的这些非常见突变,越来越多的靶向药物得以研发并投入临床应用,并取得了很好的疗效。本文就近些年NSCLC非常见突变靶向治疗的研究进展进行总结,旨在为这部分患者的个体化治疗提供参考依据。
NSCLC非常见基因突变包含了点突变、基因重排融合、基因扩增等多种不同形式,选择合适的检测方法是精准治疗的关键所在。EGFR突变主要的检测方式包括突变扩增系统(amplification refractory mutation system,ARMS)法、Super ARMS法、微滴式数字聚合酶链反应(microdroplet digital polymerase chain,ddPCR)法和二代测序(next generation sequencing,NGS)法等。ROS1基因融合的主要检测方式包括荧光原位杂交(fluorescent in situ hybridization,FISH)、逆转录-PCR(reverse transcription-PCR,RT-PCR)及NGS法等。MET外显子14跳跃突变最常用的检测方式包括RT-PCR及NGS等,MET扩增的常用检测方式为FISH及NGS等。RET基因的检测方式包括FISH、RT-PCR以及NGS法等。BRAF突变常用的检测方式包括PCR法及NGS法等。NTRK基因融合的主要检测方法包括FISH、RT-PCR以及NGS法等。Kras突变常用的检测方式包括PCR法及NGS法等。HER2突变常用的检测方式包括PCR法及NGS法等。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南及国内指南均建议基因检测需从单基因到多基因检测,同一基因从单次到多次检测。
EGFR敏感突变的患者可以从EGFR-酪氨酸受体拮抗剂(tyrosine kinase inhibitor,TKI)靶向治疗中获益,常见的敏感突变为19外显子缺失以及21外显子L858R突变,也被称作EGFR经典突变,约占EGFR突变的60%~80%。近期一项研究分析了1.17万例NSCLC患者,非常见突变约占全部EGFR突变患者的1/3[2]。该研究将EGFR非常见突变分成了四类。第一类为经典突变型,整体与19外显子缺失及21外显子L858R突变相似,也包括L861Q突变、L833F/V等突变,同时也包括一部分20外显子a-C螺旋区插入突变,如A763-Y764insFQEA突变等。对经典突变型患者各类EGFR-TKI都有很好的疗效。第二类为T790M突变型,即含T790M突变类型,包括T790M突变或T790M突变合并G719X、S768I等突变类型,T790M突变型对三代TKI最为敏感。第三类为EGFR 20外显子插入突变,整体对EGFR-TKI不敏感。第四类为PCAA型突变,即位于结合口袋内部的突变或a-C螺旋区C端末尾的突变,包括18外显子G719X、20外显子S768I、C797S突变等类型,这类突变由于ATP结合口袋突变变形,对大多数TKI不敏感,但应用第二代TKI阿法替尼有很好的疗效。目前美国食品药品监督管理局(Food and Drug Administration,FDA)批准阿法替尼用于G719X、S768I、L861Q三类非常见突变患者的治疗。EGFR 20外显子插入突变型为具有很大异质性的一类突变,除了少数位于a-C螺旋区的插入突变对EGFR-TKI敏感外,90%以上为位于a-C螺旋酪氨酸激酶结构域后的插入突变,对EGFR-TKI耐药,是治疗最为棘手的突变类型。EGFR 20外显子插入突变近些年成为了研究的热点,本文也将主要介绍EGFR 20插入突变的研究进展。
EGFR 20外显子插入突变在所有NSCLC患者中约占1.8%,在所有EGFR突变患者中约占12%。有研究显示,EGFR 20外显子插入突变在亚裔不吸烟患者中更加常见,EGFR 20外显子插入突变NSCLC患者预后差于EGFR敏感突变患者,与EGFR野生型患者相似[3]。EGFR 20外显子插入突变最常见的为D770_N771>ASVDN以及N771_P772>SVDNP,分别占21%和20%[4]。
Mobocertinib(TAK-788)为靶向作用于EGFR/HER2 20外显子插入突变的药物。Mobocertinib的Ⅰ/Ⅱ期临床研究结果显示,28例既往含铂方案化疗失败的EGFR 20外显子插入突变NSCLC患者接受Mobocertinib 160 mg/d 治疗后,客观缓解率(objective response rate,ORR)为43%,疾病控制率(disease control rate,DCR)为86%,中位无进展生存期(progression free survival,PFS)为7.3个月;136例接受Mobocertinib 160 mg/d 治疗的患者最常见的治疗相关不良事件包括腹泻、皮疹和恶心[5]。美国FDA授予TAK-788突破性疗法治疗既往含铂方案治疗进展的EGFR 20外显子插入突变晚期NSCLC患者。
Amivantamab(JNJ-61186372)为全人源化EGFR/MET双特异性抗体,CHRYSALIS Ⅰ期研究结果显示,81例既往含铂方案化疗失败的EGFR 20外显子插入突变NSCLC患者接受Amivantamab 治疗后,ORR为40%,DCR可达67%,中位PFS为8.3月。最常见的不良事件包括皮疹、输液反应和甲沟炎,最常见的3~4级不良事件包括低钾血症、皮疹、肺栓塞、腹泻和粒细胞减少[6]。美国FDA授予Amivantamab突破性疗法治疗既往含铂方案治疗进展的EGFR 20外显子插入突变晚期NSCLC患者。
DZD9008 是国产的选择性、不可逆的EGFR/HER2 抑制剂。2021年美国临床肿瘤学年会(American Society of Clinical Oncology,ASCO)报道了DZD9008 Ⅰ期临床研究结果,56 例EGFR 20 外显子插入突变NSCLC 患者接受了DZD9008 剂量递增治疗(50~400 mg/d),这些患者中92.9% 接受过化疗,2 例接受过波齐替尼治疗,4 例接受过Amivantamab治疗。4 例既往接受过Amivantamab 治疗的患者中有2 例部分缓解,23 例脑转移患者中有7 例部分缓解。31例接受300 mg/d治疗的患者ORR为41.9%,DCR为90.3%。
奥希替尼加倍剂量的Ⅱ期临床研究纳入了20例EGFR 20外显子插入突变的晚期NSCLC患者。结果显示接受奥希替尼160 mg治疗,ORR为25%,DCR 为85%,中位PFS为9.7月。3~4级不良反应主要包括乏力、贫血、QT间期延长以及呼吸衰竭。
伏美替尼是我国自主研发的第三代EGFR-TKI,2021年3月在国内获批治疗既往EGFR-TKI治疗失败的EGFR T790M突变阳性的局部晚期或转移性NSCLC患者。2021年欧洲肿瘤内科学年会报道了伏美替尼3倍剂量治疗EGFR 20外显子插入突变的晚期NSCLC患者的结果。研究结果显示10例患者接受伏美替尼240 mg治疗,ORR为60%,DCR达100%,最常见的不良反应为皮疹及腹泻,未观察到≥3级不良反应,未发生因不良事件导致的药物减量和停止。针对EGFR 20外显子插入突变新药的临床研究数据在表1中进行汇总。

EGFR 20外显子插入突变新药临床研究结果
EGFR 20外显子插入突变新药临床研究结果
| 药物 | 试验名称 | 研究类型 | 例数 | ORR(%) | DCR(%) | 中位PFS(月) |
|---|---|---|---|---|---|---|
| Mobocertinib | NCT02716116 | Ⅰ/Ⅱ | 28 | 43.0 | 86.0 | 7.3 |
| Amivantamab | CHRYSALIS | Ⅰ | 81 | 40.0 | 67.0 | 8.3 |
| 波奇替尼 | ZENITH20-1 | Ⅱ | 115 | 14.8 | 68.7 | 4.2 |
| 奥希替尼(160 mg) | ECOG-ACRIN5162 | Ⅱ | 20 | 25.0 | 85.0 | 9.7 |
| 伏美替尼(240 mg) | FAVOUR | ⅠB | 10 | 60.0 | 100.0 | - |
注:ORR为客观缓解率;DCR为疾病控制率;PFS为无进展生存期;“-”示数据未达到
ROS1基因融合在NSCLC的发生率为1%~2%,与ROS1融合的基因包括CD74、SDC4、SLC34A2、FIG、EZR、LRIG3、TPM3、CCDC6、KDELR2等,ROS1与CD74基因融合最为常见[7]。ROS1阳性在年轻、不吸烟、腺癌患者中更为常见[8]。
克唑替尼为口服Met/ALK/ROS1蛋白激酶抑制剂。PROFILE1001 Ⅰ/Ⅱ期临床研究显示克唑替尼治疗ROS1融合基因阳性NSCLC患者中位PFS达19.3个月,中位OS达51.4个月[9]。OO-1201 Ⅱ期研究纳入了127例来自东亚的既往治疗失败的ROS1阳性NSCLC患者,接受克唑替尼治疗后ORR达71.7%,DCR达 88.2%,中位PFS为 15.9个月,1年总生存(overall survival,OS)率可达 83.1%[10]。克唑替尼于2017年在国内获批治疗ROS1融合基因阳性的晚期NSCLC患者。
恩曲替尼为口服ALK/ROS1/NTRK多靶点TKI,恩曲替尼两项Ⅰ期研究及一项Ⅱ期临床研究的汇总分析显示,53例既往未经TKI治疗的ROS1阳性NSCLC患者接受恩曲替尼治疗后ORR为77%,中位PFS为19个月。颅内ORR可达55%,无脑转移患者和脑转移患者中位PFS为26个月和14个月[11]。美国FDA已批准恩曲替尼一线治疗ROS1阳性局部晚期或转移性NSCLC患者。
塞瑞替尼为二代ALK融合基因抑制剂,对ROS1融合基因也有抑制作用。塞瑞替尼的Ⅱ期临床研究显示30例既往治疗失败,但未接受克唑替尼治疗的ROS1阳性NSCLC患者,应用塞瑞替尼750 mg治疗后,ORR为62%,DCR为87%,中位PFS达19.3个月,中位OS为24个月。有脑转移患者ORR为25%,DCR为63%。常见的不良反应多为1~2级,主要为腹泻、恶心以及食欲减退等[12]。
布加替尼为二代ALK融合基因抑制剂,对ROS1融合基因也有抑制作用。一项研究汇总分析了8例布加替尼治疗的ROS1阳性NSCLC患者,1例未经克唑替尼治疗的患者应用布加替尼治疗,在21.6个月时肿瘤仍持续缓解,TKI治疗后的患者ORR为29%[13]。
劳拉替尼为三代ALK融合基因抑制剂,对ROS1融合基因也有更强的抑制作用。劳拉替尼Ⅰ/Ⅱ期临床研究入组了59例ROS1融合基因阳性的NSCLC患者。研究结果显示38例接受过ROS1-TKI治疗的患者ORR为29.4%,13例未经TKI治疗的患者ORR为76.9%。另一项Ⅱ期临床研究纳入了13例未经克唑替尼治疗的患者,ORR为61.5%,中位PFS达21个月,颅内ORR达66.7%。劳拉替尼对于ROS1耐药突变如G2032R及L2026M等也有抑制作用,劳拉替尼的Ⅰ/Ⅱ期临床研究显示既往TKI治疗后伴有G2032R突变和无G2032R突变患者ORR分别为33.3%以及23.8%。
洛普替尼(Repotrectinib)为新型ALK/NTRK/ROS1抑制剂,临床前研究显示对于G2032R等耐药突变也有抑制作用,并可透过血脑屏障。TRIDENT-1 Ⅰ期临床研究纳入了29例ROS1阳性NSCLC患者,TKI耐药患者ORR为39%,TKI初治患者ORR可达82%,其中1例脑转移伴有G2032R耐药突变的患者颅内病灶达到部分缓解。
其他研发的一些新药也正在临床研究中。Taletrectinib(DS-6051b)为ROS1及NTRK抑制剂,对ROS1融合基因阳性及耐药突变型均有抑制作用。恩沙替尼为我国自主研发的二代ALK抑制剂,对ROS1同样有抑制作用。卡博替尼为ROS1/MET/VEGFR2/RET等多靶点抑制剂,对G2032R及D2033N等ROS1耐药突变均有抑制作用。主要ROS1抑制剂的临床研究数据见表2。
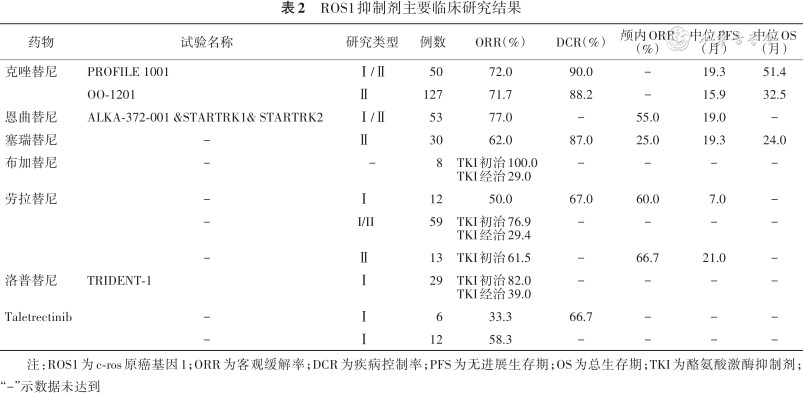
ROS1抑制剂主要临床研究结果
ROS1抑制剂主要临床研究结果
| 药物 | 试验名称 | 研究类型 | 例数 | ORR(%) | DCR(%) | 颅内ORR (%) | 中位PFS (月) | 中位OS (月) |
|---|---|---|---|---|---|---|---|---|
| 克唑替尼 | PROFILE 1001 | Ⅰ/Ⅱ | 50 | 72.0 | 90.0 | - | 19.3 | 51.4 |
| OO-1201 | Ⅱ | 127 | 71.7 | 88.2 | - | 15.9 | 32.5 | |
| 恩曲替尼 | ALKA-372-001 &STARTRK1& STARTRK2 | Ⅰ/Ⅱ | 53 | 77.0 | - | 55.0 | 19.0 | - |
| 塞瑞替尼 | - | Ⅱ | 30 | 62.0 | 87.0 | 25.0 | 19.3 | 24.0 |
| 布加替尼 | - | - | 8 | TKI初治100.0 TKI经治29.0 | - | - | - | - |
| 劳拉替尼 | - | Ⅰ | 12 | 50.0 | 67.0 | 60.0 | 7.0 | - |
| - | I/II | 59 | TKI初治76.9 TKI经治29.4 | - | - | - | - | |
| - | Ⅱ | 13 | TKI初治61.5 | - | 66.7 | 21.0 | - | |
| 洛普替尼 | TRIDENT-1 | Ⅰ | 29 | TKI初治82.0 TKI经治39.0 | - | - | - | - |
| Taletrectinib | - | Ⅰ | 6 | 33.3 | 66.7 | - | - | - |
| - | Ⅰ | 12 | 58.3 | - | - | - | - |
注:ROS1为c-ros原癌基因1;ORR为客观缓解率;DCR为疾病控制率;PFS为无进展生存期;OS为总生存期;TKI为酪氨酸激酶抑制剂;“-”示数据未达到
MET14外显子跳跃突变在肺腺癌的发生率约为3%[14]。MET外显子14跳跃突变在肺肉瘤样癌中发生率更高。在一项纳入36例肺肉瘤样癌患者的研究显示,MET外显子14跳跃突变发生率可高达22%[15]。MET扩增在初治的NSCLC中发生率为1.4%~5.6%[16],同时为EGFR突变患者应用EGFR-TKI获得性耐药的机制之一,发生率为11%~22%[17]。MET扩增的NSCLC患者整体预后较差[18]。
克唑替尼为MET-TKI,可通过阻止c-MET自身磷酸化抑制细胞增殖。PROFILE1001研究中纳入了21例初治或既往治疗失败的MET14跳跃突变的NSCLC患者,ORR为44%,DCR可达100%。不良事件多为1~2级,主要包括消化道反应、视觉异常、肝功能异常、心动过缓以及QT间期延长等。3级不良事件为水肿1例以及心动过缓1例。PROFILE1001扩展研究纳入了69例MET14跳跃突变的NSCLC患者,ORR可达32%[19]。2018年FDA授予克唑替尼突破性治疗既往治疗失败的MET 14跳跃突变的晚期NSCLC患者。
Capmatinib为一种口服的MET-TKI,可通过与ATP竞争性与MET受体结合进而诱导肿瘤细胞凋亡,抑制肿瘤细胞的增殖分化。Ⅱ期GEOMETRY mono-1临床研究纳入了364例MET14跳跃突变或MET扩增的NSCLC患者。对于初治的MET14跳跃突变患者,ORR为68%,中位缓解持续时间(duration of response,DOR)为12.6个月。既往治疗失败的MET14跳跃突变患者ORR为41%,中位DOR为9.7个月。对于MET扩增且基因拷贝数≥10的NSCLC患者,初始治疗患者ORR为40%,既往治疗失败的患者ORR为29%。13例脑转移的患者,7例脑转移灶缓解。MET扩增且基因拷贝数<10的NSCLC患者疗效欠佳,ORR为7%~12%。大多数不良反应为1~2级,主要包括外周水肿和恶心等[20]。2020年5月美国FDA批准Capmatinib用于治疗MET14外显子跳跃突变的转移性成年NSCLC患者。
Tepotinib为一种口服MET-TKI。Ⅱ期VISION临床研究纳入了99例MET14跳跃突变的NSCLC患者,这些患者应用Tepotinib 的ORR为46.5%,DCR可达65.7%。中位PFS达8.5个月,中位DOR达11.1个月。其中11例脑转移患者ORR为65.5%,中位PFS达10.9个月。Tepotinib主要不良反应均为1~2级,最常见的为水肿、恶心以及腹泻等。2020年3月日本获批Tepotinib用于MET 14外显子跳跃突变的晚期或复发性NSCLC的治疗。
赛沃替尼(Savolitinib)为口服MET-TKI,可通过抑制MET磷酸化及下游信号通路传导发挥抗肿瘤效应。赛沃替尼治疗MET 14跳跃突变肺肉瘤样癌或其他NSCLC亚型的Ⅱ期临床研究结果显示,70例既往含铂方案化疗失败的NSCLC患者接受赛沃替尼治疗,ORR可达47.1%,DCR可达81.4%,中位PFS为6.9个月。值得注意的是,该研究入组的100%都是中国患者,并且入组的患者中有21%伴有脑转移。大部分不良反应为1~2级,包括胃肠道反应(恶心呕吐)、外周水肿以及肝功能异常等,并未看到间质性肺炎的发生[21]。2021年6月22日赛沃替尼(Savolitinib)已在国内获批用于治疗含铂化疗后疾病进展或不耐受标准含铂化疗的MET外显子14跳跃突变的局部晚期或转移性NSCLC患者。
另外一大类针对MET的靶向药物为MET单克隆抗体,如Onartunzumab、TAK701、Emibetuzumab、Rilotumama以及Ficlatuzumab等。这些药物的临床研究中也看到了一定的疗效,但是研究结果并不令人满意,与其他药物的联合应用具有一定的前景。
RET基因融合在肺腺癌及腺鳞癌患者中的发生率为1%~2%。与RET融合最常见的基因包括KIF5B、NCOA4、CCDC6、EPHA5、MYO5C、ERC1、TRIM33、CLIP1等。最常见的融合基因是KIF5B。RET基因融合多为不吸烟、年龄≤60岁、实体亚型腺癌以及淋巴结N2转移的患者[22]。
Selpercatinib(LOXO-292,塞尔帕替尼)为特异性的小分子口服RET抑制剂。一项Selpercatinib 的Ⅰ期临床研究纳入了38例RET融合基因阳性的NSCLC患者,患者ORR可达77%。大多数不良事件为1~2级,主要为乏力、腹泻、便秘、恶心及呼吸困难。另一项Ⅰ/Ⅱ期临床研究纳入了329例RET融合基因阳性的NSCLC患者,39例初治的患者ORR可高达85%,105例接受过既往治疗的患者ORR可达64%。中位DOR为17.5个月,中位PFS可达17个月。其中22例脑转移的患者ORR为81.8%,并未出现颅内病灶进展。FDA于2020年5月8日批准Selpercatinib用于RET基因融合晚期NSCLC的治疗。
普拉替尼(BLU-667)为口服、高选择性的RET激酶抑制剂,其对RET基因融合及点突变均显示出很好的抗肿瘤效应。普拉替尼抑制最常见的RET-KIF5B融合自身磷酸化的作用是其他多靶点靶向药物如卡博替尼、凡德他尼的10倍以上,同时普拉替尼还可强效抑制其他RET融合(如CCDC6-RET融合等)、RET点突变(如RET V804E/L/M突变及M918T突变等)。普拉替尼的Ⅰ期临床研究纳入了51例既往接受治疗的实体瘤患者,其中NSCLC患者为19例,ORR为50%。大多数不良事件为1~2级,主要为高血压、中性粒细胞减少、转氨酶升高、乏力及腹泻等。普拉替尼的Ⅱ期临床研究纳入了132例RET基因融合的NSCLC患者。其中初治人群ORR可达73%,既往治疗失败的人群ORR可达61%,对于有脑转移的患者颅内缓解率可达56%。3级及以上的不良事件包括高血压、中性粒细胞减少等。FDA于2020年9月4日批准普拉替尼用于RET基因融合晚期NSCLC的治疗。
一些小分子多靶点TKI如卡博替尼、乐伐替尼及凡德他尼等对于RET融合基因阳性晚期NSCLC患者也显示出一定的疗效,ORR为15%~53%,中位PFS为4.5~7.3个月。但这些药物尚缺乏更高级别证据的支持,且因为这些药物对VEGFR、Kit、EGFR等多个靶点均有抑制作用,3级以上高血压、胃肠道反应、蛋白尿以及转氨酶升高等不良反应发生率较高也限制了这些药物在临床上的应用。
BRAF突变在NSCLC的发生率约为1.5%~3.5%,其中最常见的为15外显子V600E突变[23]。BRAF V600E突变在不吸烟或轻度吸烟肺腺癌患者中更为常见,BRAF V600E突变肺腺癌患者预后优于BRAF非V600E突变患者[24]。
达拉非尼为小分子BRAF激酶抑制剂,曲美替尼是MEK1/2激酶抑制剂。达拉非尼/曲美替尼治疗BRAF V600E突变的NSCLC患者的Ⅱ期临床研究共纳入了3个队列。队列A为达拉非尼二线治疗既往含铂方案治疗失败的NSCLC患者,队列B为达拉非尼/曲美替尼二线治疗既往含铂方案治疗失败的NSCLC患者,队列C为达拉非尼/曲美替尼一线治疗晚期NSCLC患者。3组的ORR分别为33%、63%以及64%。中位PFS分别为5.5、9.7以及10.9个月。大多数不良反应为1~2级,包括发热、恶心、呕吐、皮肤干燥、周围水肿以及腹泻等[25]。2017年6月22日FDA批准达拉非尼联合曲美替尼治疗BRAF V600E突变的NSCLC患者。
维莫非尼为口服的小分子BRAF激酶抑制剂。一项维莫非尼治疗BRAF突变实体瘤的多中心Ⅱ期临床研究共纳入了101例BRAF V600E突变的NSCLC患者。研究结果显示ORR为44.9%,中位PFS为5.2个月,中位OS为10个月。17例非V600E突变患者无明显疗效。最常见的不良反应包括乏力、食欲下降、皮疹以及胃肠道反应等,并有QT间期延长的报道。3~4级不良反应包括皮疹、感染以及肝功能损伤等[26]。
其他针对RAF/MEK/ERK通路的一些新药也在开展临床研究,比如新型RAF抑制剂Lifirafenib、LXH254等,ERK激酶抑制剂Ulixertinib、LY3214996等,这些新药的联合应用以及与抗EGFR单抗西妥昔单抗等的联合应用也在探索之中。
NTRK1融合在NSCLC患者中的发生率可达3.3%[27],最常见与其融合的基因包括CD74、SQSTM1、MPRIP等[28]。NTRK融合NSCLC患者的临床特征尚不明确。
拉罗替尼为一种高度选择性小分子口服TRK抑制剂,可靶向作用于TRK激酶,与TRK竞争性结合ATP,阻断下游信号通路传导,抑制肿瘤细胞的生长。3项Ⅰ/Ⅱ期试验的汇总分析共纳入了159例NTRK基因融合阳性的局部晚期或转移性实体瘤患者,整体ORR为79%。其中包括12例肺癌患者,9例肿瘤缓解。拉罗替尼对脑转移患者也有很好的疗效,其中13例脑转移患者ORR可达75%。拉罗替尼的主要不良反应包括乏力、贫血、白细胞减少以及转氨酶升高等,大多数不良反应均为1~2级,耐受性良好[29]。2018年11月美国FDA批准拉罗替尼用于治疗NTRK融合基因阳性的实体瘤患者。
恩曲替尼为多靶点TKI,可靶向作用于TRK、ROS1以及ALK融合基因。3项Ⅰ/Ⅱ期研究的汇总分析显示54例NTRK融合基因阳性的实体瘤患者ORR为57%,DCR达74%,中位DOR为10.4个月,中位PFS达11.2个月。其中11例脑转移患者ORR为55%,DCR达88%,颅脑中位PFS为14个月[30]。恩曲替尼的常见不良反应大多为1~2级,主要包括恶心、呕吐、腹泻、便秘、乏力、味觉障碍等,3~4级不良反应包括QT间期延长、转氨酶升高、充血性心衰、认知障碍等[31]。FDA批准恩曲替尼用于NTRK融合基因阳性的晚期实体瘤患者。
第二代TRK小分子抑制剂包括Selitrectinib(LOXO-195)、Repotrectinib(TPX-0005)以及国内自主研发的ICP-723等,对于TRK耐药突变以及野生型TRK都有很强的抑制作用,目前也在开展Ⅰ/Ⅱ期临床试验,有很好的应用前景。
Kras突变在肺腺癌人群更为常见,西方人群发病率高于亚裔人群,西方肺腺癌患者的发生率可高达30%,亚裔肺腺癌患者发生率为10%~15%。鳞癌患者发生率约为5%[32]。Kras12号密码子点突变为最常见的突变,发生率从高到低分别为G12C突变(39%)、G12V突变(18%~21%)以及G12D突变(17%~18%)。Kras基因突变NSCLC患者整体预后较差,且为提示应用EGFR-TKI耐药的突变。
Sotorasib为Kras G12C口服抑制剂。Sotorasib可与Kras G12C突变产生的半胱氨酸共价结合,使Kras G12C与三磷酸鸟苷(guanosine triphosphate,GTP)结合力下降,抑制肿瘤细胞的增殖。Sotorasib治疗多线治疗后Kras G12C突变晚期实体瘤患者的Ⅰ期临床研究结果显示,23例NSCLC患者ORR为48%,DCR可达96%。≥3级的不良事件发生率为8.8%,剂量限制性毒性并未出现。在纳入126例既往治疗后进展的Kras G12C突变NSCLC患者的Ⅱ期临床研究结果显示,ORR为37.1%,DCR为80.6%。中位DOR为11.1个月,中位PFS为6.8个月,中位OS为12.5个月。3级不良事件发生率为19.8%,4级不良事件发生率为0.8%[33]。其他Kras G12C抑制剂如MRTX849、LY3499446和JNJ-74699157/ARS-3248等的Ⅰ/Ⅱ期临床研究也正在开展。另外一些泛Kras抑制剂如BI-3406、BI-1701963等在基础实验中也可以通过减少Kras活化抑制肿瘤细胞增殖[34]。
HER2突变在NSCLC患者中发生率为1%~2%。20外显子插入突变占HER2基因突变的96%。一项纳入1 478例肺腺癌患者的研究显示,HER2突变患者发生率为1.6%[35]。另一项纳入3 800例NSCLC患者的研究显示,HER2突变患者发生率为1.7%。HER2突变患者多为女性、不吸烟、腺癌患者,整体预后更差[36]。
吡咯替尼为一种口服泛HER家族TKI,可以不可逆性抑制HER1、HER2以及HER4。一项Ⅱ期临床研究纳入了15例HER2 20外显子插入突变的晚期NSCLC患者,接受吡咯替尼治疗ORR可达53.3%,DCR可达73.3%,中位PFS为6.4个月[37]。另一项Ⅱ期临床研究纳入了60例既往含铂方案化疗失败的HER2突变的肺腺癌患者,接受吡咯替尼治疗ORR为30%,中位DOR为6.9个月,中位PFS为6.9个月,中位OS可达14.4个月。3~4级治疗相关不良事件发生率为28.3%,最常见的为腹泻(均为3级,20%),无治疗相关死亡的发生[38]。
波奇替尼为一种新型口服泛HER家族TKI,可以不可逆性抑制HER1、HER2以及HER4。ZENITH20 Ⅱ期临床研究纳入了30例EGFR 20号外显子插入突变或HER2 20号外显子插入突变的晚期NSCLC患者,EGFR突变患者ORR为23%,HER2突变患者ORR为50%。总体人群ORR为30%,DCR为80%,中位PFS为5.6个月,中位OS为9.5个月。3级以上不良事件发生率为66%,最常见的为皮疹、腹泻、黏膜炎以及甲沟炎等,并且有可能与药物相关的肺炎的发生[39]。
Enhertu(DS-8201)是一种靶向作用于HER2的新型抗体偶联药物,可以有效识别HER2表达的NSCLC细胞,同时发挥细胞毒作用[40]。DESTINY-Lung01是一项全球多中心Ⅱ期临床研究,纳入了170例既往治疗失败的的HER2突变的晚期非鳞NSCLC患者。研究结果显示,接受Enhertu单药治疗患者ORR为61.9%,DCR可达90.5%,中位PFS 14.0个月,最常见的不良事件包括恶心、食欲下降、中性粒细胞减少以及贫血等。有5例药物相关的间质性肺炎的发生,均为2级,未发现肺炎相关死亡的发生。2021年5月Enhertu(DS-8201)被美国FDA授予突破性疗法用于治疗既往含铂方案治疗失败的HER2突变转移性NSCLC患者。
其他抗HER2药物如小分子TKI包括阿法替尼、达克替尼、来那替尼等;单克隆抗体如曲妥珠单抗、帕妥珠单抗等;HER2抗体-药物偶联物T-DM1等针对HER2突变NSCLC也进行了一系列的研究,但是尚未达到令人满意的疗效。
随着对NSCLC发生率较高的驱动基因EGFR基因突变以及ALK融合基因靶向药物的研发,使这部分患者的生存期有了大幅度的提高。因此人们对紧随其后发现的一些非常见突变关注度也在逐渐提升。尽管每种非常见突变发生率较低,但NSCLC患者数量巨大,且非常见突变种类繁多,提高这些非常见突变的诊疗水平仍会使大量NSCLC患者获益。本文对非常见突变NSCLC患者的生物学特点、基因检测方式及最新药物研究进展进行了总结,旨在为这部分患者的个体化治疗提供参考依据。但针对非常见突变的研究仍然存在很多问题:非常见突变检测方法的敏感性以及特异性还有待提高;很多非常见突变的耐药机制仍不明确;针对非常见突变的下一代靶向药物仍需研发;非常见突变患者的围手术期治疗药物选择尚不明确;非常见突变患者是否对免疫检查点抑制剂敏感等[41],这些问题仍需进一步的研究探索。
所有作者均声明不存在利益冲突



























