
探讨术中持续静脉输注亚麻醉剂量艾司氯胺酮对胸腔镜手术患者术后阿片类药物镇痛消耗量的影响。
选取郑州大学第一附属医院2020年12月至2021年12月择期胸腔镜肺部手术患者71例,年龄18~70岁,男32例,女39例;美国麻醉医师协会(ASA)分级Ⅰ或Ⅱ级,体质指数(BMI)18.5~30.0 kg/m2。采用随机数字表法分为3组:(1)对照组(C组,n=24):术中持续静脉输注等速率生理盐水;(2)亚麻醉剂量艾司氯胺酮0.125 mg·kg-1·h-1组(ES1组,n=23):术中持续静脉输注艾司氯胺酮0.125 mg·kg-1·h-1;(3)亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1组(ES2组,n=24):术中持续静脉输注艾司氯胺酮0.250 mg·kg-1·h-1。主要观察指标为3组患者术后24、48 h内患者氢吗啡酮总消耗量;次要观察指标为3组患者术后气管导管拔出时间、麻醉复苏室(PACU)停留时间、术后首次进食时间,以及术后24 h内不良反应发生情况。
C组、ES1组和ES2组患者术后24 h氢吗啡酮消耗量分别为(5.4±1.0)、(4.5±1.5)、(4.0±0.8)mg,术后48 h氢吗啡酮消耗量分别为(9.7±2.2)、(9.0±3.0)、(7.7±1.8)mg;与C组相比,ES1组和ES2组患者术后24 h氢吗啡酮消耗量均减少(均P<0.05)。C组患者气管导管拔除时间、PACU停留时间、术后首次进食时间分别为(23±10)min、(70±12)min、(17±3)h,ES1组分别为(22±4)min、(69±11)min、(14±5)h,ES2组分别为(16±8)min、(58±12)min、(14±3)h;与C组和ES1组相比,ES2组气管导管拔除时间、PACU停留时间均缩短(均P<0.05);与C组相比,ES1组、ES2组术后首次进食时间缩短(均P<0.05)。3组患者术后24 h不良反应发生率比较差异均无统计学意义(均P>0.05)。
术中持续静脉输注亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1可显著减少术后阿片类药物消耗量,促进患者转归。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
虽然微创腔镜手术可减轻胸科患者术后应激反应程度,但微创不等于微痛[1]。研究表明,与开胸手术相比,胸腔镜手术患者术后急性疼痛程度并未减轻,且术后转化为慢性疼痛的发生率依然很高[2]。因此,无论是否采用微创方法,临床医生都需重视胸科手术的术后镇痛。
阿片类药物术后镇痛效果确切,但大剂量应用时不良反应明显,对患者术后早期康复不利。加速术后康复是围手术期医学临床实践及路径管理的重要进展,需要确保术后肠道功能的早期恢复以及有效的镇痛管理[3]。国内外专家共识建议围手术期最小化使用阿片类药物,且在多模式镇痛药物选择时纳入N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂氯胺酮[4, 5]。围手术期应用氯胺酮在为患者提供有效镇痛时,还能减少术后阿片类药物的消耗[6]。艾司氯胺酮是氯胺酮的S-对映异构体,镇痛效能和体内清除率较氯胺酮更强更高,可应用于疼痛、抑郁症和慢性疼痛的治疗。然而目前有关艾司氯胺酮在胸外科手术中的应用报道有限。术中应用艾司氯胺酮能否减少胸科患者围手术期阿片类药物用量,改善患者术后疼痛尚不明确。本研究拟探讨术中应用艾司氯胺酮对胸腔镜手术患者术后阿片类药物镇痛消耗量的影响及不良反应发生情况,为临床合理用药提供理论依据。
本研究已获本院医学伦理委员会批准(2021-KY-0044-002),并与患者或家属签署知情同意书。纳入2020年12月至2021年12月本院择期行胸腔镜肺部手术患者75例。
1. 纳入标准:年龄18~70岁;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ或Ⅱ级;体质指数(body mass index,BMI)18.5~30.0 kg/m2;拟在全身麻醉下行胸腔镜肺部手术(胸腔镜下肺癌根治术、胸腔镜下肺叶或肺段切除术);接受术后患者自控静脉镇痛(patient controlled intravenous analgesia,PCIA)治疗;患者或家属对本次试验的目的和意义有充分了解,自愿参加本次临床试验,并签署知情同意书。
2. 排除标准:术前有慢性疼痛或慢性阿片类药物使用史;对本研究中所需要使用的药物过敏;患有精神疾病无法合作者;术前因认知功能障碍或语言障碍而无法交流;心、肝、肾功能异常者;血压≥180/100 mmHg(1 mmHg=0.133 kPa);未经治疗或控制不良的高血压;青光眼、颅内压增高、甲亢患者;酗酒者;研究者判断患者不适合参加该临床试验的其他情况。
3. 样本量估算:预试验中,对照组(C组)、亚麻醉剂量艾司氯胺酮0.125 mg·kg-1·h-1组(ES1组)、亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1组(ES2组)术后24 h氢吗啡酮消耗量分别为4.50、3.85和5.50 mg,令α=0.05(双侧),β=0.10,组数k=3,计算每组最低样本量9例。考虑到试验中的脱落率、剔除率和依从性等原因,每组选取患者25例。
4. 分组:采用随机数字表法将患者分为3组(n=25):(1)C组:术中持续静脉输注等速率生理盐水;(2)ES1组:术中持续静脉输注艾司氯胺酮0.125 mg·kg-1·h-1;(3)ES2组:术中持续静脉输注艾司氯胺酮0.250 mg·kg-1·h-1。所有患者在术前均接受数字评分法(numeric rating scale,NRS)评分培训。术中所输注的研究药物事先由麻醉护士根据随机分组号进行稀释并交由盲态的麻醉医生。麻醉结束后负责随访的医生或者麻醉护士对患者分组亦不知情。
1. 麻醉方法:(1)全身麻醉诱导:患者入室后监测患者血压、心电图、血氧饱和度,建立外周静脉通道,局部麻醉下行桡动脉穿刺并连续监测动脉血压(arterial blood pressure,ABP)。静脉注射咪达唑仑0.05 mg/kg、异丙酚1~2 mg/kg、舒芬太尼0.6 μg/kg和罗库溴铵0.6 mg/kg。诱导后经口插入双腔支气管导管,气管插管术后进行机械通气。(2)麻醉维持:麻醉诱导后所有患者均进行了右颈内静脉穿刺置管。麻醉医生根据分组方案,在气管插管术后对患者分别输注生理盐水或者不同剂量的艾司氯胺酮。3组患者术中均采用全凭静脉麻醉维持,即静脉输注异丙酚4~8 mg·kg-1·h-1、瑞芬太尼0.1~0.4 μg·kg-1·min-1,间断追加罗库溴铵0.2~0.4 mg/kg。术中麻醉药物的输注速度由主管麻醉医生根据患者生命体征参数、手术进程及刺激强度变化进行调整。维持患者脑电双频指数(bispectral index,BIS)值40~60;术中维持心率、血压波动范围不超过基础值的20%;呼气末二氧化碳分压(partial pressure of end-tidal carbon dioxide,PETCO2)维持在35~45 mmHg、血氧饱和度(SpO2)≥90%。准备关胸时,所有患者接受氢吗啡酮0.5 mg、氟比洛酚酯50 mg和帕洛诺司琼0.25 mg静脉注射。手术结束前约30 min时停用罗库溴铵,术毕停用异丙酚及瑞芬太尼,将患者转送至麻醉复苏室(postanesthesia care unit,PACU)。
2. 麻醉复苏后镇痛方案:(1)PACU内复苏:待患者完全苏醒,呼喊能应答;潮气量>6 ml/kg,呼吸频率>12次/min;呼吸空气SpO2>90%,吞咽反射、咳嗽反射完全恢复后拔除气管导管。并对患者行NRS评估,若NRS<4分,接PCIA泵;若NRS≥4分,则分次给予0.2 mg氢吗啡酮静脉注射滴定(两次间隔时间5 min),待NRS<4分接PCIA泵。(2)PCIA泵配方:氢吗啡酮14 mg、氟比洛酚酯200 mg、帕洛诺司琼0.25 mg,加生理盐水至200 ml。PCIA泵背景输注速率为2 ml/h,按压剂量为4 ml,锁定时间为8 min。PCIA期间若受试者镇痛不充分(连续3次单次注射后NRS≥4分),则静脉注射氢吗啡酮0.2 mg补救镇痛,补救镇痛药物计入氢吗啡酮总消耗量中。术后如发生中重度恶心或呕吐,静脉注射帕洛诺司琼2.5 mg。
3. 观察指标:(1)主要指标:术后24、48 h内患者氢吗啡酮总消耗量。(2)次要指标:术后24 h内不良反应发生情况,包括嗜睡、呼吸抑制、瘙痒、恶心呕吐、精神障碍、睡眠障碍等。同时记录术后恢复的相关指标,包括手术时间、苏醒时间(停药至对外界言语刺激做出正确反应的时间)、气管导管拔除时间(停药至拔除气管导管的时间)、患者的PACU停留时间、术后首次进食时间和术后首次下床时间。
采用SPSS 20.0软件进行分析。正态分布的计量资料以表示,C组、ES1组、ES2组间各指标的比较采用单因素方差分析,多重比较采用LSD法。计数资料以百分率表示,组间比较采用χ²检验或Fisher确切概率法。双侧检验,检验水准α=0.05。
1. 一般资料比较:本研究共纳入75例患者,其中C组由于患者术后24 h关泵脱落1例,ES1组由于患者接受非计划二次手术脱落2例,ES2组由于患者肺水肿进入ICU观察脱落1例。最终纳入71例患者,其中C组24例,ES1组23例,ES2组24例。3组患者年龄、性别比例、身高、体重、ASA分级、手术时间、术中丙泊酚用量、瑞芬太尼用量、出血量和液体输入量比较差异均无统计学意义(均P>0.05),见表1。
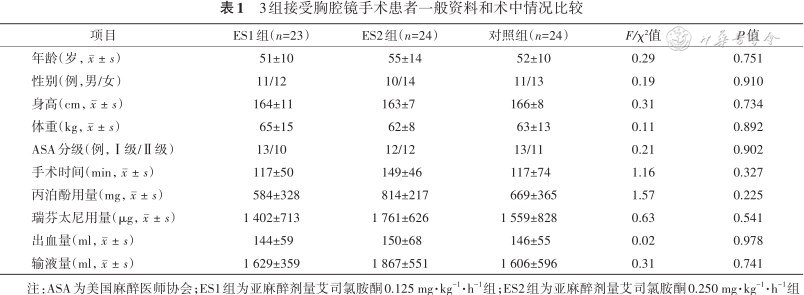
3组接受胸腔镜手术患者一般资料和术中情况比较
3组接受胸腔镜手术患者一般资料和术中情况比较
| 项目 | ES1组(n=23) | ES2组(n=24) | 对照组(n=24) | F/χ²值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁,) | 51±10 | 55±14 | 52±10 | 0.29 | 0.751 |
| 性别(例,男/女) | 11/12 | 10/14 | 11/13 | 0.19 | 0.910 |
| 身高(cm,) | 164±11 | 163±7 | 166±8 | 0.31 | 0.734 |
| 体重(kg,) | 65±15 | 62±8 | 63±13 | 0.11 | 0.892 |
| ASA分级(例,Ⅰ级/Ⅱ级) | 13/10 | 12/12 | 13/11 | 0.21 | 0.902 |
| 手术时间(min,) | 117±50 | 149±46 | 117±74 | 1.16 | 0.327 |
| 丙泊酚用量(mg,) | 584±328 | 814±217 | 669±365 | 1.57 | 0.225 |
| 瑞芬太尼用量(μg,) | 1 402±713 | 1 761±626 | 1 559±828 | 0.63 | 0.541 |
| 出血量(ml,) | 144±59 | 150±68 | 146±55 | 0.02 | 0.978 |
| 输液量(ml,) | 1 629±359 | 1 867±551 | 1 606±596 | 0.31 | 0.741 |
注:ASA为美国麻醉医师协会;ES1组为亚麻醉剂量艾司氯胺酮0.125 mg·kg-1·h-1组;ES2组为亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1组
2. 患者术后氢吗啡酮消耗量比较:与C组比较,ES2组患者术后24 h和48 h氢吗啡酮消耗量均减少(均P<0.05);ES1组和ES2组术后24 h和48 h氢吗啡酮消耗量比较差异均无统计学意义(均P>0.05),见表2。
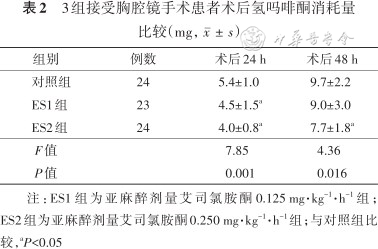
3组接受胸腔镜手术患者术后氢吗啡酮消耗量比较(mg,)
3组接受胸腔镜手术患者术后氢吗啡酮消耗量比较(mg,)
| 组别 | 例数 | 术后24 h | 术后48 h |
|---|---|---|---|
| 对照组 | 24 | 5.4±1.0 | 9.7±2.2 |
| ES1组 | 23 | 4.5±1.5a | 9.0±3.0 |
| ES2组 | 24 | 4.0±0.8a | 7.7±1.8a |
| F值 | 7.85 | 4.36 | |
| P值 | 0.001 | 0.016 |
注:ES1组为亚麻醉剂量艾司氯胺酮0.125 mg·kg-1·h-1组;ES2组为亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1组;与对照组比较,aP<0.05
3. 术后恢复指标比较:ES2组患者的气管拔管时间、PACU停留时间、术后镇痛治疗满意度NRS评分均优于C组和ES1组(均P<0.05);上述指标在ES1组和C组间差异无统计学意义(均P>0.05)。与C组相比,ES1组和ES2组术后首次进食时间均缩短(均P<0.05),该指标在ES1组和ES2组间差异无统计学意义(均P>0.05)。结果见表3。

3组接受胸腔镜手术患者术后恢复指标比较()
3组接受胸腔镜手术患者术后恢复指标比较()
| 项目 | ES1组(n=23) | ES2组(n=24) | 对照组(n=24) | F值 | P值 |
|---|---|---|---|---|---|
| 气管导管拔出时间(min) | 22±4 | 16±8a,b | 23±10 | 6.22 | 0.003 |
| PACU停留时间(min) | 69±11 | 58±12a,b | 70±12 | 8.11 | 0.001 |
| 术后NRS评分(分) | 6.5±1.6 | 7.5±1.5a,b | 6±1.7 | 5.01 | 0.009 |
| 术后首次进食时间(h) | 14±5a | 14±3a | 17±3 | 3.42 | 0.039 |
| 术后首次下床时间(h) | 19±7 | 17±4 | 20±4 | 1.88 | 0.160 |
注:PACU为麻醉复苏室;NRS为数字评分法;ES1组为亚麻醉剂量艾司氯胺酮0.125 mg·kg-1·h-1组;ES2组为亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1组;与对照组比较,aP<0.05;与ES1组比较,bP<0.05
4. 术后24 h不良事件比较:3组患者手术均顺利完成,围手术期不良反应均予对症处理,未发生严重并发症。3组患者术后24 h不良反应发生率比较差异无统计学意义(P>0.05),结果见表4。
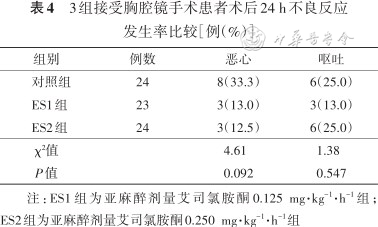
3组接受胸腔镜手术患者术后24 h不良反应发生率比较[例(%)]
3组接受胸腔镜手术患者术后24 h不良反应发生率比较[例(%)]
| 组别 | 例数 | 恶心 | 呕吐 |
|---|---|---|---|
| 对照组 | 24 | 8(33.3) | 6(25.0) |
| ES1组 | 23 | 3(13.0) | 3(13.0) |
| ES2组 | 24 | 3(12.5) | 6(25.0) |
| χ²值 | 4.61 | 1.38 | |
| P值 | 0.092 | 0.547 |
注:ES1组为亚麻醉剂量艾司氯胺酮0.125 mg·kg-1·h-1组;ES2组为亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1组
这项随机、双盲、对照研究评估了接受胸科手术的患者术中持续静脉输注亚麻醉剂量艾司氯胺酮对患者术后阿片类药物消耗量的影响。结果表明,与C组相比,术中持续输注0.250 mg·kg-1·h-1艾司氯胺酮的患者术后24、48 h氢吗啡酮消耗量明显减少。术后48 h内,ES1组有1例患者需要补救镇痛,ES2组和C组各有2例患者需要补救镇痛,差异均无统计学意义。
艾司氯胺酮在体内主要通过肝微粒体酶转化为去甲氯胺酮。去甲氯胺酮具有药理活性,其麻醉效力相当于艾司氯胺酮的1/5~1/3,但消除半衰期较长。这可解释艾司氯胺酮在患者麻醉苏醒后仍有一定的止痛效果这一事实[7, 8]。研究表明,切皮前静脉注射0.5 mg/kg艾司氯胺酮并持续输注400 μg·kg-1·min-1,可降低开胸术后48 h内的疼痛评分,并减少吗啡用量[9]。也有研究表明右旋氯胺酮复合舒芬太尼用于老年患者腹腔镜直肠癌根治术后镇痛可减少术后舒芬太尼用量[10]。在本研究中,ES2组患者术后24和48 h内氢吗啡酮的消耗量明显减少,这有益于减少术后阿片类药物应用产生的不良反应。
术后大量应用阿片类药物可引起痛觉过敏和对阿片类药物耐受。预防性和术后应用NMDA受体拮抗剂可以防止阿片类药物急性耐受[11]。本研究ES2组患者在停用艾司氯胺酮24和48 h后仍有明显的阿片类药物节约效应,这可能与NMDA受体的长期拮抗作用或最近提出的活性代谢物的镇痛作用有关[12]。阿片类药物的节约效应也可能是由于急性阿片类药物耐受和痛觉过敏的减弱所致[13, 14]。本研究中ES2组患者的术后阿片节约效应可能与上述机制都有关系,未来仍需要进行研究阐明。
本研究观察到ES2组患者的气管拔管时间和PACU停留时间与另外两组相比明显减少,各组患者术中应用的静脉麻醉药物丙泊酚和瑞芬太尼并未因泵注艾司氯胺酮而调整剂量,因为这两种药物都是经典的短效全凭静脉麻醉药,其时量相关半衰期很少因为持续静脉泵注而延长,这两种麻醉药物在3组患者之间不会导致患者苏醒时间有差异。有研究指出艾司氯胺酮能抑制阿片类药物所致的二氧化碳敏感性通气降低作用,增加患者二氧化碳敏感性通气而刺激呼吸[15],术中泵注了艾司氯胺酮的患者术后呼吸频率和潮气量恢复得更快更好,术后疼痛减轻,很少出现普通胸科手术后患者自主呼吸恢复,但潮气量较低,不耐管需要再次轻度镇静的现象。本研究显示,泵注0.250 mg·kg-1·h-1艾司氯胺酮的患者拔管时间和PACU停留时间缩短,使艾司氯胺酮所致的患者获益。ES1组和ES2组患者术后首次进食时间较C组明显缩短,这可能与这两组患者较小的氢吗啡酮消耗有关。
3组患者恶心、呕吐的发生率不因氢吗啡酮累积消耗量或术中应用艾司氯胺酮而产生较大差异,这可能是由于胸科手术患者并非术后恶心、呕吐高风险人群[16],也可能与本研究样本量较小,未发现阳性结果有关。
氯胺酮有类似精神分裂的不良反应[17]。与氯胺酮相似,艾司氯胺酮主要不良反应为精神症状[18]。本研究参考已有文献[6,19, 20],采用了两个亚麻醉剂量进行术中持续静脉输注。本研究虽然在术中仅采用了两个梯度剂量的艾司氯胺酮,但在ES2组仍有1例患者在术后24 h内产生幻觉,患者出现手抓幻视物体现象。因此还有必要继续研究更大、更长时间的手术术中是否适合应用艾司氯胺酮。
本研究的主要目的在于观察术中持续输注亚麻醉剂量艾司氯胺酮对患者术后氢吗啡酮消耗量有无节俭作用,样本量计算依据主要基于氢吗啡酮消耗量这一指标。而相关不良事件可能由于其本身发生率较低,致使本研究样本量对于不良事件等次要指标观察不够完善,这是本研究的局限性,所以后续仍需大样本的试验进行观察。
综上所述,胸科手术中持续静脉输注亚麻醉剂量艾司氯胺酮0.250 mg·kg-1·h-1可显著减少患者术后阿片类药物消耗量,促进患者转归。
所有作者均声明不存在利益冲突



























