
美国糖尿病协会(ADA)/欧洲糖尿病研究协会(EASD)的专家小组于2021年9月就成人1型糖尿病(T1DM)患者的管理发布了共识报告,即《成人1型糖尿病管理:ADA/EASD联合共识》。该《共识》提出了针对成年T1DM的诊断流程及管理途径、建议实施个体化的血糖管理并避免发生低血糖,同时强调了糖尿病自我管理教育与支持在T1DM管理中的重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1型糖尿病(type 1 diabetes mellitus,T1DM)是由自身免疫介导胰岛β细胞受损,导致严重内源性胰岛素缺乏的疾病,约占所有糖尿病患者的5%~10%。尽管T1DM的发病高峰在青春期和成年早期,但由于T1DM可以发生在任何年龄段,且成人基数大,成人T1DM患者例数反而高于儿童青少年[1]。在过去的100年中,胰岛素和血糖监测等新技术快速发展,极大地改善了T1DM患者的预后,但仍有许多T1DM患者血糖水平未达标。目前国际上对成人T1DM患者的管理仍缺乏综合性的指导建议。因此,美国糖尿病协会(American Diabetes Association,ADA)/欧洲糖尿病研究协会(European Association for the Study of Diabetes,EASD)的专家小组于2021年9月就成人T1DM患者的管理发布了共识报告,即《成人1型糖尿病管理:ADA/EASD联合共识》[2](以下简称《共识》)。《共识》基于新疗法和新技术的快速发展,对以下主题进行了讨论:成人T1DM的诊断、血糖监测及控制目标、管理途径、糖尿病自我教育和支持、胰岛素治疗、低血糖、其他行为治疗、社会心理治疗、胰腺和胰岛移植、辅助治疗以及特殊人群的糖尿病管理。笔者将对《共识》的相关内容进行解读,旨在为临床医师在成人T1DM的管理上提供综合性的指导建议。
《共识》认为成人T1DM的诊断存在一定的困难:一方面,由于患者可同时具有T1DM和2型糖尿病(type 2 diabetes mellitus,T2DM)的特征,难以用单一的临床特征对T1DM进行划分;另一方面,单基因糖尿病患者由于起病年龄低,易被误诊为T1DM。尽管缺乏公认的金标准,《共识》提出了针对成年T1DM的临床操作性强的诊断流程(图1),建议首先通过临床特征识别出疑诊成年T1DM患者,随后通过胰岛自身抗体、年龄、C肽水平等进一步确诊。
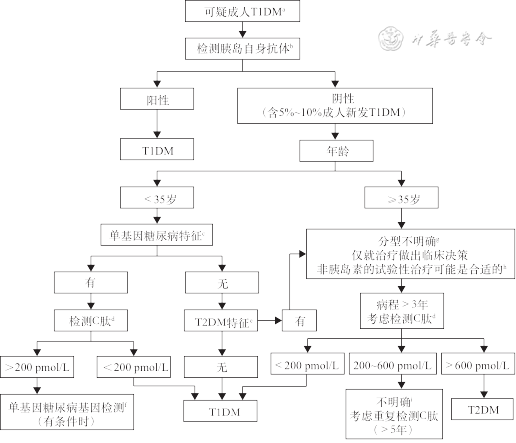

注:a为疑诊为T1DM患者的主要临床特征:(1)起病年龄<35 岁;(2)非肥胖体质指数(BMI)<25 kg/m2;(3)起病时伴有体重减轻;(4)起病时伴有糖尿病酮症酸中毒(DKA);(5)起病时血糖>20 mmol/L;b为首先检测GADA,若为阴性,再检测IA⁃2A和(或)ZnT8A,5%~10%的新发T1DM患者的胰岛自身抗体阴性;c为单基因糖尿病主要临床特征:(1)诊断时HbA1c<7.5%;(2)父母一方患糖尿病;(3)有特定单基因疾病的特征(如肾囊肿、部分脂肪营养不良、母亲遗传性耳聋、无肥胖时的严重胰岛素抵抗);(4)利用MODY Calculator评估患病风险>5%者;d为C肽检测:仅适用于接受胰岛素治疗的患者;餐后5 h内随机C肽伴血糖检测可代替标准刺激试验;C肽≥600 pmol/L或<80 pmol/L,结果可靠;C肽<600 pmol/L且血糖<4 mmol/L,考虑禁食原因,可重复检测;严重高血糖2周内不测C肽;e为T2DM主要临床特征:(1)超重或肥胖;(2)无体重减轻;(3)无酮症酸中毒;(4)高血糖不明显;f为如果基因检测不能确诊单基因糖尿病,则分类不明确,仅就治疗做出临床决策;g为老年人重点考虑T2DM诊断;某些情况下,可针对胰腺来源或其他类型糖尿病进一步检查;h为未接受胰岛素治疗的可疑T1DM患者,需予以严密的血糖监测和教育,以便在血糖恶化时迅速启动胰岛素;i为C肽介于200~600 pmol/L,多见于T1DM或MODY,也可见于胰岛素治疗的T2DM患者,尤其是正常或低BMI的患者、或长病程患者。T1DM为1型糖尿病;T2DM为2型糖尿病
1.疑诊为成年T1DM者:《共识》认为疑诊为成年T1DM患者主要临床特征包括:(1)起病年龄<35岁;(2)非肥胖,体质指数(body mess index,BMI)<25 kg/m2;(3)起病时伴有体重减轻;(4)起病时伴有糖尿病酮症酸中毒(DKA);(5)起病时血糖>20 mmol/L。其中起病年龄是诊断T1DM最重要的特征,多数研究将其划分值定为30岁以下或40岁以下[3, 4]。
2.胰岛自身抗体:《共识》强调在疑诊成年T1DM患者中进行胰岛自身抗体检测,首选谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA),若GADA阴性则进一步检测蛋白酪氨酸磷酸酶2抗体(protein tyrosine phosphatase 2 antibody,IA-2A)和(或)锌转运体8抗体(zinc transporter isoform 8 antibody,ZnT8A)。出现一种或多种胰岛自身抗体阳性的患者,可诊断为T1DM。但由于有5%~10%的新发T1DM患者的胰岛自身抗体阴性(特发性T1DM);此外,抗体可能会随着时间的推移而消失,胰岛自身抗体阴性并不能排除T1DM[5]。因此,胰岛自身抗体阴性患者仍需要进一步诊断。
3.年龄:若胰岛自身抗体阴性患者的起病年龄<35岁,且无T2DM特征和单基因糖尿病特征,则考虑T1DM诊断。其中T2DM特征主要体现为超重或肥胖;无体重减轻;无DKA;高血糖不显著。单基因糖尿病特征包括诊断时糖化血红蛋白(hemoglobin A1c,HbA1c)<7.5%;父母一方患糖尿病;有特定单基因疾病的特征。若胰岛自身抗体阴性患者年龄≥35岁,主要考虑T2DM诊断,也可以针对胰腺来源或其他类型糖尿病做进一步检查。
4.C肽:在通过以上方法仍不能明确T1DM诊断的患者中,建议行随机C肽检测。在具有单基因病特征的患者中,如随机C肽<200 pmol/L,考虑诊断为T1DM;若随机C肽>200 pmol/L,建议行基因检测予以确诊。在具有T2DM特征的患者中,建议首选非胰岛素的试验性治疗,同时严密监测血糖并做好糖尿病教育,以便血糖恶化时迅速启动胰岛素。若诊断糖尿病3年后,分型仍不明确,应考虑C肽检测;若C肽>600 pmol/L,提示T2DM诊断;若C肽<200 pmol/L,提示T1DM诊断;若C肽介于200~600 pmol/L,则考虑2年后重复C肽检测[6]。
《共识》中推荐的诊断流程建议在所有疑诊T1DM的患者中进行胰岛自身抗体检测,而仅在胰岛自身抗体阴性患者中分型不明确或具有单基因糖尿病特征的人群中进行随机C肽检测,体现了胰岛自身抗体对于T1DM诊断的重要价值。
糖尿病控制和并发症研究(Diabetes Control and Complication Trail,DCCT)和糖尿病干预和并发症流行病学研究(Epidemiology of Diabetes Interventions and Complications,EDIC)证实,采用强化胰岛素治疗,控制患者的血糖水平接近正常水平,对预防和延缓糖尿病并发症的发生发展具有重要意义[7]。目前监测血糖的技术主要包括毛细血管血糖监测(capillary blood glucose monitoring,BGM)、HbA1c监测和持续葡萄糖监测(continuous glucose monitoring,CGM)。T1DM患者每年应至少进行一次血糖评估;血糖未达标或者治疗方案改变的患者应每3个月进行一次血糖评估。结合目前新的治疗和血糖监测技术,共识提出了如下成人T1DM血糖控制目标(表1),同时强调应个体化设定血糖控制目标。

成年1型糖尿病患者血糖控制指标及目标值
成年1型糖尿病患者血糖控制指标及目标值
| 血糖监测技术 | 血糖指标 | 控制目标 |
|---|---|---|
| 毛细血管血糖监测 | 毛细血管血糖(餐前) | 4.4~7.2 mmol/L |
| 毛细血管血糖(餐后1~2 h) | <10.0 mmol/L | |
| 糖化血红蛋白监测 | 糖化血红蛋白 | <7.0% |
| 持续葡萄糖监测 | 葡萄糖管理指标 | <7.0% |
| 葡萄糖在目标范围(3.9~10.0 mmol/L)时间 | >70% | |
| 葡萄糖目标范围(<3.9 mmol/L或<3.0 mmol/L)时间 | <4% 或<1% | |
| 葡萄糖高于目标范围(>10.0 mmol/L或>13.9 mmol/L)时间 | <25% 或<5% | |
| 血糖变异度 | ≤36% |
在临床上较常用的血糖指标为BGM和HbA1c,分别反映了点血糖和近期2~3个月的血糖。HbA1c是评估糖尿病患者血糖控制水平的“金标准”,但其应用仍存在一定的局限性,例如不能反映血糖变异情况、每日低血糖或高血糖情况,且在个体化治疗中的指导作用有限。随着CGM设备的普及,葡萄糖管理指标(glucose management indicator,GMI)和葡萄糖在目标范围内时间(time in range,TIR)由于可以提供更近期的血糖水平以及较详细的血糖数据,逐渐成为临床血糖管理更为有用的指标。
TIR指24 h内葡萄糖在目标范围内(通常为3.9~10.0 mmol/L)的时间,它能更好地提供血糖变异、低血糖和高血糖信息,用来指导临床决策。我国贾伟平教授团队首次发现,通过CGM测定的TIR与T2DM患者的糖尿病视网膜病变(diabetic retinopathy,DR)患病率及严重程度呈负相关,且该相关性独立于HbA1c[8]。随后,Beck等[9]基于DCCT队列数据,进一步证实了TIR与T1DM患者的DR和微量白蛋白尿等微血管并发症密切相关。在未来,随着更多循证证据的出现,TIR或可超越HbA1c成为评估血糖控制水平及预测并发症风险的重要指标。
T1DM管理需遵循个体化原则,在选择尽可能模仿生理性胰岛素分泌的胰岛素替代治疗方案的基础上,予以定期的血糖监测和足够的教育和社会心理支持,使T1DM患者尽可能控制血糖达标,同时预防高血糖和低血糖的发生。《共识》针对既往确诊的成年T1DM患者制定了规范的总体管理途径,主要根据血糖达标情况,进行1型糖尿病自我管理教育,综合考虑心理健康因素,进行胰岛素治疗方案调整(图2)。
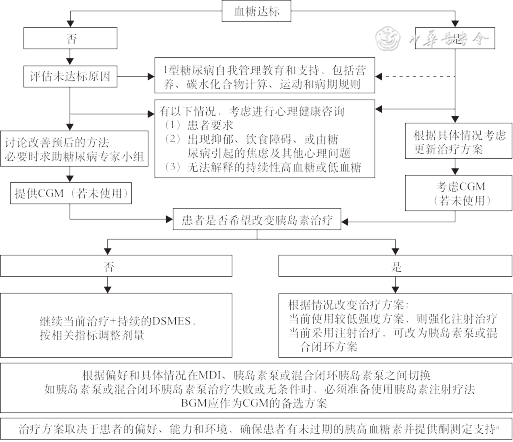

注:a为血酮和尿酮测量的选择因卫生保健系统而异;T1DM为1型糖尿病;BGM为毛细血管血糖监测;CGM为连续血糖监测;DSMES为糖尿病自我管理教育和支持;MDI为每日多次注射
《共识》特别重视DSMES对于T1DM的作用,其主要目的是为患者提供糖尿病自我护理所需的知识、技能和信心,帮助患者在减少糖尿病并发症发生的同时保证生活质量。DSMES包含提供信息和一对一建议、非正式的同伴小组学习及符合国家标准的结构化教育3个等级。其中结构化教育的级别最高,包括基于循证学的教育课程、标准化教学和定期审核。《共识》对DSMES涵盖的主题和进行DSMES的时机均进行了推荐。表2列出了DSMES需要涵盖的主题,如T1DM的病理生理、医疗技术和处理各种急慢性并发症等。实施DSMES的4个关键时刻包括:(1)诊断时;(2)每年和(或)未达到目标时;(3)合并复杂情况时;(4)生活和护理发生转变时[10]。

糖尿病自我教育和支持与T1DM相关的内容
糖尿病自我教育和支持与T1DM相关的内容
| 关键知识领域 | 与T1DM相关的内容 |
|---|---|
| 糖尿病病理生理和治疗方案 | β细胞破坏的免疫学机制 |
| 饮食 | 基础和高级碳水化合物计数 膳食构成对血糖的影响 优化推荐剂量 |
| 运动 | 对血糖和胰岛素推荐剂量的影响 |
| 药物 | 胰岛素种类及注射方式 |
| 监控和使用患者生成的健康数据 | 技术应用及加强医患沟通 回顾式CGM,胰岛素泵或胰岛素笔和APP联合应用 |
| 预防、检测和治疗急性并发症(包括低血糖、高血糖、DKA)及特殊情况下的糖尿病支持管理 | 血糖正常的DKA 胰岛素泵预防DKA的应用 胰高血糖素的应用 酮体测定 |
| 预防、检测和治疗慢性并发症 | T1DM并发症的个体风险及预防措施 如何预防未来并发症的发生发展 |
| 健康应对社会心理问题 | 探讨糖尿病困扰和倦怠 |
| 解决问题 | 设定目标 制定促进健康和行为改变的策略 发现和解决问题 发现和获取资源 病期规则 泵故障或泵渗漏的管理 手术计划 |
注:CGM为连续血糖监测;DKA为糖尿病酮症酸中毒;T1DM为1型糖尿病
糖尿病自我管理教育与支持对于减少急性和慢性并发症、改善患者生活质量具有重要意义。笔者所在医院代谢内分泌科建立了首个包括糖尿病专科医生、糖尿病教育护士、心理医生、营养师、运动康复师、儿科医生等多学科成员的结构化教育团队,并构建了国内首个T1DM的结构化教育课程—掌握我生活(type 1 diabetes education in lifestyle and self adjustment,TELSA)[11],建立了结构化教育的教材与团队和结构化教育的标准化流程,通过多学科结构化教育团队对T1DM患者的评估与管理,1年的随访显示,HbA1c的达标率由基线时的37.4%上升到58.1%,自我管理评分显著改善,患者生活质量显著提高。这反映了T1DM自我管理教育与支持的应用对于血糖达标率和生活质量的改善具有重要作用,值得进一步推广。
T1DM的胰岛素替代治疗方案旨在模拟胰岛素生理分泌模式,通过注射基础和餐时胰岛素使血糖保持在接近正常水平。随着胰岛素的更新迭代,胰岛素替代治疗方案众多且各有优劣(表3),《共识》中最被推荐的方案是每日多次注射(multiple daily injections,MDI)和胰岛素泵输注胰岛素类似物。有研究表明,最新的长效胰岛类似物(long-acting insulin analog,LAA)在降低低血糖风险方面优于一代LAA和中效胰岛素(neutral protamine hagedorn,NPH),且速效胰岛素类似物(rapid-acting insulin analog,RAA)在控制餐后高血糖和降低餐后低血糖风险方面优于常规/短效胰岛素[12, 13]。此外,超速效胰岛素类似物(ultra-rapid-acting insulin analog,URAA)的起效和达峰时间更早,有利于降低餐后高血糖,但没有证据表明其在降低HbA1c 或低血糖风险方面优于RAA。尽管胰岛素类似物优势显著,但较高的费用及部分患者对佩戴仪器和MDI的排斥限制了其应用,这部分患者也可选择常规和NPH胰岛素皮下注射,但需要承担更高的血糖变异及低血糖风险。
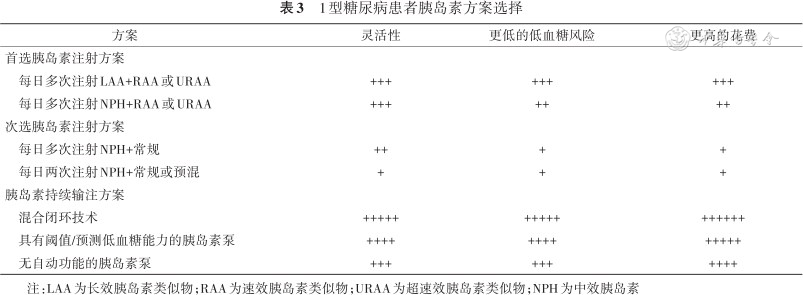
1型糖尿病患者胰岛素方案选择
1型糖尿病患者胰岛素方案选择
| 方案 | 灵活性 | 更低的低血糖风险 | 更高的花费 |
|---|---|---|---|
| 首选胰岛素注射方案 | |||
每日多次注射LAA+RAA或URAA | +++ | +++ | +++ |
每日多次注射NPH+RAA或URAA | +++ | ++ | ++ |
| 次选胰岛素注射方案 | |||
每日多次注射NPH+常规 | ++ | + | + |
每日两次注射NPH+常规或预混 | + | + | + |
| 胰岛素持续输注方案 | |||
混合闭环技术 | +++++ | +++++ | ++++++ |
具有阈值/预测低血糖能力的胰岛素泵 | ++++ | ++++ | +++++ |
无自动功能的胰岛素泵 | +++ | +++ | ++++ |
注:LAA为长效胰岛素类似物;RAA为速效胰岛素类似物;URAA为超速效胰岛素类似物;NPH为中效胰岛素
低血糖是T1DM血糖管理的主要限制因素,《共识》强调了减少低血糖事件在T1DM血糖管理中的重要性。研究表明,尽管严重低血糖(severe hypoglycemia,SH)对中年T1DM患者的认知功能无明显影响[14],但老年T1DM患者似乎更容易出现低血糖相关的轻度认知障碍,且SH与微血管并发症、非心血管事件及各种原因所致的死亡有关[15, 16]。即使胰岛素类似物和CGM在T1DM患者中的使用越来越广泛,低血糖事件的发生率仍居高不下。《共识》根据低血糖严重程度将其分为3个等级,并根据分级提出了相应的处理措施[15](表4),其中,预防2级和3级低血糖事件发生对改善患者预后尤为重要。

低血糖分级及内容
低血糖分级及内容
| 分级 | 定义 | 治疗 |
|---|---|---|
| 1级 | 血糖<3.9 mmol/L且≥3.0 mmol/L | 口服15 g葡萄糖或等量碳水化合物,每15 min重复1次直至低血糖症状改善 且血糖>3.9 mmol/L |
| 2级 | 血糖<3.0 mmol/L | 增加葡萄糖用量 |
| 3级 | 出现精神症状和(或)身体状态改变,需要进行 干预治疗 | 出现神经症状时,禁忌口服葡萄糖,应皮下、肌肉注射或经鼻腔予以胰高血糖素治疗,也可在医生的指导下静脉输注葡萄糖 急性症状缓解后,需进一步予以20 g长效碳水化合物服用,防止再发 |
《共识》指出,25%的T1DM患者处于低血糖意识受损(impaired awareness of hypoglycemia,IAH)状态,即患者识别低血糖水平的能力降低而不能及时作出调整,更容易发生低血糖。有研究表明,IAH患者发生SH的风险增加6倍[17],并可能导致患者通过故意不注射胰岛素或放松严格的血糖管理的方式,防止低血糖事件的发生。而反复低血糖是IAH的主要原因,又会使IAH状态进一步恶化,二者形成恶性循环。因此,临床医师在T1DM患者的管理过程中应及时识别患者是否存在IAH,应主动询问患者是否感到低血糖,以及在何种血糖水平下感到低血糖。《共识》提供了目前国际上较为常用的评估IAH的方法:Gold问卷、Clarke问卷、Pedersen Bjergaard问卷和HypoA-Q问卷。
低血糖事件并非不可预防,通过优化T1DM患者管理各环节可以有效降低低血糖事件发生风险,《共识》主要从DSMES、胰岛素治疗、血糖监测3个方面提供了策略。《共识》强调预防低血糖的关键措施是对患者进行结构化教育,如正常饮食的剂量调整(dose adjustment for normal eating,DAFNE)和血糖意识训练(blood glucose awareness training,BGAT),可以帮助患者更准确地识别血糖变化情况并及时自我进行胰岛素剂量调整[18, 19]。预防低血糖的第2种策略是优化胰岛素治疗方案,如选择胰岛素类似物方案或使用混合闭环系统。此外,选用CGM持续葡萄糖监测,有助于T1DM患者识别感觉不到的已存在或即将出现的低血糖水平,从而降低低血糖事件发生风险。
对于糖尿病治疗,国际上提倡实行“五驾马车”式的糖尿病综合管理方案,包括饮食、运动、药物治疗、血糖监测和糖尿病教育,五者相辅相成、缺一不可。T1DM患者要想长期维持血糖平稳,不仅需要终生依赖胰岛素治疗和血糖监测,饮食和运动等生活方式干预的作用也不容小觑。《共识》中进一步就营养、运动、吸烟、饮酒、睡眠、病期管理、驾驶、就业、旅行等方面进行了讨论,以期给T1DM患者日常生活提供指导。
1.营养:《共识》指出,T1DM患者应该接受注册营养师提供的个性化营养治疗,有效的医学营养治疗可以使患者HbA1c降低1.0%~1.9%。由于碳水化合物是影响餐后血糖的最主要因素,直接影响餐时胰岛素剂量,应在健康饮食模式的基础上结合碳水化合物计数、碳水化合物系数和血糖监测,调整餐时胰岛素剂量以改善血糖结局[20]。尽管蛋白质和脂肪对血糖的影响较小,但高蛋白或高脂肪可能导致延迟性高血糖,需要测量餐后3 h血糖指导调整胰岛素剂量。
2.运动:《共识》鼓励T1DM患者适度运动,定期运动不仅可以增加胰岛素敏感性,减少胰岛素剂量,还能降低微血管并发症、骨质疏松等风险。适度运动应在保障患者的安全下进行,《共识》建议在运动期间使用CGM系统监测血糖,根据血糖变化趋势及时调整胰岛素剂量和碳水化合物摄入,避免急性低血糖风险[21]。同时,患者应根据病情和并发症情况制定个性化的运动方案,如合并周围神经病变的患者,需避免负重运动,还需选择舒适的鞋袜,以降低溃疡发生的风险;而合并增殖性或严重非增殖性DR的患者存在玻璃体出血或视网膜脱离的风险,应禁止剧烈运动。
3.吸烟、饮酒和娱乐性药物使用:所有T1DM患者需戒烟限酒,吸烟会增加糖尿病大血管和微血管并发症的风险,过量饮酒会显著增加DKA和严重低血糖风险。然而以往在T1DM患者的血糖管理过程中,酒精的不良影响并未受到足够的重视,而且患者不会主动向临床医师报告酒精和药物使用情况,增加了这部分患者血糖管理难度。《共识》建议对T1DM患者是否过量饮酒和娱乐性药物使用情况进行系统筛查[22],告知患者酒精和娱乐性药物可能增加DKA和SH等风险并进行干预,以减少饮酒和娱乐性药物的使用。
4.睡眠:T1DM患者的睡眠可能因血糖监测、夜间高血糖和低血糖发作等事件而中断,伴有睡眠障碍。另外,睡眠障碍与血糖水平恶化有关[23]。因此,保持良好的睡眠对T1DM患者至关重要。
5.病期管理:T1DM患者在生病期间可能因为应激反应产生大量升糖激素,胰岛素相对不足,血糖水平会显著波动;也可能因为食欲降低或合并呕吐、腹泻出现低血糖,若处理不当,可能会引起DKA和严重低血糖,甚至危及生命。因此,患者病期应该在个性化的病期管理指导下,更频繁测量血糖,及时调整胰岛素方案。
6.驾驶和就业:尽管T1DM患者驾驶风险会因为可能出现的低血糖事件而增加,其急慢性并发症也会限制患者进入少部分行业的就业机会,但只要患者在驾驶前以及每隔2小时测一次血糖,就可以显著降低驾驶风险,目前已有一些国家在为支持T1DM患者安全从事各行业工作付诸行动。
7.旅行:有研究表明,高达10%的糖尿病患者在旅行中会出现低血糖等并发症。保障T1DM患者旅行安全的关键是提前做好准备,包括研究当地食物碳水化合物含量以及准备糖尿病相关应急物资。在旅行过程中建议T1DM患者频繁测量血糖,尤其跨时区旅行者会出现血糖波动,需要及时调整胰岛素方案。
糖尿病是一种公认的身心疾病,大量研究表明,社会心理因素在糖尿病的发生发展过程中起着重要作用,认知、情绪和社会因素是T1DM患者实现糖尿病自我管理和治疗成功的关键决定因素。
20%~40%的T1DM患者会经历糖尿病相关的情绪困扰,尤其是在两个“关键时刻”:诊断后和发生并发症时,主要源于对疾病的不可治愈的无助感、繁重的自我护理任务、对低血糖的恐惧、对其他并发症的焦虑以及来自社会及同伴的压力[24]。《共识》指出,这种长期、严重的情绪困扰与HbA1c升高和抑郁情绪有关。与普通人群相比,抑郁、焦虑及进食障碍在T1DM患者中更普遍,对其健康、糖尿病自我管理和治疗结果均产生负面影响。因此,《共识》建议对患者定期筛查和监测,及时发现患者可能出现的社会心理问题,国际健康结局评估联盟(the International Consortium for Health Outcome Measurement,ICHOM)提出了一套实用有效的社会心理测量标准,包括《世界卫生自主组织-5幸福指数》(WHO-5 Well-Being Index,WHO-5)、《糖尿病问题领域量表》(problem areas in diabetes,PAID)和《患者健康问卷》(patient health questionnaire,PHQ-9)。此外,《共识》推荐使用《广泛性焦虑障碍量表-7》(the Generalized Anxiety Disorder 7-item,GAD-7)筛查广泛性焦虑,《低血糖恐惧调查》(the Hypoglycemia Fear Survey,HFS)帮助评估患者对低血糖的担心程度,《糖尿病饮食问题调查(修订版)》(the Diabetes eating problems survey revised,DEPS-R)或《进食障碍量表-3风险综合表》筛查进食障碍。
《共识》强调,根据上述社会心理问题筛查结果,糖尿病护理团队应该进一步为T1DM患者提供相应级别的社会心理支持,包括非专业心理支持、专业心理治疗以及精神治疗和精神药物治疗3个等级。大部分患者不需要专业心理治疗,主要通过自助或由家人、同伴和社区等提供支持;25%的患者需要一定程度的专业心理治疗,包括行为疗法、正念疗法与人际关系疗法等,同时需要通过社会工作者和(或)社区组织获得社会支持;仅有5%的患者需要接受精神治疗和精神药物治疗[25]。
胰腺移植和胰岛移植是目前临床上唯一的β细胞替代方法,《共识》建议有手术适应症的患者,需要权衡手术风险、代谢需要以及考虑患者个人偏好,选择最佳的手术方案。受移植排斥反应的限制,目前胰腺移植和胰岛移植主要应用于晚期T1DM合并终末期肾病患者和出现难以控制的特殊情况者。
尽管胰岛素治疗对T1DM患者至关重要,但胰岛素单药治疗并非完美无缺。有研究表明,单靠胰岛素治疗的T1DM患者很难达到血糖目标,还增加了低血糖风险。另外,胰岛素治疗与不良的体重增加、胰岛素抵抗恶化和心血管疾病风险增加有关,其他病理生理异常也不能得到改善,而辅助治疗则有助于解决上述问题。《共识》中列出了几种目前已被批准用于辅助治疗的药物,如二甲双胍、普兰林肽、胰高血糖素样肽-1受体激动剂(glucagon-like peptide 1 receptor agonists,GLP-1 RA)、钠-葡萄糖协同转运蛋白2抑制剂(Sodium-glucose cotransporter inhibitors,SGLT-2抑制剂),但其有效性的证据仍有限,应该在优化胰岛素治疗方案的基础上,再针对患者情况考虑应用相应的辅助治疗(表5)。

用于T1DM辅助治疗的药物比较
用于T1DM辅助治疗的药物比较
| 项目 | 二甲双胍 | 普兰林肽 | GLP-1 RA | SGLT-2抑制剂 |
|---|---|---|---|---|
| HbA1c降低 | <0.1% | 0.3%~0.4% | 0.2%~0.4% | 0.2%~0.4% |
| 空腹血糖 | 影响极小 | 无影响 | 影响极小 | 适度降低 |
| 餐后血糖 | 影响极小 | 显著降低 | 适度降低 | 适度降低 |
| TIR | 无数据 | 无数据 | 无数据 | 增加~12%(高剂量) |
| 胰岛素剂量 | 无变化 | 餐时减少 | 餐时显著减少 | 餐时和基础均减(~10%) |
| 体重 | 适度(≤1 kg) | 适度(≤1 kg) | 明显(≤5 kg) | 适度(2~3 kg) |
| 收缩压 | 无变化 | 无变化 | 降低4 mmHg(伴心率增加) | 降低3~4 mmHg |
| 低血糖 | 发生风险低 | 低血糖风险增加 | 低血糖风险增加 | 发生风险低 |
| 不良反应 | 胃肠道反应 | 胃肠道反应 | 胃肠道反应 酮症风险增加 | 生殖器霉菌感染 DKA风险增加 |
| 欧盟/美国对T1DM的审批 | 未批准 | 美国批准 | 未批准 | 欧盟批准低剂量用(BMI≥27 kg/m2) |
| 可能受益人群 | 患多囊卵巢综合征的女性 | 无特殊人群 | 超重、肥胖人群 高剂量胰岛素治疗人群 心血管和肾病风险高的人群 | 心血管和肾病风险高的人群 |
注:T1DM为1型糖尿病;HbA1c为糖化血红蛋白;TIR为葡萄糖在目标范围内时间;GLP-1 RA为胰高糖素样肽-1受体激动剂;SGLT-2抑制剂为钠—葡萄糖协同转运蛋白2抑制剂;DKA为糖尿病酮症酸中毒;BMI为体质指数;1 mmHg=0.133 kPa
《共识》还针对特殊人群包括孕妇、老人、合并晚期并发症的T1DM患者的血糖管理提供了个性化的建议,主要集中在避免发生低血糖的前提下进行血糖监测与管理。
细胞替代治疗和免疫治疗是治疗T1DM极具潜力的新疗法。胰岛或胰腺移植是目前临床上唯一的β细胞替代治疗方法,但其应用受到胰腺或胰岛供体不足和移植后免疫排斥的限制。因此,部分研究团队开展异种移植和干细胞移植及保护移植器官和干细胞免受免疫攻击的研究,以期解决供体不足的问题[26]。关于免疫治疗,目前的临床试验旨在评估免疫治疗在预防T1DM发生及在T1DM发生后早期保存β细胞功能的潜力,其中CD3单抗、抗胸腺球蛋白和抗肿瘤坏死因子(TNF)药物如戈利木单抗在T1DM防治和保存β细胞功能中可能具有应用前景。
综上,《共识》从成人T1DM的诊断、血糖监测及控制目标、DSMES、胰岛素治疗、低血糖、其他行为考虑、社会心理治疗、胰腺和胰岛移植、辅助治疗、管理途径及特殊人群的糖尿病管理等方面进行了阐述,为临床医师在成年T1DM管理上提供了综合性指导建议,更好地帮助T1DM患者控制血糖、改善预后。
所有作者均声明不存在利益冲突



























