
建立联合多个实验室血液学指标诊断甲胎蛋白(AFP)阴性肝细胞癌(AFP-NHCC)的模型,探讨其临床诊断效能。
纳入2011年12月到2017年6月在解放军总医院首次确诊为AFP-NHCC的住院患者124例,男110例,女14例,年龄[M(Q1,Q3)]为57(51,66)岁;以同期331例非癌人群作为对照组,男279例,女52例,年龄为58(51,63)岁,包括47例乙型肝炎、40例肝硬化、64例肝血管瘤或囊肿、7例肝结节、8例脂肪肝、146例非肝病患者以及19名健康体检者。将AFP-NHCC组和对照组人群分为训练组与验证组:训练组共纳入196例受试者,包括103例AFP-NHCC患者和93例非癌人群(包括19名健康体检者、25例乙型肝炎患者、22例肝硬化患者、23例肝血管瘤和囊肿患者以及4例肝结节患者),用来分析实验室指标的差异和建立不同AFP水平下AFP-NHCC的诊断模型;验证组共纳入259例受试者,其中包括113例肝病患者,用来验证诊断模型对AFP-NHCC的诊断效能。采用受试者工作特征(ROC)曲线对不同模型的诊断效能进行灵敏度及特异度分析,采用曲线下面积(AUC)评估不同模型的诊断效能。
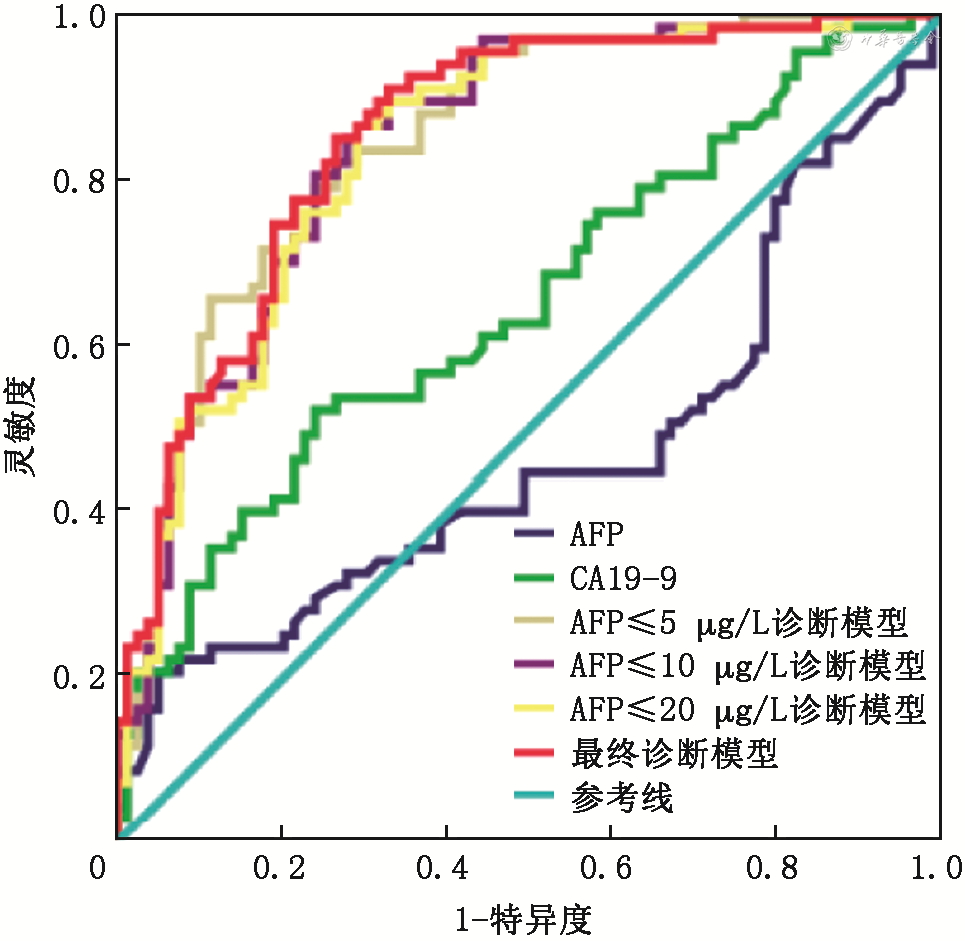
在训练组中,AFP≤5 μg/L时所建立的AFP-NHCC诊断模型包括血小板(PLT)、凝血酶原活动度(PTA)、血清白蛋白(ALB)、凝血酶原时间(PT)和糖类抗原19-9(CA19-9),AUC为0.848(95%CI:0.786~0.911);AFP≤10 μg/L时所建立的AFP-NHCC诊断模型包括PLT、PTA、ALB、PT和红细胞压积(HCT),AUC为0.839(95%CI:0.780~0.897);AFP≤20 μg/L时所建立的AFP-NHCC诊断模型包括PLT、PTA、ALB、PT、HCT和AFP,AUC为0.866(95%CI:0.815~0.917);这3种模型的AUC值均高于AFP和CA19-9单项诊断AFP-NHCC时的AUC值[0.634(95%CI:0.560~0.709)、0.691(95%CI:0.620~0.761),均P<0.05]。将这3种模型筛选出的指标联合,建立最终诊断模型,包括PLT、PTA、ALB、PT、HCT、CA19-9和 AFP,其AUC为0.873(95%CI:0.824~0.923),灵敏度为78.6%(81/103),特异度为81.7%(76/93)。在验证组中,最终诊断模型在肝病患者中的预测AUC为0.892(95%CI:0.832~0.951),灵敏度为100%(21/21),特异度为71.7%(66/92);在全部验证人群中的预测AUC为0.931(95%CI:0.890~0.972),灵敏度为100.0%(21/21),特异度为75.6%(180/238)。
建立的最终诊断模型包括PLT、PTA、ALB、PT、HCT、CA19-9和AFP,其灵敏度和特异度均较高,对于临床诊断AFP-NHCC具有较好的诊断效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
早期筛查肝细胞癌(hepatocellular carcinoma,HCC)对于提升患者的治疗疗效和改善生存率起关键作用[1]。甲胎蛋白(alpha-fetoprotein,AFP)是经过验证并在临床广泛应用于肝癌监测的血液生物学标志物,其诊断特异度达76%~96%,但敏感度较低,只有40%~65%[2]。部分肝癌患者的AFP处于低水平,被称为AFP阴性肝细胞癌(AFP-negative hepatocellular carcinoma,AFP-NHCC),这部分患者通常属于小肝癌,主要依靠影像学和病理学确诊。超声的筛查效果易受操作者的技术和被检者的个体状态影响,尤其在肥胖人群和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)患者中检测结果受较大影响[3];CT与超声相比,并没有显著改善早期检测率;MRI在肝癌早期检测中具有很高的灵敏度和特异度,但和超声相比,费用昂贵且耗时[4]。因此,寻找一种早期诊断AFP-NHCC的可靠、有效且经济的检测方法很有必要。在对肝癌的以往研究中,存在多种实验室指标的改变,如血细胞变化[5]、凝血功能障碍[6]、血清酶类异常[7]等。近年来,使用实验室数据建立临床疾病的诊断模型具有明显的低成本、微创等优势[8, 9, 10, 11]。因此,本研究旨在分析AFP-NHCC患者的部分临床特征与实验室血液学指标的关系,建立基于实验室血液学指标的诊断模型,并进行验证,为AFP-NHCC的早期筛查提供新的思路。
1. AFP-NHCC组:本研究经解放军总医院伦理委员会审核通过(伦理第S2021-182-02号)。纳入2011年12月到2017年6月解放军总医院第一医学中心首次确诊为AFP-NHCC的住院患者124例,其中男110例,女14例,年龄为57(51,66)岁;(1)纳入标准:经过两种或以上影像学检查(超声、CT或MRI)或术后病理组织检查首次确诊为原发性HCC,且为乙型肝炎病毒感染者;AFP<20 μg/L。(2)排除标准:经过手术、放疗、化疗等治疗,以及合并其他病理类型的HCC患者;除乙型肝炎病毒以外的其他病毒感染或合并感染;转移癌;复发癌。
2.对照组:以同期331例非癌人群作为对照组,其中男279例,女52例,年龄为58(51,63)岁;包括47例乙型肝炎、40例肝硬化、64例肝血管瘤或囊肿、7例肝结节、8例脂肪肝、146例非肝病患者以及19名健康体检者。其他肝病患者经过临床表现、影像学检查和血清学检查确诊;健康体检者为同一时期随机抽取的检查指标均正常的体检者。
3.训练组与验证组:将AFP-NHCC组和对照组人群分为训练组与验证组。(1)训练组:共纳入196例受试者,包括103例AFP-NHCC患者和93例非癌人群(包括19名健康体检者、25例乙型肝炎患者、22例肝硬化患者、23例肝血管瘤和囊肿患者以及4例肝结节患者),用来分析实验室指标和建立AFP-NHCC的诊断模型。(2)验证组:共纳入259例受试者,分为两种验证方式:一种是在113例肝病患者中进行验证,包括21例AFP-NHCC患者、22例乙型肝炎患者、18例肝硬化患者、41例肝血管瘤或囊肿患者、3例肝结节患者以及8例脂肪肝患者;另一种是在肝病基础上加入非肝病人群共259例受试者中进行验证;用来验证新模型对AFP-NHCC的诊断效能。
1.资料收集:收集所有受试者一般资料、相关实验室检测指标数据、HCC病理报告及影像学初诊报告等。
2.实验室检测指标:血常规[白细胞计数(white blood cell count,WBC)、红细胞计数(red blood cell count,RBC)、血小板计数(platelet count,PLT)、血红蛋白(hemoglobin,Hb)、中性粒细胞百分比、淋巴细胞百分比、单核细胞百分比、平均红细胞体积(mean corpuscular volume,MCV)、平均血红蛋白量(mean corpuscular hemoglobin,MCH)、平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、红细胞分布宽度(red blood cell distribution width,RDW)、平均血小板体积(mean platelet volume,MPV)、红细胞压积(hematocrit,HCT)]、肝脏生化检查[丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、血清白蛋白(albumin,ALB)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转移酶(γ-glutamyl transpeptidase,GGT)]、凝血检查[纤维蛋白原(fibrinogen,Fib)、凝血酶原时间(prothrombin time,PT)、凝血酶原活动度(prothrombin activity,PTA)、国际标准化比值(international standardized ratio,INR)、D-二聚体(D-Dimer)、凝血酶时间(thrombin time,TT)]、肿瘤标志物筛查[癌胚抗原(carcinoembryonic antigen,CEA)、AFP、糖类抗原125(carbohydrate antigen 125,CA125)、CA19-9、CA15-3]。
3.诊断模型的建立:建立单个检测指标AFP、CA19-9以及不同AFP水平下不同指标联合的AFP-NHCC诊断模型,并进行诊断效能评估。
4.诊断模型的验证:分为两种验证方式:一种是在113例肝病患者中进行验证,另一种是在肝病基础上加入非肝病人群共259例受试者中进行验证。
应用SPSS 22.0软件进行统计学分析。偏态分布数据用M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料采用频数及百分比表示,组间比较采用χ²检验。采用Spearman相关分析方法对临床指标与肿瘤特征的相关性进行分析。采用logistic 回归分析进行建模,筛选变量采用条件参数估计似然比检验。采用受试者工作特征(receiver operating characteristic curve,ROC)曲线对不同模型的诊断效能进行灵敏度及特异度分析,采用曲线下面积(area under the curve,AUC)评估不同模型的诊断效能。双侧检验,检验水准α=0.05。
训练组包括103例AFP-NHCC患者(男92例,女11例)和93例非肝癌人群(男83例,女10例)。非肝癌组年龄为56(52,60)岁,AFP-NHCC组年龄为58(52,65)岁,差异有统计学意义(Z=-1.97,P=0.049)。两组间性别差异无统计学意义(χ²<0.001,P=0.987)。两组实验室指标比较结果见表1。AFP-NHCC组的AFP、单核细胞百分比、MCV、MCH、RDW、MPV、ALT、AST、ALP、GGT和CA19-9水平均高于非肝癌组(均P<0.05),而PLT、PTA 和ALB 则低于非肝癌组(均P<0.05);此外,WBC、中性粒细胞百分比、淋巴细胞百分比、RBC、Hb、HCT、MCHC、Fib、PT、INR、D-Dimer、TT、CEA、CA125和 CA15-3在两组间差异均无统计学意义(均P>0.05)。
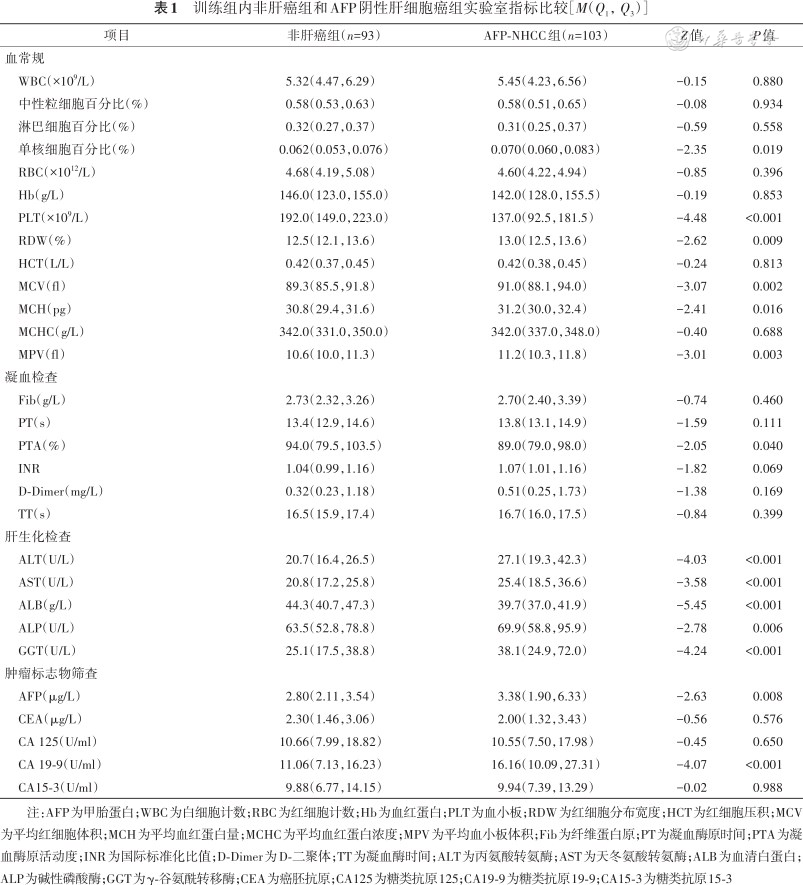
训练组内非肝癌组和AFP阴性肝细胞癌组实验室指标比较[M(Q1,Q3)]
训练组内非肝癌组和AFP阴性肝细胞癌组实验室指标比较[M(Q1,Q3)]
| 项目 | 非肝癌组(n=93) | AFP-NHCC组(n=103) | Z值 | P值 |
|---|---|---|---|---|
| 血常规 | ||||
WBC(×109/L) | 5.32(4.47,6.29) | 5.45(4.23,6.56) | -0.15 | 0.880 |
中性粒细胞百分比(%) | 0.58(0.53,0.63) | 0.58(0.51,0.65) | -0.08 | 0.934 |
淋巴细胞百分比(%) | 0.32(0.27,0.37) | 0.31(0.25,0.37) | -0.59 | 0.558 |
单核细胞百分比(%) | 0.062(0.053,0.076) | 0.070(0.060,0.083) | -2.35 | 0.019 |
RBC(×1012/L) | 4.68(4.19,5.08) | 4.60(4.22,4.94) | -0.85 | 0.396 |
Hb(g/L) | 146.0(123.0,155.0) | 142.0(128.0,155.5) | -0.19 | 0.853 |
PLT(×109/L) | 192.0(149.0,223.0) | 137.0(92.5,181.5) | -4.48 | <0.001 |
RDW(%) | 12.5(12.1,13.6) | 13.0(12.5,13.6) | -2.62 | 0.009 |
HCT(L/L) | 0.42(0.37,0.45) | 0.42(0.38,0.45) | -0.24 | 0.813 |
MCV(fl) | 89.3(85.5,91.8) | 91.0(88.1,94.0) | -3.07 | 0.002 |
MCH(pg) | 30.8(29.4,31.6) | 31.2(30.0,32.4) | -2.41 | 0.016 |
MCHC(g/L) | 342.0(331.0,350.0) | 342.0(337.0,348.0) | -0.40 | 0.688 |
MPV(fl) | 10.6(10.0,11.3) | 11.2(10.3,11.8) | -3.01 | 0.003 |
| 凝血检查 | ||||
Fib(g/L) | 2.73(2.32,3.26) | 2.70(2.40,3.39) | -0.74 | 0.460 |
PT(s) | 13.4(12.9,14.6) | 13.8(13.1,14.9) | -1.59 | 0.111 |
PTA(%) | 94.0(79.5,103.5) | 89.0(79.0,98.0) | -2.05 | 0.040 |
INR | 1.04(0.99,1.16) | 1.07(1.01,1.16) | -1.82 | 0.069 |
D-Dimer(mg/L) | 0.32(0.23,1.18) | 0.51(0.25,1.73) | -1.38 | 0.169 |
TT(s) | 16.5(15.9,17.4) | 16.7(16.0,17.5) | -0.84 | 0.399 |
| 肝生化检查 | ||||
ALT(U/L) | 20.7(16.4,26.5) | 27.1(19.3,42.3) | -4.03 | <0.001 |
AST(U/L) | 20.8(17.2,25.8) | 25.4(18.5,36.6) | -3.58 | <0.001 |
ALB(g/L) | 44.3(40.7,47.3) | 39.7(37.0,41.9) | -5.45 | <0.001 |
ALP(U/L) | 63.5(52.8,78.8) | 69.9(58.8,95.9) | -2.78 | 0.006 |
GGT(U/L) | 25.1(17.5,38.8) | 38.1(24.9,72.0) | -4.24 | <0.001 |
| 肿瘤标志物筛查 | ||||
AFP(μg/L) | 2.80(2.11,3.54) | 3.38(1.90,6.33) | -2.63 | 0.008 |
CEA(μg/L) | 2.30(1.46,3.06) | 2.00(1.32,3.43) | -0.56 | 0.576 |
CA 125(U/ml) | 10.66(7.99,18.82) | 10.55(7.50,17.98) | -0.45 | 0.650 |
CA 19-9(U/ml) | 11.06(7.13,16.23) | 16.16(10.09,27.31) | -4.07 | <0.001 |
CA15-3(U/ml) | 9.88(6.77,14.15) | 9.94(7.39,13.29) | -0.02 | 0.988 |
注:AFP为甲胎蛋白;WBC为白细胞计数;RBC为红细胞计数;Hb为血红蛋白;PLT为血小板;RDW为红细胞分布宽度;HCT为红细胞压积;MCV为平均红细胞体积;MCH为平均血红蛋白量;MCHC为平均血红蛋白浓度;MPV为平均血小板体积;Fib为纤维蛋白原;PT为凝血酶原时间;PTA为凝血酶原活动度;INR为国际标准化比值;D-Dimer为D-二聚体;TT为凝血酶时间;ALT为丙氨酸转氨酶;AST为天冬氨酸转氨酶;ALB为血清白蛋白;ALP为碱性磷酸酶;GGT为γ-谷氨酰转移酶;CEA为癌胚抗原;CA125为糖类抗原125;CA19-9为糖类抗原19-9;CA15-3为糖类抗原15-3
1. AFP-NHCC肿瘤直径与各指标的相关性:与肿瘤直径具有相对较高正相关的指标有Fib(r=0.445,P<0.001)、ALP(r=0.440,P<0.001)和GGT(r=0.361,P=0.001);另外,RDW(r=0.310,P=0.002)、AST(r=0.306,P=0.003)和CA125(r=0.301,P=0.010)与AFP-NHCC呈较弱的正相关。WBC(r=0.249,P=0.016)、中性粒细胞百分比(r=0.234,P=0.023)、淋巴细胞百分比(r=-0.271,P=0.008)、PLT(r=0.227,P=0.028)、MCHC(r=-0.263,P=0.011)和ALT(r=0.257,P=0.013)与AFP-NHCC虽然有相关性,但线性r值较低。
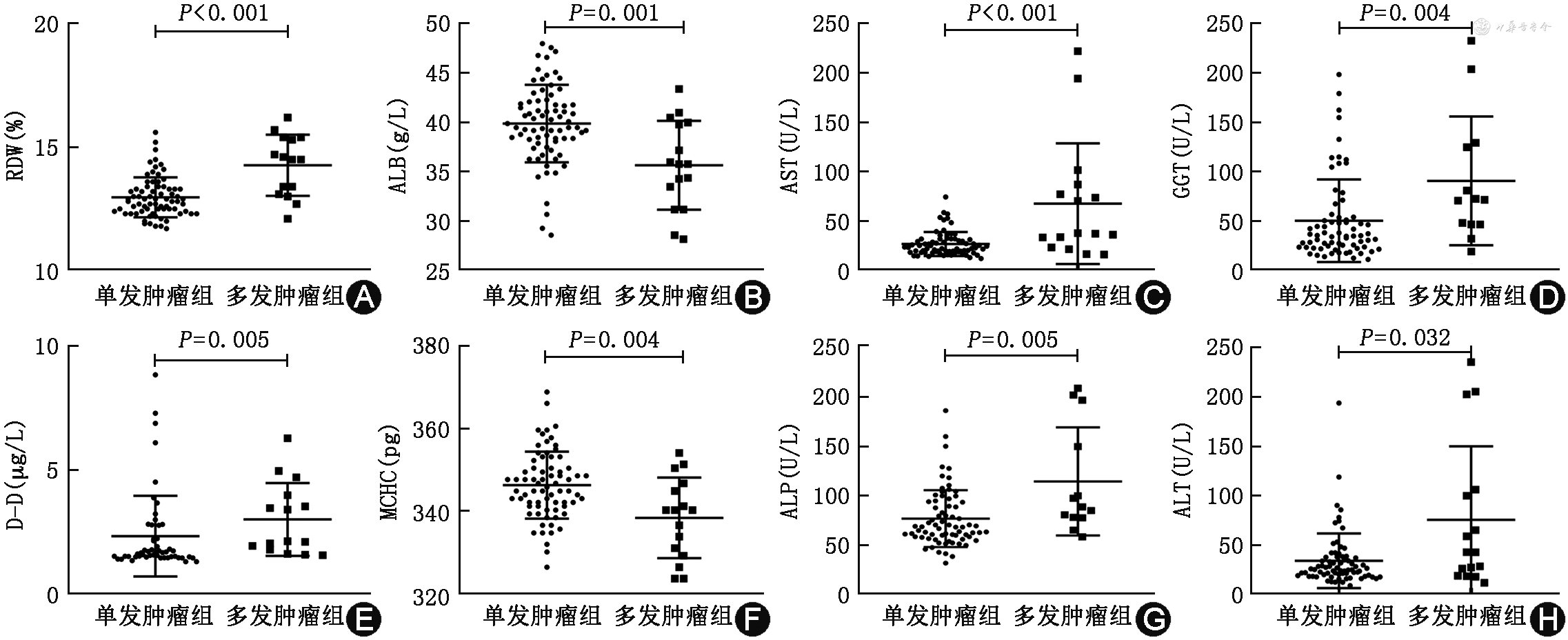
2. 单发与多发肿瘤患者各检测指标水平的比较:与单发肿瘤患者相比,多发肿瘤患者的RDW、D-Dimer、ALT、AST、ALP和GGT表达升高,而MCHC和ALB表达下降(均P<0.05,图1)。

1.单个检测指标AFP、CA19-9的诊断效能评估:绘制ROC曲线,分析AFP和CA19-9对于训练组中AFP-NHCC的诊断效率,如图2所示,AFP的AUC为0.634(95%CI:0.560~0.709),最大约登指数为0.33,灵敏度为47.6%(49/103),特异度为85.4%(79/93);CA19-9的AUC为0.691(95%CI:0.620~0.761),最大约登指数为0.292,灵敏度为57.3%(59/103),特异度为71.9%(67/93)。

注:PLT为血小板;PTA为凝血酶原活动度;ALB为白蛋白;PT为凝血酶原时间;HCT为红细胞压积
2.不同AFP水平下AFP-NHCC诊断模型的建立及诊断效能评估:本研究将所有指标纳入分析,采用条件参数估计似然比检验筛选变量进行建模。如表2所示,以不同水平AFP作为分层依据分别进行建模后,筛选出的指标略有不同。当AFP取值≤5 μg/L时,PLT、PTA、ALB、PT和CA19-9被纳入方程中,其AUC为0.848(95%CI:0.786~0.911),特异度和灵敏度分别为78.5%(63/80)、77.6%(53/68);当AFP取值≤10 μg/L时,PLT、PTA、ALB、PT和HCT被纳入方程中,其AUC为0.839(95%CI:0.780~0.897),特异度和灵敏度分别为72.7%(65/89)、83.7%(78/93);当AFP取值≤20 μg/L时,PLT、PTA、ALB、PT、HCT和AFP被纳入方程中,其AUC为0.866(95%CI:0.815~0.917),特异度和灵敏度分别为70.5%(66/93)、89.2%(92/103)。不同AFP水平下建立的各个模型的ROC曲线如图2所示。
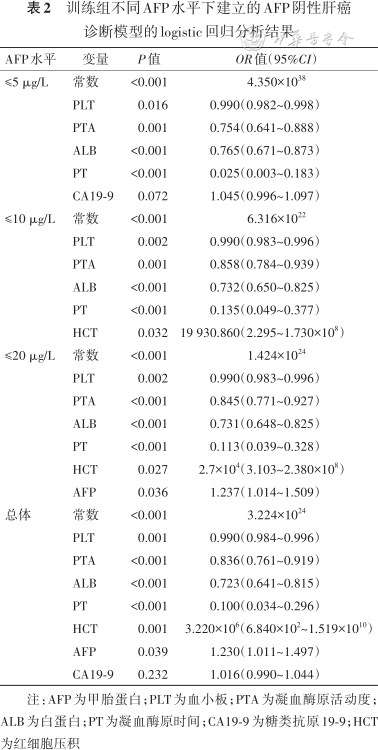
训练组不同AFP水平下建立的AFP阴性肝癌诊断模型的logistic回归分析结果
训练组不同AFP水平下建立的AFP阴性肝癌诊断模型的logistic回归分析结果
| AFP水平 | 变量 | P值 | OR值(95%CI) |
|---|---|---|---|
| ≤5 μg/L | 常数 | <0.001 | 4.350×1038 |
| PLT | 0.016 | 0.990(0.982~0.998) | |
| PTA | 0.001 | 0.754(0.641~0.888) | |
| ALB | <0.001 | 0.765(0.671~0.873) | |
| PT | <0.001 | 0.025(0.003~0.183) | |
| CA19-9 | 0.072 | 1.045(0.996~1.097) | |
| ≤10 μg/L | 常数 | <0.001 | 6.316×1022 |
| PLT | 0.002 | 0.990(0.983~0.996) | |
| PTA | 0.001 | 0.858(0.784~0.939) | |
| ALB | <0.001 | 0.732(0.650~0.825) | |
| PT | <0.001 | 0.135(0.049~0.377) | |
| HCT | 0.032 | 19 930.860(2.295~1.730×108) | |
| ≤20 μg/L | 常数 | <0.001 | 1.424×1024 |
| PLT | 0.002 | 0.990(0.983~0.996) | |
| PTA | <0.001 | 0.845(0.771~0.927) | |
| ALB | <0.001 | 0.731(0.648~0.825) | |
| PT | <0.001 | 0.113(0.039~0.328) | |
| HCT | 0.027 | 2.7×104(3.103~2.380×108) | |
| AFP | 0.036 | 1.237(1.014~1.509) | |
| 总体 | 常数 | <0.001 | 3.224×1024 |
| PLT | 0.001 | 0.990(0.984~0.996) | |
| PTA | <0.001 | 0.836(0.761~0.919) | |
| ALB | <0.001 | 0.723(0.641~0.815) | |
| PT | <0.001 | 0.100(0.034~0.296) | |
| HCT | 0.001 | 3.220×106(6.840×102~1.519×1010) | |
| AFP | 0.039 | 1.230(1.011~1.497) | |
| CA19-9 | 0.232 | 1.016(0.990~1.044) |
注:AFP为甲胎蛋白;PLT为血小板;PTA为凝血酶原活动度;ALB为白蛋白;PT为凝血酶原时间;CA19-9为糖类抗原19-9;HCT为红细胞压积
3.AFP-NHCC最终诊断模型的建立及诊断效能评估:从上述几个纳入指标可以看出,当AFP的值>10 μg/L后,AFP被纳入模型中,为了保证最终的模型在不同AFP水平下有更好的诊断效率,本研究将以上不同AFP水平下的建模指标进行合并,重新构建方程,并得到新的ROC曲线。即当PLT、PTA、ALB、PT、HCT、AFP和CA19-9均被纳入后得到的新模型为最终待验证模型,其AUC为0.873(95%CI:0.824~0.923),特异度为81.7%(76/93),灵敏度为78.6%(81/103)(图2)。
用PLT、PTA、ALB、PT、HCT、AFP和CA19-9这7个指标建立的最终模型对259例验证人群数据进行AFP-NHCC的预测。本研究采用了两种预测方式,一种是对肝部疾病组(包括21例AFP-NHCC、22例乙型肝炎、18例肝硬化、41例肝血管瘤或囊肿、3例肝结节以及8例脂肪肝)共计113例进行预测分析;另一种是在肝病基础上加入非肝病人群146例共同组成非肝癌组(259例)进行预测分析。
1.最终模型在肝部疾病中预测AFP-NHCC的诊断效能:AUC为0.892(95%CI:0.832~0.951)(图3A),约登指数为0.717,灵敏度为100%(21/21),特异度为71.7%(66/92)。
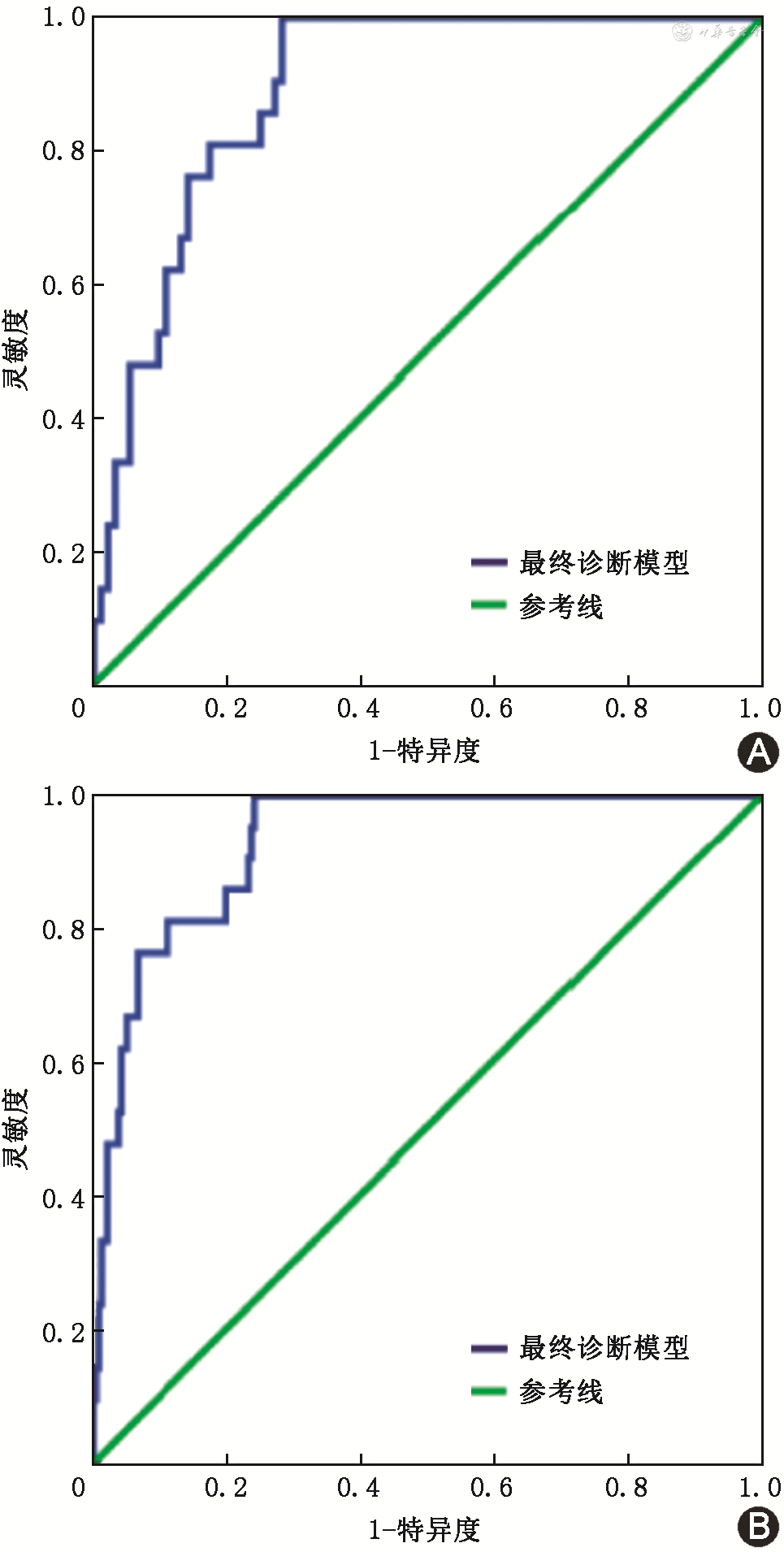

2.最终模型在全部验证人群中预测AFP-NHCC的诊断效能:AUC为0.931(95%CI:0.890~0.972)(图3B),约登指数为0.756,灵敏度为100.0%(21/21),特异度为75.6%(180/238)。
HCC的预后取决于肿瘤分期,早期HCC患者的5年生存率超过70%,而有症状的晚期患者经全身治疗后的中位生存期为1.0~1.5年[1]。因此早期诊断HCC可以提供及时治疗的机会,从而提高患者的生存率。炎症反应被普遍认为在肿瘤的发生和进展中起重要作用,血常规检查、凝血项目检查、肝功能检测、肿瘤标志物筛查是临床上常见的检查项目,其中多种指标与肝脏功能、机体免疫反应密切相关[8,12, 13, 14],如ALT、AST、ALB、PT和PLT等。
AFP的诊断效能并不能满足临床实际需求[15]。本研究分析结果也显示AFP对AFP-NHCC的诊断效能较低;同属于消化道肿瘤标志物的CA19-9的诊断效能也较低。本研究将AFP取为不同的值来分组分别建模后,得到在AFP不同低表达水平下,区分AFP-NHCC和其他肝部疾病的诊断模型及诊断效能。结果发现,AFP不同低水平时模型纳入的指标略有差异,但是灵敏度和特异度均较AFP和CA19-9有较大提升。
从纳入指标可以看出,AFP仅在20 μg/L以内时,才被纳入模型,而在更低水平时,3个模型由于入选指标不同,如果分开使用可能会造成漏诊。为了更充分地发挥筛查效果,本研究将不同的建模指标进行合并,即PLT、PTA、ALB、PT、HCT、AFP和CA19-9等7个指标均被纳入得到新的诊断模型,其AUC提高到0.873,特异度为81.7%,灵敏度为78.6%。
Luo等[16]用AFP-NHCC患者的MPV、RDW、平均血小板体积-血小板计数比、中性粒细胞-淋巴细胞比、血小板计数-淋巴细胞比的平均值等5个指标组合成的预测模型,其AUC为0.922,灵敏度为83.0%,特异度为93.1%。本研究模型的预测结果低于其研究报道,但是其研究对象未包含与AFP-NHCC更容易混淆的其他肝脏类疾病,而仅纳入健康人为对照组。Zhang等[17]也将AFP与5个常规临床指标(年龄、Na+、Cl-、ALP和APTT)结合鉴别诊断AFP-NHCC与肝硬化,但其AUC(0.854)和灵敏度(68.5 %)均低于本研究;并且对照组也仅有肝硬化患者,没有纳入其他类型肝病。本研究将部分与肝癌相关肝病和常见肝病纳入分析,使本研究建立的模型具有更好的鉴别诊断意义。在对模型的验证中,本研究建立的诊断模型也具有较好的诊断效能,其中对肝部疾病以及验证组全部人群均具有较好的预测效能(AUC=0.892、0.931)。
本研究不足之处:第一,所有的AFP-NHCC患者均来自单中心,且样本数量有限;第二,AFP-NHCC样本的病因为乙型病毒性肝炎感染,对于其他原因(如化学因素或遗传因素)诱发的AFP-NHCC的诊断效能有待进一步评价。
所有作者均声明不存在利益冲突



























