
探讨气腔播散(STAS)对不同肿瘤大小的pT1N0M0期肺腺癌患者术后无复发生存期(RFS)的影响。
回顾性分析2014年1月至2018年6月中国医学科学院肿瘤医院胸外科511例行手术治疗的pT1N0M0肺腺癌患者的临床病理及随访资料,男285例,女226例,年龄[M(Q1,Q3)]60(53,66)岁。根据STAS状态将患者分为两组,即STAS(-)组(342例)和STAS(+)组(169例);并根据美国癌症联合会(AJCC)第八版肺癌术后病理肿瘤大小T分期(pT)进行分层分析,其中分为pT1a(pT≤ 1 cm,93例)、pT1b(1 cm<pT≤2 cm,280例)、pT1c(2 cm<pT≤ 3 cm,138例)及pT1b/c(1 cm<pT≤ 3 cm,418例)。采用Cox单因素和多因素比例风险模型和逆概率加权(IPTW)调整的Kaplan-Meier(K-M)曲线分析STAS对纳入患者RFS的影响。
STAS(+)组的复发率高于 STAS(-)组(22.5%比3.2%,P<0.001)。基于pT分层的多因素Cox回归分析结果显示,在pT1b和pT1c分层中,STAS(+)患者的复发风险分别比STAS(-)患者高4.56倍(95%CI:1.56~13.33;P=0.006)和3.16倍(95%CI:1.07~9.33;P=0.038)。pT1b/c、pT1b和 pT1c的STAS(-)组患者分别与全部pT1a患者相比较,RFS差异均无统计学意义[(84.97±0.72)比(84.05±1.11)个月,(85.60±0.74)比(84.05±1.11)个月,(81.49±1.63)比(84.05±1.11)个月;均P>0.05]。IPTW调整前后,pT1b/c中STAS(+)组与STAS(-)组患者的RFS差异均有统计学意义[(72.50±2.23)比(85.12±0.72)个月,(77.74±1.12)比(84.59±0.64)个月,均P<0.001]。此外,STAS(+)组与STAS(-)组相比,局部和远处复发率更高(分别为6.7%比1.2%和8.2%比3.6%,均P<0.05)。
对于pT1bN0M0和pT1cN0M0的肺腺癌患者,STAS(+)患者局部和远处复发率更高,RFS更差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌是全球死亡率排名第一的恶性肿瘤,且发病率呈逐年上升的趋势,其中肺腺癌是最常见的组织学类型之一[1, 2]。国际抗癌联盟以及美国癌症联合委员会指南指出肿瘤、淋巴结与转移(tumor node metastasis,TNM)分期中T1N0M0为早期肺癌,手术切除是标准治疗方案,患者的5年生存率可达80%以上[3, 4, 5]。虽然早期肺腺癌预后较好,但仍有研究表明术后14%~36%的患者会复发[2,6],亟待探索高复发风险的患者特征,以期指导制定临床诊疗方案。
2015年,世界卫生组织正式提出气腔播散(spread through air spaces,STAS)为肺腺癌一种新的侵袭模式[4],定义为微乳头簇、实心巢或单个肿瘤细胞游离于肿瘤主体以外的肺泡腔中。既往的研究表明STAS 在肺腺癌的所有分期中占 28.2%~37.3%[7, 8]。一些研究者认为,STAS可以显著影响肺腺癌术后无复发生存期(recurrence-free survival,RFS)[8, 9, 10];其他研究者提出,目前尚无STAS 对RFS临床预后影响的分层分析[11, 12]。然而,STAS对早期肺腺癌RFS的影响是否因其伴有不良的预后特征,以及对早期肺腺癌不同病理诊断肿瘤大小(pathologic tumor,pT)是否均有影响仍有争议。为此,本研究对术后pT1N0M0肺腺癌患者临床病理相关特征及复发情况分析,旨在探讨STAS对不同pT的pT1N0M0期肺腺癌患者疾病复发影响。
回顾性收集2014年1月至2018年6月于中国医学科学院肿瘤医院胸外科行原发性肺癌根治性手术切除的511例pT1N0M0期肺腺癌患者,男285例,女226例,年龄60(53,66)岁。纳入标准:(1)术后病理为肺原发性恶性肿瘤;(2)术后病理确诊为肺腺癌;(3)术后病理T分期为pT1期(pT ≤ 3 cm);(4)年龄>18岁。排除标准:(1)未接受术中淋巴清扫;(2)术后病理有淋巴结转移和其他部位转移;(3)临床病理资料或随访不完整;(4)接受术前新辅助治疗和术后辅助治疗;(5)5年内合并其他恶性肿瘤病史;(6)有胸膜侵犯;(7)手术切端阳性。本研究已通过中国医学科学院肿瘤医院伦理委员会批准(NCC2018-064),患者知情同意豁免。
1.一般资料:通过电子病历系统收集,包括:手术年龄、性别、吸烟史、恶性肿瘤病史、手术方式。
2.影像信息:从术前分期检查中收集,包括胸部CT和MRI、颈部及腹部超声、骨扫描和(或)正电子发射断层扫描/计算机断层扫描;并分别由2名胸部影像学专业的影像科医师复阅图像并记录结节实性成分占比。
3.术后病理信息:由2名具有3年以上工作经验的病理科医师对切片进行复核,包括肿瘤大小、病灶数目、组织学分级、腺癌亚型、STAS以及是否存在胸膜浸润。根据第八版TNM肺癌分期[3]和世界卫生组织指南[4]进行病理分期、组织学亚型分类及组织学分级。
所有样本均为手术切除标本,部分行术中冰冻检测。所有标本经4%甲醛溶液充分固定后,经过脱水、包埋、切片、染色多道工序制成常规病理染色切片。由2名具有3年以上工作经验的病理科医师对所有肿瘤切片进行复核,根据肺腺癌STAS判断标准,将STAS阴性腺癌记为STAS(-),STAS阳性腺癌记为STAS(+),当2人意见不一致时,由第3名病理科医师进行复判。
所有纳入病例根据STAS结果分为STAS(-)组(342例)和STAS(+)组(169例);按照pT分期将患者分为pT1a(pT≤1 cm,93例)、pT1b(1 cm<pT≤2 cm,280例)和 pT1c(2 cm<pT≤3 cm,138例)和pT1b/c(1 cm<pT≤3 cm,418例),分别分析STAS对疾病复发的影响。
随访主要采用门诊随访方式,术后患者在前2年每3个月进行一次胸部 CT 扫描,其后3年每6个月进行一次常规随访。对于疑似复发的患者,通过手术样本或活检样本进行组织病理学检查;如果无法通过组织病理学诊断复发,则进行正电子发射断层扫描/计算机断层扫描或增强 CT 扫描;仍不能确认的患者至少每3个月进行一次增强 CT 扫描,持续至少1年以确认是否复发。主要终点是从初始手术到复发日期或最后一次随访的复发日期。随访截止2021年3月15日,所有患者均完成随访。
所有数据应用 R(4.0.1)软件进行统计分析。非正态分布的计量资料以M(Q1,Q3)表示,两组间差异采用Wilcoxon符号秩和检验;两组间均数比较采用t检验;计数资料用例(%)表示,组间比较采用χ²检验。通过Kaplan-Meier(K-M)法绘制RFS曲线,并行Log-rank检验分析无复发生存率的差异是否具有统计学意义。采用单因素和多因素 Cox回归模型分析STAS对RFS的影响。本研究是非随机性研究,为了消除组间基线不均衡,应用逆概率加权(inverse probability of treatment weighting,IPTW)的倾向评分分析方法[13]。纳入模型的变量包括性别、吸烟史、结节实性成分占比、组织学分级、pT大小。双侧检验,检验水准为α=0.05。
511例患者中,有169例(33.1%)患者术后病理存在STAS,其中pT1a、pT1b和pT1c患者的比例为5.9%、56.2%和3.9%(表1)。按照病理肿瘤大小分层,pT1a、pT1b和pT1c中STAS(+)患者的比例分别为10.8%、33.9%和46.4%(表2)。未进行IPTW调整前,STAS(+)组患者相比STAS(-)组的女性、吸烟者、结节实性成分高、组织学分级中-低分化患者比例高(表1)。中位随访期为62(43,70)个月。
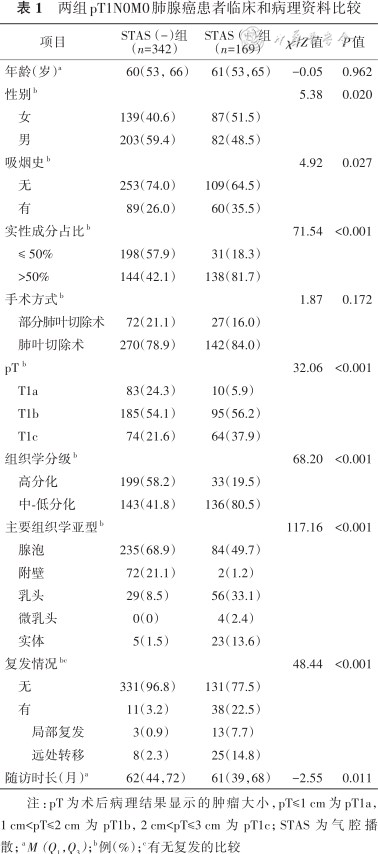
两组pT1N0M0肺腺癌患者临床和病理资料比较
两组pT1N0M0肺腺癌患者临床和病理资料比较
| 项目 | STAS(-)组(n=342) | STAS(+)组(n=169) | χ²/Z值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁)a | 60(53,66) | 61(53,65) | -0.05 | 0.962 | |
| 性别b | 5.38 | 0.020 | |||
女 | 139(40.6) | 87(51.5) | |||
男 | 203(59.4) | 82(48.5) | |||
| 吸烟史b | 4.92 | 0.027 | |||
无 | 253(74.0) | 109(64.5) | |||
有 | 89(26.0) | 60(35.5) | |||
| 实性成分占比b | 71.54 | <0.001 | |||
≤ 50% | 198(57.9) | 31(18.3) | |||
>50% | 144(42.1) | 138(81.7) | |||
| 手术方式b | 1.87 | 0.172 | |||
部分肺叶切除术 | 72(21.1) | 27(16.0) | |||
肺叶切除术 | 270(78.9) | 142(84.0) | |||
| pT b | 32.06 | <0.001 | |||
T1a | 83(24.3) | 10(5.9) | |||
T1b | 185(54.1) | 95(56.2) | |||
T1c | 74(21.6) | 64(37.9) | |||
| 组织学分级b | 68.20 | <0.001 | |||
高分化 | 199(58.2) | 33(19.5) | |||
中-低分化 | 143(41.8) | 136(80.5) | |||
| 主要组织学亚型b | 117.16 | <0.001 | |||
腺泡 | 235(68.9) | 84(49.7) | |||
附壁 | 72(21.1) | 2(1.2) | |||
乳头 | 29(8.5) | 56(33.1) | |||
微乳头 | 0(0) | 4(2.4) | |||
实体 | 5(1.5) | 23(13.6) | |||
| 复发情况bc | 48.44 | <0.001 | |||
无 | 331(96.8) | 131(77.5) | |||
有 | 11(3.2) | 38(22.5) | |||
| 局部复发 | 3(0.9) | 13(7.7) | |||
| 远处转移 | 8(2.3) | 25(14.8) | |||
| 随访时长(月)a | 62(44,72) | 61(39,68) | -2.55 | 0.011 | |
注:pT为术后病理结果显示的肿瘤大小,pT≤1 cm为pT1a,1 cm<pT≤2 cm为pT1b,2 cm<pT≤3 cm为pT1c;STAS为气腔播散; a M(Q1,Q3);b例(%);c有无复发的比较
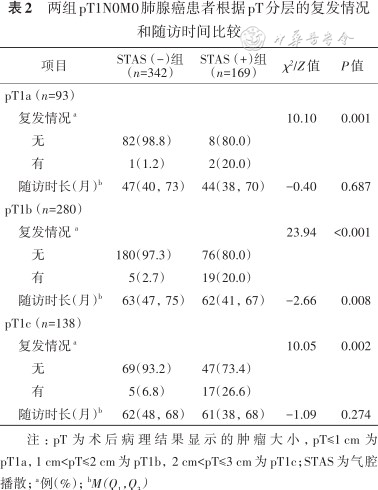
两组pT1N0M0肺腺癌患者根据pT分层的复发情况和随访时间比较
两组pT1N0M0肺腺癌患者根据pT分层的复发情况和随访时间比较
| 项目 | STAS(-)组 (n=342) | STAS(+)组 (n=169) | χ²/Z值 | P值 | |
|---|---|---|---|---|---|
| pT1a(n=93) | |||||
复发情况a | 10.10 | 0.001 | |||
| 无 | 82(98.8) | 8(80.0) | |||
| 有 | 1(1.2) | 2(20.0) | |||
随访时长(月)b | 47(40,73) | 44(38,70) | -0.40 | 0.687 | |
| pT1b(n=280) | |||||
复发情况 a | 23.94 | <0.001 | |||
| 无 | 180(97.3) | 76(80.0) | |||
| 有 | 5(2.7) | 19(20.0) | |||
随访时长(月)b | 63(47,75) | 62(41,67) | -2.66 | 0.008 | |
| pT1c(n=138) | |||||
复发情况a | 10.05 | 0.002 | |||
| 无 | 69(93.2) | 47(73.4) | |||
| 有 | 5(6.8) | 17(26.6) | |||
随访时长(月)b | 62(48,68) | 61(38,68) | -1.09 | 0.274 | |
注:pT为术后病理结果显示的肿瘤大小,pT≤1 cm为pT1a,1 cm<pT≤2 cm为pT1b,2 cm<pT≤3 cm为pT1c;STAS为气腔播散; a例(%);bM(Q1,Q3)
1.患者复发率的比较:STAS(+)组的复发率高于 STAS(-)组(22.5%比3.2%,χ²=48.44,P<0.001)(表1)。根据术后pT分层,pT1a、pT1b和pT1c复发患者分别为3例(3.2%)、24例(8.6%)和22例(15.9%);在pT1a、pT1b和pT1c中STAS(+)组和STAS(-)组间复发人数的差异均有统计学意义(χ²=10.10、23.96、10.05,均P<0.05)(表2)。
2. 单因素和多因素Cox回归分析STAS对RFS的影响:经单因素Cox回归分析检验,在pT1a(HR=16.48,95%CI:1.49~181.80;P=0.022)、pT1b(HR=8.09,95%CI:3.02~21.67,P<0.001)和pT1c(HR=4.45,95%CI:1.64~12.08,P=0.003)分层中,STAS(+)组和STAS(-)组间RFS差异均有统计学意义。将性别、吸烟史、实性成分占比和组织学分级等混杂因素纳入多因素Cox回归模型后,在pT1a分层中,STAS(+)组和STAS(-)组间RFS差异无统计学意义(HR=71.99,95%CI:0.92~5 639.73,P=0.055);在pT1b和pT1c分层中,STAS(+)组的复发风险分别比STAS(-)组高4.56倍(95%CI:1.56~13.33;P=0.006)和3.16倍(95%CI:1.07~9.33;P=0.038)(表3)。
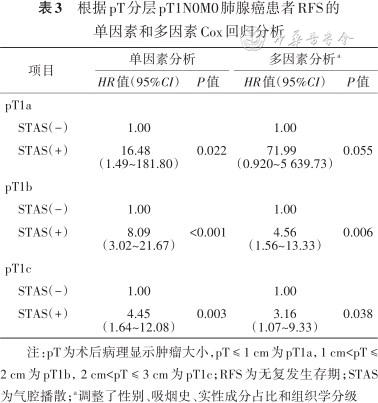
根据pT分层pT1N0M0肺腺癌患者RFS的单因素和多因素Cox回归分析
根据pT分层pT1N0M0肺腺癌患者RFS的单因素和多因素Cox回归分析
| 项目 | 单因素分析 | 多因素分析a | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| pT1a | ||||
STAS(-) | 1.00 | 1.00 | ||
STAS(+) | 16.48 (1.49~181.80) | 0.022 | 71.99 (0.920~5 639.73) | 0.055 |
| pT1b | ||||
STAS(-) | 1.00 | 1.00 | ||
STAS(+) | 8.09 (3.02~21.67) | <0.001 | 4.56 (1.56~13.33) | 0.006 |
| pT1c | ||||
STAS(-) | 1.00 | 1.00 | ||
STAS(+) | 4.45 (1.64~12.08) | 0.003 | 3.16 (1.07~9.33) | 0.038 |
注:pT为术后病理显示肿瘤大小,pT ≤ 1 cm为pT1a,1 cm<pT ≤ 2 cm为pT1b,2 cm<pT ≤ 3 cm为pT1c;RFS为无复发生存期;STAS为气腔播散;a调整了性别、吸烟史、实性成分占比和组织学分级
3. pT分层下K-M无复发生存分析:在pT1a、pT1b和pT1c中,STAS(+)组和STAS(-)组间RFS差异均有统计学意义[(72.57±6.61)比(85.20±0.80)个月,(72.84±2.81)比(85.60±0.74)个月,(70.63±3.57)比(81.49±1.63)个月;均P<0.05](图1)。基于pT分层的分析,pT1b/c、pT1b和 pT1c的STAS(-)组患者与全部pT1a患者相比较,RFS差异无统计学意义[(84.97±0.72)比(84.05±1.11)个月,(85.60±0.74)比(84.05±1.11)个月,(81.49±1.63)比(84.05±1.11)个月;均P>0.05];而pT1b/c、pT1b 和 pT1c的STAS(+)组与全部pT1a患者的RFS差异有统计学意义[(72.50±2.23)比(84.05±1.11)个月,(72.84±2.81)比(84.05±1.11)个月,(70.63±3.57)比(84.05±1.11)个月;均P<0.05]。不考虑pT1a患者,在pT1b/c、pT1b 和 pT1c中,STAS(+)组与STAS(-)组间RFS差异有统计学意义[(72.50±2.23)比(85.12±0.72)个月,(73.63±2.85)比(85.60±0.74)个月,(70.63±3.57)比(83.58±1.70)个月;均P<0.05](图2)。
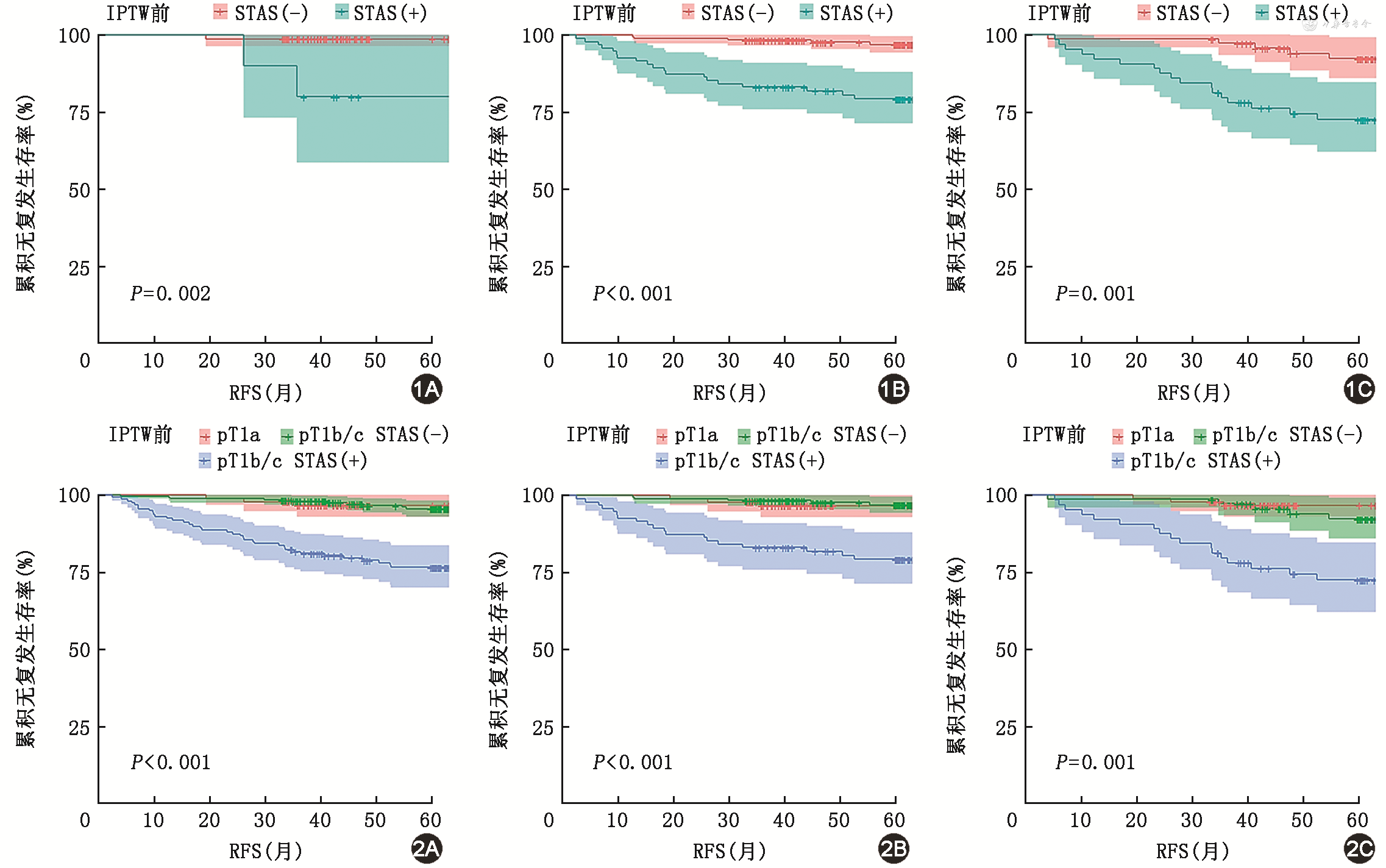

注:IPTW为逆概率加权;STAS为气腔播散;RFS为无复发生存期
IPTW调整前,STAS(+)和STAS(-)组的吸烟史、组织学分级、结节实性成分占比和pT差异均有统计学意义(χ²=4.33、46.83和50.33,均P<0.05)。IPTW调整后,STAS不同组间患者特征差异无统计学意义,具有可比性(χ²=0.11、2.76和2.96,均P>0.05)(表4)。IPTW 调整前后倾向得分的SMD值<0.200,表明组间协变量差异较小,分布均衡。
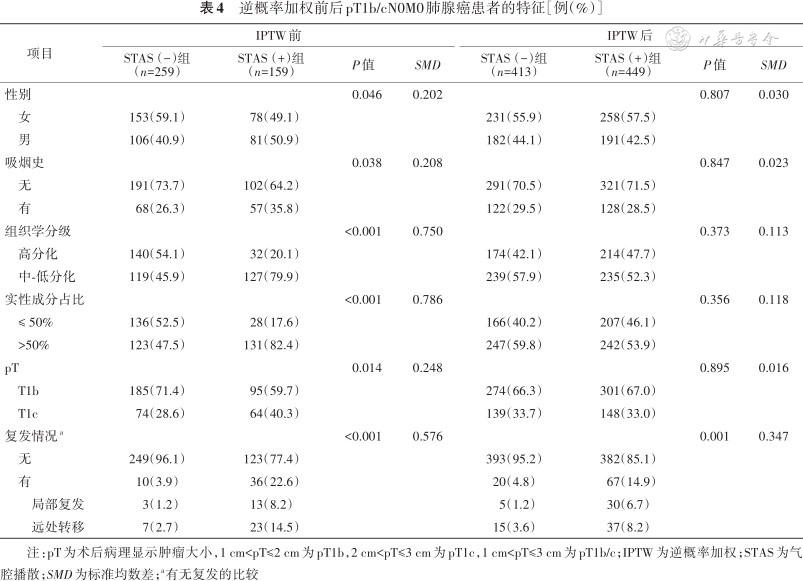
逆概率加权前后pT1b/cN0M0肺腺癌患者的特征[例(%)]
逆概率加权前后pT1b/cN0M0肺腺癌患者的特征[例(%)]
| 项目 | IPTW前 | IPTW后 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| STAS(-)组(n=259) | STAS(+)组(n=159) | P值 | SMD | STAS(-)组(n=413) | STAS(+)组(n=449) | P值 | SMD | |||
| 性别 | 0.046 | 0.202 | 0.807 | 0.030 | ||||||
女 | 153(59.1) | 78(49.1) | 231(55.9) | 258(57.5) | ||||||
男 | 106(40.9) | 81(50.9) | 182(44.1) | 191(42.5) | ||||||
| 吸烟史 | 0.038 | 0.208 | 0.847 | 0.023 | ||||||
无 | 191(73.7) | 102(64.2) | 291(70.5) | 321(71.5) | ||||||
有 | 68(26.3) | 57(35.8) | 122(29.5) | 128(28.5) | ||||||
| 组织学分级 | <0.001 | 0.750 | 0.373 | 0.113 | ||||||
高分化 | 140(54.1) | 32(20.1) | 174(42.1) | 214(47.7) | ||||||
中-低分化 | 119(45.9) | 127(79.9) | 239(57.9) | 235(52.3) | ||||||
| 实性成分占比 | <0.001 | 0.786 | 0.356 | 0.118 | ||||||
≤ 50% | 136(52.5) | 28(17.6) | 166(40.2) | 207(46.1) | ||||||
>50% | 123(47.5) | 131(82.4) | 247(59.8) | 242(53.9) | ||||||
| pT | 0.014 | 0.248 | 0.895 | 0.016 | ||||||
T1b | 185(71.4) | 95(59.7) | 274(66.3) | 301(67.0) | ||||||
T1c | 74(28.6) | 64(40.3) | 139(33.7) | 148(33.0) | ||||||
| 复发情况a | <0.001 | 0.576 | 0.001 | 0.347 | ||||||
无 | 249(96.1) | 123(77.4) | 393(95.2) | 382(85.1) | ||||||
有 | 10(3.9) | 36(22.6) | 20(4.8) | 67(14.9) | ||||||
| 局部复发 | 3(1.2) | 13(8.2) | 5(1.2) | 30(6.7) | ||||||
| 远处转移 | 7(2.7) | 23(14.5) | 15(3.6) | 37(8.2) | ||||||
注:pT为术后病理显示肿瘤大小,1 cm<pT≤2 cm为pT1b,2 cm<pT≤3 cm为pT1c,1 cm<pT≤3 cm为pT1b/c;IPTW为逆概率加权;STAS为气腔播散;SMD为标准均数差;a有无复发的比较
IPTW调整后STAS(+)组比STAS(-)组患者复发率高(14.9%比4.8%,P=0.001,表4)。IPTW调整前,STAS(+)组和STAS(-)组之间的RFS差异有统计学意义[(72.50±2.23)比(85.12±0.72)个月,P<0.001];IPTW调整后,两组患者RFS的差异也有统计学意义[(77.74±1.12)比(84.59±0.64)个月,P<0.001](图3)。此外,STAS(+)组的局部和远处复发率均高于STAS(-)组(分别为6.7%比1.2%和8.2%比3.6%,均P<0.05)(表3)。
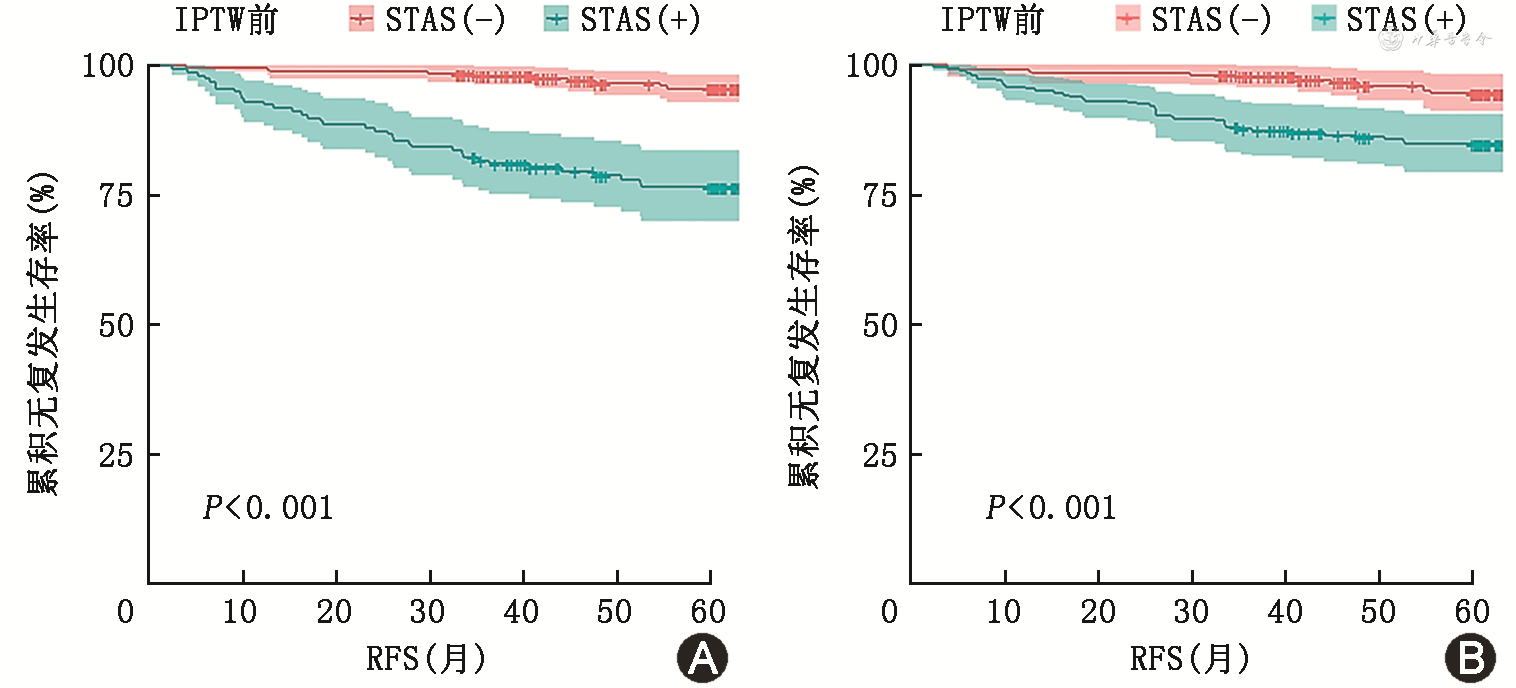

注:pT为术后病理显示肿瘤大小,1 cm<pT ≤ 3 cm为pT1b/c;IPTW为逆概率加权;STAS为气腔播散
本研究表明,在pT1N0M0肺腺癌患者中,STAS(+)组比STAS(-)组更容易复发。基于pT分层和对患者的IPTW调整分析,STAS(+)是pT1b和pT1c肺腺癌患者复发的危险因素,而STAS(-)的pT1b和pT1c患者与pT1a腺癌患者复发风险差异无统计学意义。
随着低剂量计算机断层扫描筛查肺癌的广泛应用,早期肺腺癌检出率不断攀升,尤其是≤3 cm的病灶。尽管进行了手术治疗,早期肺腺癌患者仍有14%~36%的患者会复发[14],这提示除了临床分期外还应考虑其他的复发危险因素。既往研究表明STAS是早期肺腺癌患者术后复发的独立危险因素[4,9,15, 16, 17],但对不同pT分期的病灶STAS是否影响患者RFS仍有争议。Dai等[18]认为STAS 对直径<2 cm的肺腺癌的预后影响较小,而对于直径2~3 cm的肺腺癌,STAS可造成肺腺癌患者明显的预后不良。而Kadota等[9]认为STAS是<2 cm肺腺癌复发的独立危险因素。尽管之前的研究分析了STAS 对早期腺癌的影响,但有3项研究[14,16, 17]分析中包括了有预后相关危险因素(如pT2分期和胸膜侵犯)的肿瘤,2项研究[14,18]分别有22%、40%患者接受了术后辅助治疗。此外,由于STAS常与其他不良预后特征(如组织学分级中低分化[12]、胸膜浸润[16])同时被观察到,一些研究者分析STAS(+)肺腺癌患者复发的危险因素可能是上述不良预后特征,而STAS本身并不是一个危险因素。为了解决以上争论,有必要根据pT分层分析STAS对pT1N0M0肺腺癌患者预后的影响,并调整研究人群中可能的混杂因素。
初步分析中,本研究团队发现在pT1N0M0肺腺癌中,STAS是不同pT分期患者复发的独立危险因素。在 pT1a 分层中,STAS(+)占比过低(10.8%),复发患者仅3例(2.3%),因此pT1a 腺癌患者被排除在后续分析之外。在控制了组间患者基线不平衡后,pT1b和pT1c层中STAS(+)组的复发风险仍高于STAS(-)组,这一发现与Jung等[16]和Dai等[18]的研究结果基本一致。有研究提出STAS与上皮-间质转化相关[16],是细胞黏附分子E-cadherin丢失导致细胞黏附减少[19],促进细胞侵袭和通过淋巴管、血管、胸膜和STAS而在肿瘤转移中发挥作用。通过这种机制,STAS(+)可能会增加早期肺癌手术时肺叶外隐匿性转移的可能性,从而导致局部和远处复发的风险增加。需要更全面的研究来阐明STAS存在的分子机制及其与不良预后的关系,本研究结果强调了前瞻性随机试验的必要性,以获得关于更积极治疗STAS(+)的pT1N0M0肺腺癌(如辅助化疗)的具体证据。
本研究基于临床长期完整随访数据,采用IPTW调整减少组间混杂偏倚,可为临床确定诊疗方案提供一定的参考依据,但仍存在一定的局限性。本研究为单中心回顾性研究,可能有患者选择偏倚,未来应进一步设计多中心大样本研究,以期验证在不同肿瘤大小的肺腺癌中STAS对预后的影响。
总之,本研究表明STAS(+)增加了术后pT1b/cN0M0腺癌患者的复发风险,pT1b/cN0M0肺腺癌队列中STAS(-)组与pT1aN0M0肺腺癌队列复发风险相似。
所有作者均声明不存在利益冲突



























