
胰岛素样生长因子(IGFs)主要参与细胞分裂增殖、个体生长发育以及物质合成代谢。近年来临床实践数据表明,IGFs影响男性睾丸发育、青春期启动以及精子生成。本文将综述IGFs对男性生殖功能影响的研究现状,并探讨未来研究方向。总体来说,IGFs可作为神经内分泌因子以及自分泌/旁分泌调节因子,在下丘脑-垂体-睾丸轴的不同水平发挥特异性调节作用。在下丘脑层面,IGFs促进促性腺激素释放激素(GnRH)神经元发育、迁移和激活。在垂体层面,IGFs促进促性腺激素分泌细胞的生长和功能激活。在外周生殖器官层面,IGFs参与胚胎发育过程中的睾丸发育和性别分化,以及睾丸细胞的增殖分化和精子生成。未来对于IGFs治疗能否改善少精弱精症患者男性生殖功能是此领域的探索方向。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
下丘脑-垂体-睾丸轴(HPT轴)是一个复杂且精细的调控系统,主要负责调控男性生殖内分泌功能。HPT轴受到体内体外诸多信号影响,如外界环境、能量供应、内分泌激素等[1]。其中,生长激素(GH)作为男性生殖系统重要的调控因子,通过激活磷脂酶C/蛋白激酶C(PLC/PKC)以及磷脂酰肌醇激酶/蛋白激酶B(PI3K/AKT)等关键信号转导通路,刺激睾丸发育和分化、促进类固醇激素合成、刺激精子发生以及提高促性腺激素敏感性。GH主要通过诱导产生胰岛素样生长因子(IGFs)对男性生殖系统发挥作用[2]。因此,作为GH发挥作用的关键因子[3, 4],IGFs在男性生殖系统中发挥重要作用。在本文中,我们将探讨IGFs在调节HPT轴中的作用以及潜在的作用机制,从临床和基础两方面阐明IGFs在男性生殖系统中的作用。
IGFs系统在物种进化过程中高度保守,在几乎所有人体器官组织中均有表达,以内分泌、自分泌/旁分泌的方式参与并调节细胞的生长、增殖和分化。由于其生物学效应的广泛性及对各种临床疾病的治疗潜力,IGFs已成为内分泌生殖领域越来越多研究者关注的焦点。
IGFs系统包括两种生长因子、两种生长因子结合受体以及至少6种胰岛素样生长因子结合蛋白(IGFBPs)。其中,两种生长因子分别为IGF-1和IGF-2;两种生长因子结合受体分别为IGF-1受体(IGF-1R)和胰岛素样生长因子2受体(IGF-2R)。6种胰岛素样生长因子结合蛋白分别为IGFBP-1~6。
数量方面,IGF-2是主要的循环IGFs,血清浓度高达0.7 ng/L,约为IGF-1的3倍。结构方面,IGF-1与IGF-2非常相似,并与胰岛素原享有大量的同源性序列(50%)。功能方面,基于相似的结构同源性,IGFs功能也与胰岛素类似,负责调节细胞的增殖和分化。两者的区别在于,IGF-1主要负责调节儿童和成年期的生长发育,而胎儿期的生长发育主要依靠IGF-2[5]。IGFs通过结合IGF-1R与IGF-2R发挥生物学功能。IGF-1R作为激活型受体,可结合IGF-1与IGF-2激活下游信号通路。而IGF-2R作为抑制型受体,降解IGF-2并阻断细胞内信号转导。活性调节方面,IGFBP3可结合95%的血清IGFs,并与酸不稳定性蛋白亚单位(ALS)一起,形成IGFs/IGFBP3/ALS三元复合物。三元复合物的形成降低了IGFs的生物利用度、延长其半衰期,同时保护IGFs免受蛋白酶水解并促进其转运。
IGFs的调控主要基于以下两种机制。第一,依据GH/IGFs假说,IGFs存在经典内分泌负反馈调节机制。在下丘脑促生长激素释放激素(GHRH)的调控下,垂体合成和分泌GH,随后GH作用于肝脏合成并分泌IGFs。IGFs通过血液循环反馈作用于垂体细胞,减少GH合成与分泌,从而达到维持GH-IGFs轴的生理稳态。第二,外周组织可通过自分泌/旁分泌机制合成IGFs,且受到周围细胞产生的GH以及其他细胞因子所调控。尽管外周循环中的IGFs主要产生于肝脏,但全身各组织细胞均可测到IGFs mRNA。特别是在睾丸组织中,睾丸间质细胞以及支持细胞可独立产生IGF-1。睾丸局部IGF-1的产生主要受到黄体生成素(LH)与卵泡刺激素(FSH)的刺激。
临床数据表明,IGFs不仅参与骨骼的纵向生长,还参与调控HPT轴,影响睾丸下降、青春期启动以及生殖器功能成熟。在出生后微小青春期阶段,血清IGF-1浓度、睾丸间质细胞和支持细胞功能共同决定了出生后睾丸的位置能否下降到阴囊内。此时,血清IGF-1浓度与睾丸到耻骨的距离(TDP)呈独立正相关[6]。也就是说,IGF-1浓度越高,睾丸下降越完全。总体上,在儿童和青春期,IGF-1水平呈线性升高。在达到青春期最大生长速度后,血清IGF-1水平还将持续升高约2年,并在成年期缓慢下降。在青春发育前期,IGF-1通过促进促性腺激素释放激素(GnRH)神经元成熟以及增加GnRH脉冲分泌,参与诱导青春期启动。在青春过渡期,即在生长速度达峰后,循环IGF-1水平仍显著升高,表明IGFs在这一阶段的重要靶器官可能是生殖系统,而非骨骼。在此阶段,IGF-1的明显增加诱导“休眠”生殖器官恢复生长和发育[7]。在成人阶段,IGFs的水平与精子数量、质量和活力存在一定相关性。
IGF-1以及IGF-2基因突变的相关病例报告均表现为青春期延迟。1例IGF-1纯合部分缺失的男童表现为明显的青春期延迟(15.8岁,Tanner Ⅱ期,双侧睾丸体积4 ml)[8]。1例IGF-ALS基因失活突变的男孩中同样观察到了青春期的延迟启动以及缓慢进展(14.6岁,Tanner Ⅰ期,双侧睾丸体积3 ml)[9]。在IGF-2基因突变的家系中,虽然早期开始GH治疗,但仍有1例男童青春期发育晚于平均年龄(15.5岁)[10]。此外,GH不敏感综合征(GHIS),又称为Laron综合征,表现为青春期的延迟启动以及缓慢进展。特别是男性Laron综合征的患者,平均青春期启动年龄为(15.6±2.6)岁,青春期持续时间为(6.2±0.6)年,且存在小睾丸(成熟睾丸体积7~13 ml)以及小阴茎(长度7~8 cm)[11]。给予IGF-1治疗后,1例28岁的Laron综合征男性患者的血清LH从1 U/L升高到6 U/L,睾酮从15 nmol/L升高到30 nmol/L,且睾丸体积及阴茎长度明显增加;在中止IGF-1治疗后,睾丸体积及阴茎长度缩小[12]。目前尚无研究评估IGF突变患者成年后精子参数与生育能力。与此同时,有个案报道显示,IGF-1R蛋白表达增多男性患者(15号染色体结构异常)表现为隐睾以及小睾丸[13],提示IGF-1R的表达异常也会影响男性青春发育时间。
成年后男性不育患者主要表现为精子数量、质量或形态异常。精子参数的差异可能和血清和精浆IGFs有关[14, 15]。研究表明,精子活力与形态异常与血清IGF-1降低相关,但与精液IGF-1无关[14]。相反,近期前瞻性队列研究表明,精浆IGF-1、IGF-2水平与精子数量呈正相关,IGF-2与精子活力呈负相关[15]。
在中枢系统中,IGFs通过两方面调控HPT轴:(1)在下丘脑层面,IGFs促进GnRH神经元发育、迁移和激活;(2)在垂体层面,IGFs促进促性腺激素分泌细胞的生长和功能激活。
IGF-1能促进GnRH神经元的发育和迁移。正常发育至青春期的小鼠,GnRH神经元复杂树突结构逐渐减少。但在GnRH神经元特异性敲低IGF-1R(GnRH-IGF-1RKO)的雄性转基因小鼠中,仍能观察到复杂树突结构,提示GnRH神经元发育较野生型小鼠延迟[16]。此外,体外实验表明IGF-1以剂量依赖的方式促进GnRH神经元迁移。在0.1 ng/L的IGF-1刺激下,GnRH神经元细胞的迁移数量显著增加[17]。
IGF-1能促进GnRH神经元合成分泌GnRH。首先,IGF-1可直接结合GnRH启动子AP-1位点,促进GnRH基因表达[18]。其次,IGF-1可作为外周和中枢代谢信号,与中枢神经系统内IGF-1R结合,刺激下丘脑GnRH神经元合成与分泌GnRH。当注射IGF-1至小鼠外周血液后,刺激神经胶质细胞分泌前列腺素E2,后者与附近GnRH神经末梢表面受体结合,促进GnRH分泌[19]。当注射IGF-1抗体至脑脊液后,雄性小鼠表现为青春发育延迟[20]。此外,IGF-1也可通过刺激青春期前神经激肽B(NKB)分泌,抑制强啡肽(DYN)释放,促进GnRH释放[21]。
IGF-1不仅可刺激垂体促性腺激素细胞增殖,还能以剂量依赖的方式增加基础以及GnRH刺激后LH的释放。IGF-1与GnRH在垂体促性腺激素分泌细胞中存在协同作用,增强垂体细胞对GnRH的反应,促进LH释放[22]。与此同时,IGF-2也可促进垂体促性腺激素细胞合成与分泌LH[22]。
在外周生殖器官中,IGFs参与胚胎发育过程中的睾丸发育和性别分化,以及睾丸间质细胞(LC)、支持细胞(SC)、生精细胞(GC)的增殖分化和精子生成。
胰岛素受体酪氨酸激酶家族,包括IGF-1R、胰岛素受体(INSR)以及胰岛素相关受体(INSRR)对睾丸发育和性别决定发挥重要的作用。在IGF-1R/INSR/INSRR三基因敲除的XY小鼠中观察到SRY表达减少,以及雄性特异性相关基因包括CYP11A1、INSL3、SOX9表达缺失,导致睾丸分化失败,最终表型为雌性生殖道结构[23]。值得注意的是,只有当IGF-1R等位基因均发生突变时才能观察到性别逆转表型,表明IGF-1R对睾丸发育和性别决定的整体贡献大于INSR/INSRR。
在睾丸细胞增殖与分化方面,IGF-1基因敲除小鼠成年后睾丸体积缩小。支持细胞选择性IGF-1R/INSR敲除小鼠,睾丸体积减小,支持细胞的数量下降以及发育不成熟,睾丸以及附睾精子浓度均下降[24]。增加外源性FSH刺激无法改善此类小鼠的睾丸体积与精子生成[24]。这一现象说明,IGFs在FSH介导的PI3K/AKT信号中发挥不可或缺的作用。小鼠间质细胞敲除IGF-1后,间质细胞前体细胞发育和增殖受损,成年后间质细胞数量减少,睾丸内睾酮浓度降低[25]。因此,IGFs在建立正常数量的间质细胞、诱导间质细胞成熟以及维持细胞合成类固醇能力中起到重要作用。此外,IGF-1还可通过IGF1R-PI3K/AKTt-哺乳动物雷帕霉素靶蛋白(mTOR)/缺氧诱导因子2α(HIF2α)途径促进生殖干细胞增殖[26]。
既往研究显示,IGF-1通过IGF-1/PTEN/Akt/FoxO信号通路在应激大鼠的精子细胞中发挥抗损伤作用[27]。此外,IGF-2在精子发生中起到重要作用。在8例中度(17%,P=0.026)和15例重度(30%,P=0.002)少精子症患者中发现,男性少精症的发生与IGF-2基因表达降低相关[28]。
IGFs在HPT轴不同水平(空间),以及生长发育的不同阶段(时间)发挥时空特异性调节作用,参与男性睾丸发育、青春期启动以及精子生成(图1)。虽然有个案报道发现注射IGF-1可改善少弱精症患者的精子数量和质量[29],但仍需大样本前瞻性研究来证实治疗效果。此外,对于睾丸局部自分泌产生的IGFs对类固醇生成、精子发生的影响以及潜在的调控机制等诸多问题,尚缺少基础和临床的研究,是将来此领域的探索方向。
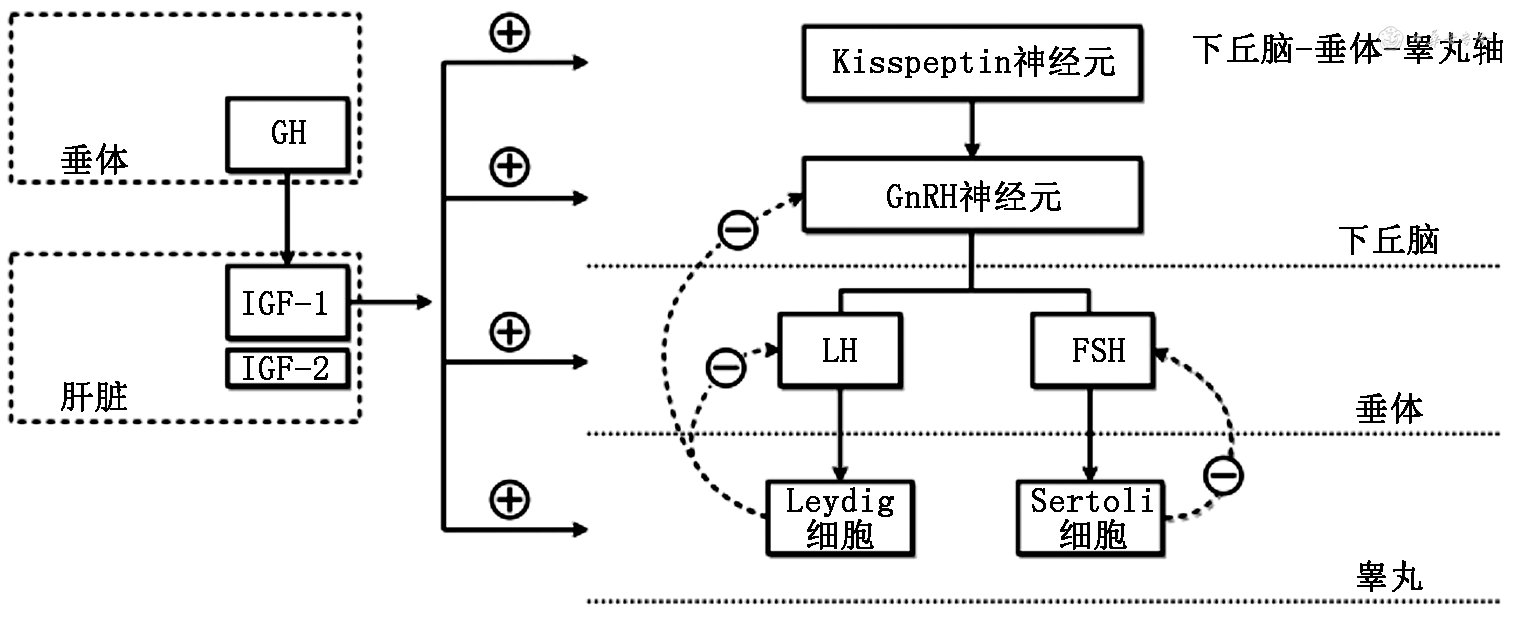

注:GH为生长激素;IGF为胰岛素生长因子;GnRH为促性腺激素释放激素;LH为黄体生成素;FSH为卵泡刺激素
所有作者均声明不存在利益冲突



























