
随着大规模根除治疗的推进,导致幽门螺杆菌(H. pylori)耐药率不断升高,加上宿主CYP2C19基因多态性、H. pylori球形变、患者依从性、医生治疗方案不正规或经验式反复根除治疗等因素,H. pylori根除率逐渐下降。个性化治疗是实现H. pylori感染者首诊成功得以根除的有效措施。随着克拉霉素耐药分子诊断试剂盒在我国首次获批与美国胃肠病协会(AGA)有关难治性H. pylori感染定义更新,遵循国际最新共识与指南、符合国情、赶超国际水平的基于耐药基因检测的H. pylori首诊个性化诊疗走向前台。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
幽门螺杆菌(Helicobacter pylori,H. pylori)是慢性胃炎、消化性溃疡、胃癌与胃黏膜相关淋巴样组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤的重要病因。2014年,京都H. pylori胃炎全球共识将H. pylori胃炎定义为感染性疾病[1]。H. pylori具有传染性,可在人-人间通过口-口、粪-口途径传播 [2]。H. pylori被国际癌症研究机构(International Agency for Research on Cancer,IARC)认定为Ⅰ类致癌因子,在肠型胃癌的发病过程中起始动作用。几项大型队列研究显示,根除H. pylori能显著降低胃癌发病风险[3, 4]。因此京都共识提出无论有无症状和并发症,只要检测证实H. pylori感染,均建议根除H. pylori[1]。随后我国《第五次全国H. pylori感染处理共识报告》也将“证实有H. pylori感染”列入推荐根除指征,将推荐根除治疗对象扩展至无症状者[5]。
目前我国H. pylori呈现“三高一低”现状,即高感染率(约50%)、高致病力、高耐药率和低根除率[6]。大规模的H. pylori根除治疗导致抗生素耐药日益严重。根据中国H. pylori分子医学中心(China Center for Helicobacter pylori Molecular Medicine,CCHpMM)组织全国多中心H. pylori耐药监测数据显示,我国克拉霉素、左氧氟沙星、甲硝唑的原发耐药率分别为37.00%、34.21%、87.87%,继发耐药率高达76.93%、61.58%和93.48%,对一些过去少见耐药的抗生素(如阿莫西林、呋喃唑酮、四环素)的耐药性在部分地区也有悄然抬头的趋势,值得警惕[7]。宿主CYP2C19基因多态性也是导致根除失败不容忽视的因素,不恰当地选用受此基因多态性影响较大的质子泵抑制剂(proton pump inhibitor,PPI)会降低抑酸效果,削弱抗生素疗效,同样可能使根除治疗失败[8]。加上H. pylori球形变、医生治疗方案不正规或经验式反复根除治疗等因素,H. pylori根除率大幅下降[9]。尽管共识推荐的根除方案组合的种类越来越多,疗程越来越长或剂量增加,但首次根除成功率总体下降趋势并没有得到有效控制。反复治疗失败使得患者经受诸多的药物不良反应,承受了巨大的心理压力,加上反复就医导致的误工误时等,增加社会经济负担不容忽视。同时反复治疗失败后加重了抗生素耐药,不但使得患者个体的后续治疗选择困难,还加重了所在地区的抗生素耐药,由此产生的负面影响极其深远。因此提高首诊根除率意义重大,H. pylori个性化精准诊疗力求首战告捷势在必行。
H. pylori首诊个性化诊疗的理念逐渐被国际主流接受和认可。在2017年的国际Maastricht V共识中提到,当一线治疗中考虑使用克拉霉素方案时推荐行克拉霉素药敏试验,除非已有充分证据显示该地区人群中克拉霉素耐药率<15%,克拉霉素药敏试验可采用标准培养的方法,也可采用分子生物学方法直接对胃黏膜活检标本进行检测[10]。2020年台北全球共识建议的H. pylori诊疗流程为:若药敏试验可行,则推荐做药敏试验。若不可行,则推荐给予当地证实有效的方案[11]。2020年H. pylori韩国循证医学指南将治疗前行聚合酶链反应(polymerase chain reaction,PCR)或测序法的克拉霉素耐药试验列入了一线推荐[12]。世界胃肠病学组织在2021年更新的H. pylori诊疗指南中指出[13]:根除成功的主要决定因素是在治疗前了解抗生素耐药性。使用PPI-阿莫西林-克拉霉素方案根除成功的主要决定因素是治疗前克拉霉素是否耐药。PCR检测能够以较高的灵敏度和特异性检测H. pylori,也能检测导致克拉霉素耐药的突变,有望成为H. pylori感染管理方面的一个重大进展。在耐药性高的地区提供这种检测可能会大大有助于为个体患者选择治疗方法,同时也有利于调查人群中的流行情况[13]。从近年的国际共识/指南可见,基于耐药检测尤其是基于PCR等分子生物学方法的耐药检测的个体化治疗越来越受到认可和重视。
CCHpMM于2016年由已故的胃肠病学专家萧树东教授倡导下成立,从分子研究与检测水平,致力于倡导、践行H. pylori首诊个性化诊疗。早在2019年,CCHpMM就提出重视首诊成功根除H. pylori的重要性,个性化诊疗是实现首诊成功根除有效措施的观点[14]。2020年,CCHpMM对H. pylori个性化与标准化诊疗流程进行了整合,提出了H. pylori特色门诊的运行模式[15]。2021年研发的H. pylori 23S rRNA基因突变检测试剂盒获得国家药品监督管理局(National Medical Products Administration,NMPA)三类医疗器械创新通道审批,这是我国首个获得国家药监机构医疗器械审批的H. pylori克拉霉素耐药分子检测试剂盒,可同时实现H. pylori诊断和耐药的快速检测,使得基于分子诊断的H. pylori首诊个性化诊疗在中国普及成为可能,有望改变中国H. pylori感染的处理流程。
同时,笔者注意到,难治性H. pylori感染的定义也在发生变化。国内学者既往认为,按照共识方案根除失败至少3次才视为难治性H. pylori感染[16]。而2021年美国胃肠病协会(American Gastroenterological Association,AGA)制订的难治性H. pylori感染临床实践则将难治性H. pylori感染的定义更新为1次及以上的根除失败[17]。换而言之,H. pylori感染应该在首诊即成功根除,否则即进入难治性感染诊疗流程。呋喃唑酮是一种硝基呋喃类抗生素,其因安全性问题在美国、欧盟等地已不再适用,在中国目前仅允许用于难治性H. pylori感染,其在根除H. pylori治疗中短期使用相对有效和安全[18]。若依据AGA对难治性H. pylori感染的定义,则呋喃唑酮方案可用于首诊治疗失败和因耐药问题导致一线方案不适用的患者,既合法合规,又体现中国特色。
鉴于我国已有获批的H. pylori克拉霉素耐药PCR检测试剂盒,使得广泛开展基于耐药基因检测的H. pylori首诊个性化诊疗成为现实,加上难治性H. pylori感染定义的更新,以及我国呋喃唑酮方案的适用性,笔者根据临床研究数据[18, 19, 20, 21],初步提出了遵循台北全球共识[11]诊疗流程和符合中国国情的H. pylori(首诊)个性化诊疗流程(图1)。对于H. pylori检测阳性行胃镜检查的患者,可取胃黏膜(新鲜或石蜡)样本进行克拉霉素耐药基因检测。对于检测敏感的患者,给予克拉霉素+阿莫西林的铋剂四联方案可获得满意疗效,并注意避免选择受宿主CYP2C19基因多态性影响较大的PPI,作为一线治疗方案。对于检测耐药或一线治疗方案失败的患者,可视为难治性H. pylori感染,合法合规地使用符合中国国情的呋喃唑酮铋剂四联方案或大剂量阿莫西林+PPI二联方案。对于仍然失败的患者,可进行传统培养+药物敏感性检测,选择敏感抗生素。同时应重视H. pylori球形变对根除治疗的影响,对难治性病例进行H. pylori球形变检测,若发现球形变应及时停止治疗3~6个月,避免无效治疗[22]。这一流程既遵循了国际共识,也符合中国国情,赶超了国际H. pylori诊疗水平,对提高我国H. pylori首诊根除率力求首战告捷具有重要作用。同时,注重H. pylori特色门诊和H. pylori-CBDTM特色学科建设[23],即以H. pylori感染和相关胃黏膜病变患者为中心(center,C),打造高标准的H. pylori(耐药)菌株库及相关胃黏膜病变组织样本库(biobank,B),开展高质量的临床学科建设(discipline construction,D)和转化研究(translational research,T),最终实现H. pylori个性化精准诊疗(precision medicine,M)。
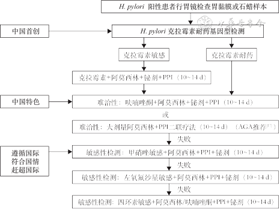

注:H. pylori为幽门螺杆菌;PPI为质子泵抑制剂;AGA为美国胃肠病协会
所有作者均声明不存在利益冲突



























