
以程序性细胞死亡受体1(PD-1)、程序性细胞死亡配体1(PD-L1)及细胞毒性T淋巴细胞相关抗原4(CTLA-4)等免疫检查点抑制剂为代表的免疫治疗已成为晚期非小细胞肺癌的主要治疗手段之一,显著延长了患者生存。但免疫治疗在临床应用上仍然存在很多悬而未决的问题,应用时长就是其中一个比较棘手的问题:治疗有效的患者是用够一定的时长停止,还是越长越好?病情进展的患者是否要立即停药,还是可以继续应用?同时考虑到免疫治疗独特的不良反应、有限的有效率及较高的治疗费用等临床实际问题,免疫治疗应用的合理时长问题显得尤为突出。本文结合免疫治疗的原理、现有的免疫检查点抑制剂在肺癌中应用时长的研究数据等进行梳理和分析,通过对免疫治疗的起点-应用时机、终点-停药时机以及延长指征的分析,探讨免疫治疗的合理应用时长,以期为患者的精准治疗和更多获益提供依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫治疗在肿瘤治疗中的探索和实践已有百余年的历史,近十年来免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的问世和应用使免疫治疗进入快速发展的时代。目前临床应用的ICIs主要为程序性细胞死亡受体1(programmed death-1,PD-1)、程序性细胞死亡配体1(programmed death-ligand 1,PD-L1)及细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)等抗体药物;其凭借独特的作用机制、确切的临床疗效,已经成为非小细胞肺癌(non-small cell lung cancer,NSCLC)等多种恶性肿瘤继手术、放疗、化疗和靶向治疗后肿瘤治疗手段的一场革命[1, 2]。免疫治疗目前已成为驱动基因阴性晚期NSCLC的主要治疗手段之一[3],显著延长了患者生存:从含铂双药化疗时代7.4~8.1个月的中位总生存期(median overall survival,mOS)[4],到ICIs治疗将晚期NSCLC的5年生存率从过去40年的5%提高到现在的15%[5, 6],尤其是PD-L1高表达、初治晚期NSCLC患者的5年生存率达到29.6%~31.9%[6, 7];充分显示出免疫治疗长生存的独特优势。目前,免疫治疗在NSCLC治疗中的位置逐渐前移,从晚期NSCLC的二线到一线治疗(免疫治疗单药或联合化疗,双免疫治疗或联合化疗)[8],再到局部晚期的巩固治疗[9],甚至发展到早期可手术NSCLC的新辅助治疗[10]和辅助治疗[11]。
尽管免疫治疗效果确切,给患者带来了显著的生存获益,但是在临床应用上仍然存在很多悬而未决的问题。应用时长就是其中一个比较突出的问题:免疫治疗何时开始、何时终止?治疗有效的患者是用够一定的时长停止,还是越长越好?病情进展的患者是否要立即停药,还是可以继续应用?考虑到免疫治疗有限的有效率、广泛的不良反应以及较高的治疗费用等实际问题,解决免疫治疗应用多长时间合适的问题就显得尤为突出。本文依据免疫治疗的原理,通过对免疫治疗的起点(应用时机)与终点(停药时机)的分析,结合现有的ICIs在NSCLC中应用时长的研究数据进行梳理,分析、探讨免疫治疗的合理应用时长。
2013年,Chen和Mellman[12]提出“肿瘤-免疫循环”理论,即机体抗肿瘤免疫反应有效杀伤肿瘤细胞需要依次经历3个部位(肿瘤、淋巴系统、血管)、7个步骤(抗原释放、加工递呈、激活CD8+T细胞、T细胞通过循环系统迁移、浸润至肿瘤局部、识别、杀伤肿瘤细胞)才能启动、完成效应T细胞杀死肿瘤细胞的过程。而目前的ICIs类药物通过阻断肿瘤免疫循环起始抗原递呈阶段的CTLA-4/CD80或效应阶段的PD-1/PD-L1、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoglobulin and ITIM domain,TIGIT)、T细胞免疫球蛋白粘蛋白3(T cell immunoglobulin domain and mucin domain-3,TIM-3)、淋巴细胞激活基因-3(lymphocyte activation gene-3,LAG-3)、唾液酸结合免疫球蛋白样凝集素15(sialic acid-binding immunoglobulin-like lectin 15,Siglec 15)等免疫检查点抑制性分子来恢复、增强效应T细胞的抗肿瘤活性[13]。
通过上述ICIs作用机制的分析可以发现,免疫治疗与传统抗肿瘤手段不同,具有鲜明的特征:(1)免疫治疗的疗效有赖于机体的免疫储备,即可调动的T细胞的数量和质量,显然机体免疫储备较好时应用更为有利,因此应尽早使用。(2)免疫治疗是间接治疗,并非直接杀死肿瘤细胞,免疫激活的环节较多、起效需要一定过程和时间,因此需要给予免疫治疗一定的观察时间,应用时间不宜太短;而传统的疗效判断标准和方式未必适用于免疫治疗,需要结合其作用的机制特点修正旧的评价方法或研发新的疗效评价手段。(3)免疫治疗一旦激发,会形成正反馈的循环过程,持续发挥治疗作用。而在这个过程中免疫记忆细胞的形成,也有助于免疫系统长时间保持对肿瘤抗原的监控、识别和清除作用。这些特点为免疫治疗应用时长的思辨选择提供了理论基础。
虽然不同临床研究给出了不同的免疫治疗应用时长的设计,但并未提供其设计依据。通常,一段时间的长短可以用结束的时间(终点)减去开始的时间(起点)来计算和衡量,因此不妨从免疫治疗的起点——应该从什么时候开始和终点——应该到什么时候停止两个方面来分析免疫治疗的合理应用时长。
目前,晚期NSCLC一线应用免疫治疗的成功临床研究越来越多,医生和患者对于免疫治疗的接受度越来越高。但是也应该清醒地认识到并非所有的免疫治疗研究都是阳性结果(CheckMate 026、MYSTIC、IMpower 132等)[14, 15, 16];免疫治疗也并非适用于所有人群。因此,在准备启动免疫治疗之前,不仅需要筛选出可能从免疫治疗中获益的患者,还包括排除掉不会从免疫治疗中获益(原发性耐药)、甚至会发生病情超速进展的患者。不管是作为伴随诊断还是补充诊断,免疫单药还是免疫联合其他治疗手段,以PD-L1、肿瘤突变负荷(tumor mutation burden,TMB)、微卫星不稳定性/错配修复(microsatellite instability/mismatch repair,MSI/MMR)为代表,以驱动基因改变为研究热点,聚焦肿瘤本身、局部免疫微环境及宿主生态微环境(如肠道菌群)三大方面的生物标志物的研究和应用[17],在进行免疫治疗决策时发挥重要的作用。虽然这些生物标志物各自具有局限性,但是仍为我们选择免疫治疗提供了有力的依据。那么,免疫治疗是应该前线应用,还是病情进展后后线应用呢?
KEYNOTE-001研究比较了初治和经治的晚期NSCLC患者接受帕博利珠单抗(Pembrolizumab)单药治疗的生存数据[18],客观缓解率(objective response rate,ORR)分别是41%和23%,mOS分别是22.3和10.5个月,似乎提示早用ICIs的患者生存获益更大。KEYNOTE-024研究纳入初治晚期肿瘤细胞PD-L1阳性比例评分(tumor proportion score,TPS)高表达(TPS≥50%)的NSCLC患者,观察3年的结果显示,即使化疗组有64.9%的受试者在一线治疗进展后交叉至帕博利珠单抗组,后者的mOS(26.3个月)仍显著长于化疗组(14.2个月,HR=0.65,P=0.001);而帕博利珠单抗组与化疗组无进展生存期(progression-free survival,PFS)2(从随机开始至第二次疾病进展或死亡的时间)分别是24.1和8.5个月(HR=0.51,P<0.001),18个月的PFS率分别为54%和24.6%。这提示即使为PD-L1高表达人群,化疗进展后二线使用ICIs的生存获益显著低于一线早应用免疫治疗者[19]。在KEYNOTE-189中,一线帕博利珠单抗联合化疗组的PFS2比化疗组显著延长8个月,复发风险下降超过50%[20]。这一结果也提示免疫治疗二线应用效果差于一线应用。因此,对于免疫治疗的应用时机即起点,应该是早期应用更优,能给患者带来更长的生存获益。
此外,免疫治疗在不可切除Ⅲ期NSCLC巩固治疗[9]、早期肺癌新辅助治疗及辅助治疗[21]均已取得了阳性临床研究结果,其从晚期后线、一线,到局部晚期、再到早期NSCLC取得的一系列成绩,都支持ICIs治疗早用优于晚用这样一个观点。这与前面分析的免疫治疗的机制是恢复患者体内免疫应答,其成功与否与患者体内有多少可调动的免疫储备和免疫资源密切相关。很难想象一个终末期、恶液质的患者体内还残余多少免疫杀伤细胞可以用来激活和抑制肿瘤,这种情境下免疫治疗发挥作用的空间非常有限。因此,对于适宜患者应该尽早使用免疫治疗。
与决定是否应用以及何时应用免疫治疗相比,何时结束免疫治疗的问题显得尤为复杂。这直接决定了患者接受免疫治疗的时长,也决定了患者能否从免疫治疗中获得最大程度的生存和尽可能小的不良反应。
如前所述,免疫治疗药物发挥作用需要经过一个逐级推进的步骤以成功地实现完整的免疫应答、免疫循环和正反馈。因此,免疫治疗的起效较其他治疗(如化疗)需要更长的时间。在CheckMate 227研究中,双免疫治疗组(纳武利尤单抗+伊匹木单抗)的中位应答时间(2.7个月)明显长于化疗组(1.5个月)[22]。在几乎所有ICIs单药对比化疗的临床研究中,生存曲线会在4~6个月的时候出现交叉现象;这可能是因为免疫治疗起效较慢(也不排除个别病例发生超进展),初始并不占优势;而3~6个月后才逐渐发挥出疗效[14,22, 23, 24, 25]。在免疫治疗联合化疗的KEYNOTE-189等研究中,尽管这种交叉消失,但两组的生存曲线也会或长或短地重合一段时间后,免疫联合治疗组才逐步“胜出”[26]。从这个角度来看,免疫治疗不宜少于半年。
在晚期NSCLC的大型Ⅲ期研究中,多设定为疾病进展或达到固定时长后停止ICIs治疗;固定的时长长短不一,包括1年、2年(或35个周期)(表1)。那么,1年或2年的时间是否可以作为临床标准呢?
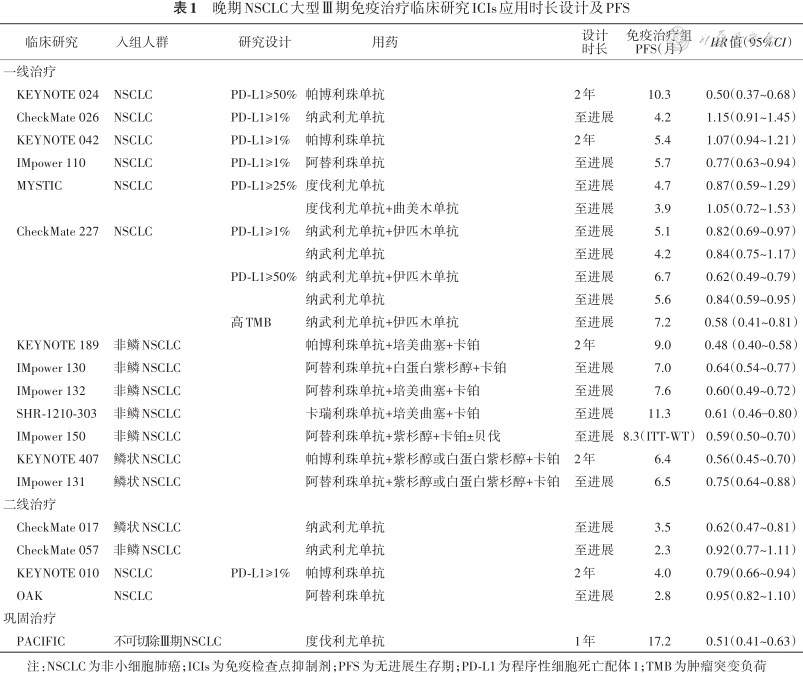
晚期NSCLC大型Ⅲ期免疫治疗临床研究ICIs应用时长设计及PFS
晚期NSCLC大型Ⅲ期免疫治疗临床研究ICIs应用时长设计及PFS
| 临床研究 | 入组人群 | 研究设计 | 用药 | 设计 时长 | 免疫治疗组 PFS(月) | HR值(95%CI) |
|---|---|---|---|---|---|---|
| 一线治疗 | ||||||
KEYNOTE 024 | NSCLC | PD-L1≥50% | 帕博利珠单抗 | 2年 | 10.3 | 0.50(0.37~0.68) |
CheckMate 026 | NSCLC | PD-L1≥1% | 纳武利尤单抗 | 至进展 | 4.2 | 1.15(0.91~1.45) |
KEYNOTE 042 | NSCLC | PD-L1≥1% | 帕博利珠单抗 | 2年 | 5.4 | 1.07(0.94~1.21) |
IMpower 110 | NSCLC | PD-L1≥1% | 阿替利珠单抗 | 至进展 | 5.7 | 0.77(0.63~0.94) |
MYSTIC | NSCLC | PD-L1≥25% | 度伐利尤单抗 | 至进展 | 4.7 | 0.87(0.59~1.29) |
度伐利尤单抗+曲美木单抗 | 至进展 | 3.9 | 1.05(0.72~1.53) | |||
CheckMate 227 | NSCLC | PD-L1≥1% | 纳武利尤单抗+伊匹木单抗 | 至进展 | 5.1 | 0.82(0.69~0.97) |
纳武利尤单抗 | 至进展 | 4.2 | 0.84(0.75~1.17) | |||
PD-L1≥50% | 纳武利尤单抗+伊匹木单抗 | 至进展 | 6.7 | 0.62(0.49~0.79) | ||
| 纳武利尤单抗 | 至进展 | 5.6 | 0.84(0.59~0.95) | |||
高TMB | 纳武利尤单抗+伊匹木单抗 | 至进展 | 7.2 | 0.58(0.41~0.81) | ||
KEYNOTE 189 | 非鳞NSCLC | 帕博利珠单抗+培美曲塞+卡铂 | 2年 | 9.0 | 0.48(0.40~0.58) | |
IMpower 130 | 非鳞NSCLC | 阿替利珠单抗+白蛋白紫杉醇+卡铂 | 至进展 | 7.0 | 0.64(0.54~0.77) | |
IMpower 132 | 非鳞NSCLC | 阿替利珠单抗+培美曲塞+卡铂 | 至进展 | 7.6 | 0.60(0.49~0.72) | |
SHR-1210-303 | 非鳞NSCLC | 卡瑞利珠单抗+培美曲塞+卡铂 | 至进展 | 11.3 | 0.61(0.46‒0.80) | |
IMpower 150 | 非鳞NSCLC | 阿替利珠单抗+紫杉醇+卡铂±贝伐 | 至进展 | 8.3(ITT-WT) | 0.59(0.50~0.70) | |
KEYNOTE 407 | 鳞状NSCLC | 帕博利珠单抗+紫杉醇或白蛋白紫杉醇+卡铂 | 2年 | 6.4 | 0.56(0.45~0.70) | |
IMpower 131 | 鳞状NSCLC | 阿替利珠单抗+紫杉醇或白蛋白紫杉醇+卡铂 | 至进展 | 6.5 | 0.75(0.64~0.88) | |
| 二线治疗 | ||||||
CheckMate 017 | 鳞状NSCLC | 纳武利尤单抗 | 至进展 | 3.5 | 0.62(0.47~0.81) | |
CheckMate 057 | 非鳞NSCLC | 纳武利尤单抗 | 至进展 | 2.3 | 0.92(0.77~1.11) | |
KEYNOTE 010 | NSCLC | PD-L1≥1% | 帕博利珠单抗 | 2年 | 4.0 | 0.79(0.66~0.94) |
OAK | NSCLC | 阿替利珠单抗 | 至进展 | 2.8 | 0.95(0.82~1.10) | |
| 巩固治疗 | ||||||
PACIFIC | 不可切除Ⅲ期NSCLC | 度伐利尤单抗 | 1年 | 17.2 | 0.51(0.41~0.63) |
注:NSCLC为非小细胞肺癌;ICIs为免疫检查点抑制剂;PFS为无进展生存期;PD-L1为程序性细胞死亡配体1;TMB为肿瘤突变负荷
CheckMate 153研究探索了晚期NSCLC二线及以上应用ICIs治疗1年以上的时长与生存的关系[27]。应用纳武利尤单抗1年后未进展的人群,分为持续治疗组和停止治疗、进展后再挑战纳武利尤单抗组,结果显示:持续治疗组的中位PFS(mPFS)显著长于进展后再用组;复发风险下降58%,1年PFS率显著提高。持续治疗组的OS趋势上也优于再挑战组[未达到(not reached,NR)比23.2个月,HR=0.63,95%CI:0.33~1.20]。CheckMate 153研究的结果表明,对于未进展的患者,应用1年的免疫治疗可能并不充分。
CheckMate 017和057这两个鳞癌和非鳞癌的免疫治疗二线单药研究中均规定纳武利尤单抗使用至疾病进展[28],纳武利尤单抗组和多西他赛组的5年OS率分别是13.4%和2.6%。界标分析的数据表明,接受纳武利尤单抗治疗并在第2、第3、第4年未发生疾病进展的患者,其5年OS率分别为82%、93%、100%。虽然患者的生存期与完成免疫治疗的时长呈正比,但是完成2年ICIs治疗未进展的45例患者的5年生存率已超过80%,与完成3年者和4年者已经较为接近,这是否意味着2年治疗时长已足够呢?KEYNOTE-024研究[7,29]中帕博利珠单抗组有38例患者完成了计划2年的治疗,其中10例完成2年治疗的患者在后续进展后再次应用帕博利珠单抗治疗,仍有7例达到客观缓解,8例仍存活。在高表达PD-L1的晚期NSCLC中完成2年帕博利珠单抗治疗者的3年生存率接近90%,而且复发后再次应用帕博利珠单抗有效率仍然较高(70%);这似乎与从上述CheckMate 017/057研究中得到的免疫治疗应用2年左右可获得较大生存获益的结论相类似。
一项真实世界的小型回顾性研究探索了应用纳武利尤单抗治疗晚期NSCLC 2年以上的结果[30]。将接受纳武利尤单抗治疗2年未进展的患者分为三组,A组:纳武利尤单抗 3 mg/kg或240 mg 每2周1次,或480 mg 每4周1次,继续持续给药;B组:3 mg/kg 每3~8周1次,继续持续给药;C组:停止治疗;主要研究终点为PFS和安全性。随访35.6个月的结果显示,A组、B组、C组进展的患者比例分别为4%、31%和29%。这提示即使是完成2年ICIs治疗未进展的患者,按照固定剂量和周期继续给药,仍可以继续降低进展风险。
综合以上数据,接受ICIs治疗未进展的患者应该至少进行持续2年的治疗,从而有效降低疾病复发风险,获得持久生存获益。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也推荐对于一线方案使用PD-1/PD-L1等免疫治疗、在完成常规4~6个周期的治疗达到疾病稳定或更佳疗效的患者,应该继续使用该免疫药物维持2年[31]。如果患者是在二线使用免疫治疗,维持治疗时间应该直到疾病进展。
事实上,只有一部分患者具有长期应用免疫治疗从而获得长期生存延长的机会。不是所有研究都规定了免疫治疗应用的固定时长,但是所有的研究都明确疾病进展后停止使用;这使我们能通过mPFS这个指标间接了解某项研究中患者应用免疫治疗的时长的概况(表1)。由表1可知,在获得阳性结果的NSCLC的大型Ⅲ期研究中,一线接受ICIs治疗(包括联合)的mPFS为5.1~11.3个月,多数在6个月以上;二线接受ICIs治疗的mPFS仅3.5~4.0个月。这些客观指标提示我们,对于有效的患者,免疫治疗应用的时间一线不宜小于半年,二线不宜<3个月。当然,这只是从mPFS的角度判断应用免疫治疗时长的下限,不代表某个患者用到mPFS时间就应该停药;同时,免疫治疗过程中疾病进展的判断也充满了挑战,需要谨慎处理。
疾病进展或严重不良反应是停用抗肿瘤药物的最常用指标,而以往传统是基于实体瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)的影像学手段来判断疾病是否进展,这也是相对简单而明确的。但免疫治疗却有其不同之处,除了原发和继发性耐药导致的疾病进展,还存在假性进展、超进展的现象;这些情况有时候很难分辨。
1.免疫治疗耐药:免疫治疗耐药包括原发性耐药、获得性耐药以及继发性耐药[32],无论哪种机制的耐药发生,均可能是终止免疫治疗的指征。目前对于免疫治疗耐药的机制发现主要集中在肿瘤细胞自身[新生抗原生成障碍或丢失[33]、递呈缺陷[34]、信号转导通路异常[35]、肿瘤细胞可塑性及干细胞化[36]、细胞DNA表观遗传学修饰[37, 38]、吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)表达[39]],肿瘤微环境[树突状细胞成熟缺陷[40]、趋化因子表达下调[41]、免疫代谢紊乱[42]、免疫抑制细胞激活[43, 44, 45]、血管内皮生长因子(vascular endothelial growth factor,VEGF)促血管生成及抑制免疫作用[46]]以及宿主微环境(肠道微生物种类及数量[47])等三个方面。充分了解免疫治疗耐药的主要机制和关键因素有助于预测患者从免疫治疗中获益的潜在可能性大小,判断是否需要停止免疫治疗。
不同机制或模式的免疫治疗耐药会影响对于免疫治疗是否停药的决策。对于原发耐药的患者,其往往初始即难以从免疫治疗中获益,发现治疗无效、耐药后需要及时停药,避免过度治疗。因此,需要特别关注和识别这一群体的患者,已报道的临床病理特征既包括PD-L1表达低/阴性、低TMB/TNB、缺乏CD8+T细胞浸润、敏感驱动基因突变(EGFR、ALK等)、STK11/LKB1突变等这些常用指征;也包括一些新发现的指标,如外泌体PD-L1表达、特定肿瘤免疫亚型、胚系遗传突变及合并用药(如抗生素、非甾体类药物)等[48, 49]。而对于获得性/继发性耐药的患者,则需要判断其能否从继续使用免疫治疗中获益。美国一项对4 223例晚期NSCLC患者的真实世界回顾分析发现,免疫治疗进展后继续用药30 d以上患者的mOS显著优于进展后30 d内停药的患者(11.5比5.1个月,P<0.001);相比短期内停药的患者,免疫治疗进展后再继续使用一段时间ICIs还能带来生存获益,其死亡风险降低了31%(HR=0.69,P<0.001)[50]。Reinhorn等[51]对207例接受ICIs治疗进展的NSCLC患者分析也发现,继续免疫治疗(TBP)仍有部分患者获益,其中寡进展并接受了放疗等局部治疗的患者免疫治疗有效率更高、控制时间更长。这些结果提示,免疫治疗耐药与其他肿瘤治疗药物耐药不完全相同,部分患者(如缓慢进展或寡进展)仍然可以继续应用免疫治疗并可从中继续获益,联合其他治疗手段可能疗效更佳。
2.假性进展与超进展:假性进展是免疫治疗所独有的现象,患者出现肿瘤病灶初始大小增大或新病灶出现,活检证实为坏死或炎性细胞浸润,随后肿瘤负荷减轻,这种非传统的临床反应被认为是假性进展[52]。假性进展在NSCLC免疫治疗进展中占5%左右[53]。如果未能把假性进展从真性进展中分辨出来而终止免疫治疗,那就有可能牺牲这部分免疫优势人群可能的生存获益。目前,在临床上推荐使用实体肿瘤免疫治疗疗效评价标准(modified response evaluation criteria in solid tumors for immune based therapeutics,iRECIST)标准[54],即影像学判定肿瘤进展后暂时评价为待确认的疾病进展(immune unconfirmed progressive disease,iUPD);4~8周后进行第2次确认评价,如果仍然影像学进展,即评价为已确认的疾病进展(immune confirmed progressive disease,iCPD)。这就从临床的角度为分辨假性进展以免“误停”免疫治疗提供了可行性。假性进展也有一定的潜在生物标志物,包括外周血计数、循环肿瘤DNA、细胞因子水平等[55, 56, 57, 58, 59],可以提供部分参考依据。
部分患者在接受免疫治疗后,出现肿瘤加速生长的现象,这种现象被称为超进展[60]。超进展在NSCLC患者中发生率大致在10%~16%[61, 62]。一旦发生超进展后,患者的mOS显著缩短(4.4~4.6个月比17.7个月)[62]。目前报道的与超进展可能相关的预测因素包括:高龄(>65岁)[60]、基础转移灶数目(>2个)[62]、DNMT4扩增、MDM2/4突变扩增[61]、EGFR突变阳性、疾病进展时间<2个月[61]、ICIs导致的Treg细胞增加[63]等。但是这些指标目前并非都是确定的因素,发生机制方面尚有很多矛盾和争议[64, 65],需要大规模的临床研究数据和临床经验的积累来证实。
判断患者免疫治疗为假进展或超进展后,是否继续应用免疫治疗比较明确。对于假进展的患者,可以继续应用ICIs;研究表明,发生假进展的患者比未发生假进展的患者从免疫治疗中可能获益更多[66]。而对于发生超进展或快速进展的患者,则需要立即停用免疫治疗;这部分患者往往也预后很差[67]。
3.严重不良反应:免疫治疗相关不良反应(immune-related adverse events,irAEs)发生率较高,涉及机体各脏器系统,发生时间、程度不易预测。虽然严重不良反应发生率低,但部分不良反应病死率较高,如免疫性心肌炎[68, 69, 70]等,需要尽早停药。免疫治疗不良反应的严重程度是决定免疫治疗是否继续的重要因素。总体来说,1级毒性可以在密切监测下继续使用ICIs。2级毒性需考虑暂停用药,可以酌情考虑使用糖皮质激素,直至症状和实验室指标恢复至1级或更低。3级毒性应接受高剂量糖皮质激素治疗,并根据发生脏器决定暂时或永久性停用ICIs。4级毒性则需要立即停止使用ICIs,多数患者需要永久停用ICIs。
以上所述为免疫治疗不良反应停药和处理的总体原则,但并非所有的3~4级不良反应都需要永久停用ICIs。如3~4级内分泌毒性,包括甲状腺功能减退、垂体炎、肾上腺功能不全等,在症状缓解、给予内分泌替代治疗后,可考虑继续应用ICIs治疗。对于3级免疫相关肝炎,如果是抗PD-1/PD-L1联合抗CTLA-4治疗时发生,在肝功恢复后重启时可考虑仅用抗PD-1/PD-L1治疗。而对于出现过可能危及生命的3~4级不良反应患者,如心肌炎、严重肺炎、脑炎、皮肤大疱性损伤等,需永久停药。这些irAEs的具体处理原则和免疫治疗再挑战可参考NCCN、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)相关指南。值得注意的是,近年来关于irAEs与疗效呈正相关关系的报道和荟萃分析越来越多[71, 72, 73],更提示基于不良反应的永久性停药应该充分论证、慎重决定,争取在控制好不良反应的同时,能使更多的患者从免疫治疗中获益。
除了没有公认的用药时长、停药指征含糊不清以外,免疫治疗还面临一个停药以后再次应用的独特问题。这不仅包括前述免疫治疗不良反应恢复后的继续用药,而且包括不管当时什么原因(包括肿瘤进展)停药,在肿瘤出现进展后再次应用免疫治疗。
在一项接受纳武利尤单抗治疗晚期NSCLC后再挑战的真实世界研究显示[69],按照初治时有效患者的持续缓解时间分层,<3个月和3~6个月的OS分别为12.5和17.9个月,而初治时持续缓解超过6个月的患者OS仍未达到,初治有效的患者再次重启ICIs治疗仍有生存获益。另一项NSCLC免疫治疗再挑战的研究发现,初治获得缓解的50%人群再次接受ICIs治疗的有效率为16%[70]。初治因毒性或临床因素停药的,初治未接受化疗的,以及初治接受ICIs治疗的持续缓解时间超过3个月的患者,重启ICIs的生存数据会更好。
筛选能够从免疫治疗中长期获益的人群也是延长免疫治疗的一个重要考量因素。随着之前大型临床研究的深入挖掘和数据更新,一些从免疫治疗中获得长期生存人群的临床病理学及分子生物学特征逐渐显现。CheckMate 227更新的结果显示,用药6个月处于完全缓解(complete response,CR)/部分缓解(partial response,PR)的患者,其3年生存率是70%;而处于疾病稳定(stable disease,SD)或疾病进展(progressive disease,PD)的患者,其3年生存率分别只有34%和19%,与6个月时处于同样状态的化疗组患者的生存数据几乎一致(33%和17%)[74]。这说明免疫治疗中近期疗效好的患者往往可以长期获益。当然从分子特征来看,TMB及PD-L1同时高表达的患者也是免疫治疗长生存的优势人群[75]。因此,对这些临床或分子特征显示可能长期获益的患者,应该给其长疗程的免疫治疗,以获得超长的生存时间。
目前关于免疫治疗的应用时长尚没有明确结论,需要大型头对头随机对照临床研究来阐明、证实,同时需要结合免疫治疗机制与临床研究进行思辨。综合以上理论和研究数据,ICIs治疗应用不宜过晚,也不宜过短,部分患者停药后可以再尝试ICIs。对于irAEs,需要在充分论证的基础上决定永久停药还是恢复应用。临床上应积极开展免疫治疗应用时长生物标志物及精准个体化治疗策略的探索。在缺乏直接预测免疫治疗时长的生物标志物的情况下,可借鉴免疫治疗疗效、耐药、进展等相关的预测指标来决定免疫治疗的起点和终点,从而更合理地确定治疗时长。需要注意的是,对于免疫治疗时长的判断而言,上述指标的动态监测尤为重要:通过免疫治疗相关指标的实时变化推测、判断肿瘤或机体对免疫应答的可能情况,从而及时调整免疫治疗决策提供重要的依据。综合、动态应用相对敏感的生物标志物决定患者的免疫治疗时长也是免疫治疗向精准化、个体化迈进的趋势和方向。
所有作者均声明不存在利益冲突































