
探讨不同产膜能力白色念珠菌入侵后诱导人气道上皮细胞的免疫损伤机制。
选择2019年6至12月宁夏医科大学总医院分离培养的25株白色念珠菌,质控菌株SC5314为标准菌株。建立白色念珠菌生物膜体外模型,利用结晶紫染色和酶标板法检测不同白色念珠菌的生物膜形成能力;采用酶标板法测定570 nm处的吸光度值(A570):A570≥0.5为强产膜菌(SBF),0.25<A570<0.5为中产膜菌(DRF),A570≤0.25为不产膜菌(WBF)。在体外分离培养并建立人气道上皮细胞的气液相培养模型,分为5组:空白对照组(n=20)、标准菌株组(n=20)、强产膜组(n=19)、不产膜组(n=17)、耐氟康唑组(n=18)。扫描电镜观察气液相培养上皮细胞的形态。采用免疫荧光检测气液相培养上皮细胞体外模型标志蛋白的表达。通过微孔板法检测细胞中乳酸脱氢酶(LDH)含量,利用酶联免疫吸附实验(ELISA)检测细胞培养液中细胞内β-防御素(hBD2)、粒巨噬细胞集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)等的分泌情况。
强产膜菌株以菌丝相互交错生长,能看到极少数酵母细胞包裹于其中。扫描电镜观察气液相培养的上皮细胞菌丝能够主动入侵上皮细胞;纤毛乙酰化的微管蛋白和角蛋白的表达量明显减少,同时细胞增殖相关蛋白的表达也被下调。空白对照组、标准菌株组、强产膜组、不产膜组、耐氟康唑组细胞中LDH含量分别为(12.21±5.68)、(46.35±6.35)、(18.69±4.38)、(12.56±3.69)、(13.48±4.28)U/L,差异有统计学意义(P<0.001);与标准菌株组相比,强产膜组、不产膜组、耐氟康唑组细胞内LDH含量均降低(均P<0.01)。空白对照组、标准菌株组、强产膜组、不产膜组、耐氟康唑组细胞内hBD2的含量分别为(26.14±0.77)、(56.18±0.83)、(30.66±2.59)、(29.22±0.48)、(28.28±1.56)ng/L,差异有统计学意义(P<0.001);与空白对照组相比,只有标准菌株组的上皮细胞可诱导细胞内hBD2表达量增加(P<0.001)。不同组别间细胞内GM-CSF、G-CSF的表达量差异均无统计学意义(均P>0.05)。
强产膜白色念珠菌可通过下调细胞增殖相关蛋白的表达,抑制细胞的增殖,破坏上皮细胞的完整性,从而诱导细胞损伤。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,严重真菌感染性疾病在临床日渐增多,其中白色念珠菌已成为医院获得性感染的主要病原菌之一,尤其是白色念珠菌生物膜的形成给临床治疗带来了很大的挑战[1]。局部微生态失衡的情况下,该菌群可由共生酵母相转化为致病菌丝相,会引起脑炎、真菌性败血症以及消化道和呼吸道等全身侵袭性感染疾病。此类疾病治疗难度大,易复发,且耐药性问题日趋严峻,严重威胁患者的生命[2]。白色念珠菌形成生物膜后,对包裹的细胞形成保护层,使其对临床上所用的抗真菌药物高度耐受,包括两性霉素B和氟康唑等抗真菌药物[3]。目前,不同产膜能力的白色念珠菌感染呼吸道上皮细胞的具体机制尚不清楚。本文旨在探讨感染呼吸道的白色念珠菌的产膜能力与致病性,以期能够阐明不同产膜能力白色念珠菌感染呼吸道上皮细胞引起的凋亡和免疫反应作用机制,为新型抗真菌药物的研究提供新的靶点,为临床治疗提供理论依据。
1.菌株来源:分离、鉴定2019年6至12月宁夏医科大学总医院感染性疾病住院患者微生物检验项目标本,标本分别来源于静脉导管、导尿管、心脏起搏器、患者静脉血。按照《全国临床检验操作规程》[4]操作,选择分离培养的25株白色念珠菌作为研究对象。质控菌株:SC5314为标准菌株。所有菌株-80 ℃保存。
2.人气道上皮细胞(human airway epithelial cells,hBEC)来源:利用消化液对手术切除的肺组织块进行消化,将消化得到的细胞通过差速贴壁法去除成纤维细胞,由此得到P0代hBEC。将上述得到的hBEC进行传代培养至P5代。以上组织和标本的研究得到患者或家属知情同意,并通过医院伦理审查(伦理编号:2019-259)。
3.仪器与试剂:酵母膏胨葡萄糖琼脂(yeast peptone dextrose medium,YPD)液体培养基和沙氏琼脂培养基购自青岛海博生物技术有限公司;胎牛血清(fetal bovine serum,FBS)购自澳大利亚Ausbian公司;细胞全蛋白提取试剂盒购自北京凯基生物科技有限公司;结晶紫染液、细胞活性氧检测辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG和HRP标记的山羊抗小鼠IgG购自北京中杉金桥生物科技有限公司;DME/F12培养基、胰蛋白酶和青霉素、链霉素、DMEM高糖培养基、Rho关联含巻曲螺旋蛋白激酶(Rho-associatedcoiled-coil kinase,ROCK)培养基购自美国Hyclone公司;兔抗GAPDH抗体购自北京博奥森公司;VDF膜购自美国Millipore公司;酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自上海酶联生物科技有限公司;VECTASHIELD含有DAPI的封片剂(vectashield mounting medium with DAPI)购自美国 Vector Laboratories公司;荧光倒置显微镜购自日本Olympus公司。
4.分离白色念珠菌及生物膜形成能力分析:取100 μl菌悬液加入96孔培养板,CO2培养箱培养24 h;吸取培养基,用磷酸盐缓冲液缓慢冲洗3次,戊二醛固定,结晶紫染色30 min。采用酶标板法测定570 nm处的吸光度值(A570),采用倒置显微镜拍照,观察不同产膜能力白色念珠菌的形态。生物被膜形成能力评价标准:A570≥0.5为强产膜菌类型(strong biofilm Candida albican form,SBF),0.25<A570<0.5为中产膜菌类型(moderate biofilm Candida albican form,DRF),A570≤0.25为不产膜菌类型(weak biofilm Candida albican form,WBF)[5]。分别选取强产膜和不产膜白色念珠菌各1株用于后续实验。
5.白色念珠菌感染hBEC气液相界面感染模型的建立:将对数期生长的hBEC进行消化离心,细胞数量5×105个/ml;分别接种于用Ⅱ型鼠尾胶原包被的96孔板;将标准菌株SC5314以及SBF、WBF、DRF单菌落接种于YPD液体培养基中,37 ℃、120 rpm/min恒温摇床震荡过夜培养12 h,使其处于对数生长期,分光光度计对各菌悬液进行计数,离心收集菌体,随后用磷酸盐缓冲液调整菌液浓度至106个/ml,用ROCK培养基重悬菌液后感染hBEC。感染菌的数量与hBEC数量之比为5∶1,即每个微孔膜需要白色念珠菌的数量为5×106 个。hBEC分组:空白对照组、标准菌株组(加入SC5314菌液)、强产膜组(加入SBF菌液)、不产膜组(加入WBF菌液)、耐氟康唑组(加入耐氟康唑菌液)。贴壁培养24 h,菌液终浓度达1×105个/ml。收集细胞用S3400扫描电子显微镜观察气液相上皮细胞表面形态。
6.白色念珠菌生长曲线测定:吸取分离鉴定的各种白色念珠菌菌悬液2 ml至250 ml锥形瓶,再补加98 ml YPD液体培养基,37 ℃、120 转/min恒温摇床震荡同步培养。每2小时取样,用分光光度计测定600 nm处菌液吸光度值(A600),每组重复测定3次,记录测定值,直至白色念珠菌生长达到自身生长平台期。最后以测定时间为横坐标,A600为纵坐标,绘制白色念珠菌生长动力学曲线图。
7. 免疫荧光检测气液相hBEC体外模型上皮标志蛋白表达:为评估气液相培养的hBEC分化程度,利用免疫荧光染色法进行形态学水平检测。吸取20 μl细胞悬液,置加热板晾干玻片上的液体。移置染缸,在玻片脂肪圈内滴加50 μl带有封闭液稀释的一抗,4 ℃孵育过夜;滴加带有Alexa Fluor 488荧光标记的二抗;滴加10 μl封片剂进行核染;自然晾干10 min,置于荧光显微镜下观察,采集图像。
8.测定不同处理组细胞乳酸脱氢酶(lactate dehydrogenase,LDH)释放量及细胞因子的分泌:收集细胞上清液,离心5 min弃沉淀,检测细胞上清中LDH浓度,根据标准品的浓度与A值计算出不同处理组LDH浓度。根据ELISA试剂盒操作说明,分别检测细胞上清中人β-防御素(human β-defensin 2,hBD2)、粒巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)、粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)的浓度,根据标准品的浓度与A值计算出待测样品中各种细胞因子浓度。
9.统计学分析:采用SPSS 23.0 统计学软件进行分析,正态分布的计量资料以表示,组间比较采用单因素方差分析。双侧检验,检验水准α=0.05。
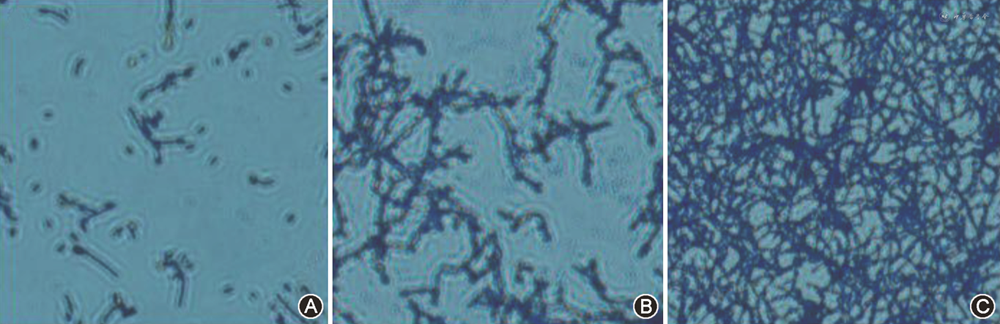
1.不同白色念珠菌生物膜测定分析:25株白色念珠菌中,不产膜菌株3株,中产膜菌株4株,强产膜菌株18株。其中耐氟康唑白色念珠菌为中产膜菌株,标准株SC5314为强产膜菌株。结晶紫染色结果显示,强产膜菌多呈菌丝状相互交错密集生长,而不产膜菌大部分以酵母样黏附于底部,说明酵母相可能是不产膜白色念珠菌的形态,菌丝相是白色念珠菌生物膜构成的主要形态(图1)。

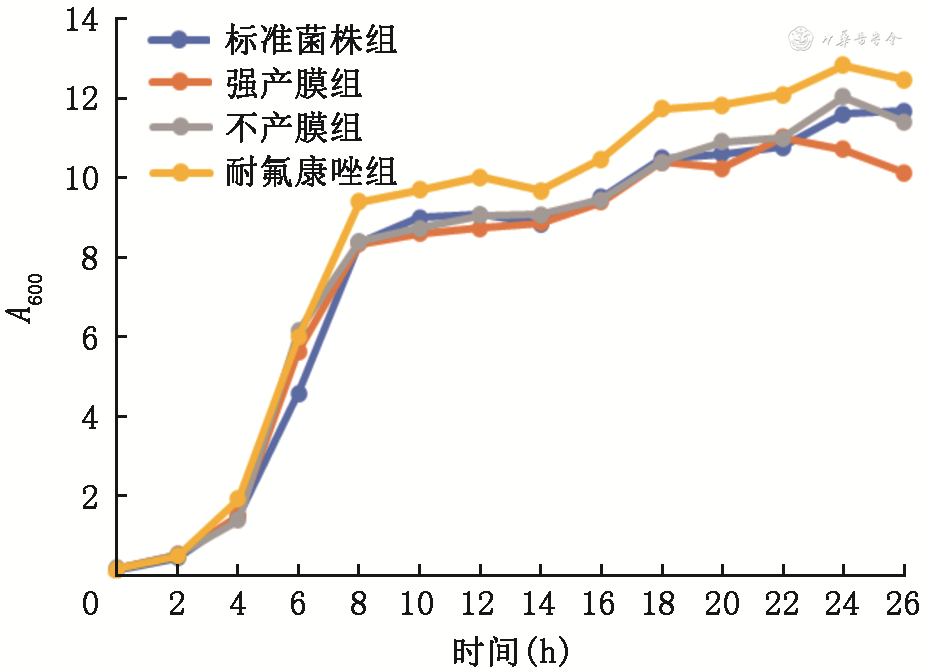
2.白色念珠菌生长动力学比较:白色念珠菌生长动力学曲线见图2。各组菌株数量在2~20 h内均随时间的增加而呈现上升趋势,在2~10 h处于对数生长期,在10~20 h处于平缓期。

3.气液相培养hBEC形态:扫描电镜结果显示,气液相培养下的hBEC在微孔膜上可以形成一层完整的细胞层,生长状态良好,形状不规则,表面有大量的突起,同时伴有大量分泌物的形成。细胞表面有微绒毛形成,细胞间相互挤压生长更加紧密,细胞与细胞之间有明显的细胞连接(图3A、D)。与对照组细胞相比,白色念珠菌感染的上皮细胞,细胞表面的微绒毛出现塌陷、融合,部分菌丝入侵的地方,绒毛有脱落,黏液分泌减少,且菌丝能够主动入侵hBEC及其相邻的hBEC(图3B、C、E、F)。


4.免疫荧光检测上皮标志蛋白的表达:气液相培养的hBEC可以分化出初级和运动的纤毛乙酰化的α-微管蛋白(ace-α-tubulin)、β-微管蛋白(β-tubulin)以及基底上皮细胞角蛋白(Krt14)。而与对照组相比,经过白色念珠菌刺激后的气液相hBEC,纤毛和角蛋白的表达量明显减少,同时细胞增殖相关蛋白(Ki67)的表达也被下调,说明白色念珠菌感染hBEC可抑制hBEC的增殖,并导致宿主细胞纤毛脱落,破坏hBEC的完整性(图4)。
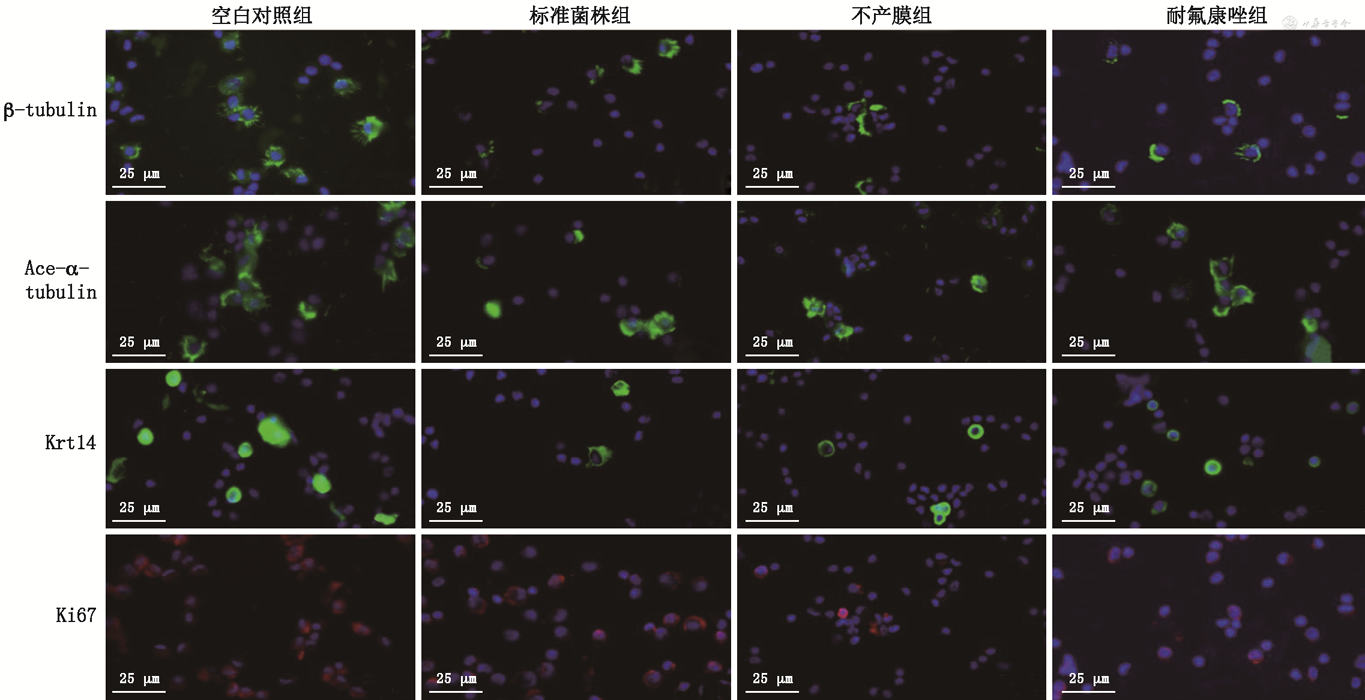

注:β-tubulin为β-微管蛋白;Ace-α-tubulin为纤毛乙酰化的α-微管蛋白;Krt14为基底上皮细胞角蛋白;Ki67为细胞增殖相关蛋白
5.白色念珠菌感染引起的细胞毒性检测:空白对照组、标准菌株组、强产膜组、不产膜组、耐氟康唑组LDH含量分别为(12.21±5.68)、(46.35±6.35)、(18.69±4.38)、(12.56±3.69)、(13.48±4.28)U/L,差异有统计学意义(F=60.07,P<0.001);与标准菌株组相比,强产膜组、不产膜组、耐氟康唑组LDH含量均显著降低(均P<0.01);与空白对照组相比,白色念珠菌感染的气液相上皮细胞,产生的细胞毒性都很低;只有产膜能力最强的标准菌株组,其LDH含量高于强产膜组、不产膜组和耐氟康唑组(均P<0.05)。结果表明产膜能力最强的标准菌株白色念珠菌感染可以引起上皮细胞胞内LDH含量的上升,从而导致细胞坏死。
6.ELISA测定细胞因子的表达:hBD2、GM-CSF、G-CSF细胞因子的表达量结果见表1。与空白对照组相比,只有标准菌株组的上皮细胞可诱导细胞内hBD2表达量增加(P<0.001),而强产膜组、不产膜组、耐氟康唑组hBD2表达量均未增加(均P>0.05)。不同组别间GM-CSF、G-CSF的表达量差异均无统计学意义(均P>0.05)。
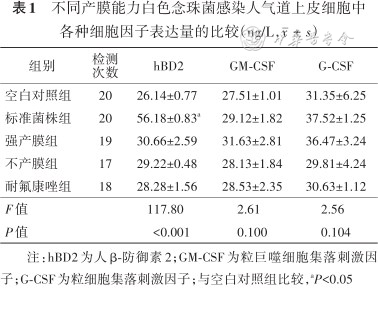
不同产膜能力白色念珠菌感染人气道上皮细胞中各种细胞因子表达量的比较(ng/L,)
不同产膜能力白色念珠菌感染人气道上皮细胞中各种细胞因子表达量的比较(ng/L,)
| 组别 | 检测次数 | hBD2 | GM-CSF | G-CSF |
|---|---|---|---|---|
| 空白对照组 | 20 | 26.14±0.77 | 27.51±1.01 | 31.35±6.25 |
| 标准菌株组 | 20 | 56.18±0.83a | 29.12±1.82 | 37.52±1.25 |
| 强产膜组 | 19 | 30.66±2.59 | 31.63±2.81 | 36.47±3.24 |
| 不产膜组 | 17 | 29.22±0.48 | 28.13±1.84 | 29.81±4.24 |
| 耐氟康唑组 | 18 | 28.28±1.56 | 28.53±2.35 | 30.63±1.12 |
| F值 | 117.80 | 2.61 | 2.56 | |
| P值 | <0.001 | 0.100 | 0.104 |
注:hBD2为人β-防御素2;GM-CSF为粒巨噬细胞集落刺激因子;G-CSF为粒细胞集落刺激因子;与空白对照组比较,aP<0.05
白色念珠菌常见的表现形式包括酵母菌和菌丝,其中酵母菌体积小,单细胞,一般通过血液传播;而菌丝通常为自然入侵,可以逃避血管系统,渗透到内部器官,并损害宿主[6]。生物膜的出现造成上皮细胞完整性的丧失和上皮细胞的坏死,更有利于逃逸宿主防御[7, 8]。本研究中,强产膜菌多呈菌丝状相互交错密集生长,而不产膜菌大部分以酵母样黏附于底部,说明酵母相是不产膜白色念珠菌的形态,菌丝相是白色念珠菌生物膜构成的主要形态。白色念珠菌从共生生物到病原体的转变归因于在适当的易感性条件下选择性表达的大量毒力因子[9, 10]。白色念珠菌致病毒力因子主要有:二相性转变、黏附素、分泌水解酶以及生物被膜的形成[11]。
白色念珠菌感染宿主细胞的机制有两个:真菌诱导的内吞作用、真菌的主动入侵。本研究通过扫描电镜实验发现,在hBEC中,白色念珠菌感染的后期,菌丝主动入侵上皮细胞,使上皮细胞的微绒毛融合,出现塌陷,部分地方有绒毛脱落,导致细胞的凋亡和坏死。免疫荧光实验结果显示白色念珠菌感染可下调纤毛乙酰化的α-微管蛋白、β-微管蛋白以及基底上皮细胞角蛋白Krt14,同时细胞增殖相关蛋白Ki67的表达也被下调,进而抑制上皮细胞增殖。以上结果说明白色念珠菌通过主动入侵方式进入细胞,引起上皮细胞形态发生变化,使上皮细胞受损,最终破坏上皮细胞的完整性。
细胞坏死的明显标志是胞内LDH含量增加,以此表征细胞毒性。有研究表明[12],白色念珠菌通过肠上皮屏障易位介导的上皮细胞损伤,可释放大量LDH,这与本研究结果并不完全一致。本研究中只有最强生物膜的菌株可诱导上皮细胞损伤,并伴随LDH的释放。这可能是由于气液相培养的细胞属于假复层状上皮细胞,在抵御外界刺激以及病原菌入侵方面具有比单层细胞更强的保护作用。
支气管上皮细胞是机体呼吸系统免疫防御的重要屏障,当呼吸系统被有毒、有害物质或病原菌感染时,上皮细胞参与炎症反应,分泌多种细胞因子和趋化因子进行免疫防御[13]。非专业的免疫细胞,例如上皮细胞、内皮细胞、成纤维细胞等可以通过激活Toll样受体(Toll-like receptors,TLRs)或释放细胞因子等方式来发挥固有免疫效应[14, 15, 16]。免疫系统有多种多样的固有免疫受体去感知并传递外界的感染信号,这些受体通常表达在细胞表面、胞质内或分泌在血液和组织[17]。能够识别病原体的最常见的固有免疫受体是模式识别受体[18]。包括TLRs、C型凝集素受体和NODs受体。在模式识别受体中,TLRs是最具代表性的受体家族[19]。针对大多数微生物等病原体的免疫反应都要依赖TLRs来完成,在脊椎动物的微生物感染中,TLRs是主要的免疫识别受体系统[20]。然而,除了在宿主防御中的作用外,最近的研究表明,TLRs在维持上皮细胞稳态和避免细胞损伤方面有着更常见的作用[21]。其中,TLR2与 TLR4和宿主抵御白色念珠菌的感染有密切的关系[22],TLRs对上皮细胞的免疫保护作用,引起上皮细胞产生IL-8、GM-CSF和其他的一些促炎因子,例如hBD2、G-CSF等,hBD2是宿主黏膜表面防御的关键成分,本研究通过ELISA法评估hBD2、GM-CSF及G-CSF在白色念珠菌感染的上皮细胞中的表达,发现与对照组相比,在强产膜菌株的刺激下,hBD2的表达被显著上调,而GM-CSF、G-CSF的变化并不明显。这些细胞因子已经涉及到抵御白色念珠菌感染的免疫机制中[23]。
综上所述,白色念珠菌感染hBEC主要以主动入侵的方式发生,可引起细胞表面绒毛的脱落,上皮细胞标志蛋白减少,抑制细胞增殖,破坏上皮细胞的完整性诱导细胞损伤。强产膜菌更容易发生免疫逃逸,引发机体反复严重感染。同时强产膜能力白色念珠菌能刺激细胞产生不同的细胞因子来发挥免疫反应,引起上皮细胞中的炎症反应,进而产生炎性介质以调控免疫应答。随着耐药性形成的分子机制、基因对生物膜形成的调控机制等方面的研究进展,将加深临床对白色念珠菌生物被膜的分子调控机制的认识和了解,为临床上防治白色念珠菌引起的感染提供理论依据,为抗真菌药物的研发提供方向。
所有作者均声明不存在利益冲突



























