
骨髓增生异常综合征(MDS)患者因粒细胞缺乏、免疫力减低,容易合并严重感染。感染性心内膜炎(IE)为少见感染,表现为发热、心脏瓣膜杂音、心脏瓣膜赘生物,出现血管和免疫学异常,有可能合并脑、肺或脾栓塞等。因其临床表现不典型,容易出现漏诊或误诊。本文拟通过对1例MDS患者合并IE的诊治经过,复习相关文献,以提高临床医生对血液病合并IE的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,35岁,主因“血小板减少5年,全血细胞减少7个月,发热5 d”于2020年11月10日收入首都医科大学附属复兴医院。患者5年前妊娠期间出现血小板减少,未诊治。7个月前血常规白细胞(WBC)1.96×109/L、血红蛋白(Hb)46 g/L、血小板(PLT)13×109/L,骨髓形态学提示骨髓增生Ⅱ级,原始粒细胞2%,35%幼红细胞有巨幼样或核碎裂表现,全片巨核细胞22只,8只为核畸形或核分叶颗粒巨核细胞;骨髓流式CD117+原始/幼稚细胞占有核细胞总数1.8%,其免疫表型CD34-CD117+CD33+CD13+HLA-DR+CD7部分+,CD10-CD19-CD56-CD5-CD2-CD3-,粒细胞比例相对减少,免疫表型CD11b,CD13,CD15,CD16可见表达紊乱;染色体:46,XX[20];骨髓增生异常综合征(MDS)荧光原位杂交(FISH):未检测到+8、20q-、17p-、7q-/-7等;融合基因:NPM132. 3%,KM T2D 48. 9%。诊断“MDS伴多系血细胞发育异常(MDS-MLD),国际预后积分系统(IPSS)中危-1”,予以成分输血治疗。2020年4月开始先后口服十一酸睾酮、维A酸、达那唑、泼尼松、氨肽素口服,疗效欠佳,拟行异基因造血干细胞移植。2020年11月5日患者无诱因出现发热,体温最高39℃,无畏寒、寒战,无咽痛、咳嗽、咳痰等不适,查血常规WBC 0.4×109/L、Hb 54g/L、PLT 21×109/L,降钙素原(PCT)10.2ng/ml,电子计算机断层扫描(CT)示右肺炎症,血培养检出铜绿假单胞菌,先后予亚胺培南、万古霉素、莫西沙星抗感染治疗,仍有发热,体温最高40℃。2020年11月9日出现血压下降,间羟胺10ml/h泵注升压治疗,血压维持在90/50 mmHg(1 mmHg=0.133 kPa)左右,为进一步诊治收入本科。患者既往体健。入院查体:体温36.8℃,心率80次/min,呼吸 22次/min,血压90/50 mmHg,贫血貌,表情淡漠,全身皮肤可见淤点、瘀斑,咽充血,双侧扁桃体未见肿大,双下肺叩诊呈浊音,双肺呼吸音粗,双肺可闻及湿啰音,心率80次/min,心律齐,二尖瓣听诊区、主动脉瓣听诊区闻及2/6级舒张期杂音,无压痛,肝脾肋下未触及,双下肢凹陷性水肿。入院诊断MDS-MLD IPSS中危-1、菌血症、重症肺炎、感染中毒性休克。
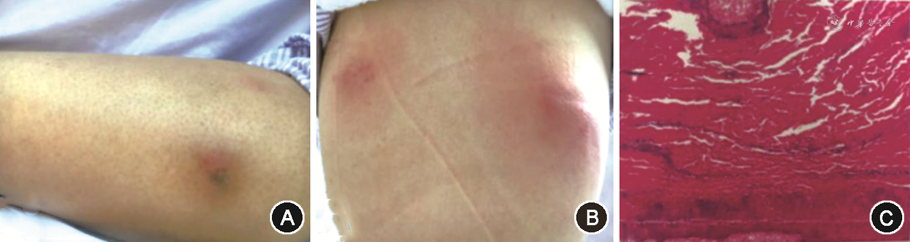
入院予美罗培南、万古霉素抗感染,同时予细胞因子促进造血等支持治疗,2020年11月13日休克纠正、血压恢复,患者仍有反复高热、体温最高39℃,鉴于患者持续粒细胞缺乏且应用广谱抗生素超过1周,不除外合并真菌感染可能,加用伏立康唑抗真菌治疗,2020年11月14日流感病毒抗体阳性、超广谱抗细菌治疗9 d仍疗效不佳,根据外院血培养铜绿假单胞菌阳性对环丙沙星敏感停用美罗培南及万古霉素,继续环丙沙星抗细菌、伏立康唑抗真菌,并联合奥司他韦抗病毒治疗。2020年11月16日体温高峰一度下降至37.5℃左右。2020年11月18日体温再次达38.5℃,出现右下肢皮下结节,局部红肿疼痛、皮温增高,考虑合并皮肤感染,再次加用万古霉素,联合环丙沙星、伏立康唑抗感染治疗,皮下结节部位增多,双侧大腿、右上肢及背部出现数个皮下结节(图1A、B),局部皮温高,伴有触痛,考虑迅速出现新发的多处皮肤软组织感染,停用环丙沙星,调整为哌拉西林钠他唑巴坦,同时继续万古霉素联合伏立康唑抗感染治疗,患者仍高热,皮下结节未控制,2020年11月21日将抗球菌药物调整为利奈唑胺。2020年11月23日患者体温高峰42℃,复查肺CT显示炎症较前减轻,考虑体温升高与皮肤软组织感染相关,根据其存在多发皮肤结节,且伴有红肿热痛、同时合并菌血症,考虑皮肤表现为血行播散可能,心脏彩超及腹部超声结果未发现心内膜炎、肝脓肿证据,将哌拉西林他唑巴坦调整为美罗培南、利奈唑胺联合伏立康唑抗感染。2020年11月22日拔除经外周插管的中心静脉导管(PICC),行导管尖端二代测序检查,2020年11月26日结果回报可见铜绿假单胞菌、金黄色葡萄球菌,同时检出铜绿假单胞菌耐药相关TEM和CAT基因,加用阿米卡星。2020年11月28日体温高峰仍无下降,调整为头孢他啶阿维巴坦、克林霉素、阿米卡星联合伏立康唑抗感染治疗,体温高峰仍波动在40℃左右。2020年11月24日行皮肤活检,2020年11月29日结果回报镜下见表皮增生,真皮小血管及附属器周围见多量中性粒细胞及少量淋巴细胞浸润(图1C)。

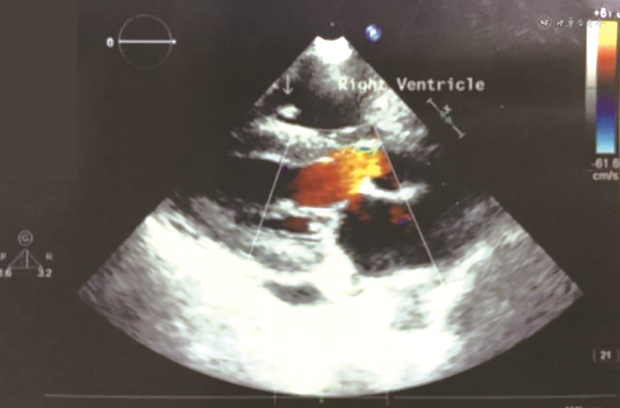
2020年12月1日复查肺CT,炎症进一步吸收,但患者仍高热,心脏查体二尖瓣区可闻及收缩期2级吹风样杂音,经胸超声心动图(TTE)瓣膜反流较前无明显变化,肺动脉收缩压升至65 mmHg,未见赘生物,调整为美罗培南2 g/次、3次/d静脉滴注,环丙沙星400 mg/次、2次/d静脉滴注,阿米卡星0.4 g/次、2次/d静脉滴注,利福平600 mg/次、1次/d口服,达托霉素360 mg/次、1次/d静脉滴注,磺胺0.48 g/次、1次/d口服联合伏立康唑200 mg/次、2次/d静脉滴注抗感染治疗,体温仍不能控制。2020年12月7日再次出现42℃的体温高峰,将阿米卡星调整为乙胺丁醇并停用伏立康唑,2020年12月8日仍因血小板低下难以承受经食管超声心动图(TEE),再次TTE检查,右心室内探及多个低-中等回声团块,附着于三尖瓣前叶腱索上,最大约16.0 mm×7.3 mm(图2),活动度小,左心室内探及低-中等回声团块,约2.8 mm×3.6 mm,附着于二尖瓣外乳头肌上,活动度小,瓣膜反流较前无明显变化,肺动脉收缩压降至35 mmHg。患者感染性心内膜炎(IE)诊断明确,有手术指征、需行瓣膜置换术,但因血小板明显减少无法手术治疗。2020年12月8日复查肺CT可见新发炎症,患者经多种抗生素治疗后,二尖瓣反流较前下降,肺动脉压有所回落,但体温仍未能控制,2020年12月13日患者自动出院。

MDS有发生IE的可能性,因疾病本身存在贫血或心脏杂音而掩盖IE的临床表现。
IE临床表现缺乏特异性,即便疑诊IE,TTE漏诊率高。
MDS患者血小板低下,一方面限制TEE检查的应用、造成延误诊断,另一方面使具备手术适应症的患者无法耐受手术治疗,最终影响预后。
MDS合并感染性发热时应积极血培养寻找病原学,必要时反复多次留取,要密切关注血培养证实有血流感染的患者心脏杂音变化。
对发生心脏杂音改变的患者及时安排TTE检查,对有瓣膜反流增加和(或)肺动脉高压(PAH)的患者及时与超声科医生沟通尽可能TEE检查寻找心内膜赘生物。
血培养阴性患者病原微生物二代测序可以作为必要的补充。
对于缺乏特异性的皮肤感染表现要警惕IE造成菌栓脱落的可能性。
MDS是一组起源于造血干细胞的异质性髓系克隆性疾病,表现为髓系细胞发育异常,无效造血、血细胞减少等[1]。MDS常合并粒细胞缺乏、感染高发,严重时导致死亡。但通常能够明确感染部位的患者仅占50%,最常见感染部位为肺,其后依次为上呼吸道、肛周、血液感染等[2]。IE在欧洲的发生率为每年3/10万~10/10万[3],在MDS、急性白血病等血液肿瘤患者的发生率无流行病学资料。有学者分析了2009—2013年收治的605例合并感染的恶性血液病患者,只发生1例IE[4]。Demir等[5]和Konik等[6]分别报道1例MDS患者合并真菌性IE,其中1例不治死亡,1例症状缓解。血液病患者免疫力低下,是IE的高危人群,但血液病患者合并IE报道很少。
IE的典型临床表现包括[7]:新出现的反流性心脏杂音、不明来源的栓塞;不明原因的脓毒症(特别是可导致IE的病原体)、发热等。其中最常见的表现是发热,其次为心脏杂音,老年患者及免疫抑制状态患者的临床表现常不典型[6]。Servy等[8]研究487例IE患者,其中58例(11.9%)有皮肤表现(5例有2种皮肤表现),39例(8.0%)有紫癜,13例(2.7%)有Osler结节,8例(1.6%)有Janeway病变。典型的IE皮肤改变为皮肤黏膜瘀点(常见于锁骨以上皮肤、口腔黏膜及睑结膜)、Roth 斑(视网膜的卵圆形出血斑)、Osler 结节(指和趾垫出现豌豆大小的红色或紫色痛性结节)、Janeway 损害(手掌或足跖处直径 1~4 mm 无痛性出血性红斑)。此例患者有发热、菌血症、新出现的心脏杂音,但其皮肤损害不是典型的IE皮肤改变,以躯干部位多发游走性皮下结节为突出表现,最大结节直径约15 cm,伴有明显的红肿热痛,造成鉴别诊断困难。
PAH的出现对IE的诊断有一定提示作用,通过心脏彩超检查可实现早期诊断。陈勇等[9]研究7例妊娠合并IE患者,有5例合并PAH。此例患者肺动脉压从35 mmHg升高至65 mmHg,且PAH出现早于心脏瓣膜杂音改变,可以对IE诊断起到预警作用。目前IE引起PAH的机制尚不明确,瓣膜引起左心衰竭、IE的栓塞表现都可能引起PAH。
IE的主要诊断标准是血培养阳性和心内膜感染的证据(心脏超声赘生物、脓肿及新出现的人工瓣膜瓣开裂或新出现的瓣膜反流)。TTE及TEE对IE诊断的敏感性[7]分别为40%~63%和90%~100%。此例患者第2次TTE发现三尖瓣反流有少量增加至中量,同时开始出现二尖瓣反流,肺动脉压由35 mmHg升至65 mmHg,高度怀疑IE可能,最终第4次TTE才发现瓣膜赘生物,得以确诊。IE的诊断同时需要确定病原菌。病理、血培养都是确定病原菌的重要手段。病程中发生过任何一种菌血症都需要警惕IE,本患者病初期有过铜绿假单胞菌血症,尽管后期多次血培养阴性,但血、PICC管尖病原微生物二代测序均检出铜绿假单胞菌,显然长期超广谱抗生素应用导致了后续多次血培养的假阴性。基于心脏彩超及血培养做出的临床诊断,仍可能出现误诊。有文献报道1例MDS患者合并眼眶真菌感染,TTE、TEE均发现三尖瓣13 mm的回声肿块,可疑IE,手术病理诊断乳头状纤维弹性瘤[10]。因此病理学检查才是IE诊断的金标准。
我国IE最常见病原菌为链球菌和葡萄球菌[7,11]。许环亲等[12]研究 85例IE患者,呼吸系统感染占42.31%,泌尿系统感染占30.77%,消化系统感染占15.48%,其他部位感染占11.54%。感染患者共分离出病原菌43株,其中革兰阴性菌26株,革兰阳性菌12株,真菌5株。美国统计近15年的IE患者,金黄色葡萄球菌引起的IE显著增多[13]。有文献报道57例IE患者,其中葡萄球菌感染占34%,链球菌感染占16%,其他病原菌感染占13%,另有37%患者培养阴性[14]。IE治愈的关键在于清除赘生物中的病原微生物[7]。抗感染治疗基本要求是:应用杀菌剂、联合应用2种具有协同作用的抗菌药物、大剂量、静脉、长疗程给药4~6周,以降低复发率。内科治疗在有严重脓毒症、并有多重耐药肠杆菌科细菌、铜绿假单胞菌感染危险因素时,建议予万古霉素联合美罗培南经验性抗感染治疗,同时等待血培养结果。葡萄球菌心内膜炎治疗方案宜根据病原菌是否属甲氧西林耐药株而定,在获知细菌药敏前经验治疗宜首选耐酶青霉素类。需氧革兰阴性杆菌心内膜炎应选用具抗假单胞菌活性的青霉素类或头孢菌素类联合抗假单胞菌氨基糖苷类,疗程常需6~8周或更长[7]。约一半的IE患者在活跃期(即患者仍在接受抗生素治疗期间)因心力衰竭、感染无法控制以及预防栓塞事件等严重并发症需手术治疗[10,15]。活跃期接受手术治疗存在显著的风险。此例患者在活跃期内有明确的手术指征,但因无法耐受手术继续内科抗感染治疗,尽管体温下降不理想,但患者的肺动脉压和瓣膜反流有改善,提示内科治疗存在一定疗效。
总之,恶性血液病患者粒细胞缺乏合并发热时要警惕IE的可能性。播散性皮肤结节、心脏瓣膜杂音改变、肺动脉压升高、瓣膜反流的变化都提示要警惕IE。铜绿假单胞菌败血症进展快,致死率高,易耐药,对合并此类感染的粒缺患者早期予以强化抗感染治疗是必要的,一般多采用多药联合方案。铜绿假单胞菌败血症一旦发生,死亡率超过60%。IE的早期诊断至关重要,需要临床医生提高对IE的认识。
所有作者均声明不存在利益冲突



























