
供者特异性抗体(DSA)的预防、诊断和针对性治疗是目前肾移植抗体介导排斥反应(AMR)临床诊疗的关键。免疫抑制治疗强度不足以控制由同种异体人类白细胞抗原(HLA)激发的免疫反应是受者产生DSA的原因。肾移植受者术后应定期检测HLA抗体,分析阳性HLA抗体是否具有供者特异性,综合DSA的特性和病理活检诊断及时明确其临床意义,指导进一步的合理治疗。对DSA应重在预防、定期检测、积极适度治疗,防止AMR疾病过程中一系列不良事件的因果发展,以期提高移植肾长期存活率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分
本世纪初以来,在肾移植领域抗体介导排斥反应(antibody-mediated rejection,AMR)日益受到重视[1]。越来越多的证据显示AMR是影响移植肾长期存活的最大的障碍,约60%的移植肾失功与其有关[2];而且,AMR相对于细胞介导的排斥反应(T cell-mediated rejection,TCMR)病理机制和临床表现更为复杂,诊断和治疗更为困难。因此,中国医药生物技术协会移植技术分会和上海市肾脏移植质量控制中心组织专家撰写了3篇共识[3, 4, 5],对肾移植AMR进行了较为全面和详细的梳理。本文就其中的临床重点问题及其内在关系做简要概述。
供者特异性抗体(donor-specific antibody,DSA)是AMR的初始病因。《黄帝内经》云:“治病必求于本”,DSA的预防、诊断和针对性治疗是 AMR临床诊疗的关键,主要包括以下三方面问题。
所谓供者特异性,是指抗体只针对供肾携带的同种异体抗原而不针对受者的自身抗原。目前认为供者和受者抗原性的差异主要体现在人类白细胞抗原(human leucocyte antigen,HLA)系统。尽管HLA之外人类还有其他具有多态性的抗原,也可以激活受者的免疫应答产生非 HLA 抗体[6],但目前学界广泛认同抗供者HLA抗体是实体器官移植AMR的主要病因[7](下文DSA暂不涉及非HLA抗体)。供者的差异性HLA既是激发受者免疫系统产生DSA的原始动因,也是DSA的攻击靶点。供受者之间HLA差异越大,免疫反应越强。因此准确分析潜在供受者HLA的差异是优化器官分配、评估肾移植免疫风险和指导免疫抑制治疗的必要基础。
目前国内、外大部分移植中心仍在使用中低分辨率的HLA分型方法。这些方法虽然技术成熟,试验时间短,但是得到的是HLA血清型分型结果,不能代表抗原的唯一性。近年来HLA分型方法不断进步,分辨率越来越高,高分辨HLA分型方法可以得到抗原的唯一氨基酸序列的结果,这是准确分析HLA的免疫原性和抗原性的必要基础[3]。相较于传统的血清型错配数,目前基于HLA 高分辨分型有数种计算机辅助的分子配型方法,可以更精确地评估供受者HLA的错配负荷,其中功能表位分析法的研究比较充分。其基本原理是:每种HLA分子都包含一系列功能性表位,由各个功能性表位而不是整体HLA抗原决定了相应抗体的特异性结合[8]。通过比对功能性表位错配数,可以更准确评估HLA分子之间的抗原性和免疫原性的差异。供受者HLA的功能性表位错配数越少,产生DSA的可能性越小[9]。
除非是同卵双生,供受者HLA都存在或多或少的差异,受者需要接受免疫抑制治疗以控制对同种异体HLA的免疫反应。当免疫抑制强度相对不足时,免疫系统启动反应,经过一系列免疫检查点事件,包括T细胞激活、B细胞激活、T-B细胞交互作用、B细胞生发中心反应等,最终产生免疫记忆和DSA。
因此器官移植受者DSA产生的两大决定因素为:移植物HLA的免疫原性以及受者免疫系统的反应性[10]。免疫抑制强度不足以控制由同种异体HLA激发的免疫反应是受者产生DSA的原因。
DSA具有两方面临床意义:一方面可以作为器官移植后免疫抑制不足和可能发生排斥反应的生物标志物[11],另一方面它也是引起AMR损伤的初始病因。因此对DSA的检测和诊断是移植临床中非常重要的问题。除了移植手术前获取供者活细胞通过经典淋巴细胞交叉反应试验筛查DSA以外,临床DSA的检测实际包含三步,首先检测是否存在HLA抗体,其次判断HLA抗体是否具有供者特异性,最后评估DSA的临床意义。
HLA抗体的检测方法根据不同的HLA抗原携带载体分为细胞学法和纯化抗原法。纯化抗原法用纯化的HLA 作为抗原载体,直接与受者血清反应检测相应抗体。因其不依赖于供者的细胞,适合于术前和术后HLA抗体的检测,目前广泛应用的单抗原微珠法(single antigen beads,SAB),敏感性高,可以明确抗体的抗原特异性。但是受试剂携带抗原种类数的限制和抗原制备过程中的变性等因素的影响,存在抗体漏检和假阳性的可能[12]。因此,当手术前获得供者活细胞后一定要采用细胞法进行交叉反应试验,以检测真实完整的供者抗原谱,确保移植安全。
通过纯化抗原法检测到的HLA抗体,并非都是DSA,需要进一步判别这些抗体对于供者 HLA有无特异性的结合。SAB法可以显示HLA抗体对应的HLA基因型,当其与供者HLA基因型一致时,可推断是DSA。因此获得供者HLA基因型是准确判断受者体内HLA抗体是否是 DSA的必要条件。需要注意的是,由于目前中国人群常见的HLA基因型并未被现有SAB试剂完全覆盖,可能出现检测盲区,此时可以通过HLA功能表位分析来帮助判定。携带共同功能性表位的抗原之间存在抗体交叉反应,因此当阳性抗体针对的HLA与漏检的供者HLA存在共同功能性表位时,该抗体有可能是DSA。
用SAB法检测DSA可以得到平均荧光强度(mean fluorescence intensity,MFI)数据,一般将校正后MFI>1 000作为阳性阈值[13]。虽然MFI不能准确代表抗体的含量,但在试验条件基本一致的情况下,能一定程度反映抗体的强度,也与AMR的风险正相关。对于预存DSA(preformed DSA,pfDSA)而言,根据国内外多家配型实验室的经验,HLA-A、B、DR 抗体的MFI值<2 000,DQ抗体的MFI值<5 000,DP抗体的MFI值<7 000,C抗体的MFI值<10 000 时,通常流式交叉反应阴性,临床风险可接受。新生 DSA(de novo DSA,dnDSA)则多见DQ和DR位点的抗体[14],当MFI>3000或上升>25%时,建议进行移植肾监视性活检和病理学诊断,明确是否存在AMR[5]。
应对DSA的总体原则可归纳为:重在预防,定期检测,合理治疗。根据产生的时间DSA分为pfDSA和dnDSA[11,15]。在移植之前就存在的HLA抗体,称为预存HLA抗体,其中针对移植肾HLA的抗体,被称为pfDSA。而在移植之后新产生的针对移植肾HLA的抗体则被称为dnDSA。对于这两种DSA,上述应对原则有不同的含义。
对致敏等待者而言,最好的防范pfDSA的办法是选择不携带预存HLA抗体所针对的HLA的供肾[4]。这样预存HLA抗体就是非DSA,对移植肾的影响很小。致敏受者避开致敏抗原寻找到合适供肾的可能性由其HLA抗体谱的宽窄决定。根据受者已发现的所有HLA抗体的种类,以及潜在供者人群HLA的频率,就可以计算出受者预存HLA抗体与供者人群发生特异性反应的百分率,也就是cPRA。致敏等待者cPRA越高,寻找到合适供肾的概率越小[16]。目前各国对高cPRA等待者都有一定的分配优先政策,以促进供肾分配的公平性。致敏等待者HLA抗体的种类和强度可能随时间变化,因此每3~6个月应检测一次,根据检测结果调整cPRA。对于高cPRA的等待者,可进行脱敏治疗,以降低 HLA抗体的强度和缩窄HLA抗体谱的宽度,以增加获得合适供肾的可能性。但目前国内外还没有公认的标准脱敏治疗方案,对于高致敏等待者的脱敏治疗往往需要较长疗程及较大花费,且脱敏效果个体差异大。应根据致敏程度和有无潜在供者,在等待者充分知情后合理制定脱敏治疗方案。
新生DSA的产生主要由移植肾的免疫原性和受者免疫反应能力决定[17],故其预防策略主要包括:第一提高配型的准确度,尽量减少供受者之间的错配负荷,第二是要根据受者的免疫风险,进行个体化的足量免疫抑制治疗。移植后对HLA抗体进行计划性动态监测,可以及早发现dnDSA,并提示可能存在免疫抑制不足,在尚未产生明显病理损伤时予以积极处理,往往预后较好。从dnDSA的产生到活动性AMR、慢性活动性AMR、慢性(非活动性)AMR是一个连续变化的病理过程,在此期间定期DSA检测,对抗体的种类及强度进行序贯观察,必要时行活检病理学诊断,对于判断病程的发展和调整治疗策略改善预后具有重要的意义[18]。总体而言,AMR以活动性病变为主时治疗效果好。DSA的针对性治疗策略包括清除循环DSA和减少DSA的产生。但目前仍没有一种治疗方法获得一致性的临床数据证明其对dnDSA有效[19],应根据受者的不同病情给予个体化治疗,推荐将血浆置换和静脉注射免疫球蛋白作为标准基础治疗,在此基础上根据各中心的经验探索性应用新型生物制剂[5]。
总之,肾移植临床、实验室等相关各方对DSA都应予以高度重视,多方协作[20],应用现代精准配型和风险评估手段[21],从供肾选择开始设防、术后规律监测、对pf DSA和dn DSA积极适度治疗,合理干预AMR疾病过程中一系列事件的因果发展[14],避免最终不良结局(图1),以期提高移植肾长期存活率。
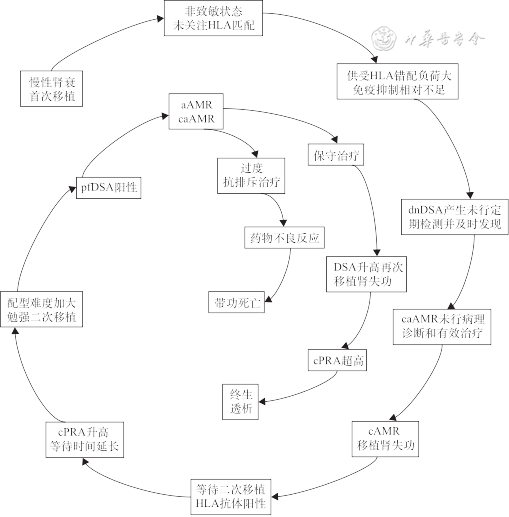

注:HLA为人类白细胞抗原;DSA为供者特异性抗体;dnDSA为新生DSA;pfDSA为预存DSA;cPRA为估算群体反应抗体反应率;AMR为抗体介导排斥反应;aAMR为活动性AMR;caAMR为慢性活动性AMR;cAMR为慢性AMR
海军军医大学长海医院器官移植中心郝美杰为本文制图
所有作者均声明不存在利益冲突
1.介导同种异体肾移植排斥反应的抗原主要是()
A.Rh抗原;
B.次要组织相容性抗原;
C.人类白细胞抗原;
D.组织特异性抗原;
E.ABO血型抗原
2.目前预防肾移植AMR的最理想方法是()
A.应用足量免疫抑制维持治疗;
B.移植前优化供受者HLA配型;
C.诱导治疗使用B细胞清除抗体;
D.诱导治疗使用T细胞清除抗体;
E.加强移植后免疫检测
3.肾脏移后最常见的dnDSA是针对哪个HLA位点()
A.HLA-A;
B.HLA-B;
C.HLA-C;
D.HLA-DQ、HLA-DR;
E.HLA-DP
4.关于HLA抗体,下列哪项说法正确()
A.SAB法能检测受者所有的HLA抗体;
B.cPRA越高,受者发生AMR的概率越大;
C.HLA抗体MFI值可量化表达抗体含量;
D.新生DSA的MFI值不断升高提示AMR风险增加;
E.通过纯化抗原法检测到的HLA抗体都是DSA
5.目前,影响移植肾长期存活的最主要因素是()
A.T细胞介导的排斥反应;
B.超急性排斥反应;
C.抗体介导的排斥反应;
D.移植肾肾病;
E.药物毒性作用



























