
检测初诊多发性骨髓瘤(MM)患者血清中分泌型成熟B细胞表面抗原(sBCMA)表达水平和在治疗过程中的变化,并探索其临床意义。
回顾性分析2018年8月至2020年9月苏州大学附属第一医院血液科收治的158例多发性骨髓瘤患者的临床资料。通过酶联免疫吸附试验(ELISA)测定患者血清中sBCMA的水平并和正常范围比较,并分析其与临床疗效、年龄、疾病类型、修订的国际分期系统(R-ISS)分期、肾功能、体液免疫功能等指标的关系。
患者中位年龄57岁(31~73岁),男86例(54.5%)、女72例(45.5%),以IgG型为主,占51.2%(81例)。初诊患者治疗前sBCMA值M(Q1,Q3)为76.50(55.50,94.40)μg/L,100%高于正常值上限(14.5 μg/L)。按照疗效评估分为完全缓解(CR)组、较好缓解(VGPR)组、部分缓解(PR)组及无效组,结果显示,CR组[80.10(58.05,96.90)比15.70(9.85,28.65)μg/L]及VGPR组[74.60(52.20,93.00)比17.20(13.30,38.80)μg/L]sBCMA水平较治疗前差异均有统计学意义(均P<0.001),PR组及无效组治疗前后血清sBCMA水平差异均无统计学意义(均P>0.05)。初诊患者血清完整蛋白型M蛋白含量与sBCMA表达水平呈正相关(r=0.22,P=0.040),骨髓浆细胞占比与sBCMA表达无相关性(r=0.07,P=0.449)。初诊时sBCMA水平与MM类型[IgG型、IgA型与轻链型分别为(78.6±3.5)、(72.4±5.4)与(83.8±6.9)μg/L]、年龄[≥65岁比<65岁:(73.6±5.5)比(79.3±3.1)μg/L]、R-ISS分期[Ⅰ、Ⅱ期比Ⅲ期:(80.2±3.1)比(69.4±6.1)μg/L]、肾功能[肌酐清除率(Ccr)≤30 ml/min比Ccr>30 ml/min:(81.6±4.8)比(76.5±3.4)μg/L]及高危核型[高危比标危:(73.6±5.7)比(80.2±3.2)μg/L]均无相关性(均P>0.05)。sBCMA的表达水平与MM患者IgM水平负相关(r=-0.39,P=0.002),而且治疗后sBCMA表达水平与MM患者IgM水平负相关(r=-0.25,P=0.015)。
MM患者血清中sBCMA表达变化是MM临床判断疗效的可靠指标并且与MM免疫缺陷发生及治疗后恢复相关。sBCMA可作为一种监测和预判MM患者疗效的新的独立标志物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(multiple meyloma,MM)是常见的恶性浆细胞病,随着新药(蛋白酶体抑制剂、免疫调节药物、单克隆抗体等)不断问世,MM患者疗效明显改善,但对于MM患者的临床状态变化的监测仍是一个难题[1]。目前用于检测的指标通常包括骨髓浆细胞比例、M蛋白和血清游离轻链(serum free light chain,sFLC)等,但是都有其局限性[2, 3]。因此需要找出新的检测标记物,更方便、快捷、准确地反应MM患者的肿瘤负荷变化。
B细胞成熟抗原(B cell maturation antigen,BCMA)是肿瘤坏死因子(tumor necrosis factor,TNF)受体超家族成员,发现于成熟正常B淋巴细胞和正常及恶性浆细胞表面的一种受体。BCMA与B细胞激活因子(B cell activating factor,BAAF)和增殖诱导配体(A Proliferation-induced Ligand,APRIL)结合促进MM细胞的存活和增殖,其上调与破骨细胞活化、黏附、血管生成/转移和免疫抑制相关[4]。MM细胞膜结合BCMA(mBCMA)被γ-分泌酶直接切割产生分泌型BCMA(sBCMA),MM患者血清中sBCMA增加[5]。sBCMA与APRIL结合导致MM免疫缺陷[6]。它还可以通过降低靶抗原的密度和结合BCMA介导的靶向治疗药物来影响其疗效[7]。相较于目前监测指标,sBCMA无需行骨髓穿刺术,患者创伤性小,接受程度更高。目前M蛋白是评估MM患者疾病状态的标志,但M蛋白半衰期3~4周[8],时间较长。sBCMA的半衰期(24~36 h)相较于M蛋白相比更短,对于临床状态变化的检测比M蛋白更快[9]。本研究拟通过检测初诊MM患者接受诱导治疗前后sBCMA表达水平的变化,探索sBCMA是否可能做为新的检测标记物,及其反应疗效和其他生物学指标的关系。
回顾性分析2018年8月至2020年9月苏州大学附属第一医院血液科收治的初诊158例MM患者。本研究符合《赫尔辛基宣言》原则及相关伦理要求。所有患者符合《中国多发性骨髓瘤诊治指南(2017年修订)》[10]标准进行诊断,按照修订的国际分期系统(revised international staging system,R-ISS)分期。所有患者在诱导治疗前完成血常规、生化检测(包括血清白蛋白、球蛋白、总蛋白、血钙、乳酸脱氢酶、肌酐)、β2微球蛋白检测、血清蛋白电泳、免疫固定电泳、sFLC检测、外周形态分析、骨髓细胞形态学检测、免疫分型检测、荧光原位杂交(fluorescence in situ hybridization,FISH)、骨髓活检;辅助检查:心电图、心脏超声、全身低剂量CT、磁共振弥散加权成像,所有患者按照《中国多发性骨髓瘤诊治指南(2017年修订)》遗传学高危定义为:FISH检测到t(4,14)、t(14,16)、t(14,20)或17P-染色体异常[10]。本研究符合《赫尔辛基宣言》原则及相关伦理要求。
1. sBCMA检测:血清样本采用BCMA酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)进行分析,该方法来自美国研发系统公司。血清样品被稀释1∶50,并按照说明书进行BCMA-ELISA检测。样品分析使用EPOCH2酶标仪,设置为450 nm,Gen5软件用于数据收集[11]。数值代表每个样本上的三个重复样本的平均值。正常值范围:2.4~14.5 μg/L。本研究在患者初诊前及完成诱导后进行了sBCMA检测。MM患者依据免疫学分型分为IgG、IgA、IgD、轻链型及不分泌型,由于IgD及不分泌型例数过少,本研究只统计了IgG、IgA、轻链型。
2. 治疗方法:使用硼替佐米、来那度胺联合地塞米松(VRD方案)治疗,具体方案为:硼替佐米1.3 mg/m2皮下注射(第1、4、8、11天),地塞米松20 mg/d静脉滴注(第1、2、4、5、8、9、11、12天),来那度胺25 mg/d(第1~21天),21 d为1个疗程;依据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南标准[12],对肾功能不全患者进行药物减量。所有患者治疗4个疗程后进行疗效评估。
3. 疗效标准:参考2016年国际骨髓工作组(International Myeloma Working Group,IMWG)制订的统一疗效标准[13],分为五级评分标准:完全缓解(complete remission,CR):免疫固定电泳显示为阴性,骨髓中浆细胞<5%,软组织浆细胞瘤检查彻底消失;非常好的部分缓解(very good partial remission,VGPR):血中M蛋白下降>90%;部分缓解(partial remission,PR):血清M蛋白下降>50%;疾病稳定(stable disease,SD):不符合其他标准,且无骨病变进展;疾病进展(progressive disease,PD):血中M蛋白升高。
4.统计学方法:采用统计软件包Graphpad Prism8.0对数据进行分析。符合正态分布的计量资料以表示,采用独立样本t检验进行两组间比较;偏态分布的计量资料以M(Q1,Q3)表示,采用秩和检验进行两组间比较;计数资料用例(%)表示,两组以上数据采用ANOVA进行比较;相关分析使用Spearman相关系数。双侧检验,检验水准α=0.05。
共计158例患者纳入本研究,年龄57(52,63)岁(31~73岁)。患者的一般资料见表1。

158例多发性骨髓瘤患者一般资料[例(%)]
158例多发性骨髓瘤患者一般资料[例(%)]
| 项目 | 结果 |
|---|---|
| 性别 | |
| 男 | 86(54.5) |
| 女 | 72(45.5) |
| 类型 | |
| IgG | 81(51.2) |
| IgA | 33(20.9) |
| IgD | 7(4.4) |
| 轻链型 | 36(22.8) |
| 不分泌型 | 1(0.6) |
| R-ISS分期 | |
| Ⅰ | 21(13.3) |
| Ⅱ | 108(68.4) |
| Ⅲ | 26(16.5) |
| 无法评估 | 3(1.9) |
| 核型 | |
| 高危 | 37(23.4) |
| 标危 | 117(74.1) |
| 无法评估 | 4(2.5) |
注:Ig为免疫球蛋白;R-ISS为修订的国际分期系统
所有患者初诊时sBCMA水平[76.50(55.50,94.40)μg/L]均高于正常值(14.50 μg/L)。完成诱导治疗后达到CR 68例(43%),VGPR 46例(29.1%),PR 17例(10.8%),SD 1例(0.6%),PD 8例(5.1%),无法评估18例(11.4%)。其中122例患者具有进行4个疗程VRD诱导治疗前后的sBCMA水平检测结果。CR组及VGPR组sBCMA水平下降,前后差异有统计学意义,PR组及无效组差异均无统计学意义[初诊诱导后,CR组:80.10(58.05,96.90)比15.70(9.85,28.65)μg/L,Z=13.43,P<0.001;VGPR组:74.60(52.20,93.00)比17.20(13.30,38.80)μg/L,Z=7.34,P<0.001;PR组:67.90(47.95,99.85)比43.50(22.85,68.65)μg/L,t=2.17,P=0.051;无效组:72.00(46.65,105.30)比65.10(52.60,87.65)μg/L,t=0.28,P=0.800]。
对比4组患者sBCMA下降幅度,CR组下降75.34%,VGPR组下降69.71%,PR组下降48.31%,无效组下降3.47%,sBCMA下降幅度与缓解深度有关联[CR、VGPR、PR以及无效组分别为61.10(43.45,77.65)、52.00(18.60,74.30)、32.80(-8.60,54.60)和2.50(-31.10,45.00)μg/L,F=5.61,P=0.001]。1例不分泌型患者的sBCMA水平变化与其骨髓浆细胞变化比较显示,sBCMA水平变化与其疾病过程中骨髓浆细胞占比变化有关联(r=0.99,P=0.049)(图1)。
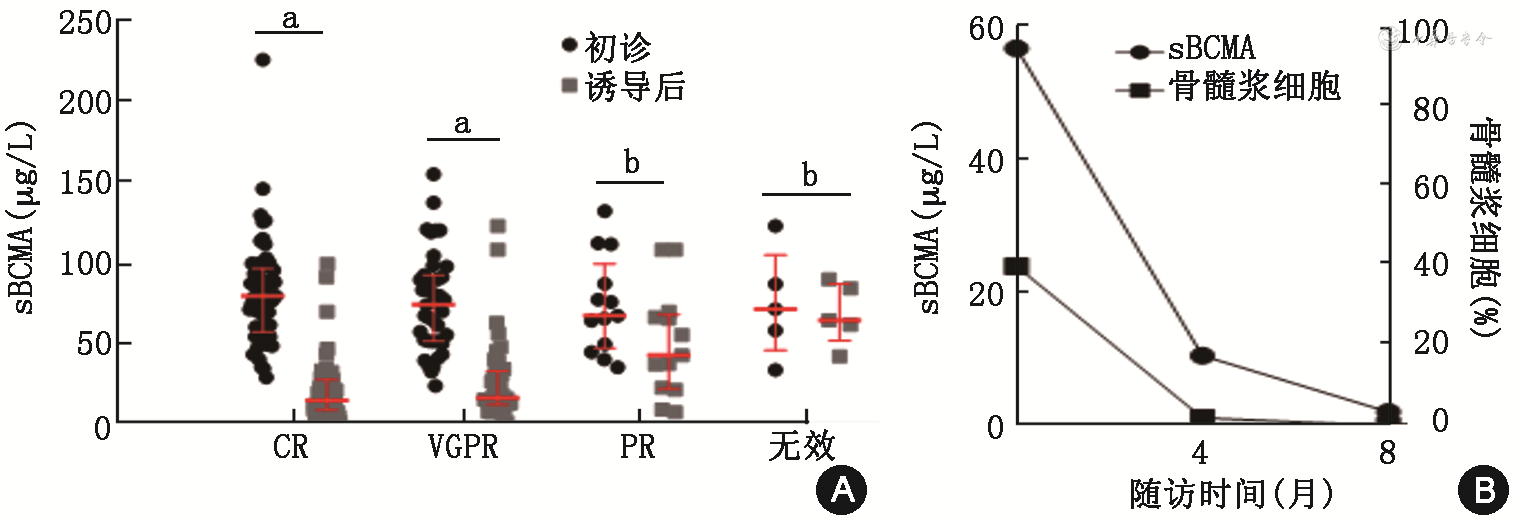

注:sBCMA为分泌型成熟B细胞表面抗原;CR为完全缓解(n=61);VGPR为较好缓解(n=39);PR为部分缓解(n=13);无效组(n=5);aP<0.001;bP>0.05
不同分型的MM患者sBCMA表达水平差异无统计学意义(P>0.05)(表2)。患者按照年龄是否≥65岁、R-ISS分期Ⅰ~Ⅱ期、Ⅲ期、肌酐清除率是否>30 ml/min、遗传学是否高危分为两组进行比较,差异均无统计学意义(均P>0.05)(表2)。
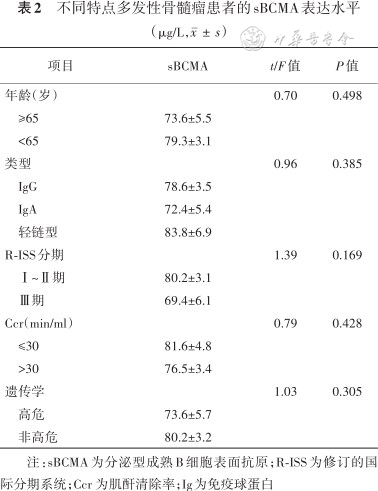
不同特点多发性骨髓瘤患者的sBCMA表达水平(μg/L,)
不同特点多发性骨髓瘤患者的sBCMA表达水平(μg/L,)
| 项目 | sBCMA | t/F值 | P值 |
|---|---|---|---|
| 年龄(岁) | 0.70 | 0.498 | |
| ≥65 | 73.6±5.5 | ||
| <65 | 79.3±3.1 | ||
| 类型 | 0.96 | 0.385 | |
| IgG | 78.6±3.5 | ||
| IgA | 72.4±5.4 | ||
| 轻链型 | 83.8±6.9 | ||
| R-ISS分期 | 1.39 | 0.169 | |
| Ⅰ~Ⅱ期 | 80.2±3.1 | ||
| Ⅲ期 | 69.4±6.1 | ||
| Ccr(min/ml) | 0.79 | 0.428 | |
| ≤30 | 81.6±4.8 | ||
| >30 | 76.5±3.4 | ||
| 遗传学 | 1.03 | 0.305 | |
| 高危 | 73.6±5.7 | ||
| 非高危 | 80.2±3.2 |
注:sBCMA为分泌型成熟B细胞表面抗原;R-ISS为修订的国际分期系统;Ccr 为肌酐清除率;Ig为免疫球蛋白
初诊患者血清中完整免疫球蛋白型的M蛋白含量与sBCMA表达水平呈正相关(r=0.22,P=0.040),骨髓浆细胞占比与sBCMA表达无相关性(r=0.07,P=0.449)(图2)。
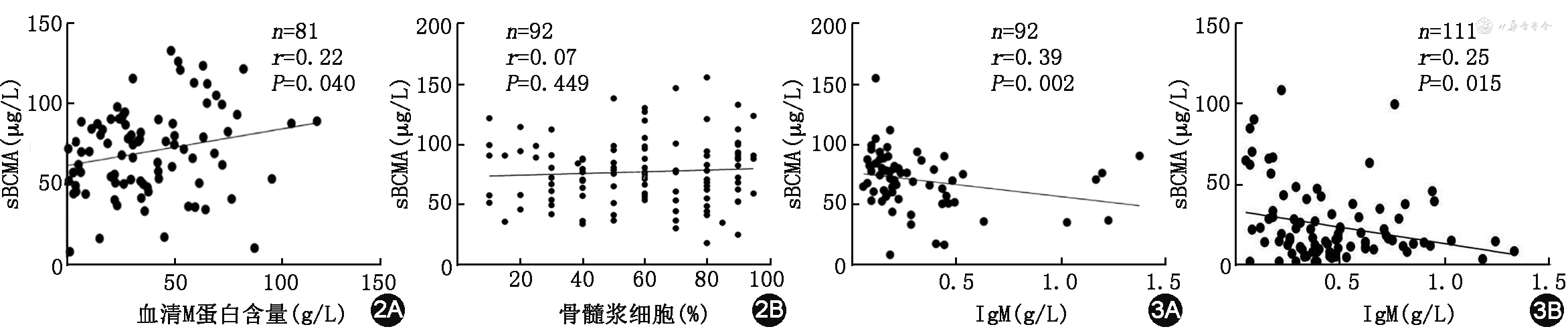

注:sBCMA为分泌型成熟B细胞表面抗原;IgM为免疫球蛋白M
sBCMA的表达水平与MM患者IgM水平负相关(r=-0.39,P=0.002),而且治疗后sBCMA表达水平与MM患者IgM水平负相关(r=-0.25,P=0.015)(图3)。
本研究结果表明,所有初诊MM患者sBCMA水平明显高于正常上限,且与MM患者完整免疫球蛋白型的M蛋白量正相关。本研究比较了不同预后亚组中的sBCMA表达水平,发现sBCMA的表达水平与患者年龄、肾功能不全、R-ISS分期、高危核型无关。而且sBCMA的表达水平与患者的蛋白类型无关,可用于独立判断患者疾病状态。循环中的BCMA与导致MM患者免疫缺陷的途径有关[6]。Sanchez等[6]在体外、体内研究中证实,游离态BCMA或结合态BCMA可以阻止BAFF诱导B细胞增殖和产生抗体,体外观察到BCMA-BAFF复合物,sBCMA在体内结合BAFF可以中和BAFF对B细胞增殖和分化的刺激效果,同样在患者血清中也观察到BCMA-BAFF复合物,并且sBCMA水平与多克隆抗体水平呈反比关系。由于本研究中患者均为非IgM受累患者,且IgM是体液免疫应答经抗原刺激后最先产生的抗体,故笔者将IgM水平作为体液免疫标志。本研究与之相一致。因此,sBCMA的升高水平反映了MM患者的体液免疫缺陷程度。
诱导治疗后sBCMA的水平变化与疗效判断是显著相关的,并独立于所有测试的协变量,包括肾功能;肾功能不全患者中利用肾脏依赖的生物标志物如血清β2微球蛋白(作为预后指标)和sFLC(作为实验室检测)来监测疾病往往不够准确[3]。本研究中无论患者是否伴随肾功能不全sBCMA恢复正常患者都达到VGPR及以上疗效。目前不分泌型MM患者疗效评估靠骨髓浆细胞检查及PET-CT检查。本研究中1例不分泌型患者的sBCMA变化与骨髓浆细胞变化相一致。同样在国外的一项研究中,sBCMA变化与不分泌型MM患者的骨髓浆细胞及PET-CT变化也相符[14]。预示可以用sBCMA水平对不分泌型患者进行评估。这将减少不分泌型患者仅依靠侵入性的骨髓检查及昂贵的PET-CT才能评估病情的问题,但这仍需更大的样本量来支持研究。sBCMA可作为一种监测和预判MM患者疗效的新的独立标志物,它还可能提供了一种血液检测方法来监测不分泌MM患者的疾病状态,需要更多的长期随访来进一步探索sBCMA是否可用于判断在治疗中尤其随访期MM患者的疾病状态。鉴于sBCMA与患者免疫相关,确定其水平是否可预测接受免疫治疗的患者,这些需要更多的研究来进一步探索。
目前针对MM患者BCMA的靶向治疗正引起越来越多的重视。嵌合抗原受体T细胞、单克隆抗体单独或联合化疗药物已被用于靶向MM细胞表面的BCMA,并且在复发难治MM中起到了良好效果[15]。sBCMA对BCMA抗体抗MM肿瘤细胞干扰可能会影响BCMA靶向治疗的疗效。在使用抗BCMA靶向治疗MM患者之前,测定sBCMA水平可能是很重要的。在国外,Chen等[7]研究中显示在sBCMA水平为156 μg/L以上的复发难治MM患者中,sBCMA干扰抗BCMA抗体与MM肿瘤细胞的结合。随着以BCMA为靶点的治疗方法的广泛应用,测定sBCMA水平及降低其水平在优化这些治疗方法的临床疗效可能变得越来越重要。本研究目前存在作为回顾性研究部分样本数据缺失,以及需要更大的样本量及更长的随访时间支持研究结果等问题需要进一步完善。
所有作者均声明不存在利益冲突



























