
对比氩氦刀冷冻消融(CYA)与射频消融(RFA)治疗Ⅰ期非小细胞肺癌(NSCLC)的安全性和有效性。
回顾性分析2014年1月至2019年1月符合纳入标准的郑州大学第一附属医院90例Ⅰ期NSCLC患者的临床资料,其中男48例,女42例,年龄39~85(63.6±10.1)岁。根据治疗方法不同分为CYA组(38例)和RFA组(52例)。对比分析2组患者手术持续时间、术中疼痛情况、局部进展率及并发症发生率,采用Kaplan-Meier方法进行生存分析,Log-rank检验比较生存曲线差异。
两组患者基线资料差异无统计学意义(均P>0.05)。CYA组手术时间长于RFA组[(73.5±17.2)比(51.4±18.7)min,P<0.001],CYA 组疼痛视觉模拟评分低于RFA组[0.53±0.89)比(3.44±2.44)分,P<0.001)]。CYA组和RFA组的中位随访时间分别为53个月和52个月。随访期间,CYA组和RFA组的局部进展率差异无统计学意义[31.6%(12/38)比25.0%(13/52),P=0.491]。两组中位肿瘤无进展生存期(PFS)差异无统计学意义[51(95%CI:40.3~55.0)个月比44(95%CI:37.2~54.1)个月,P=0.649];两组中位总生存期(OS)均未达到。两组常见的并发症为气胸、出血和胸腔积液,CYA组总的并发症发生率与RFA组差异无统计学意义[42.1%(16/38)比28.8%(15/52),P=0.191],其中CYA组胸腔积液发生率高于RFA组[26.3%(10/38)比5.8%(3/52),P=0.006],气胸和出血的发生率差异无统计学意义[13.3%(5/38)比13.5%(7/52)和15.8%(6/38)比9.6%(5/52),均P>0.05]。
CYA和RFA治疗Ⅰ期NSCLC患者的有效性和安全性差异无统计学意义,CYA术中疼痛相对较轻,但手术持续时间长。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌是全世界发病率、死亡率最高的恶性肿瘤。其中约80%患者在就诊时已属中晚期,失去外科根治性手术机会。部分早期肺癌患者,由于合并症多、身体状况差、心肺功能差,不能耐受或不愿外科手术[1]。对于不能接受外科手术的患者,热消融被认为是除手术之外的另外一种局部根治方法[2],主要用于肿瘤最大径≤3 cm且无转移的原发性肺癌或原发灶得到控制的肺转移癌的治愈性治疗,也用于肿瘤最大径>3 cm的原发性肺癌及经其他方法治疗后进展或复发肺癌的姑息性治疗[3]。迄今,关于热消融在肺癌中的应用多数是射频消融(radiofrequency ablation,RFA)。氩氦刀冷冻消融(cryoablation,CYA)由于其清楚的消融边界、良好的耐受,在肺癌的治疗中应用逐步增加[4]。为了进一步研究CYA在Ⅰ期非小细胞肺癌(none-small cell lung cancer,NSCLC)治疗中的有效性和安全性,本研究对比分析了两种消融方式治疗Ⅰ期NSCLC的局部控制率、近期有效率、生存期及并发症发生率,以期为热消融治疗早期NSCLC方法选择提供依据。
回顾性分析郑州大学第一附属医院2014年1月至2019年1月268例接受CT引导下CYA治疗和543例接受RFA治疗的NSCLC患者临床资料。(1)纳入标准:①经病理证实NSCLC;②术前均接受胸腹部增强CT、颅脑MRI、99Tcm-亚甲基二膦酸盐全身骨显像或18F-脱氧葡萄糖(fluorodeoxyglucose,FDG)正电子发射计算机断层显像/X线计算机体层成像(positron emission tomography/computed tomography,PET/CT)等检查,根据美国肿瘤研究联合委员会第8版TNM分期标准临床分期为T1-2N0M0;③初诊患者;④最短随访时间2年;⑤所有患者医学上无法耐受手术或拒绝手术;⑥年龄≥18岁。(2)排除标准:①影像学表现为磨玻璃样的NSCLC;②造影剂过敏;③既往接受过化疗、靶向等系统治疗或放疗等局部治疗;④随访时间<2年。最后共纳入90例患者,男48例,女42例,年龄39~85(63.6±10.1)岁。根据治疗方法分为CYA组[38例,其中男19例,女19例,年龄39~85(64.8±10.7)岁]和RFA组[52例,其中男29例,女23例,年龄44~82(62.8±9.6)岁]。本研究已通过郑州大学第一附属医院伦理委员会审核(2019-KY-383)。
1.手术要求:所有手术均由本科室同一名高级职称(主任)医师(具有20年以上CT介入手术经验)带领具有5年以上手术经验的中级职称医师完成。均在局部麻醉下完成。所有患者均在术前30 min应用“哌替啶针100 mg”肌肉注射进行镇痛。
2.仪器设备:16排螺旋CT(荷兰 Philip Brilliance型及美国GE Dicovery CT590 RT型)、Cool-TipTM射频消融系统(治疗仪和电极包)(美国美敦力公司)和CryoHit型氩氦刀低温冷冻手术系统(以色列GML公司)。
3.术前准备:(1)所有患者术前行增强CT检查;(2)完善血常规、凝血功能、传染病筛查、心电图等检查;(3)排除手术禁忌证;(4)建立静脉通路,连接心电监护;(5)所有患者均签署治疗知情同意书。
根据病变位置选择合适体位,CT扫描,确定病变位置,设定进针路线,做好体表标记后,消毒、铺巾,2%利多卡因局部浸润麻醉至胸膜。
1.RFA:根据肿瘤大小选择裸露端2 cm或者3 cm的射频电极针,按设计进针计划在CT引导下穿刺至理想位置,开启射频系统,选择阻抗模式,进行消融。消融终点为肿瘤病灶周围出现晕征或根据射频消融针说明书消融范围超过靶病变边缘5~10 mm。术后即刻行CT扫描,确定有无并发症(图1)。
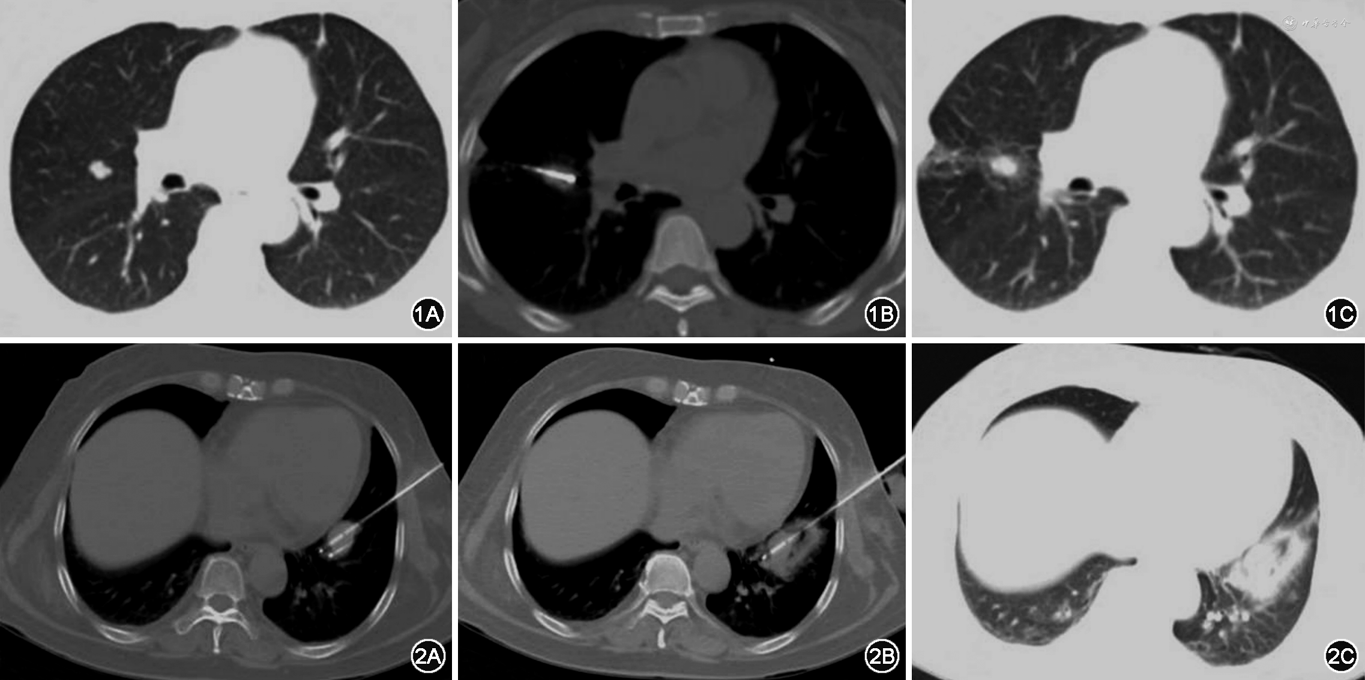

2.CYA:依据病灶大小及形态,准备相应数量的冷冻探针(17G,直径1.47 mm)在CT引导下将冷冻探针穿刺至计划位置。将装有温水的无菌手套置于皮肤冷冻探针周围保护皮肤,采用适当压力冷冻15 min、复温3 min作为一治疗循环,共治疗2个循环。术中每5~10 min 进行一次CT扫描,监测冰球大小,判定消融范围(理想消融范围为冰球超过靶病变0.5~1 cm),术后即刻行CT平扫确定有无并发症(图2)。
1.随访内容和时间:手术持续时间、患者术中疼痛情况、术后并发症、初次完全消融率。术后1个月复查增强CT,1个月后每3个月复查增强CT,1年后每半年复查增强CT。根据美国介入放射学会评价标准将并发症分为轻度(A~B级)及重度(C~F级)[5];具体评价标准为:A级:无需治疗,无不良后果;B级:需要治疗,无不良后果,包括需要短时间住院观察者;C级:需要治疗,住院时间<48 h;D级:需要治疗,医护级别增加,住院时间>48 h;E级:导致了长久后遗症;F级:死亡。
2.疗效评价:根据术后影像学表现进行疗效评价:(1)完全消融(出现以下任何一项):①病灶消失;②完全形成空洞;③病灶纤维化可为疤痕;④实性结节增强CT无强化征象和(或)PET/CT肿瘤无代谢活性;(2)不完全消融(出现以下任何一项):①空洞形成不完全,有部分实性且增强CT有强化征象和(或)PET/CT肿瘤有代谢活性;②部分纤维化或实性结节,纤维化周围、实性结节或边缘CT扫描有对比剂强化征象和(或)PET/CT肿瘤有代谢活性;③活检发现肿瘤细胞;(3)局部进展(local tumor progression,LTP)(有以下任何一个类型):①病灶增大≥10 mm,CT上不规则或内部强化范围增大,PET/CT上FDG摄取明显增大;②局部出现新的病变,CT上新出现强化征象和(或)PET/CT上FDG摄取明显增高。
采用IBM SPSS 22.0软件进行统计分析。符合正态分布计量资料用表示,组间计量资料的比较用两独立样本t检验;分类变量用例(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析,组间比较应用Log-rank检验。双侧检验,检验水准α=0.05。
两组患者年龄、东部肿瘤协作组评分、肿瘤大小、肿瘤位置、与胸膜距离等各项指标差异均无统计学意义(均P>0.05)(表1)。
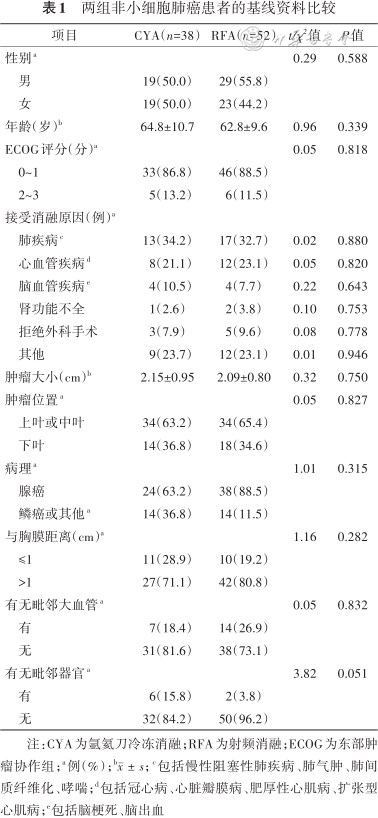
两组非小细胞肺癌患者的基线资料比较
两组非小细胞肺癌患者的基线资料比较
| 项目 | CYA(n=38) | RFA(n=52) | t/χ2值 | P值 |
|---|---|---|---|---|
| 性别a | 0.29 | 0.588 | ||
| 男 | 19(50.0) | 29(55.8) | ||
| 女 | 19(50.0) | 23(44.2) | ||
| 年龄(岁)b | 64.8±10.7 | 62.8±9.6 | 0.96 | 0.339 |
| ECOG评分(分)a | 0.05 | 0.818 | ||
| 0~1 | 33(86.8) | 46(88.5) | ||
| 2~3 | 5(13.2) | 6(11.5) | ||
| 接受消融原因(例)a | ||||
| 肺疾病c | 13(34.2) | 17(32.7) | 0.02 | 0.880 |
| 心血管疾病d | 8(21.1) | 12(23.1) | 0.05 | 0.820 |
| 脑血管疾病e | 4(10.5) | 4(7.7) | 0.22 | 0.643 |
| 肾功能不全 | 1(2.6) | 2(3.8) | 0.10 | 0.753 |
| 拒绝外科手术 | 3(7.9) | 5(9.6) | 0.08 | 0.778 |
| 其他 | 9(23.7) | 12(23.1) | 0.01 | 0.946 |
| 肿瘤大小(cm)b | 2.15±0.95 | 2.09±0.80 | 0.32 | 0.750 |
| 肿瘤位置a | 0.05 | 0.827 | ||
| 上叶或中叶 | 34(63.2) | 34(65.4) | ||
| 下叶 | 14(36.8) | 18(34.6) | ||
| 病理a | 1.01 | 0.315 | ||
| 腺癌 | 24(63.2) | 38(88.5) | ||
| 鳞癌或其他a | 14(36.8) | 14(11.5) | ||
| 与胸膜距离(cm)a | 1.16 | 0.282 | ||
| ≤1 | 11(28.9) | 10(19.2) | ||
| >1 | 27(71.1) | 42(80.8) | ||
| 有无毗邻大血管a | 0.05 | 0.832 | ||
| 有 | 7(18.4) | 14(26.9) | ||
| 无 | 31(81.6) | 38(73.1) | ||
| 有无毗邻器官a | 3.82 | 0.051 | ||
| 有 | 6(15.8) | 2(3.8) | ||
| 无 | 32(84.2) | 50(96.2) |
注:CYA为氩氦刀冷冻消融;RFA为射频消融;ECOG为东部肿瘤协作组;a例(%);b; c包括慢性阻塞性肺疾病、肺气肿、肺间质纤维化、哮喘;d包括冠心病、心脏瓣膜病、肥厚性心肌病、扩张型心肌病;e包括脑梗死、脑出血
所有患者均顺利完成手术,无手术相关死亡病例。CYA组手术时间长于RFA组[(73.5±17.2)比(51.4±18.7)min,P<0.001]。术中CYA组视觉模拟评分低于RFA组[(0.53±0.89)比(3.44±2.44)分;t=-0.70,P<0.001](表2)。
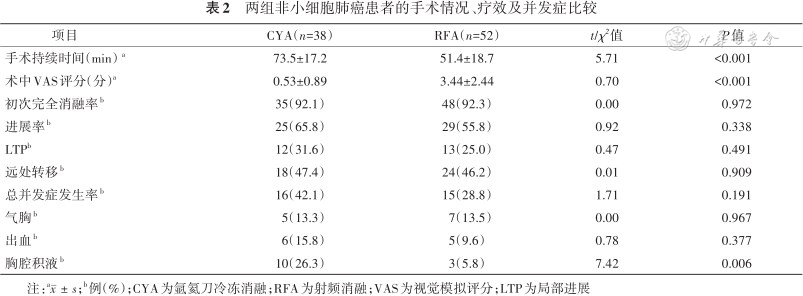
两组非小细胞肺癌患者的手术情况、疗效及并发症比较
两组非小细胞肺癌患者的手术情况、疗效及并发症比较
| 项目 | CYA(n=38) | RFA(n=52) | t/χ2值 | P值 |
|---|---|---|---|---|
| 手术持续时间(min)a | 73.5±17.2 | 51.4±18.7 | 5.71 | <0.001 |
| 术中VAS评分(分)a | 0.53±0.89 | 3.44±2.44 | 0.70 | <0.001 |
| 初次完全消融率b | 35(92.1) | 48(92.3) | 0.00 | 0.972 |
| 进展率b | 25(65.8) | 29(55.8) | 0.92 | 0.338 |
| LTPb | 12(31.6) | 13(25.0) | 0.47 | 0.491 |
| 远处转移b | 18(47.4) | 24(46.2) | 0.01 | 0.909 |
| 总并发症发生率b | 16(42.1) | 15(28.8) | 1.71 | 0.191 |
| 气胸b | 5(13.3) | 7(13.5) | 0.00 | 0.967 |
| 出血b | 6(15.8) | 5(9.6) | 0.78 | 0.377 |
| 胸腔积液b | 10(26.3) | 3(5.8) | 7.42 | 0.006 |
注:a;b例(%);CYA为氩氦刀冷冻消融;RFA为射频消融;VAS为视觉模拟评分;LTP为局部进展
CYA组和RFA组中位随访时间分别为53个月和52个月。首次复查CYA组有3例不完全消融(2例再次行CYA治疗、1例行RFA治疗),RFA组有4例不完全消融(2例再次行RFA,2例行CYA治疗),CYA组和RFA组初次完全消融率差异无统计学意义[92.1%(35/38)比92.3%(48/52),P=0.972](表2)。
在随访中,CYA组有25例患者出现疾病进展(disease progression,PD)(7例LTP,13例远处转移,5例同时有LTP和远处转移)。RFA组有29例出现PD(5例LTP,16例远处转移,8例同时有LTP和远处转移)。CYA组和RFA组在总进展率、LTP率、远处转移率差异无统计学意义(均P>0.05)(表2)。CYA组和RFA组中位肿瘤无进展生存期(progression-free survival,PFS)分别为44.0(95%CI:35.0~53.0)个月和51.0(95%CI:40.1~61.9)个月,差异无统计学意义(P=0.649)(图3A)。随访期间,CYA组有14例患者死亡,RFA组有16例患者死亡,CYA组1、2、3、5年生存率分别为100%、92.1%、76.2%和64.2%,RFA组为100%、90.2%、86.1%和63.5%,两组差异无统计学意义(均P>0.05)(图3B)。
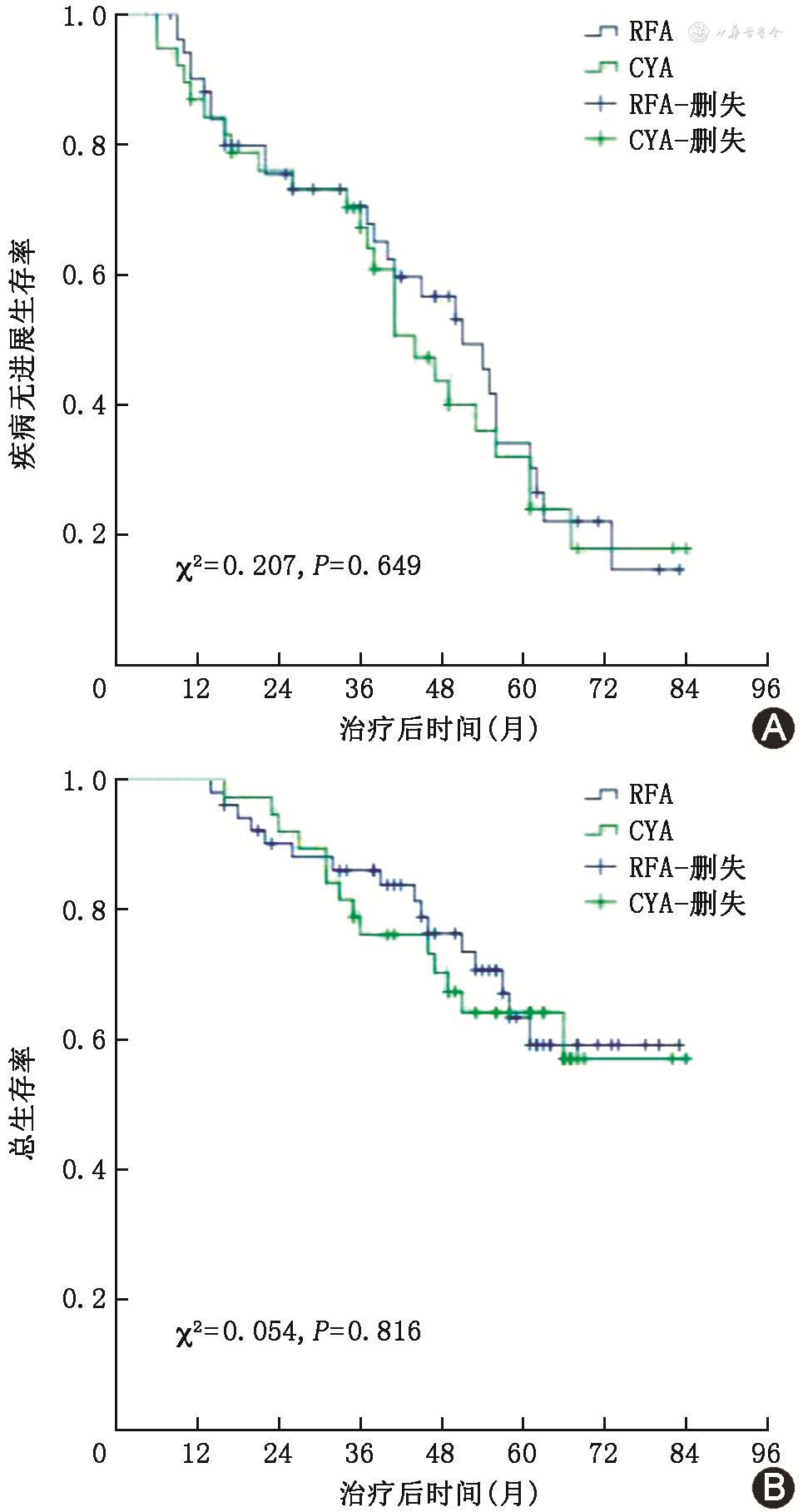

注:CYA为氩氦刀冷冻消融;RFA为射频消融
两组常见并发症为气胸、出血和胸腔积液。CYA组的总并发症发生率与RFA组差异无统计学意义[42.1%(16/38)比28.8%(15/52),χ2=1.71,P=0.191](表2)。
1. CYA组的并发症:CYA组轻微和严重并发症发生率分别为28.9%(11/38)和13.2%(5/38),气胸、出血、胸腔积液的发生率分别为13.3%(5/38,3例需要引流)、15.8%(6/38)和26.3%(10/38,其中2例需要引流)(表2)。
2. RFA组的并发症:RFA组轻微和严重并发症发生率分别为23.1%(12/52)和5.8%(3/52);气胸(包含1例支气管胸膜瘘)、出血、胸腔积液(包含1例脓胸)的发生率分别为13.5%(7/52)、9.6%(5/52,1例需要引流)和5.8%(3/52),支气管胸膜瘘和脓胸经过持续引流及抗感染治疗后好转(表2)。两组中无手术相关死亡病例发生。
影像引导热消融治疗具有创伤小、并发症发生率低、可重复、靶向性强等优点,成为不可切除早期NSCLC的替代治疗方案。常用于肺部肿瘤的消融技术包括RFA、微波消融和CYA。RFA是通过高频电流(375~500 Khz)激发肿瘤组织细胞内带电离子产生震荡,所产生的热量使局部温度达到60~100 ℃,使肿瘤细胞凝固坏死,同时使肿瘤周围血管组织凝固,阻断肿瘤血供,进一步杀灭肿瘤细胞。RFA是第一个用于肺部肿瘤的热消融技术,也是评估最多的技术[6, 7]。CYA通过焦耳-汤姆逊原理,快速使组织内温度降至-140 ℃,然后再快速升温至20~40 ℃,使组织内蛋白变性、细胞裂解,同时产生微血管栓塞效应,进一步杀灭肿瘤细胞。随着临床实践与探索,CYA在NSCLC的治疗中逐渐得到临床认可。但如何选择恰当的消融方法以使患者获益更多?与RFA相比,CYA治疗NSCLC的安全性和有效性如何?这些都缺乏相应的临床研究。
与RFA相比,CYA具有以下特点:(1)CT可以观察到冰球的形成及清楚显示消融边界[8];(2)大气道、血管等脏器结构对冷的耐受优于对热的耐受[9];(3)CYA免疫激活作用强于RFA [6];(4)镇痛作用,患者耐受好;(5)往往要多针穿刺导致手术时间长、出血风险增加;(6)消融周围区域可能存在肿瘤抵抗[10]。本研究结果显示CYA平均手术时间长于RFA手术时间(P<0.001),CYA术中疼痛程度明显低于RFA组(P<0.001)。分析原因可能与CYA操作复杂且需要“冷冻-复温”有关;局部麻醉下进行的热消融所产生疼痛与热传导刺激胸膜神经所致,冷冻可通过多种机制缓解疼痛。因此当肿瘤靠近大血管、气道、胸膜和其他重要脏器时,不宜使用RFA,更多地选择CYA,当患者无法耐受长时间手术时,更多选择RFA[10]。
有效性方面,一项回顾性分析显示RFA治疗早期NSCLC的1、2、3、4、5年生存率分别为78%、57%、36%、27%、27%,术后1、2、5年的无进展生存率分别为87%、63%、55%[11, 12]。Pennathur等[13]在2009年撰文指出RFA在治疗Ⅰ期NSCLC患者中,复发率为3.0%~38.1%;平均PFS为25.0~26.7个月,平均21.0个月;1、2、3年生存率为63%~85%、55%~65%和15%~46%。一项回顾性研究显示,CYA治疗22例患者共34个病变,中位随访时间为23(12~68)个月,在随访时间内,只有1例病变出现了局部进展,平均PFS为(69±2)个月,2年和3年生存率均为88%,平均生存期为(62±4)个月,中位生存期为68个月[14]。另一项对无法耐受外科手术的47例T1N0M0 NSCLC患者进行CYA治疗,5年生存率为(67.8±15.3)%,5年PFS为(87.9±9.0)%,LTP率为36.2%[15]。本研究对比了CYA和RFA治疗早期NSCLC疗效,两种消融方法初次完全消融率、局部复发率、总体进展率、PFS、生存率方面与既往研究相似,差异无统计学意义[16, 17]。
并发症方面,CYA和RFA治疗NSCLC常见并发症为气胸、胸腔积液、咯血,发生率分别为10%~30%、4%~21%、2.7%~16.1%[18]。本研究中,气胸、出血和胸腔积液发生率CYA组分别为13.3%、15.8%、和26.3%,RFA组分别为13.5%、9.6%和5.8%,与既往报道基本相当[19, 20, 21]。本研究中CYA组胸腔积液发生率高于RFA组,且差异具有统计学意义,分析原因为热消融治疗NSCLC出现胸腔积液与胸膜热损伤有关,多发生在术后1周内,本研究中CYA组有更多的病变靠近胸膜。
本研究存在以下不足:首先本研究是回顾性分析,在选择患者上存在偏倚;其次样本量较少,需扩大样本量进行倾向评分匹配或进行前瞻性随机对照研究。
综上,与RFA相比,CYA 治疗早期NSCLC具有相同的安全性、有效性,术中疼痛发生率低、患者耐受好,但出血、胸腔积液、气胸等并发症发生率略高于RFA。
所有作者均声明不存在利益冲突



























