
泛凋亡是一种炎症性程序细胞死亡,受到泛凋亡小体复合物的调控且具有细胞焦亡、凋亡和坏死性凋亡的关键特征,无疑是未来程序性细胞死亡研究的热点和重点。目前,已有研究证实泛凋亡与感染性疾病、肿瘤等多种人类疾病密切相关,尽管其具体的调控机制还未明确,但作为一个潜在的干预靶点,泛凋亡已经展现出良好的研究前景。全面了解泛凋亡在人类疾病中的作用研究进展,对阐明泛凋亡在人类疾病中的作用和调控机制,有望探索出一条新的治疗策略,为相关患者的治疗带来突破。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
程序性细胞死亡(programmed cell death,PCD)是机体发育的重要组成部分,在宿主防御病原体和维持体内平衡中发挥重要作用[1]。然而,PCD通路的过度激活已被证明是有害的,可能导致多种疾病的发生。因此,合理化调节PCD在感染性、神经退行性、自身炎症、代谢性疾病和癌症等多种人类疾病中具有巨大的治疗潜力。PCD主要包括焦亡、凋亡、坏死性凋亡、铁死亡和泛凋亡等,与先天性免疫密切相关。泛凋亡(PANoptosis)是2019年由美国学者Malireddi等[2]提出的一种全新程序性死亡方式,其具有细胞焦亡、凋亡和坏死性凋亡的关键特征,但却不能由这3种PCD途径单独解释。此外,泛凋亡受到上游感受器和分子信号的级联调控,这些传感器和级联信号组装成一种多聚体复合物,即泛凋亡小体(PANoptosome)[3]。作为下游分子的激活平台和3种PCD途径的启动“总开关”,PANoptosome及其上游的感受器为人类疾病的治疗提供了颇具吸引力的干预靶点[4]。在本文中,我们从PCD和细胞炎症出发,重点阐述了泛凋亡概念的提出、泛凋亡小体的形成,以及泛凋亡在人类疾病中发挥作用的具体调控机制,尤其是诱导和参与泛凋亡小体形成的相关分子或蛋白。最后,我们展望了通过靶向干预这些分子或蛋白治疗人类疾病的意义和可行性,希望能够给相关领域研究人员提供一些启发。
细胞死亡对于机体正常发育和抵抗病原体入侵至关重要。早期,根据细胞死亡发生的自主性以及是否继发炎症反应将其分为凋亡和坏死,前者是程序性、非炎性的,后者则相反。凋亡的特征表现为半胱天冬酶(Caspase)的激活、细胞核破碎和凋亡小体的形成,凋亡小体通过吞噬细胞内的碎片防止炎症信号的释放,这种细胞死亡方式在性质上是有益的,因为它避免了炎症免疫反应的激活,有助于维持细胞和机体的稳态。与凋亡不同,坏死性或溶解性的细胞死亡具有免疫活性,其特征是细胞膜的损伤或破裂,并向周围环境释放炎症刺激,这种炎症过程被认为是一种非程序性的、自发的事件,是对损伤或极端不利条件的应激反应[5]。
除了凋亡,PCD还包括焦亡、铁死亡和坏死性凋亡等。焦亡也是宿主应对病原感染的一种防御手段,其特征是Caspase-1的激活和炎性小体的形成,进而通过Gasdermin家族成员GSDMC、GSDMD或GSDME在细胞膜表面打孔,引起促炎细胞因子白细胞介素1β(interleukin1β,IL-1β)和IL-18的释放。坏死性凋亡最早被认为是由死亡域受体(肿瘤坏死因子受体以及Toll样受体3、4)参与的一种程序性死亡方式,当上述死亡域受体与外源性或内源性损伤物质结合后,会触发受体相互作用蛋白激酶(receptor-interacting protein kinases,RIPK)的激活和伪激酶混合家族激酶样域(mixed-lineage kinase domain-like pseudokinase,MLKL)的磷酸化,最终形成坏死小体并在细胞膜表面打孔,通过离子内流诱发细胞肿胀、膜溶解等,是一种具有坏死特征的凋亡。铁死亡则主要依赖细胞内二价铁离子的聚集引起脂质过氧化,进而在活性氧的作用下诱发细胞死亡。越来越多的证据表明,介导这些PCD方式的分子并不是孤立存在的,而是相互交织在一起,一种病原体或无菌损害可以诱导多种PCD方式的发生[6]。例如,凋亡可以被焦亡分子激活,反之亦然,而当凋亡途径被病原体或其他信号抑制时,会诱发坏死性凋亡途径的补偿等等。
泛凋亡是一种炎症性程序细胞死亡,受到泛凋亡小体复合物的调控,具有细胞焦亡(pyroptosis)、凋亡(apoptosis)和(或)坏死性凋亡(necroptosis)的关键特征,这也是PANoptosis术语中“P”“A”和“N”的来源;此外,最重要的一点,PANoptosis不能被细胞焦亡、凋亡和坏死性凋亡中任意一种死亡方式单独表征[7]。尽管细胞焦亡、细胞凋亡和坏死性凋亡在研究史上一直被描述为不同的、独立的通路,但是越来越多的证据表明这些PCD之间存在广泛的相互作用。早期研究发现,焦亡通过Caspase-1可以切割其他Caspase,而凋亡的Caspase-8对nod样受体蛋白3(nod like receptor protein 3,NLRP3)依赖的炎症小体也很重要。在Caspase-1缺失的情况下,炎性小体复合物的形成可招募和激活Caspase-8,导致Caspase-8介导的炎症细胞死亡。此外,凋亡执行者Caspase-3和Caspase-7不仅可以通过氨基端分裂灭活GSDMD,还可以裂解GSDME,使细胞死亡的形态由凋亡转变为焦亡。最近的证据也表明,坏死性凋亡的执行和MLKL孔的形成可通过膜损伤激活细胞凋亡;此外,Caspase-8作为细胞死亡方式的中枢变阻器,在生存信号、凋亡和坏死之间决定细胞的命运[8]。综上所述,焦亡、凋亡和坏死性凋亡之间的相互重叠和联接促成了PANoptosis概念的建立。2019年,美国学者Malireddi将这种具有焦亡、凋亡和坏死性凋亡特征的新型死亡方式命名为泛凋亡,并提出先天性免疫传感器Z-DNA 结合蛋白1(Z-DNA binding protein 1,ZBP1)和转化生长因子β活化激酶1(transforming growth factor β-activated kinase 1,TAK1)在泛凋亡小体复合物组装的调控中发挥重要作用,且首次探究了这些调控因子在人类疾病中的意义和治疗潜力。
与凋亡中的凋亡小体和焦亡中的炎性小体类似,泛凋亡中也存在一种特征性的多聚复合物,即泛凋亡小体。尽管不同病原体感染激发的近端感受器存在差异,但这些感受器分子均可启动泛凋亡小体的形成。后者提供了一个分子支架,允许焦亡[NLRP-3、凋亡相关的含有CARD结构域的斑点状蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和Caspase-1]、凋亡(Caspase-8/3)和坏死性凋亡(RIPK3,p-MLKL)所需的蛋白或分子进行耦联和结合[9]。值得一提的是,上游感受器如何特异性识别病原微生物感染以及这些成分之间相互作用的具体机制依旧未知。迄今为止,已经明确了三种泛凋亡上游分子,分别是ZBP1、RIPK1和干扰素诱发蛋白2(interferon-inducible protein 2,AIM2),它们可以感受特定刺激并触发泛凋亡小体的组装,但毋庸置疑的是一定还有其他上游分子可启动泛凋亡的发生(图1)。
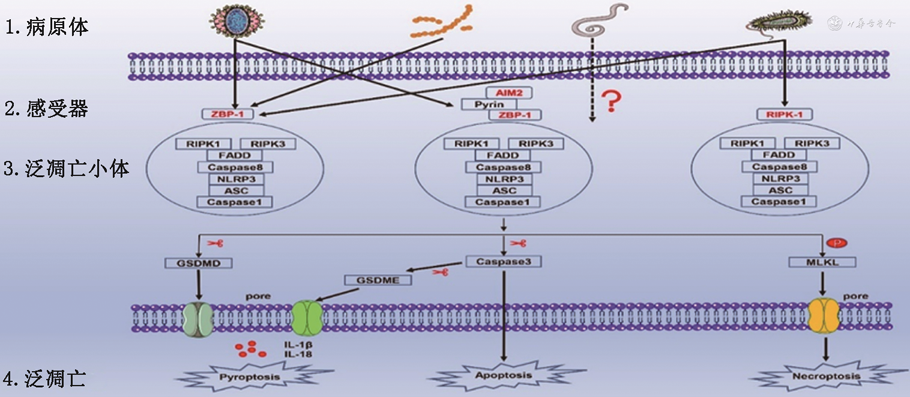

1.ZBP1泛凋亡小体:ZBP1被鉴定为甲型流感病毒(influenza A virus,IAV)的感受器和IAV感染期间细胞死亡的主要调节因子。在IAV刺激下,ZBP1作为特异的感受器被激活,进而触发PANoptosome的组装,目前研究已经证实组件ZBP1-PANoptosis包括RIPK3、Caspase-8、Caspase-6、ZBP1、ASC和NLRP3等[10]。ZBP1-PANoptosis形成后,可以启动由焦亡、凋亡和坏死性凋亡成分组成的泛凋亡,最终导致溶解性炎症细胞死亡,其特征是Caspase-1、Caspase-3、Caspase-8的激活和MLKL的磷酸化[11]。此外,ZBP1的缺失能够完全抑制泛凋亡的发生,而PCD中任一通路成分的缺失无法达到同样的效果。多种实验结果表明ZBP1介导的泛凋亡是触发依赖性的,ZBP1主要通过其Zα结构域感受IAV的刺激[12]。此外,ZBP1还可以通过干扰素调节因子1(interferon regulatory factor 1,IRF1)响应干扰素信号而上调,在IAV感染期间作为病毒核糖核蛋白的感受器,激活巨噬细胞的泛凋亡。
2.RIPK1泛凋亡小体:RIPK1介导的泛凋亡小体主要由RIPK1、ASC、Caspase-1、Caspase-8和死亡相关结构域蛋白(fas-associated protein with death domain,FADD)构成,最早由Malireddi教授团队提出。此外,该团队还发现TAK1可作为RIPK1-PANoptosome的调控主开关,因为TAK1基因的缺失或者功能失活可以触发RIPK1-PANoptosome的组装[2]。有趣的是,2020年该团队又研究发现TAK1的缺乏可以诱导RIPK1非依赖的泛凋亡通路的激活,后者主要由RIPK3-MLKL介导,并成功在体内实验中进行了验证:TAK1的失活导致了RIPK3-Caspase8信号轴驱动的骨髓增生和严重的脓毒症样综合征,整个过程没有触发RIPK1的高表达[13]。耶尔森氏菌属的细菌病原体可导致胃炎甚至致命的脓毒症,Malireddi等人研究发现:耶尔森氏菌可以通过协同激活与焦亡、凋亡和坏死性凋亡有关的蛋白来启动泛凋亡。而RIPK1基因的缺失可消除耶尔森氏菌诱导的细胞焦亡和凋亡,但增加了坏死性凋亡的发生。此外,他们还观察到耶尔森菌可诱导RIPK1-PANoptosome的组装,该复合体能够调节泛凋亡的所有3个分支,证实了RIPK1-PANoptosome在耶氏菌诱导炎症细胞死亡和宿主防御中的作用。因此,通过干预RIPK1分子来调控泛凋亡现象的发生,可能是未来应对感染性和炎症性疾病的潜在治疗策略之一[14]。
3.AIM2泛凋亡小体:最近还报道了一种AIM2-PANoptosome,其组成分子包括AIM2、ZBP1、pyrin、ASC、Caspase-1、Caspase-8、RIPK1、RIPK3和FADD[15]。炎性小体是先天性免疫防御的重要哨兵,可以感知病原体或损伤相关的分子模式(pathogen associated molecular pattern,PAMP或damage associated molecular pattern,DAMP)并诱导受感染细胞死亡[16]。AIM2 炎性小体可感知双链DNA,并在人类的正常发育、传染性疾病、炎症和肿瘤方面发挥重要作用。单纯疱疹病毒1(herpes simplex virus 1,HSV1)作为一种双链DNA病毒可导致终生无法治愈的复发性病变,弗朗西斯氏菌作为一种革兰氏阴性菌可在感染后迅速致死,这两种不同的病原体均可激活AIM2,但导致细胞死亡的分子机制还不清楚。美国圣裘德儿童研究医院的Malireddi团队研究提出AIM2可以调节先天免疫传感器pyrin和ZBP1以驱动炎症信号的传导,并诱发骨髓来源的巨噬细胞泛凋亡,在HSV1和弗朗西斯氏菌感染期间发挥宿主保护作用。该研究结果很大程度上促进了对AIM2-PANoptosome组成分子在先天免疫和炎症细胞死亡中所发挥功能的理解,为AIM2、ZBP1和pyrin介导疾病的治疗指明了新的方向[15]。
泛凋亡小体的组装以及泛凋亡的激活是机体有效防御外来病毒、细菌和真菌感染的一种自身保护性反应[17, 18]。泛凋亡概念的提出强调了分子精准化干预在疾病治疗学中的重要性,随着细胞PCD途径之间的界限变得越来越模糊,单一性地阻断或者干扰某一种死亡方式可能不会带来预期的治疗效果。目前阻断炎症细胞死亡的方法包括靶向传感器分子(如NLRP3),抑制酶促靶点(如RIPK1),以及中和下游细胞因子信号(如IL-1信号)等,然而这些抑制剂是特异性针对焦亡、凋亡和坏死性凋亡设计的,临床治疗效果并不理想。通过靶向干预泛凋亡上游信号传导通路、感受器或支架分子可以有效地阻断泛凋亡所属3种死亡方式的启动,这无疑为人类相关疾病的治疗带来新的选择[19](表1)。
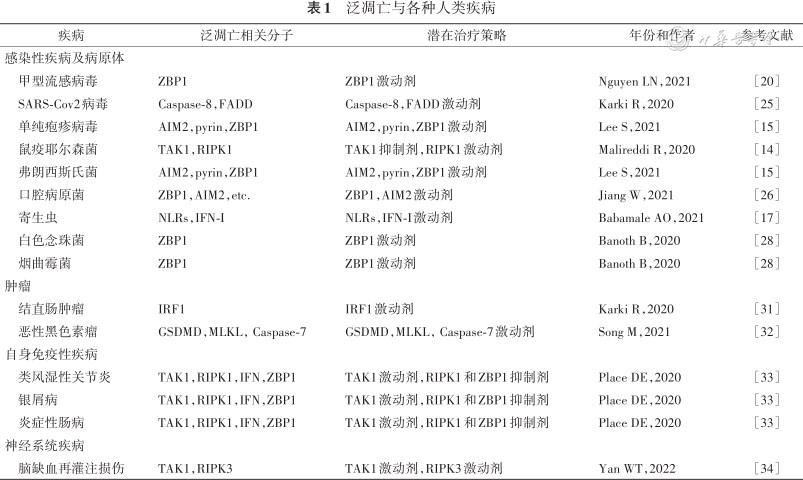
泛凋亡与各种人类疾病
泛凋亡与各种人类疾病
| 疾病 | 泛凋亡相关分子 | 潜在治疗策略 | 年份和作者 | 参考文献 |
|---|---|---|---|---|
| 感染性疾病及病原体 | ||||
| 甲型流感病毒 | ZBP1 | ZBP1激动剂 | Nguyen LN,2021 | [20] |
| SARS-Cov2病毒 | Caspase-8,FADD | Caspase-8,FADD激动剂 | Karki R,2020 | [25] |
| 单纯疱疹病毒 | AIM2,pyrin,ZBP1 | AIM2,pyrin,ZBP1激动剂 | Lee S,2021 | [15] |
| 鼠疫耶尔森菌 | TAK1,RIPK1 | TAK1抑制剂,RIPK1激动剂 | Malireddi R,2020 | [14] |
| 弗朗西斯氏菌 | AIM2,pyrin,ZBP1 | AIM2,pyrin,ZBP1激动剂 | Lee S,2021 | [15] |
| 口腔病原菌 | ZBP1,AIM2,etc. | ZBP1,AIM2激动剂 | Jiang W,2021 | [26] |
| 寄生虫 | NLRs,IFN-I | NLRs,IFN-I激动剂 | Babamale AO,2021 | [17] |
| 白色念珠菌 | ZBP1 | ZBP1激动剂 | Banoth B,2020 | [28] |
| 烟曲霉菌 | ZBP1 | ZBP1激动剂 | Banoth B,2020 | [28] |
| 肿瘤 | ||||
| 结直肠肿瘤 | IRF1 | IRF1激动剂 | Karki R,2020 | [31] |
| 恶性黑色素瘤 | GSDMD,MLKL,Caspase-7 | GSDMD,MLKL,Caspase-7激动剂 | Song M,2021 | [32] |
| 自身免疫性疾病 | ||||
| 类风湿性关节炎 | TAK1,RIPK1,IFN,ZBP1 | TAK1激动剂,RIPK1和ZBP1抑制剂 | Place DE,2020 | [33] |
| 银屑病 | TAK1,RIPK1,IFN,ZBP1 | TAK1激动剂,RIPK1和ZBP1抑制剂 | Place DE,2020 | [33] |
| 炎症性肠病 | TAK1,RIPK1,IFN,ZBP1 | TAK1激动剂,RIPK1和ZBP1抑制剂 | Place DE,2020 | [33] |
| 神经系统疾病 | ||||
| 脑缺血再灌注损伤 | TAK1,RIPK3 | TAK1激动剂,RIPK3激动剂 | Yan WT,2022 | [34] |
1. 泛凋亡与病毒感染:清除感染细胞是宿主在病毒感染下存活的重要目标,而病毒则希望阻断宿主细胞的死亡来维持自己的繁殖。泛凋亡作为一种程序性死亡方式,可以启动受感染细胞的死亡并继发机体炎症反应,在病毒感染中发挥着关键作用。在IAV感染期间,ZBP1作为感受器,可触发ZBP1-PANpotosome的组装,后者不仅可以激活NLRP3-和Caspase-1依赖的炎症小体并促使细胞因子IL-1β、IL-18的成熟,还会启动Caspase-8/3/7的激活,进而导致细胞凋亡的发生。值得一提的是,当使用Caspase抑制剂z-VAD后,细胞坏死性凋亡明显增加[20]。作为一种双链DNA(dsDNA)感受器,ZBP1的Zα结构域可以感知IAV蛋白,通过RIPK1-RIPK3-Caspase-8轴触发病毒宿主细胞程序性死亡。更重要的是,ZBP1基因缺陷小鼠可以通过减轻炎症反应和上皮损伤来增强其对IAV感染的抵抗力,充分证明了ZBP1及其介导的泛凋亡在IAV感染中的重要性[21]。不过,ZBP1并非位于IAV感染过程中的最上游,Kuriakose等[22]研究发现IRF1是ZBP1的转录调控因子,在IAV感染期间促进NLRP3炎症小体激活和细胞死亡,当IRF1敲除后,ZBP1的表达和NLRP3炎症小体的激活明显降低。除了IAV,ZBP1在冠状病毒中的作用也引起相关研究人员的广泛兴趣[23, 24]。当机体受到SARS-Cov-2病毒感染时,先天性免疫细胞可以产生大量的炎症细胞因子,例如肿瘤坏死因子(tumor necrosis factorα,TNF-α)和干扰素-β(interferon-β,IFN-β)等,进而触发泛凋亡的发生。其机制可能是TNF-α和IFN-β激活了JAK/STAT1/IRF1炎性轴,导致了一氧化氮的聚集和Caspase-8/FADD的活化,而Caspase-8/FADD是泛凋亡小体不可或缺的组成部分[25]。体内实验也证实了抑制泛凋亡后,可以有效改善因TNF-α和IFN-β导致的小鼠组织损伤和死亡,为泛凋亡在病毒感染中的临床应用提供了一定实验基础和证据。
2.泛凋亡与细菌感染:除了病毒感染,细胞程序性死亡也是机体抵御大多数细菌性病原体的有效手段。鼠疫耶尔森菌(Yersinia pestis)是一个研究细菌感染与PANoptosis关系的良好模型,因为耶尔森菌具有T3SS效应蛋白YopJ,可抑制宿主蛋白TAK1[14]。TAK1在对抗微生物的先天免疫中发挥重要作用,也一定程度上限制了TAK1抑制剂的发展。TAK1抑制剂是一把双刃剑,一方面,这些抑制剂能够阻止TAK1功能的执行,从而促进病原体免疫逃逸;另一方面,宿主的反馈机制将TAK1的干扰或抑制视为细胞内致病性的损伤信号,可触发RIPK1-PANoptosome介导的泛凋亡,通过激活下游的caspases-3/7,磷酸化MLKL,并裂解GSDMD等引起感染细胞程序性死亡[2]。因此,当机体在生长发育过程中受到细菌或者其他病原微生物感染时,RIPK1可以通过调控泛凋亡,导致感染细胞以“自杀式”死亡方式维持机体免疫稳态,构成宿主的先天性免疫屏障。不仅仅是鼠疫耶尔森菌,其他革兰氏阴性或者阳性菌也可以通过触发泛凋亡启动机体的免疫反应,进而有效清除侵入机体的病原菌[19,26]。值得一提的是,不同于病毒感染已经有明确的泛凋亡上游感受器ZBP1,细菌感染启动泛凋亡的机制要复杂很多,因为不同类型细菌不仅可以释放内外细胞毒素,还可以诱导炎性细胞因子的产生,细菌感染的泛凋亡上游感受器还需进一步研究证实。
3.泛凋亡与真菌感染:白色念珠菌和烟曲霉菌是较常见和危险性较高的真菌病原体,在免疫低下的患者中具有较高的发病率和死亡率。作为细胞焦亡的特征性复合物,炎性小体被认为是真菌感应的关键介质和促炎反应的驱动因素[27]。2020年,美国学者Malireddi团队首次报道了白色念珠菌和烟曲霉菌感染可以诱导泛凋亡的发生[28]。他们首先用白色念珠菌和烟曲霉菌感染小鼠的骨髓来源的巨噬细胞(bone marrow derived macrophage,BMDM),观察到Caspase-1、Caspase-3、Caspase-8、GSDMD的明显激活和MLKL的磷酸化,在人外周血单个核细胞中也观察到白色念珠菌感染诱导细胞死亡的剂量依赖性。进一步,他们分别构建了ZBP1基因缺陷鼠和ZBP1的Zα2结构域条件性敲除鼠,鉴定出先天性免疫传感器ZBP1是真菌感染的上游感受器,负责激活泛凋亡,且ZBP1的Zα2结构域是促进炎症小体的激活和泛凋亡发生不可或缺的。除了病毒、细菌和真菌,有研究证实寄生虫感染也能触发泛凋亡的发生,但其具体机制还需进一步研究[17]。
与泛凋亡在感染领域中的深入研究相比,其在肿瘤领域的研究还处于起步阶段,但考虑到肿瘤免疫与感染免疫的诸多相似之处,泛凋亡与肿瘤相互作用的研究有望成为新的研究热点[29, 30]。除了作为ZBP1的转录调控因子,IRF1在多种生理和病理过程中发挥重要作用,包括微生物感染、炎症、先天和适应性免疫反应,以及肿瘤免疫监测等。尽管研究证实其基因突变和功能改变与多种肿瘤的发生密切有关,但其调控肿瘤发生的具体机制尚不清楚。Karki等[31]首次探究了IRF1在调节肿瘤发生和细胞泛凋亡中的作用,并提出IRF1能够显著降低小鼠结直肠肿瘤的发生率,而IRF1缺陷小鼠则表现出对结肠炎相关结直肠肿瘤的异常易感性。作者首先构建IRF1基因缺陷小鼠,比较其与野生型小鼠在促炎细胞因子产生和结肠细胞死亡的差异情况,结果显示二者在促炎细胞因子产生方面相似,但IRF1基因缺陷小鼠结肠细胞死亡明显减少,众所周知,细胞的异常增殖和死亡减少是肿瘤发生的重要病理机制之一。他们进一步研究证实,结肠细胞死亡的减少与凋亡蛋白caspase-3/7激活受损和焦亡、坏死性凋亡的降低有关,其机制可能是IRF1调控了促炎细胞因子TNF和IFN的分泌。考虑到肿瘤细胞能够对化疗药物诱导的细胞凋亡产生耐药性,同时激活多种细胞死亡有望在未来肿瘤治疗中克服这一局限性。IRF1作为泛凋亡的一种上游调控分子,可能是调节多种程序性细胞死亡的有效靶点。
恶性黑色素瘤是一种危及生命的皮肤癌,单剂化疗反应率低。虽然二甲双胍(melbine,MET)和阿霉素(doxorubicin,DOX)的联合治疗对包括恶性黑色素瘤在内的多种肿瘤有效,但二者理化性质和给药剂量的不同很大程度上限制了联合用药在肿瘤中有效性的积累。纳米颗粒(nano-particles,NPs)已被证明可以提高诸如肝癌和肺癌等肿瘤治疗过程中的药物传递效率。中国药科大学陈思禹教授团队基于海藻酸钠、胆固醇和叶酸(folic acid,FCA)等生物材料,制备出了一种生物相容性更好、肿瘤靶向更精确地NPs[32]。正如预期的那样,由于胆固醇和叶酸是黑色素瘤生长的两个不可或缺的底物,他们观察到FCA NPs可以在异种移植黑色素瘤肿瘤中特异性、高效地积累。利用FCA NPs这个特性,可将MET和DOX特异且高效地传递到黑色素瘤肿瘤中,以触发黑色素瘤细胞的凋亡、焦亡和坏死性凋亡等多种程序性死亡方式,从而阻止黑色素瘤的进展。尽管携带MET和DOX的FCA NPs触发黑色素瘤肿瘤泛凋亡的上游感受器和具体分子机制还未明确,但这样一种FCA NPs系统的建立为黑色素瘤的有效药物传递提供了一个载体,增加了药物联合治疗肿瘤的有效性和可行性。
从病理机制角度来看,自身免疫性疾病大多是由于细胞因子的大量释放导致的机体各系统不可控的炎症反应。目前,Ⅰ型IFN受体下游酪氨酸激酶(Janus kinase,JAK)的抑制剂(如巴瑞替尼、托法替尼等)在临床上用于治疗类风湿性关节炎、银屑病和炎症性肠病等多种自身免疫性疾病,因为此类药物可以有效改善细胞因子的生产失调,阻止细胞因子风暴的产生。泛凋亡作为一种程序性的炎性死亡方式,可以刺激促炎细胞因子的产生并继发炎症反应,当炎症反应过度激活时,可能会导致自身免疫性疾病的发生。究其机制,一方面,细胞凋亡可以引起核碎裂、细胞皱缩,该形态变化对机体来说是一种细胞膜紊乱的信号;其次,细胞焦亡通过GSDMD/GSDME在细胞膜表面打孔,可促使炎性细胞因子IL-18和IL-1β的释放;最后,坏死性凋亡也可引起膜紊乱和DAMPs的释放,引起炎症反应的发生。综上,泛凋亡在炎性细胞因子和DAMP释放中的重要作用表明:通过适度阻断程序性死亡来缓解机体过度的炎症反应可能是治疗自身炎症和自身免疫疾病的有效措施[33]。前期研究已证实TAK1抑制情况下可诱发RIPK1介导的泛凋亡,而IFN刺激下也可产生基因产物ZBP1,进而启动ZBP1介导的泛凋亡,这些都为治疗自身炎症或自身免疫性疾病提供了潜在药物靶点。
不同类型的程序性细胞死亡方式可能同时被调控,泛凋亡为研究细胞死亡方式与人类疾病的关系提供了新的思路。为了检验感染性疾病以外的人类疾病中是否也存在泛凋亡,中南大学熊鲲教授团队选择脑缺血再灌注损伤作为研究模型,因为从病理生理机制来看,炎症反应和免疫反应在中枢神经系统疾病中的作用与感染性疾病相似。研究者从Pubmed、Scopus和Web ofscience三大数据库中收集关于脑缺血再灌注的文章,通过文献计量学、数据挖掘等方法从这些文章中获取原始研究数据,然后对这些数据进行整合和分析。最终发现在模拟缺血性脑损伤的细胞模型中,焦亡、细胞凋亡和坏死可以同时发生,这一现象广泛存在于不同神经细胞系或原代神经元中,大鼠和小鼠缺血再灌注损伤动物模型也进一步证实了该结论[34]。虽然该研究只是基于以往的细胞实验和动物实验进行的文献计量学分析,但研究结果提示我们:寻找干预神经元泛凋亡的靶点,有望为神经系统疾病的治疗提供更多选择。
作为当下最复杂、且与多种人类疾病密切相关的程序性死亡方式,泛凋亡具有良好的研究前景,但同时也有很多亟待解决的问题。例如,病毒、细菌和真菌感染均可通过ZBP1感受器启动泛凋亡的发生,但它们之间具有什么样的联系和区别?寄生虫感染也可以触发泛凋亡,但其具体的感受器和分子通路是什么?病原体和肿瘤细胞想方设法逃脱泛凋亡以避免自身被清除,但这些病原体和肿瘤细胞通过什么分子机制来实现泛凋亡逃逸过程?除了文中已知的3种泛凋亡小体,是否还存在其他未发现的蛋白或分子可以介导泛凋亡小体的组装?作为3种程序性死亡的共有上游通路,干预泛凋亡能否发挥出预期临床效果?尽管泛凋亡还存在诸多疑问,但此概念的提出和相关研究进展无疑为研究人员开辟了一片全新的领域,早日阐明泛凋亡在人类疾病中的作用和调控机制,或许能够探索出一条新的治疗策略,为相关患者的治疗带来突破。
所有作者均声明不存在利益冲突



























