
分子靶向药物是治疗中晚期肝癌的主要手段,近年来,肝癌分子靶向药物研究取得众多新进展。为了更好地指导临床合理、有效、安全地应用靶向药物,中国医师协会肝癌专业委员会组织相关领域专家,根据相关临床研究及用药经验,结合循证医学证据等级,历经多次讨论和修改,对肝细胞癌分子靶向药物临床应用(临床治疗推荐、使用方法等)中国专家共识进行了完善和更新。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性肝癌是我国最常见的恶性肿瘤之一,我国2020年肝癌发病患者数410 038例,死亡人数达到391 152例,居于中国恶性肿瘤所致死亡的第2位,其中肝细胞癌(hepatocellular carcinoma,HCC)占到85%~90% 以上[1],严重威胁我国人民的生命和健康[2]。本共识仅讨论HCC的分子靶向治疗。HCC起病隐匿、恶性程度高且进展迅速,我国HCC患者在确诊时,多已处于局部晚期或伴有远处转移[3],对于该部分患者,国内外指南均推荐患者接受系统性治疗。根据《原发性肝癌诊疗指南(2022年版)》[4]推荐:中晚期肝癌患者可用靶向药物治疗;而美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)临床实践指南:肝胆肿瘤(2021年V5版)[5]推荐的系统性治疗方案与国内相比种类更多。众多的靶向药物,针对不同的治疗目的,在不同的患者人群,应该如何选择才能使患者得到最大的获益,之前缺乏权威指南进行解读。中国医师协会肝癌专业委员会组织相关领域专家,根据相关临床研究及用药经验,历经多次讨论和修改,编写了《肝细胞癌分子靶向药物临床应用中国专家共识(2020版)》。这两年,HCC分子靶向药物研究取得了众多新进展,国家药品监督管理局(National Medical Products Administration,NMPA)基于更新证据批准了多种新的肝癌靶向治疗药物。为了更好地指导临床实践,中国医师协会肝癌专业委员会完善和更新了《肝细胞癌分子靶向药物临床应用中国专家共识(2022版)》,以供临床医师参考。
本共识中的推荐意见共分5个级别,分别基于6个证据等级,肝癌分期参照《原发性肝癌诊疗指南(2022年版)》。见表1、2。

循证医学证据等级
循证医学证据等级
| 证据级别 | 描述 |
|---|---|
| Ⅰa | 证据源于对多项随机对照研究的meta分析结果 |
| Ⅰb | 证据源于至少一项设计良好的随机对照研究结果 |
| Ⅱa | 证据源于至少一项设计良好的前瞻性非随机对照研究结果 |
| Ⅱb | 证据源于至少一项设计良好的其他类型干预性临床研究结果 |
| Ⅲ | 证据源于设计良好的非干预性研究,如描述性研究、相关性研究等 |
| Ⅳ | 证据源于专家委员会报告或权威专家的临床经验报道 |

专家推荐意见级别
专家推荐意见级别
| 证据级别 | 描述 |
|---|---|
| A | 良好的科学证据提示该医疗行为带来明确获益;建议医师对患者实施该医疗行为 |
| B | 现有证据表明该医疗行为可带来中度获益,超过其潜在风险;医师可建议或对患者实施该医疗行为 |
| C | 现有证据表明该医疗行为可能获益较小,或获益与风险接近;医师可根据患者个体情况有选择地向患者建议和实施该医疗行为 |
| D | 现有证据表明该医疗行为无获益,或其潜在风险超过获益;医师不宜向患者实施该医疗行为 |
| I | 缺乏科学证据,或现有证据无法评价该医疗行为的获益与风险;医师应帮助患者理解该医疗行为存在的不确定性 |
1.一线治疗:(1)甲苯磺酸索拉非尼是一种口服多激酶抑制剂,两项大型、随机对照、国际多中心的Ⅲ期临床试验证明,索拉非尼能够延缓肿瘤进展,延长晚期HCC患者的生存期[6, 7]。而近期的一项研究表明,尽管所有晚期HCC患者接受索拉非尼治疗均能获益,且丙肝患者和无肝外转移患者获益更佳[8]。2008年8月NMPA正式批准索拉非尼用于晚期HCC一线治疗,也是我国首个获批的肝癌靶向治疗药物(表3)。(2)甲磺酸仑伐替尼是一种口服多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),REFLECT研究(Ⅲ期临床研究)证实仑伐替尼的疗效非劣于索拉非尼且有效率获得突破性进展[9]。该研究分析发现,仑伐替尼在中国人群中的疗效较全球人群更佳[10, 11]。仑伐替尼于2018年9月在我国获批用于晚期HCC一线治疗(表3),本共识所提仑伐替尼证据均源于乐卫玛。(3)贝伐珠单抗联合阿替利珠单抗:贝伐珠单抗是靶向血管内皮生长因子(VEGF)的单克隆抗体,联合阿替利珠单抗有相互协同抗肿瘤的作用,IMbrave150研究(Ⅲ期临床研究)[12]证实,同索拉非尼相比,阿替利珠单抗联合贝伐珠单抗可显著延长患者中位总生存期(mOS);此外,联合治疗组患者的中位无进展生存期(mPFS)、客观缓解率(ORR)也显著改善,且安全性可耐受。基于该研究,NMPA于2020年10月批准了贝伐珠单抗联合阿替利珠单抗晚期HCC一线治疗的适应证(表3)。(4)多纳非尼是一种新型氘代小分子TKI,ZGDH3研究[13]证实多纳非尼组患者的mOS优效于索拉非尼组,且确认的ORR有优于索拉非尼组的趋势。基于该研究,多纳非尼于2021年6月8日在我国获批用于晚期HCC的一线治疗(表3)。(5)IBI305是一种贝伐珠单抗生物类似药,ORIENT-32研究[14]证实IBI305联合程序性细胞死亡(programmeddeath-1,PD-1)单抗(信迪利)一线治疗不可切除乙型肝炎病毒(HBV)相关HCC患者较索拉非尼显著改善总生存期(OS)和无进展生存期(PFS),且安全性可接受。基于该研究,NMPA于2021年6月25日批准IBI305联合信迪利单抗用于晚期HCC一线治疗(表3)。
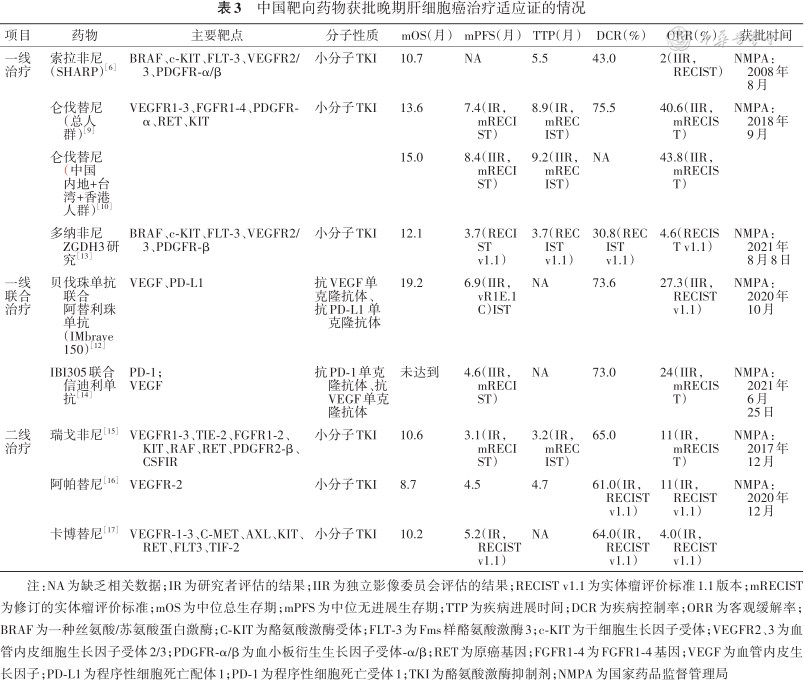
中国靶向药物获批晚期肝细胞癌治疗适应证的情况
中国靶向药物获批晚期肝细胞癌治疗适应证的情况
| 项目 | 药物 | 主要靶点 | 分子性质 | mOS(月) | mPFS(月) | TTP(月) | DCR(%) | ORR(%) | 获批时间 |
|---|---|---|---|---|---|---|---|---|---|
| 一线治疗 | 索拉非尼 (SHARP)[6] | BRAF、c-KIT、FLT-3、VEGFR2/3、PDGFR-α/β | 小分子TKI | 10.7 | NA | 5.5 | 43.0 | 2(IIR,RECIST) | NMPA:2008年8月 |
| 仑伐替尼(总人群)[9] | VEGFR1-3、FGFR1-4、PDGFR-α、RET、KIT | 小分子TKI | 13.6 | 7.4(IR,mRECIST) | 8.9(IR,mRECIST) | 75.5 | 40.6(IIR,mRECIST) | NMPA:2018年9月 | |
| 仑伐替尼(中国内地+台湾+香港人群)[10] | 15.0 | 8.4(IIR,mRECIST) | 9.2(IIR,mRECIST) | NA | 43.8(IIR,mRECIST) | ||||
| 多纳非尼ZGDH3研究[13] | BRAF、c-KIT、FLT-3、VEGFR2/3、PDGFR-β | 小分子TKI | 12.1 | 3.7(RECIST v1.1) | 3.7(RECIST v1.1) | 30.8(RECIST v1.1) | 4.6(RECIST v1.1) | NMPA:2021年8月8日 | |
| 一线联合治疗 | 贝伐珠单抗联合阿替利珠单抗(IMbrave150)[12] | VEGF、PD-L1 | 抗VEGF单 克隆抗体、 抗PD-L1 单克隆抗体 | 19.2 | 6.9(IIR,vR1E.1C)IST | NA | 73.6 | 27.3(IIR,RECIST v1.1) | NMPA:2020年10月 |
| IBI305联合信迪利单抗[14] | PD-1; VEGF | 抗PD-1单克隆抗体、抗VEGF单克隆抗体 | 未达到 | 4.6(IIR,mRECIST) | NA | 73.0 | 24(IIR,mRECIST) | NMPA:2021年6月25日 | |
| 二线治疗 | 瑞戈非尼[15] | VEGFR1-3、TIE-2、FGFR1-2、KIT、RAF、RET、PDGFR2-β、CSFIR | 小分子TKI | 10.6 | 3.1(IR,mRECIST) | 3.2(IR,mRECIST) | 65.0 | 11(IR,mRECIST) | NMPA:2017年12月 |
| 阿帕替尼[16] | VEGFR-2 | 小分子TKI | 8.7 | 4.5 | 4.7 | 61.0(IR,RECIST v1.1) | 11(IR,RECIST v1.1) | NMPA:2020年12月 | |
| 卡博替尼[17] | VEGFR-1-3、C-MET、AXL、KIT、RET、FLT3、TIF-2 | 小分子TKI | 10.2 | 5.2(IR,RECISTv1.1) | NA | 64.0(IR,RECIST v1.1) | 4.0(IR,RECIST v1.1) |
注:NA为缺乏相关数据;IR为研究者评估的结果;IIR为独立影像委员会评估的结果;RECIST v1.1为实体瘤评价标准1.1版本;mRECIST为修订的实体瘤评价标准;mOS为中位总生存期;mPFS为中位无进展生存期;TTP为疾病进展时间;DCR为疾病控制率;ORR为客观缓解率;BRAF为一种丝氨酸/苏氨酸蛋白激酶;C-KIT为酪氨酸激酶受体;FLT-3为Fms样酪氨酸激酶3;c-KIT为干细胞生长因子受体;VEGFR2、3为血管内皮细胞生长因子受体2/3;PDGFR-α/β为血小板衍生生长因子受体-α/β;RET为原癌基因;FGFR1-4为FGFR1-4基因;VEGF为血管内皮生长因子;PD-L1为程序性细胞死亡配体1;PD-1为程序性细胞死亡受体1;TKI为酪氨酸激酶抑制剂;NMPA为国家药品监督管理局
2.二线治疗:(1)瑞戈非尼是一种多激酶抑制剂,瑞戈非尼的获批是基于Ⅲ期临床研究(RESORCE研究)[15]结果,该研究结果提示同安慰剂组相比,瑞戈非尼组患者的mOS和mPFS均显著延长。2017年4月、12月,瑞戈非尼分别被美国食品药品监督管理局(Food and Drug Administration,FDA)和NMPA批准用于索拉非尼治疗失败的晚期HCC二线治疗(表3)。(2)阿帕替尼是一种小分子多激酶抑制剂。AHELP 研究(Ⅲ期临床研究)[16]评估了阿帕替尼对比安慰剂在晚期HCC二线治疗中的有效性和安全性,结果表明阿帕替尼组患者的mOS 和mPFS 均显著延长。基于该研究的数据,NMPA于2020年12月正式批准阿帕替尼用于晚期HCC的二线治疗(表3)。(3)苹果酸卡博替尼也是一种小分子TKI。CELESTIAL研究[17]结果显示,在既往经治的晚期HCC中,卡博替尼组较安慰剂组显著延长mOS和mPFS。卡博替尼最初由美国Exelixis生物制药研发,2019年1月获美国FDA批准用于HCC的二线治疗。
推荐意见1:晚期HCC的一线靶向药物为索拉非尼、仑伐替尼、贝伐珠单抗联合阿替利珠单抗、多纳非尼、IBI305联合信迪利单抗(Ⅰb,A);二线靶向药物为瑞戈非尼、阿帕替尼和卡博替尼(Ⅰb,A)。
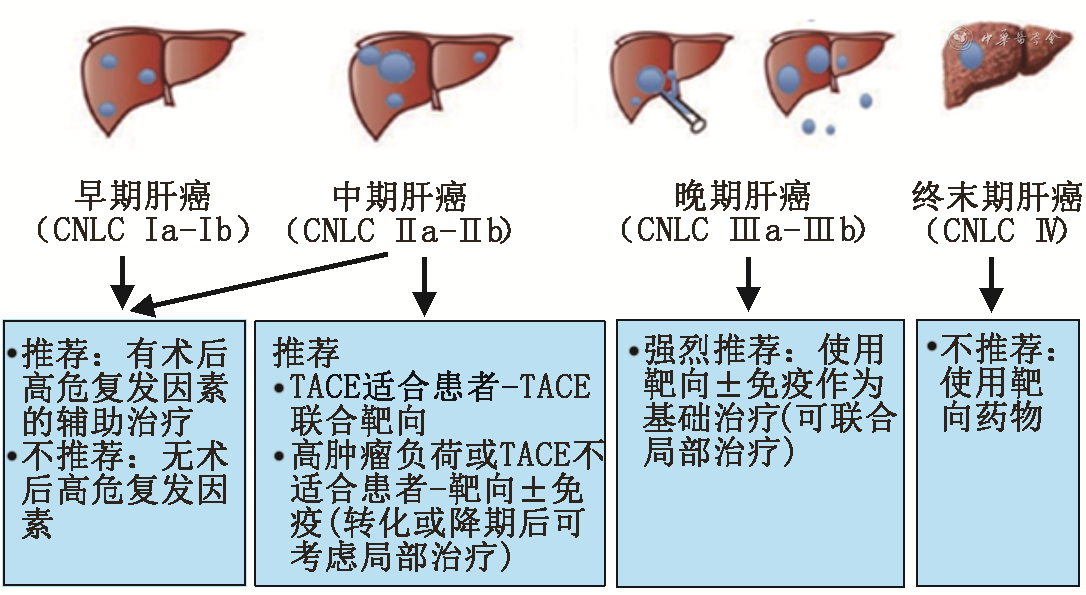

注:高危复发因素(以下任意一项):(1)病理提示微血管侵犯(MVI);(2)肿瘤数目≥3个;(3)肿瘤直径≥8 cm;(4)边界不清,包膜不完整。TACE不适合:肿瘤负荷超出up-to-seven标准;白蛋白-胆红素(ALBI)分级为2级;恶性表型,如结节外生长、多结节融合、巨大肿瘤;CNLC为中国肝癌分期方案;TACE为肝动脉化疗栓塞术
对于早期HCC[中国肝癌分期方案(China liver cancer staging,CNLC)Ⅰa~Ⅰb]患者,手术是主要的治疗手段,合并高危复发因素者,推荐靶向药物作为辅助治疗;针对中期HCC(CNLC Ⅱa~Ⅱb)患者,国内指南推荐以手术或者介入治疗为主,对于合并术后高危复发因素的患者可加用靶向药物作为辅助治疗;而对于晚期HCC(CNLC Ⅲa~Ⅲb)患者,国内指南推荐以系统性治疗为主。近年来,由于药物客观有效率不断提高,初始不可切除患者有望通过药物治疗达到肿瘤明显缩小、癌栓降期的治疗效果,从而获得根治性治疗机会。在肝功能较差患者中靶向药物应用也积累了一定的使用经验,可供临床参考。
1.靶向药物作为辅助治疗的推荐:靶向药物作为HCC患者辅助治疗的作用尚存争议。虽然STORM研究未达到研究预期[18],但近年来又有多项研究证实合并有高危复发风险(微血管侵犯,存在卫星结节)的早期HCC及中期HCC患者,分子靶向药物作为术后辅助治疗可以降低术后复发风险[19, 20, 21, 22, 23]。2021年欧洲肿瘤学会(European Society for Medical Oncology,ESMO)报道的LANCE研究表明,对于切除后复发风险较高的患者,仑伐替尼联合肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)较单用TACE显著延长PFS(17.0 与 9.0个月,P=0.002 8)[24]。病例对照研究结果显示肝移植后仑伐替尼辅助治疗在延长高风险HBV相关HCC患者无病生存率(DFS)和减少复发方面具有潜在获益,且安全性可耐受[25]。辅助治疗时间尚无统一标准,不同研究标准不一致。
推荐意见2:对于手术后高复发风险的早期肝癌患者(合并微血管侵犯、存在卫星结节等),可使用分子靶向药物作为辅助治疗,预防复发(Ⅱb,B);此外,对于可手术的中期患者,推荐使用分子靶向药物作为辅助治疗,预防术后复发(Ⅱb,B)。
2.靶向药物作为转化治疗的推荐:目前有关转化治疗的研究多见于小样本回顾性临床报道,转化切除率约在10%~30%[26, 27, 28]。临床实践中,针对潜在可切除的肝癌患者究竟选择何种系统抗肿瘤治疗方案尚无定论。从转化切除的角度考察系统性治疗方案,除外基础肝病和患者意愿,最重要的考量因素是ORR和缓解方式,包括肿瘤进展率、到达缓解时间和病灶缓解持续时间。从目前肝癌一线系统抗肿瘤治疗的临床研究数据分析,仑伐替尼较索拉非尼可能具有更高的ORR[9],而靶向治疗联合免疫[12,14,29, 30]治疗不可切除肝癌时可能较单药治疗具有更强大的转化潜力。目前缺乏不同药物组合之间的比较研究,在选择药物或组合时一方面需要考虑药物抗肿瘤的效果,另一方面也要考虑其在安全性和可及性的特点。
转化治疗的手术时机还应考虑手术的安全性,不同治疗手段后转化手术的时机也各不相同。目前少有研究明确术前需停药的时间,根据已有的文献报道,分子靶向药物应停药1~2周以上[31, 32, 33],贝伐珠单抗术前一般需要停药4~6周以上以保证肝切除的安全性[34]。目前,对于抗血管生成药物联合PD-1抑制剂治疗对于术后肝脏功能以及手术安全性影响的研究结果较少,仍需要积累更多数据以确定合理的术前评估策略。
推荐意见3:针对具有转化可能的不可手术的中晚期HCC患者,可行以分子靶向药物为基础的联合治疗方案,并建议入组临床试验(Ⅱb,A)。转化成功后,术前分子靶向药物应停药1~2 周以上,贝伐珠单抗应停药4~6 周以上(Ⅲ,A)。
3.靶向药物作为新辅助治疗的推荐:系统抗肿瘤治疗在肝癌新辅助治疗中仍处于探索阶段。目前,分子靶向药物联合TACE或免疫治疗作为肝癌新辅助治疗的探索性试验已取得一些成果,具有良好的研究前景。一项单臂Ⅰb期研究,评估了新辅助卡博替尼和纳武利尤单抗在HCC患者中的可行性,在入组的15例患者中,12 例(80%)成功实现切缘阴性切除,5/12(42%)患者实现主要病理缓解[35]。一项单臂的Ⅱ期研究[36]评估了新辅助西米普利单抗在可切除HCC患者中的应用,结果发现疾病控制率(disease control rate,DCR)为100%,ORR为35%,限于随访时间还没有披露远期效果。另一项研究[37]评估了肝移植前PD-1抑制剂联合仑伐替尼新辅助治疗HCC患者的疗效和安全性,结果显示8例患者(80%)达到部分缓解(partial remission,PR),DCR为100%,表明新辅助免疫治疗+仑伐替尼在移植受者中可能有效。目前的相关研究仍较少,建议将高危复发风险的肝癌患者积极纳入相关临床试验。
推荐意见4:目前靶向药物作为新辅助治疗手段尚在探索阶段,建议将高危复发风险的肝癌患者积极纳入相关临床试验(Ⅳ,B)。
4.靶向药物联合局部治疗的推荐:临床实践中,CNLC Ⅲ期患者按照合并脉管癌栓类型和是否有肝外转移可采用放疗、TACE或肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)作为联合治疗手段,分子靶向药物应作为CNLC Ⅲ期患者的单药或联合治疗的基本选择[38]。
抗血管生成药物(包括 TKI 或 VEGF 抗体)可能会延迟TACE 后肿瘤血管重建和复发[39]。虽然国外几项大型研究显示索拉非尼联合TACE 治疗未能延长患者PFS[40, 41],但是考虑到临床实践中TACE治疗的疗效评估以及实施频率的个体化的特点,采用至疾病无法治疗的进展时间(time to TACE progression,TTUP)作为研究终点的TACTICS研究最终OS分析证实了在无血管侵犯、无肝外转移、不可切除的中期HCC患者中,TACE联合索拉非尼可显著提高患者的mPFS但不能提高OS[42]。但回顾性研究显示仑伐替尼联合TACE可以改善中期HCC患者的预后[43]。
推荐意见5:分子靶向药物应作为CNLC Ⅲ期患者治疗的基本药物(Ⅰb,A),同时推荐根据肝功能水平,可选择联合局部治疗加强肝内病灶控制或联合其他药物加强全身病灶控制(Ⅱb,B)。
5.靶向药物联合免疫治疗推荐:靶向药物联合免疫治疗理论上具有协同作用,VEGF抑制剂可将免疫抑制性肿瘤微环境重新编程为免疫刺激性环境,在这种情况下给予PD-1/程序性细胞死亡-配体1(programmed cell death-ligand 1,PD-L1)抗体可增强T细胞的抗肿瘤活性[44]。目前贝伐珠单抗联合阿替利珠单抗、贝伐珠单抗类似物(IBI305)联合信迪利单抗均已经在我国获批晚期HCC一线治疗的适应证,尚有多种靶、免联合方案正在临床试验中且初步显示了良好的疗效(附件1,扫描本文首页二维码查看)。
Meta分析显示贝伐珠单抗增加动脉和静脉不良事件的风险,接受高剂量贝伐珠单抗治疗会增加这些风险[45]。IMbrave 150研究中,阿替利珠单抗-贝伐珠单抗组中25.2%的患者发生了贝伐珠单抗引起的任何级别的出血,而索拉非尼组17.3%的患者发生了出血[46]。因此,靶、免联合应用前建议伴有高出血风险的食管胃底静脉曲张的患者评估食管胃底静脉曲张情况并进行预处理。
推荐意见6:对于Child A或Child B7的肝癌患者,建议靶向药物联合免疫治疗,并建议积极入组临床试验探索最佳的组合方式(Ⅰb,A)。
6.靶向药物治疗肝功能较差患者:目前靶向药物的Ⅲ期临床研究均针对Child-Pugh A 级的患者,根据国内外指南推荐,Child-Pugh 评分≤7分的患者可以使用分子靶向治疗。但部分真实世界研究报道显示Child-Pugh B期患者使用靶向药物的安全性整体上同Child-Pugh A级患者相似,并可获得一定的生存获益[8,47],但仍需谨慎使用且需大规模临床试验观察。
推荐意见7:针对肝功能不全(Child-Pugh B8-9)的患者,推荐根据个体情况,谨慎使用分子靶向药物进行挽救性治疗,同时需密切监测肝功能情况,避免严重肝功能损害的发生(Ⅲ,C)。终末期HCC 患者,不推荐进行分子靶向药物治疗(Ⅲ,D)。
7.靶向药物治疗肾功能损害患者:轻度、中度或不需要透析的重度肾功能损害的患者无需调整索拉非尼剂量。尚未进行透析患者应用索拉非尼的研究。对于可能有肾损害危险的患者,建议对其体液平衡和电解质平衡进行监测。对于轻度或中度肾功能不全患者,无需根据肾功能调整仑伐替尼剂量。目前尚无重度肾功能不全患者的研究数据,重度肾功能不全患者不建议服用仑伐替尼。如果发生肾病综合征,应停用仑伐替尼[10]。现有临床数据表明[48],轻度、中度或重度肾损伤患者与肾功能正常患者相比,瑞戈非尼及其代谢产物M-2和M-5的暴露量相似,轻度、中度或重度肾损伤患者不必调整剂量;在轻度或中度肾功能不全的个体中应谨慎使用卡博替尼,不建议对轻度或中度肾功能不全的患者进行剂量调整,没有在严重肾功能损害或需要透析的患者中使用卡博替尼的经验。
推荐意见8:针对肾功能损害的患者,推荐根据个体情况,谨慎使用分子靶向药物进行治疗,同时需密切监测肾功能情况,避免严重肾功能损害的发生。一般轻度、中度肾功能损害患者无需调整剂量(Ⅲ,B)。
1.索拉非尼用法:为400 mg,2次/d,持续治疗直至患者不能临床受益或出现不可耐受的不良反应。随机对照的Ⅲ期临床研究以及上市后真实世界研究均显示:索拉非尼按照标准剂量应用耐受性好[6, 7,49, 50]。
2.仑伐替尼是首个根据患者千克体重调整药物使用剂量的靶向药物:参照说明书推荐:体重≥60 kg患者12 mg/d,体重<60 kg患者8 mg/d[10]。然而由于HCC患者通常存在基础肝病,临床实践中常常会以低剂量起始使用,一项多中心的真实世界研究中显示,对于体重≥60 kg患者,平均剂量强度为8.4 mg/d,也可获得满意的疗效[51]。而中国HCC患者由于疾病原因通常体重下降迅速以及基础肝功能不足,故而在临床治疗中常选择较低剂量(8 mg/d)作为治疗剂量,同样也证实具有满意的疗效。
3.贝伐珠单抗联合阿替利珠单抗用法:首先静脉输注阿替利珠单抗,推荐剂量为1 200 mg,然后静脉输注贝伐珠单抗15 mg/kg。该方案每3周给药1次。治疗直至临床获益消失或出现不可接受的毒性。根据说明书规定:如果在预定日期漏用了本品,应尽快给药,并应调整给药计划,使两次给药之间间隔3 周;不建议调整本品的用药剂量;对于免疫相关不良反应,给予暂停给药、永久停药或联合其他辅助治疗。
4.多纳非尼:推荐用法用量为200 mg,口服,2次/d,连续服用[1],建议每天同一时段服药,持续至患者不能获得临床获益或出现不可耐受的毒性反应。如果漏服药物,无需补服。
5.信迪利单抗+贝伐珠单抗类似药(IBI305):首先静脉输注信迪利单抗,推荐剂量为200 mg,间隔至少5 min,建议给药当天静脉输注IBI305,推荐剂量为15 mg/kg,该方案每3周给药1次,治疗直至出现疾病进展或产生不可耐受的毒性。根据说明书规定:如果在联合治疗期间,由于无法耐受的毒性反应而暂时或永久终止IBI305的治疗,可在医生基于患者的病情综合判断后,继续接受信迪利单抗单药的治疗,但不推荐降低IBI305的使用剂量,并且不建议调整阿替利珠单抗的使用剂量。
6.瑞戈非尼的推荐剂量用法:160 mg,1次/d,于每一疗程的前21 d口服,28 d为一疗程。持续治疗直至患者不能临床受益或出现不可耐受的不良反应。说明书建议对于常见不良反应,基于个人的安全性及耐受性考虑,可能需要中断给药或降低剂量。应采用每次40 mg的剂量调整。建议每日最低剂量为80 mg,每日最高剂量为160 mg。日本和韩国晚期HCC的回顾性研究发现,对于肝储备功能Child-Pugh B/C 级合并肾功能不全、体重<50 kg或索拉非尼治疗期间出现过2或3级治疗相关不良事件(TRAE)的患者,临床医生往往在二线应用瑞戈非尼时将起始剂量调整为120 mg或80 mg[52, 53]。
7.阿帕替尼用法:阿帕替尼为750 mg,1次/d,疗程中漏服阿帕替尼的剂量不能补充,治疗时间为连续服用直至疾病进展或出现不可耐受的不良反应。阿帕替尼在使用过程中应密切监测不良反应,并根据需要进行剂量调整。
8.卡博替尼用法:推荐用法用量为60 mg,口服,1次/d。
目前国内已获批的分子靶向药物均为多靶点TKI,如索拉非尼、仑伐替尼、瑞戈非尼等。尽管已有多项研究旨在评估靶向药物治疗HCC的疗效预测指标[如微血管侵犯(microvascular invasion,MVI)、淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、肝外扩散(extrahepatic metastases,EHS)、丙型肝炎病毒(hepatitis C virus,HCV)、肝功能(mALBI评分)、微小RNA(miRNA)、腹泻和手足综合征等][54, 55, 56, 57],但是目前尚无明确的可预测疗效的标志物。影像学检查及HCC相关肿瘤标记物[如甲胎蛋白(alpha-fetoprotein,AFP)、异常凝血酶原等]仍是判断分子靶向药物起效的主要指标。肝功能(mALBI联合Child-Pugh分级)有助于预测索拉非尼治疗后二线治疗选择[58]。在一线治疗进展后,需要及时进行评估,更换治疗方案。
推荐意见9:目前尚无可用于预测靶向药物疗效的明确指标。在一线靶向药物影像学进展后,应及时进行综合评估,更换合适的二线治疗方案(Ⅱb,B)。
1.分子靶向药物不良反应总体处理原则:由于HCC靶向治疗药物多为多靶点TKI,治疗相关不良事件发生普遍[6, 7,9,15],可能导致药物减量甚至停药,甚至少数患者发生药物相关性死亡。因此需明确用药患者一般情况和常见不良反应处理。目前国内外指南未对患者一般情况给予推荐。临床研究对患者一般情况推荐为:血小板≥60×109/L,中性粒细胞计数≥1.5×109/L,血红蛋白≥85 g/L,凝血酶原时间(prothrombin time,PT)国际标准化比值(INR)≤2.3,白蛋白≥28 g/L,血清肌酐≤1.5倍正常值上限[6, 7,9]。同时需要加强不良反应管理,密切监测患者一般情况,尽早发现不良反应,及时对症处理,中度至重度不良反应需暂停或终止给药。对重症患者应需专科会诊。
2.不良反应发生后剂量调整总体原则:根据CTCAE 5.0常见不良事件评价标准将不良事件的严重程度分为1~5级(附件2,扫描本文首页二维码查看),按照目前临床研究以及药物说明书建议,出现≥3级不良事件则需要暂停靶向药物治疗,对症治疗至不良事件缓解至1级及以下时,减低药物剂量重新开始治疗(具体药物减量调整方案见表4)。
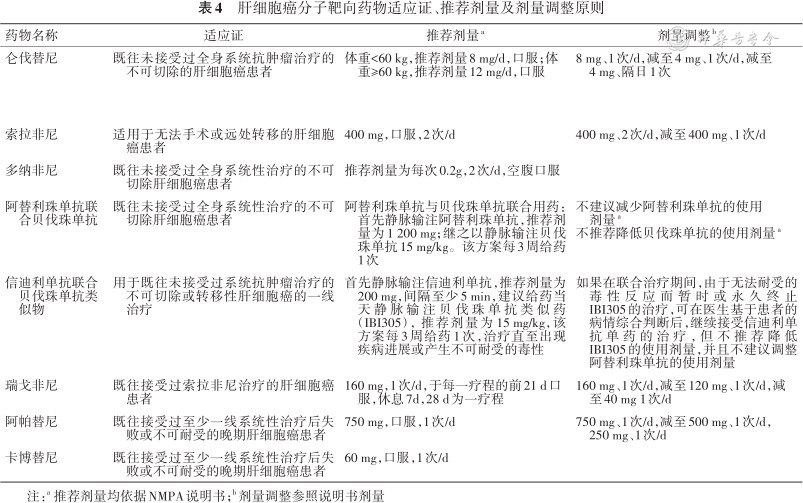
肝细胞癌分子靶向药物适应证、推荐剂量及剂量调整原则
肝细胞癌分子靶向药物适应证、推荐剂量及剂量调整原则
| 药物名称 | 适应证 | 推荐剂量a | 剂量调整b |
|---|---|---|---|
| 仑伐替尼 | 既往未接受过全身系统抗肿瘤治疗的不可切除的肝细胞癌患者 | 体重<60 kg,推荐剂量8 mg/d,口服;体重≥60 kg,推荐剂量12 mg/d,口服 | 8 mg、1次/d,减至4 mg、1次/d,减至4 mg、隔日1次 |
| 索拉非尼 | 适用于无法手术或远处转移的肝细胞癌患者 | 400 mg,口服,2次/d | 400 mg、2次/d,减至400 mg、1次/d |
| 多纳非尼 | 既往未接受过全身系统性治疗的不可切除肝细胞癌患者 | 推荐剂量为每次0.2g,2次/d,空腹口服 | |
| 阿替利珠单抗联合贝伐珠单抗 | 既往未接受过全身系统性治疗的不可切除肝细胞癌患者 | 阿替利珠单抗与贝伐珠单抗联合用药:首先静脉输注阿替利珠单抗,推荐剂量为1 200 mg;继之以静脉输注贝伐珠单抗15 mg/kg。该方案每3周给药1次 | 不建议减少阿替利珠单抗的使用剂量a 不推荐降低贝伐珠单抗的使用剂量a |
| 信迪利单抗联合贝伐珠单抗类似物 | 用于既往未接受过系统抗肿瘤治疗的不可切除或转移性肝细胞癌的一线治疗 | 首先静脉输注信迪利单抗,推荐剂量为200 mg,间隔至少5 min,建议给药当天静脉输注贝伐珠单抗类似药(IBI305),推荐剂量为15 mg/kg,该方案每3周给药1次,治疗直至出现疾病进展或产生不可耐受的毒性 | 如果在联合治疗期间,由于无法耐受的毒性反应而暂时或永久终止IBI305的治疗,可在医生基于患者的病情综合判断后,继续接受信迪利单抗单药的治疗,但不推荐降低IBI305的使用剂量,并且不建议调整阿替利珠单抗的使用剂量 |
| 瑞戈非尼 | 既往接受过索拉非尼治疗的肝细胞癌患者 | 160 mg,1次/d,于每一疗程的前21 d口服,休息7d,28 d为一疗程 | 160 mg、1次/d,减至120 mg、1次/d,减至40 mg 1次/d |
| 阿帕替尼 | 既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌患者 | 750 mg,口服,1次/d | 750 mg、1次/d,减至500 mg、1次/d,250 mg、1次/d |
| 卡博替尼 | 既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌患者 | 60 mg,口服,1次/d |
注:a 推荐剂量均依据NMPA说明书;b 剂量调整参照说明书剂量
3.分子靶向药物主要不良反应的处理:(1)高血压:高血压是抗血管生成抑制剂,特别是VEGF/VEGF受体(VEGFR)抑制剂最常见的不良反应之一,在HCC分子靶向药物治疗的发生比例为5%~42%[6, 7,9,15],可以引起继发性高血压或使原有的高血压病情加重[59, 60]。原有高血压病患者血压控制不佳[>150/100 mmHg(1 mmHg=0.133 kPa)],或有高血压合并血栓病史,需要长期服用抗凝药物的患者应该慎用。防治建议:美国国立癌症研究所(National Cancer Institute,NCI)心血管毒性小组推荐[61],在使用VEGF/VEGFR抑制剂治疗开始前,应当明确患者的基线血压;在治疗过程中,保持血压稳定和尽可能<140/90 mmHg。血压监测应当从用药前就开始,贯穿于整个治疗过程,尤其是治疗初期的2周内,要求进行每日监测[62]。因此,对于原有高血压病的患者,在给予分子靶向药物前,必须遵循个体化的原则应用降压药,预先使血压得以良好控制(<140/90 mmHg);但是对于血压正常的患者,不推荐预防性降压治疗。应充分告知患者,当血压>140/90 mmHg或出现与血压升高相关的症状时(如明显头痛、头晕、视觉障碍等),立即联系经治医师,获得指导[63, 64]。降压药物的选择,建议遵循《中国高血压防治指南2018》[65]。对于合并有蛋白尿的患者,一般推荐使用血管紧张素转换酶抑制剂(angiotensin Ⅰ-converting enzyme inhibitor,ACEI)及血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)[65]。
(2)蛋白尿:蛋白尿在HCC 分子靶向药物治疗的发生比例为9.1%~51.0%[9]。防治建议:对于抗血管生成靶向药物诱发的蛋白尿,目前尚无明确的治疗方法。ACEI及ARB类药物可以通过降低肾小管内压力进而减轻蛋白尿,并降低可能的心脏不良事件发生率,可以酌情使用。但是,最有效的方法是及时减量或停用靶向药物[66]。建议靶向药物治疗开始前及治疗过程中定期检查患者的尿常规,动态监测血压、肾功能和蛋白尿情况,在最初2个月内每2周检查1次尿常规和(或)24 h尿蛋白定量,之后每4周检查1次,发生蛋白尿时要及时就医。尿蛋白≥++,应进一步行24 h尿蛋白定量;尿蛋白定量≥2 g/24 h则建议暂停药物,待蛋白尿恢复至<2 g/24 h后,将药物减量后继续治疗。值得注意的是,一旦发生肾病综合征,分子靶向药物治疗应永久终止,并且积极进行对症支持治疗。对于具有潜在的肾功能疾病,肾切除手术后,既往有高血压病、肾脏疾病以及糖尿病病史的患者,需要慎用靶向药物和严密观察随访[67]。
(3)手足皮肤反应(HFSR):是分子靶向药物临床最常见的皮肤毒性之一,在HCC分子靶向药物治疗的发生比例为21%~52%[6, 7,9,15]。主要表现为手足的麻木感、烧灼感、红斑肿胀、皮肤变硬、起疱、皲裂以及脱屑,具有手指或足趾弯曲部位皮肤角化的特征,通常为双侧性,症状常常同时或接连发生,主要发生在手掌和足底,受力区往往症状更为显著[68]。防治建议:教育患者在服用分子靶向药物期间应该避免手掌和足底的机械性损伤和摩擦,例如穿着宽松透气的鞋子、柔软的全棉手套和线袜,使用凝胶鞋垫,避免压力式剧烈运动。手足都应避免接触高热和直接日晒,使用保湿、含有羊毛脂或尿素成分的护肤品来保护皮肤;避免进食辛辣、刺激性食物[69]。
(4)出血:晚期HCC的分子靶向药物通常都以抗血管生成相关通路为主要靶点,根据抗血管生成药物的应用经验[70, 71],必须高度关注临床上可能存在的出血风险,特别是正在接受溶栓或抗凝治疗的患者需要慎用,目前出血在HCC分子靶向药物治疗中的发生比例为7%~23%[6, 7,10]。抗血管生成药物容易引起出血的机制尚不清楚。可能与抑制VEGF/VEGFR 转导通路,降低血管内皮细胞的再生能力,使基质下的促凝血磷脂暴露和引起血小板功能障碍,从而导致出血或血栓形成有关[59]。防治建议:对于具有高出血风险的患者,应该慎用抗血管生成靶向药物,包括:第一是胃部存在活动性消化溃疡病灶,且大便潜血(++)者;第二是3个月内有黑便和(或)呕血病史者;第三是凝血功能异常,具有出血倾向者。同时,在用药期间应严密监测PT和INR,关注患者是否发生出血倾向及其有关症状;一旦出现严重异常(3~4级),建议停药(附件2,扫描本文首页二维码查看)。如果发生上消化道大出血,必须立即停用靶向药物,并且按照临床常规积极治疗出血。如果在服用靶向药物过程中需要进行某种手术,应在预定手术前中断用药[70],术后直至伤口完全愈合后再恢复使用。
推荐意见10:肝癌患者在分子靶向药物的使用时需要重视患者教育,履行全面告知的义务,一些症状不明显的不良反应,需要按时随访,需要指导患者采取预防不良反应的措施,医护人员及时监测和管理,提高患者的依从性,改善生活质量,使患者获得最大程度的获益(Ⅲ,A)。
1.一线系统抗肿瘤治疗期间若出现以下2种情况:(1)不可耐受;(2)影像学进展;可考虑进行序贯治疗[71]。二线治疗选择应基于患者和临床医生决定以及其他因素,包括合并症、肝功能、体能状态以及与治疗方案相关的潜在获益和危害风险[72]。序贯治疗选择原则:①最大化生存获益或生活质量;②考虑临床试验纳入标准;③允许暴露于3类活性药物:TKI,ICI和抗血管生成抗体[73]。
2.除前已述及NMPA批准的二线靶向治疗药物(瑞戈非尼、阿帕替尼)外,NMPA还批准了两种二线免疫治疗药物,即卡瑞利珠单抗[74]或替雷利珠单抗[75],亦可用于一线靶向治疗失败的二线用药(附件3,扫描本文首页二维码查看)。其他仅FDA批准的二线靶向或免疫治疗药物有:雷莫芦单抗[76](适用于AFP≥400 μg/L的HCC患者)、帕博利珠单抗[77]和纳武利尤单抗联合伊匹木单抗[78]。
目前分子靶向药物+免疫一线治疗进展后的后线治疗经验有限,多限于小样本回顾性研究报道。鉴于作用机制不同,阿替利珠单抗+贝伐珠单抗治疗后使用分子靶向药物进行二线治疗可能会提供临床获益[72,79]。基于Ⅲ期随机临床试验(RCT)开发确定序贯治疗策略的模型结果显示,阿替利珠单抗+贝伐珠单抗序贯仑伐替尼(中位OS,24个月)或索拉非尼(中位OS,23个月)可能是目前最有效的序贯策略[79]。
推荐意见11:在一线治疗使用索拉非尼、仑伐替尼或多纳非尼后,二线治疗可选择瑞戈非尼、阿帕替尼、卡博替尼、卡瑞利珠单抗或替雷利珠单抗(Ⅰa,A);阿替利珠单抗+贝伐珠单抗或信迪利单抗联合贝伐珠单抗类似物一线治疗后,分子靶向药物(一线或二线)(Ⅲ,A)、卡瑞利珠单抗或替雷利珠单抗(Ⅲ,B)可作为二线治疗选择,并建议患者积极入组临床试验。
中期HCC在肝功能储备、肿瘤大小和肿瘤数量方面具有极强的异质性[80, 81]。长期以来,欧美指南根据巴塞罗那临床肝癌(BCLC)分期推荐中期HCC患者行TACE治疗,而包括中国在内的亚太地区则推荐差异化治疗策略[4,82, 83]。临床实践也发现TACE不适用于所有中期HCC病例,有学者推荐TACE仅用于肝功能尚可的孤立性或局限性多结节HCC[84]。2021 年底,BCLC 分期系统迎来了一次重大更新,新版BCLC分期系统(2022版)推荐高肿瘤负荷患者,如弥漫性、浸润性,或者广泛的肝双叶受累患者,首选系统抗肿瘤治疗(靶向药物±免疫治疗)[85]。回顾性研究显示[86],与继续 TACE 的患者相比,TACE难治改用索拉非尼患者的中期HCC患者的OS延长。一项大型队列全球前瞻性观察研究(OPTIMIS)证实,在不适合TACE后立即改用索拉非尼可改善 OS(倾向评分匹配队列:15.2 与11.8 个月)。因此,如果TACE的疗效不能达到预期或TACE后可能出现慢性肝功能恶化,应考虑转为或联用系统抗肿瘤治疗。
日本学者则提出,对于高肿瘤负荷的中期肝癌应转变治疗理念,将靶向药物的应用节点放在TACE治疗之前[87]。一项概念验证性研究[88]表明,对于肿瘤负荷超出up-to-seven标准的BCLC B期HCC患者,与单纯TACE治疗组比较,仑伐替尼治疗组(选择性序贯TACE治疗)的ORR更高(73.3%与 33.3%,P<0.001),中位OS更长(37.9个月与21.3个月,P<0.01)。从理论上来说,仑伐替尼序贯TACE具有协同效应,仑伐替尼能够诱导肿瘤血管正常化,从而在TACE治疗时改善药物分布,提高TACE疗效[80]。此外,初步经验表明[87],可以通过靶向药物联合免疫的转化治疗,使肿瘤缩小,为中期HCC患者带来根治性治疗机会。
有鉴于此,对B期患者进行分层,将有助于实施差异化治疗策略。如Bolondi 标准将BCLC B期细分为B1~B4期,Kinki标准分为B1~B3期。中国学者提出的“six-and-twelve”模型:肿瘤负荷>12的患者可能是比较单独TACE和TACE联合系统抗肿瘤治疗试验的候选人群[89, 90]。肝细胞癌患者再次TACE适用性评价(ART评分)系统中,若患者ART评分≥2.5,则不适合再接受TACE治疗[91]。日本学者则提出了“TACE不适用”的概念[87],包括:肿瘤负荷超出up-to-seven标准;白蛋白-胆红素(ALBI)分级为2级;恶性表型,如结节外生长、多结节融合、巨大肿瘤等。另外,HAIC或联合靶向药物治疗亦可用于TACE疗效不能达到预期的中期HCC患者。
推荐意见12:推荐对于中期HCC的靶向治疗采用差异化治疗策略,如果TACE的疗效不能达到预期则应考虑转为或联用系统抗肿瘤治疗(Ⅱb,A)。对于高肿瘤负荷的中期HCC应考虑转变治疗理念,推荐首选靶向药物或联合免疫治疗(Ⅲ,B)。
1.仑伐替尼联合帕博利珠单抗:KEYNOTE-524研究[29]证实,该联合方案表现出令人鼓舞的疗效。mOS:22.0个月,mPFS:9.3个月,ORR:46%(附件1,扫描本文首页二维码查看)。为进一步探索该联合治疗组合的治疗作用,正在进行晚期HCC患者的全球3期临床试验LEAP-002[92]。
2.瑞戈非尼联合帕博利珠单抗:不同剂量瑞戈非尼一线治疗晚期HCC的一项开放标签的Ⅰb期研究[93]提示联合治疗中瑞戈非尼的最大耐受剂量(MTD)为120 mg/d,联合治疗的有效性令人鼓舞(120 mg 剂量组ORR 为29%,DCR为94%)(附件1,扫描本文首页二维码查看)。
3.仑伐替尼联合纳武利尤单抗:Study117研究[94]的初步数据显示:在30例可评估患者中,研究者根据mRECIST 标准评估的ORR 达76.7%,DCR达96.7%。2020年ESMO大会报告了IMMUNIB研究的数据,该研究评估了纳武利尤单抗联合仑伐替尼治疗晚期HCC的安全性,结果表明240 mg的纳武利尤单抗和12 mg或8 mg仑伐替尼联合治疗耐受性良好[95](附件1,扫描本文首页二维码查看)。
4.安罗替尼是一种新型小分子多靶点TKI。2020年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)大会上公布了安罗替尼联合派安普利单抗(抗PD-1单抗)一线治疗晚期HCC的Ⅰb/Ⅱ期研究数据[96]。结果表明联合治疗组的ORR为24%,DCR为84%,中位进展时间(mTTP)为8.8 个月,6 个月生存率为91.6%(附件1,扫描本文首页二维码查看)。
5.阿帕替尼联合卡瑞利珠单抗:RESCUE 研究的初步数据显示:该联合方案用于晚期肝癌一线和二线治疗的ORR 分别为34.3% 和22.5%,mPFS分别为5.7个月和5.5个月,12个月生存率分别为74.7%和68.2%[3](附件1,扫描本文首页二维码查看)。
6.卡博替尼联合阿替利珠单抗:Ⅲ期COSMIC-312研究[97]评估了卡博替尼联合阿替利珠单抗与索拉非尼一线治疗晚期HCC患者的安全性和疗效,结果显示卡博替尼联合阿替利珠单抗较索拉非尼显著改善PFS(mPFS 6.8与4.2个月),但OS无显著获益。
7.德瓦鲁单抗联合曲美木单抗:Ⅲ期HIMALAYA研究[98]显示德瓦鲁单抗联合曲美木单抗的ORR和OS分别为20.1%和16.4个月,显著高于索拉非尼的5.1%和13.8个月。
HCC分子靶向药物治疗在近年来发展迅速。一线治疗继索拉非尼和仑伐替尼之后,多纳非尼、贝伐珠单抗联合阿替利珠单抗、IBI305联合信迪利单抗等方案相继获得NMPA批准上市;二线治疗继瑞戈非尼、阿帕替尼之后,卡博替尼也在我国获批HCC适应证。目前也在积极探索新型的分子靶向药物联合治疗策略(如仑伐替尼联合帕博利珠单抗等)、新的治疗靶点、抗体药物偶联物(antibody-drug conjugate,ADC)(靶向GPC3 和CD24)、新型给药系统(纳米颗粒给药系统)用于治疗HCC。同时,对TKI耐药机制的探索,可能为克服耐药提供新的策略。
一系列的临床研究证明,采用分子靶向药物治疗晚期HCC疗效确切,具有较好的客观疗效和明显的生存获益;同时,多种靶向药物在获得NMPA批准上市之后也初步积累了一定的用药经验;本共识结合了分子靶向药物治疗晚期HCC的Ⅲ期临床研究数据、上市后临床用药情况、专家学者的实践经验以及其他抗血管生成靶向药物的使用情况,对于如何合理、安全有效地应用靶向药物提出了意见和建议,提供给临床医师作为用药参考。目前HCC的靶向治疗发展迅猛,新的药物和治疗方式不断涌现,有关各种分子靶向药物最佳给药方法、剂量强度、用药终点的探索、不良反应的类型和程度以及有关防治措施等,都需要进一步密切观察和积累证据,以完善用药细节和注意事项,我们据此对本共识进行了更新和补充,后续也将持续更新。
专家共识修订委员会成员名单
顾问:刘允怡(香港中文大学医学院);郑树森(浙江大学附属第一医院);王学浩(南京医科大学第一附属医院);陈孝平(华中科技大学同济医学院附属同济医院);樊嘉(复旦大学附属中山医院);董家鸿(清华大学附属北京清华长庚医院)
主任委员:程树群(海军军医大学第三附属医院)
副主任委员(按姓氏汉语拼音为序):陈敏山(中山大学肿瘤防治中心);蔡建强(中国医学科学院肿瘤医院);戴朝六(中国医科大学附属盛京医院);文天夫(四川大学华西医院肝胆外科);夏景林(温州医科大学第一附属医院);应敏刚(厦门弘爱医院);张志伟(华中科技大学附属同济医院肝胆外科);张学文(吉林大学第二医院);方驰华(南方医科大学珠江医院肝胆外科);纪智礼(首都医科大学附属北京安贞医院)
执笔者:孙居仙(海军军医大学第三附属医院);李秋(四川大学华西医院)
委员(按姓氏汉语拼音为序):白雪莉(浙江大学附属第一医院);陈亚进(中山大学孙逸仙纪念医院);程张军(东南大学附属中大医院肝胆外科);方驰华(南方医科大学珠江医院肝胆外科);冯爽(海军军医大学第三附属医院);郭卫星(海军军医大学第三附属医院);胡逸人(温州市第三人民医院肝胆外科);黄彬(海军军医大学第三附属医院);黄杨卿(上海市公共卫生临床中心);贾宁阳(海军军医大学第三附属医院);荚卫东(安徽省立医院肝胆外科);李相成(江苏省人民医院肝胆外科);梁超(上海中医药大学附属岳阳医院);孟岩(海军军医大学第三附属医院);石洁(海军军医大学第三附属医院);唐裕福(北部战区总医院);滕皋军(东南大学附属中大医院);王康(海军军医大学第三附属医院);魏文京(太原市人民医院);吴威(沈阳市第六人民医院);严茂林(福建省立医院);袁振刚(海军军医大学第三附属医院);翟健(海军军医大学第三附属医院);张宇(四川省人民医院);曾昭冲(复旦大学附属中山医院)
所有共识制定者均声明不存在利益冲突




























