
熵,这一原本热力学概念被引入功能磁共振成像(fMRI)中,用于度量时间尺度上的规律性和不可预测性。时域功能熵和功能连接之间存在负的时空线性相关,被认为是大脑处理信息能力的重要指标,能提供区域灌注、低频波动幅度所不能提供的信息。作为大脑功能信号的一项基本特征,fMRI的时域功能熵已用于揭示意识、衰老等生理和病理状态(如阿尔茨海默病、精神分裂症、重度抑郁症、自闭症谱系障碍、成瘾和多发性硬化等疾病),为认识脑疾病提供了新的利器。本篇文章从fMRI时域功能熵及其分析技术的优势及局限性、生理基础及意义、临床应用和未来方向几个方面进行描述,以期能为相关专业领域的同道们进一步了解功能熵提供帮助。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分
大脑,是自然界最为复杂的器官之一。其正常运作涉及复杂的信息处理与交互,这一过程依赖于众多神经元或脑区之间的动态耦合。而这些耦合充满了高度非线性、复杂与非平稳、长时与瞬态共存的不确定性状态。多种成像技术试图表征这一状态。熵(entropy),原本是热力学概念,用于描述热力学系统中紊乱程度或不确定性的度量。引入神经影像后,比如脑电图、脑磁图和功能磁共振成像(functional MRI,fMRI),熵被用于量化时间序列波动的规律性和不可预测性。熵[1]和线性统计中的时间变异性[2]、活动幅度[3]和脑区间一致性(功能连接[4])一同被认为是fMRI血氧水平依赖信号基本属性的4个方面,并以其较高的时间和空间分辨率优势,用于揭示意识、衰老等生理和病理状态(阿尔茨海默病、精神分裂症、重度抑郁症、自闭症谱系障碍、成瘾和多发性硬化等)。
1990年Seiji Ogawa首次定义血氧水平依赖(blood oxygenation level dependent,BOLD)信号,并为Ken Kwong证实可用于神经活动的间接测量以来,fMRI的信号起源和准确解释就一直存有争议。事实上,fMRI并不能直接测量神经元的电活动,而是通过神经活动后血流动力学后果(脑血流量和耗氧量变化)间接反应。当前,BOLD信号被认为是血管动力学驱动的非神经元波动信息叠加神经元的血流动力学波动共同产生[5],或者说,BOLD信号是快速的神经元活动信号和慢血流动力学函数卷积的结果。
fMRI的采集是通过一个快速的平面回波序列进行,以一定的间隔时间(通常为2或3 s)对全脑进行信号采集。对于某一个体素或采集点而言,采集到的信号(脱氧血红蛋白产生的T2*缩短效应所致)会随着时间波动,称为时间序列。fMRI信号的复杂度通常是通过量化分析时间序列所检测到的信号规律性(有序性)来评估生理活动的动态变化。
1. 香农熵:熵的概念最早起源于物理学,用于度量热力学系统的无序程度。在信息论中,经典的香农信息熵主要是通过估算概率密度函数进行。可以理解为不确定性的量度,越随机的信息源的熵越大。在长度有限(通常180~240个时间点,6~8 min)的fMRI时间序列中,香农熵的应用存在明显的局限性,无法对fMRI的复杂性以合理的精度进行估计。
2. 近似熵(approximate entropy,ApEn)采用升维变换策略,计算高维向量间的相似度用于推导一维的时间序列的规律性和(或)不可预测性。其简要技术原理是:在长度为个(通常为180~240个)时间点的fMRI时间序列中,提取长度为(或)的数据构建向量(),通过计算向量(和)之间最大差值,获得小于值(时间序列标准差的10.0%~20.0%[6])的向量个数比:,然后再定义,最后获得。
用于fMRI的ApEn 的优势主要有两个:其一是对数据长度的依赖性较小;其二是抗噪声能力较强。一些改良技术,如交叉ApEn(cross-ApEn)、模糊ApEn(fuzzy entropy,FuzzyEn)等一定程度上改善了ApEn 的自匹配偏差性、结果一致性差等不足。
3. 样本熵(sample entropy,SampEn):是ApEn的一种改进,它不包括时间序列的自匹配,而是与下一时间点保持相似的两个时间序列条件概率的负自然对数[6]。SampEn的优势在于具有数据长度独立性、较好的辨识力和较好的重测信度。随机噪声在SampEn中也表现为高熵值和高度规则的fMRI信号(低复杂度)无法区分。如果将SampEn扩展到多个时间尺度(τ),可区分高熵值是由于规则性增加还是随机性增加所致的问题。
4. 多尺度熵(multiscale entropy,MSE)主要采取非重叠式(每次跳跃τ个数据做平均)和重叠式(每次跳跃1-τ个数据做平均)两种方式进行粗粒化(coarse graining),即对不同数量的连续点取平均值。尺度因子(τ)越大,时间分辨率越粗略[7]。在粗粒化的高尺度因子中,信号的局部一致性可进一步提高而突显出复杂性减低,因此可以观察到更多这种受影响的差异脑区[8]。而MSE也存在诸多不足,如通过不断调节尺度因子大小得到的SampEn集合,并没有统一的参数取值标准或规范;且MSE粗粒化后的“匹配”是由整个时间序列的 倍标准差的阈值定义,实际上标准偏差会随子采样尺度变化[9],影响结果。(SampEn和MSE的数据分析方法和工具分别可以在https://www.cfn.upenn.edu/zewang/BENtbx.php和http://loft-lab.org/index-5.html下载使用)。
在fMRI中,上述熵的计算主要考察的是时间尺度上的复杂程度。此类基于时间尺度的熵计算方法还有排列熵和模糊熵。如果将时间序列进行傅里叶变换,fMRI信号将呈现一定的频率特性。而基于频率尺度的熵计算方法如瑞利熵、谱熵和Tsallis熵,以及赫斯特指数、Lempel-Ziv复杂性、关联维数和分形维数等分析技术,近年也取得了一定进展。
在fMRI时域熵中,虽然也存在灰、白质空间分布不同,但大部分灰质区的时域功能熵与区域灌注、低频波动幅度之间并无相关[10],而是和跨网络的功能连接之间存在显著相关[11]。即区域神经活动越复杂,该区域与其他大脑区域的功能连接越高。Wang等[12]通过研究发现熵与功能连接的相关性依赖于时间尺度。熵和功能连接的这种相关性(负时空线性相关)也得到动物模型研究的证实[13]。在时间尺度上理解神经元间的动态对于解析信息是如何在脑区间传递至关重要[14]。
熵的意义,很多时候同它的定义一样不易理解。从物理意义上来看,熵越大意味着系统越混乱,越不可靠,最终可能趋向于热力学描述的热寂死;另一方面熵越大意味着信息量越大,意味着相应的复杂性和灵活性比较大,在有些时候反而是有益的。对于大脑而言,神经信号的可变性是健康大脑功能的重要指标。信号复杂性也是如此,它与信息处理能力有关。更高的熵可以被解释为具有更高的信息处理能力[13]。但大脑的fMRI功能熵会维持在一个正常范围,过高可能会导致脑功能紊乱,出现注意力不集中等症状;过低可能会导致功能锁相,让系统僵化,只能完成一些机械系的动作。咖啡因的研究证实这一观点:虽然咖啡因降低了整个大脑的脑血流,但增加了整个大脑皮层的SampEn,其中前额叶皮层、默认网络、视觉皮层和运动网络的增幅最大。这和咖啡因有利于提高机体的警惕和注意力是一致的[15]。此外,过量食用咖啡因容易导致失神、注意力不集中也证实了熵的生理意义。
此外,静息状态的fMRI时域功能熵具有较好的预测行为能力。在低静息SampEn的脑区,往往存在更强的任务激活和(或)去激活[16]。工作负荷越大,静息时熵的水平与任务激活之间的负相关越明显[16]。例如,在默认网络和执行控制网络内熵值较低的区域,熵的水平与高认知表现明显相关。因此,fMRI时域功能熵也可以作为潜在功能储备的替代指标[1]。
意识的本质是大脑中神经电化学信号的产物,是由特定的前脑回路机制调节的广泛额顶叶网络连接的集体行为的突现属性,和分布式大脑区间的信息共享有关。传统fMRI分析技术主要关注于特定脑区或神经元组在意识中的贡献[17]。但这些方法并未注意到信息的调制并不一定涉及大脑区域性的能力和(或)活动的变化。而熵的测量原则上是为量化信息,可以反映大脑信号的复杂性,而复杂性正是意识体验的一种基本属性[18, 19]。
研究表明,丙泊酚诱导麻醉期间大脑表现出fMRI信号复杂性降低[19],类似改变也存在于意识障碍的患者[19]。患者无意识期间默认网络后部(后扣带回/楔前叶)熵值明显减低,推断其主要原因是患者接收外部信息显著减少所致[20];从时间尺度来看,默认网络-额顶网络间呈负相关,默认网络-丘脑之间失连接改变也是动态的,其复杂程度和意识水平有关[19]。当然,也有研究认为意识状态的变化主要取决于岛叶、扣带回和顶叶皮质[20]。当患者处于丙泊酚轻度镇静向深度镇静过渡阶段,初级感觉系统的熵明显降低,但默认网络或其他高级认知系统并没有发现熵的下降[21]。而患者从深度镇静中恢复正常反应性后,感觉系统中的熵值得到恢复,而高级认知系统也并未得到同步的恢复[22]。这些发现支持、信息多样性下降和整合能力丧失可导致大脑失去意识[19,21, 22]。也可以说,复杂性是大脑支持各种意识状态的基本属性,同时人类大脑活动的复杂性也受到意识状态的调节。基于目前所获得的知识,静息状态fMRI信号局部变异性和相关的绝对功率是唯一能有效区分觉醒状态的信息度量[23]。
人脑的不同功能系统不仅在结构、功能连接和网络效率上存在一定的规律性,反映大脑信息处理能力的功能活动复杂性指标——排列熵也存在不同的衰老轨迹。例如,视觉、听觉和躯体感觉等皮层活动复杂性表现为早峰值(<35岁)年龄型,而后呈现下降趋势,这与生理性衰老过程感觉系统功能逐渐丧失有关。研究观察发现,与年轻组相比,静息状态下老年受试者在嗅觉皮层、枕上回和丘脑也表现出显著的MSE降低。感觉障碍会限制最佳认知表现所需的神经资源,降低自下而上的感官知觉信息加工速度,从而阻止系统通过后验概率更新。复杂性减低可能反映了突触修剪的过程,这一过程可直接影响大脑的结构和功能[24]。在衰老的过程中,相互抑制的脑网络或系统之间的负相关关系会逐渐减低,而功能熵的减低与这种负相关减弱有关。如老年人默认网络的后扣带回和海马成分也比年轻人具有更低的复杂性,这能够解释老年人短时程记忆能力下降这一现象。整体而言,大脑功能熵呈倒U形轨迹,在40岁左右达到峰值后,呈现出下降趋势[25, 26]。从毕生发展的角度来看,衰老存在4种轨迹模式:线性增加的功能网络(感觉运动网络),早峰值年龄网络(峰值<35岁),中峰值年龄网络(峰值35~44岁,包括默认网络、腹侧注意网络和突显网络)和晚峰值年龄网络(峰值>44岁,背侧注意网络和额顶网络)[26]。
当然,也有证据表明,在衰老的过程中,可存在fMRI信号局部复杂性增高的现象[1],这种复杂性增加通常涉及“认知”脑区,而不是“情绪”反应区,且和认知功能(如注意力等)呈正相关,这为自适应训练改善老年人神经活动复杂性提供了依据[27]。这些表明,在衰老过程中,功能性大脑网络变化的轨迹可能具有复杂性和时空依赖性[28, 29]。
与fMRI其他指标类似,时域功能熵已用于多种疾病状态的研究[29, 30],以熵减和熵增为主的发现为解析患者的病理生理机制提供了独特视角。
1. 阿尔茨海默病、注意缺陷多动障碍(attention-deficit/hyperactivity disorder,ADHD)等脑疾病存在SampEn减低或功能复杂性降低:根据复杂性丧失理论,在多种疾病中都可存在血氧信号复杂性降低。例如,阿尔茨海默病是一种常见的慢性神经退行性疾病,认知和记忆能力下降是其主要特征。在海马等记忆、认知等β-淀粉样蛋白沉积的脑区,发现阿尔茨海默病患者局部fMRI信号复杂性降低[31, 32],其中默认网络和执行控制网络的SampEn下降更为显著,而这些区域同样存在功能连接的降低。当然,也有研究发现阿尔茨海默病患者颞中回和中央前回的熵呈现增加改变[33]。但就总体而言,从正常衰老、轻度认知障碍再进展到阿尔茨海默病,SampEn变化遵循倒U字曲线[34]。在大脑网络中,神经细胞参与复杂的动态处理,如果神经元细胞死亡会导致局部神经网络失连接。因此,神经元死亡和神经递质缺乏是导致阿尔茨海默病患者fMRI信号复杂性下降的主要原因[9]。此外,研究还发现,局部熵值在短时间尺度上与认知功能呈正相关,而在较长时间尺度上与认知功能呈负相关;随着大脑复杂性的降低,阿尔茨海默病患者的症状负荷显著增加[35]。
ADHD是一种常见的神经发育障碍,其主要特征是与发育水平不相称的注意缺陷和(或)多动冲动,与脑前额叶区域网络未激活或激活程度低有关。功能熵的研究表明,ADHD患者额、枕叶(含视觉区)、双侧中央前、后回及部分默认网络区SampEn降低较为明显[36, 37, 38],并且与症状的严重程度相关[36, 37],表明此类患者局部功能活动或大脑子网络间更为有序,过度有序是不利的[37]。
2. 精神分裂症、重度抑郁症等脑疾病存在SampEn增加或功能复杂性增高:对于精神分裂症,特定脑区分布式网络整合缺陷的“失连接假说”是其重要机制假说之一。青春期开始的不正常突触修剪是该机制假说的内核。熵的研究似乎表明,与衰老趋势相反,精神分裂症患者存在更多熵。尽管“补偿效应”的推论有些过度,但有意义的是,精神分裂症的阳性症状会随着衰老在生理上有所改善[39]。一项动态功能连接的研究支持皮层下超连接的增加,可导致精神分裂患者全脑功能熵的增加[40]。而Sokunbi等[36]研究发现在执行社会排斥任务时,精神分裂患者前额叶皮层腹外侧的fMRI信号SampEn较对照组更高,而不是功能连接的复杂性。使用抗精神病药似乎可以减少这些患者异常的信号紊乱;这种效应可能是由于额叶区域的多巴胺能调节效应,这与精神分裂症断开理论(“失连接假说”)是一致的。Takahashi等[41]通过脑电图发现精神分裂症患者潜在的无组织尖峰活动,为前述的Fmri SampEn增加提供了直接证据。
关于脑熵值与精神疾病之间的关系,目前还没有一致的结论。可以肯定的是,不同精神障碍患者的大脑皮层如左侧额中下回和右侧梭状回、楔叶、楔前叶的熵普遍增加;而皮层下区域和小脑没有发现共同的改变[42]。这表明,大脑皮层(而非皮层下区域和小脑)熵的增加可能与精神疾病的病理生理密切有关[42]。
在成瘾的研究中,如慢性吸烟者(尼古丁成瘾)全脑SampEn整体增高,其原因可能与尼古丁长期精神刺激有关,类似于服用迷幻药物后观察到的熵的增加[43]。高频重复经颅磁刺激的戒烟治疗可以改善这一现象,用于监测或量化治疗效果[43]。
多数研究表明,重度抑郁患者眶额皮层内侧/扣带皮层膝下部、情感加工(壳核和丘脑)、感觉和运动等存在SampEn增高,这种增高在治疗后可大幅度降低,并且与病情状况改善有关[44]。
fMRI时域功能熵可以较为敏感地捕捉不同疾病状态的动态特征,用于脑疾病诊断和评估。如优化的MSE可以准确识别认知敏感的大脑功能,达到区分良好认知的老年患者的目的,使用机器学习的方法可以获得80.05%准确性[45]。
难治性癫痫的首选是手术治疗,定致痫侧、致痫灶和癫痫传播路径是术前重要准备,这其中定侧是基础。与致痫灶、致痫侧的金标准——脑电图比较,常规MRI的检出率低至33%。其原因是海马区神经元需丢失达50%才会出现形态学改变。这类患者静息态fMRI的信号复杂性远高于健康人,fMRI时域功能熵结合机器学习的方法其定测准确度高达90%~95%[46, 47],远高于功能连接的定侧率(83%)和常规MRI[48]。
此外,采用机器学习的fMRI时域功能熵在自闭症谱系疾病、青少年强迫症、精神分裂等疾病的诊断和评估中均取得不俗的效果[49, 50, 51]。
自从ApEn被引入fMRI以来,时域功能熵取得了长足进展,在熵的计算方法、复杂性度量参数、生理基础和意义、揭示生理和病理状态和机制以及作为成像标志物上进行大量的、富有创造性探索,研究成果呈现蓬勃的状态(图1),能够提供众多静息态fMRI指标不可提供的重要信息,其应用前景乐观。
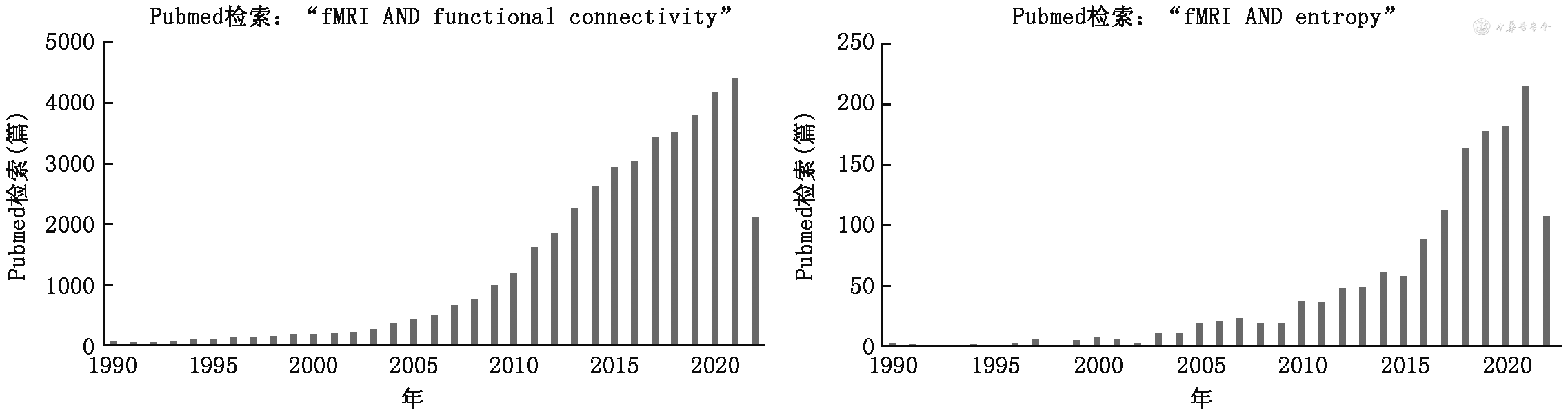

注:fMRI为功能磁共振成像
在未来,fMRI时域功能熵需要朝以下方向进行努力。首先,精确可靠的、简单实用的分析方法对于fMRI时域功能熵的推广应用非常重要。对于时域功能熵的分析技术,目前主要在改善和改进其计算参数,并未考虑到fMRI数据作为一个三维多体素的事实,相邻体素间的影响并未得到充分考虑,不同脑区间的相互影响或全局属性也未得到重视。此外,熵可以提供其他静息态fMRI几乎没有重叠的信息[11]。因此,在分析fMRI和临床变量之间错综复杂的关系时,作为变量考虑或许能够改善两者的关系。
其次,准确的特征分类方法是将fMRI时域功能熵进一步推向临床的关键环节。到目前为止,只有少数研究通过机器学习的方法对患者进行了预测和分类研究。这表明机器学习技术对复杂模式进行分类是未来的发展趋势。由于人脑是一个高度复杂的系统,没有单一的度量标准可以提供大脑的全面信息。在未来的研究中,可以结合大脑复杂度、局部一致性和分数低频振幅等各种指标来生成多维特征,采用深度学习等人工智能分析技术用于疾病的诊断和预后。
最后,未来的研究可建立在动态功能连接分析、足够长的时间点和高时间分辨率的基础上,研究fMRI信号复杂性的动态。
作为大脑功能活动的一项基本特征,时域功能熵能够度量fMRI时间序列的复杂性,用于表征神经元活动的不确定性。fMRI时域功能熵存在其生理基础并且能够体现大脑的生理和病理状态,具有成为理想生物标志物的潜质。
常见的fMRI时域功能熵分析方法各有优缺点,就目前掌握的信息和研究进展来看,SampEn或许是fMRI时间序列复杂性分析的最优选择。MSE可以进一步区分fMRI信号复杂性下降是朝向规则还是随机。在未来,通过利用诸如综合信息理论等熵框架进一步推进对意识状态、衰老、疾病及其与大脑功能复杂性关系的研究,而深度学习等人工智能分析技术将扩展其在脑疾病的诊断与鉴别中的应用场景。
所有作者均声明不存在利益冲突
1.熵(entropy),最先用于描述()系统中紊乱程度或不确定性的度量。
A.热力学;
B.天文学;
C.化学;
D.脑科学
2.下列哪项不属于fMRI时域功能熵分析技术?()
A.近似熵;
B.样本熵;
C.多尺度熵;
D.瑞利熵
3.大部分灰质区的fMRI时域功能熵与下列哪项参数有关()
A.灌注;
B.低频波动幅度;
C.跨网络的功能连接;
D.脑血流
4.下列哪项不是样本熵的优势()
A.具有数据长度独立性;
B.时间序列的自匹配;
C.较好的辨识力;
D.较好的重测信度
5.下列那种脑疾病存在样本熵减低或功能复杂性降低?()
A.阿尔茨海默病;
B.精神分裂症;
C.成瘾;
D.重度抑郁症



























