
作为一种非有创、无辐射的床旁成像手段,目前电阻抗断层成像技术(EIT)可对患者进行实时的肺通气评估和肺血流监测,从而实现床旁通气血流比的可视化,有效指导低氧血症的病理生理机制研判,同时也为肺血流生理学的研究提供新方法。在新型冠状病毒肺炎的研究及治疗中EIT也发挥了其独特、不可替代的作用。同时作为功能性成像,该技术的操作细节和图像重建算法仍需要更多的研究去进一步优化,在临床应用中提供更稳健的评估。本文从EIT肺血流监测的方法介绍、操作实施与监测指标、应用及相关研究进展三个方面进行了阐述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺脏有效的气体交换,离不开匹配的通气血流分布。监测患者通气血流分布,对诊疗危重症患者顽固性低氧血症,进一步指导、优化呼吸治疗,提高医疗质量等有重要意义。肺血流一直是临床较难捕捉的指标,即使可以测量,也难以成为反馈指导具体治疗的监测指标。已有的MRI、CT、PET-CT和单光子发射CT(single-photon emission computed tomography,SPECT)等,不能及时、多次地进行床旁的监测,并不适用于危重症患者。
电阻抗断层成像(electrical impedance tomography,EIT)是通过在生物体表面放置一圈电极,施加微弱的安全电流,利用不同生物组织的电阻抗值不同,测量其边界电压,通过系列算法后图像重构得到生物体内电阻抗分布及变化的图像[1]。作为一种非有创、无辐射的床旁成像手段,目前EIT技术可对患者进行实时的肺通气评估和肺血流监测,从而实现床旁通气血流比的可视化,有效指导低氧血症的病理生理机制研判,且对于肺血流生理学的研究也提供新方法。在新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的研究及治疗中EIT也发挥了其独特、不可替代的作用[2]。本文就目前EIT技术在床旁肺血流监测的相关研究进展进行阐述。
同一位置测得的电阻抗会随着通气和血流的变化而变化。人体中吸气末到呼气末肺容量的变化会导致胸部区域阻抗值增加300%左右[3],而心脏的舒张收缩引起的胸腔阻抗变化范围仅3% [4],因此肺电阻抗的变化主要与潮气量有关。当EIT评估肺灌注时,需要降低肺通气对阻抗变化的影响[5, 6],目前通过EIT评估肺灌注分布的方法主要有两种:一种方法是基于心脏搏动相关信号;另一种是通过注射高渗盐水造影法。
通过心电触发数据采集[7]、频域滤波[8]、短暂呼吸暂停[9]或主成分分析[10]等方法,从EIT信号中排除呼吸相关的信号,从而获取心脏搏动相关的信号来评估肺灌注情况[11]。此方法是对心脏搏动引起的肺血容量变化的监测而不是真正的流动的肺血流情况。由于血液具有比组织更高的导电率,电阻抗较低,因此当血液进入或离开某区域时,可以观察到阻抗的降低或增加。在心脏区域,心脏收缩期观察到阻抗增加,舒张期阻抗降低;而在肺部区域,会观察到相反且延迟的阻抗变化,在心脏收缩期,肺部阻抗值降低,而在心脏舒张期间肺部阻抗值增加[7]。这种方法具有无创和可连续监测的优点,但是得到的结果往往不够准确。许多潜在因素会影响心脏搏动信号与肺灌注的相关性,例如血管张力的变化、气体含量的同步变化、气道压力和肺小血管的扩张等[9,11, 12, 13, 14]。有试验通过SPECT和EIT肺血管搏动法对肺不张及使用血管扩张药物后的肺血流分布进行评估,两者结果表现出明显的差异,甚至相反的变化,在肺不张的左肺,SPECT监测的肺血流分布只有19%,而EIT肺血管搏动法得出的肺血流分布却是74%[14]。
该方法是注射高渗盐水放大血液流动导致的阻抗变化,通过算法分析EIT监测到的阻抗变化做出肺血流分布的成像。在屏气阶段,通过中心静脉导管注射高渗盐水,由于血液中氯化钠浓度升高,胸部总阻抗首先会下降;之后经过一段时间,高渗盐水随血液通过心肺循环,胸部总阻抗会回升。在阻抗下降的这段时间内,灌注较差的区域血流量会比灌注正常的区域的血流量少[15, 16],而这个差别会体现在EIT 图像中像素点的像素值下降斜率上,通过不同像素点的相对阻抗值的下降斜率,能够在一定程度上反映胸腔内血流量灌注分布情况。通过γ变化模型从EIT数据中分析出区域肺灌注[17]。目前,已有动物研究通过注射高渗盐水造影来使用EIT 对小猪进行肺血流灌注评估,并通过SPECT 或PET对结果进行了验证[14,17, 18],EIT与其得到的区域灌注成像明显相关。但高渗盐水造影法需放置中心静脉导管、短暂的呼吸暂停以及高渗盐水的渗透压改变有可能带来溶血。有研究发现使用3%的较低浓度的高渗盐水得出的EIT肺血流成像与PET成像仍有较好的相关性与一致性[17, 18],目前已有越来越多的学者应用EIT注射高渗盐水监测肺血流用于临床研究。
最近,Kircher等[19]提出了EIT肺灌注重建图像的优化算法,在8只猪肺损伤模型中研究发现在吸入空气和纯氧两种状态下,EIT与多探测器计算机断层扫描(multi-detector computed tomography,MDCT)监测的肺灌注有较高的一致性和相关性,初步证实了该算法在不同病理条件下追踪肺部区域灌注变化的能力及稳健性。虽然肺通气和肺血流监测,EIT和SPECT或PET的成像具有足够的相关性,但在通气、血流分布两者图像的重叠匹配分析上并不那么准确,进而影响着局部通气血流匹配区域的像素计算的精确性。这可能与EIT重建图像(三维立体变成二维平面)以及算法中γ模型假设错误等相关[20],因此关于EIT 通气血流成像算法仍需更多的研究[21]。
高渗盐水造影肺灌注EIT技术方法操作实施并不复杂,有中心静脉导管和可以保持屏气是两个重要的前提,具体操作流程如下:(1)检查患者是否有中心静脉导管通路;(2)配制5%高渗盐水20 ml(10 ml灭菌用水、1支10 ml 10%氯化钠);(3)绑好EIT缚带,输入住院号及患者姓名(EIT界面“系统设置”-“患者数据”),确保各电极信号正常;(4)机械通气患者,加深镇静,确保(屏气阶段)无自主呼吸出现;自主呼吸患者,可嘱其屏气,若屏气时间过短(<8 s),不建议实施盐水造影步骤;(5)点击“记录”,记录5次以上正常呼吸后,按吸气/呼气末保持键不放,观察到EIT阻抗曲线出现平台后,立即从中心静脉导管快速推注5%高渗盐水10 ml(推药速度要快,2 s内推完);(6)吸气/呼气末保持10 s以上后结束,再点击“记录”,记录结束;(7)稍等几分钟后,用剩余10 ml 5%高渗盐水重复上述“操作4”。
记录的EIT肺血流数据,通过软件分析,可以得到肺通气分布图像、肺血流分布图像以及匹配图像,在这3个图像上分析得出各兴趣区的占比,以及匹配区域、死腔区域和分流区域占比等指标(图1)。
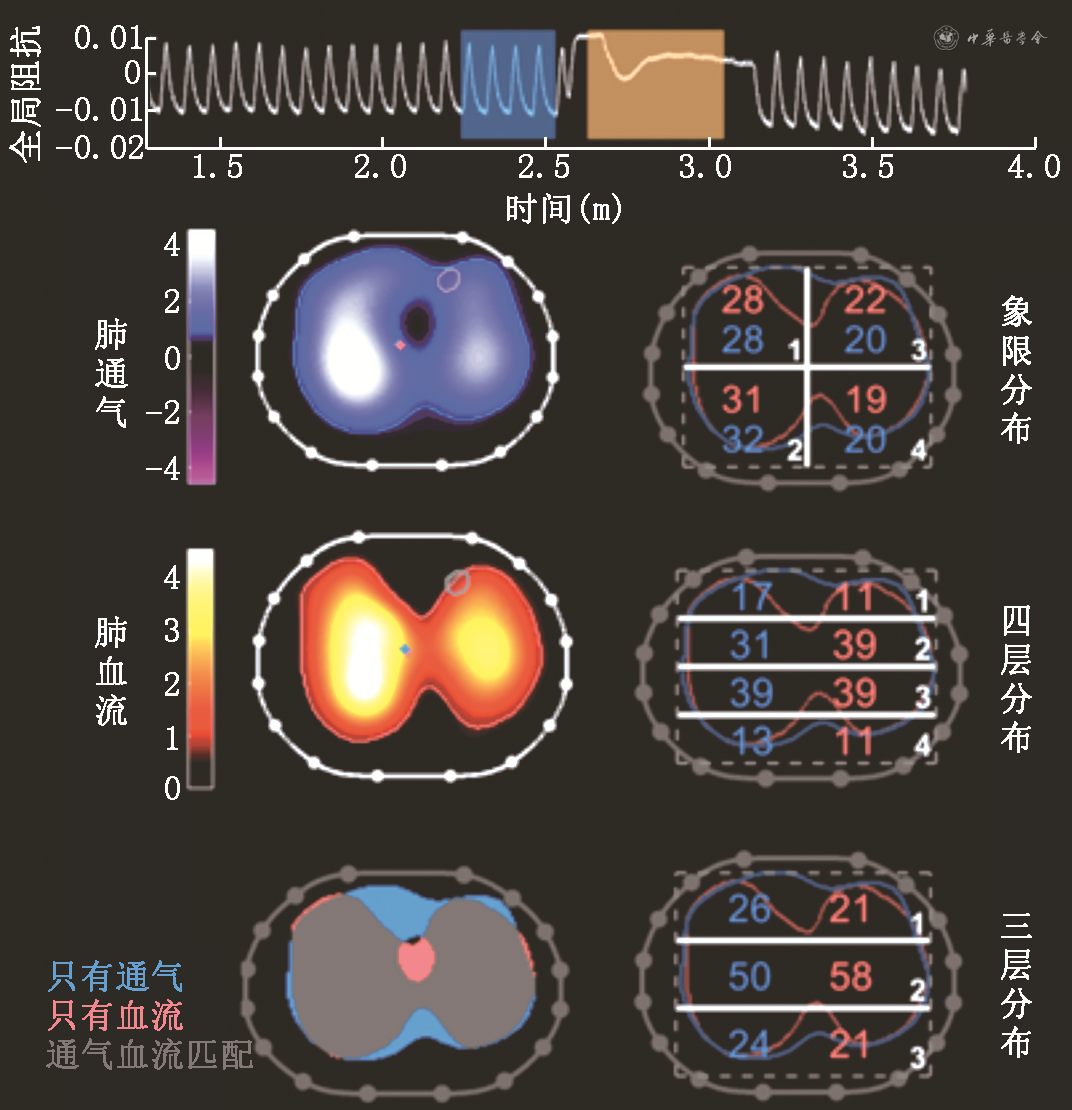

应用高渗盐水进行EIT肺灌注显像是安全可行的,但技术规范及分析标准仍需统一,北京协和医院隆云教授的团队[22]发表了关于使用高渗盐水造影肺灌注EIT的技术规范。对于EIT监测肺血流,屏气操作至关重要,对于屏气时间、吸气末还是呼气末屏气等问题,操作细节的不同使得最后监测出的通气、血流以及匹配情况是否有差异,以及造影盐水的浓度在不同肺部生理中是否应有不同也仍需更多的研究证实[23, 24]。EIT监测血流的数据需要后期的算法分析,对于监测指标,除了EIT分析出的通气、血流分布图像以及匹配情况的指标,肺阻抗-时间的波形曲线也蕴藏了很多的信息,例如曲线下降/回升的面积以及曲线的峰值、基线确定、出现下降到达到峰值的时间,平均传输时间等[25],仍需更多研究来挖掘。
床旁肺血流的监测,除了可视化肺血流的分布,还可量化通气血流的匹配情况,应用方面主要包括识别肺灌注的缺损,监测和评估相关治疗效果以及探究急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)病理生理指导治疗决策,同时也为一些生理学研究提供新的方法。
近年来通过EIT肺血流图像发现血流缺损,识别肺血栓的动物实验和病例报道并不少[26, 27, 28, 29, 30],同时有临床研究[28]发现当EIT通气血流分布图像计算得出死腔通气分数(%)>30.37%,可有效指导诊断急性肺栓塞,其特异度和灵敏度明显高于D-二聚体。除了识别肺灌注的缺损,还可用于评估肺血流变化情况,Safaee Fakhr[31]等报道了1例已诊断肺栓塞的新冠患者,接受抗凝治疗后,肺灌注明显改善。肺动脉高压影响着肺血流的灌注,Smit[32]等对21例肺动脉高压患者及30名健康对照者进行了EIT监测,发现肺动脉高压患者具有更低的肺灌注阻抗变化信号,此次研究也提示EIT有望成为肺动脉高压患者新的无创辅助诊断手段。Zarantonello[33]等报道了1例通过EIT识别肺移植术后的肺动脉狭窄的有趣病例,提出相较于床旁食道超声来评估肺血管直径和压力,EIT床旁肺血流监测更无创和简单,但未来仍需更多研究来探索EIT和食道超声在识别肺血管狭窄方面的相关性如何。Tingay等[34]报道了1例出生13 d的新生儿,EIT监测显示左肺通气及血流完全缺损,而右肺正常,这与该新生儿出生后出现左肺血管大面积栓塞、肺坏死情况相符,EIT未来在新生儿肺血流监测的应用价值也不容小视。
1. 呼气末正压(positive end expiratory pressure,PEEP)水平对通气血流比的影响:在ARDS患者的机械通气中,较高的PEEP可能会复张部分重力依赖区塌陷的肺泡,但同时也会使非重力依赖区原本开放的肺泡出现过度膨胀,通气血流比也因此受影响。He等[35]通过EIT监测了30例ARDS或ARDS高风险的患者,研究发现肺复张性较好的患者中,适当的高PEEP会使肺通气分布更均匀,并且改善通气血流比;在低复张性的患者中,使用更高的PEEP则会出现过度膨胀,使得区域肺通气减少,出现更多的分流。滴定PEEP的方法有很多,传统的氧合法、各种力学法、还有影像法等,目前尚未证实哪一种最佳。但EIT无疑在PEEP滴定的过程中,帮助我们可视化监测到肺通气变化,同时肺血流的监测,更直观、方便地监测到通气血流的匹配,有助于指导ARDS患者的机械通气个体化设置。
2. 俯卧位对通气血流比的影响:俯卧位可复张重力依赖区塌陷的肺泡并改善气体分布,以及痰液引流作用,但对血流分布重力影响较小,血流分布仍以背侧为主,因此俯卧位可减少分流,改善通气血流比。临床上我们更多以指脉氧饱和度和血气结果来间接评估通气血流比的改善。EIT可以帮助可视化监测通气血流比的变化,Zarantonello等[36]报道了1例新冠患者俯卧位1 h后,背侧通气明显增加,背侧血流有所减小,部分血流从背侧转移到了腹侧;但局部的通气血流匹配区域(ventilation-perfusion,VQ matched %)相对增加,同时通气、血流的分布较仰卧位都更均质。Perier等[37]通过EIT研究9例机械通气的COVID-19患者俯卧位3 h后的肺通气和血流,发现与传统的ARDS患者俯卧位效果相似,背侧通气增加,而血流变化不明显,背侧为优势血流分布区,使得VQ matched % 增加。近期有学者[38]在传统的ARDS患者俯卧位前、俯卧位早期(3 h)、俯卧位结束前,通过EIT监测发现俯卧位早期肺通气分布开始变化,而肺血流变化不明显,随着俯卧位时间的延长,背侧肺血流增加,进一步改善了背侧的通气血流比。俯卧位不仅改善氧合,且其特殊的肺保护性通气也会进一步减少肺损伤,降低ARDS的病死率。EIT监测通气和血流的分布及变化,可视化俯卧位的效果,有助于辨别不同患者对于俯卧位的反应差异,个体化指导俯卧位的时间,以及验证俯卧位及重回仰卧位潜在的生理变化。
3. 吸入一氧化氮(NO)对通气血流比的影响:个案报道1例顽固性低氧的患者通过EIT监测肺血流发现背侧区域有分流,尝试俯卧位失败,考虑吸入NO治疗。吸入的NO优先分布在通气良好的腹侧区域,进而舒张腹侧区域的肺血管,肺血流从背侧转移到腹侧,减少了背侧分流,进而改善氧合。吸入NO治疗1.5 h后,通过EIT重新监测肺血流,发现背侧血流分布减少了23 %,分流分数从之前14%减少到9%,通气血流匹配区域增加[39],可视化证实了吸入NO对肺血流的影响。
1. COVID-19患者中的通气血流比的监测:Mauri等[40]对7例COVID-19患者进行了EIT肺血流监测,发现区域通气血流不匹配分数(死腔通气分数与分流分数之和)升高至34%(32%~45%),存在严重的V/Q比失调,其中死腔分数是分流分数的两倍之多(1.6~3.9)。研究人员得出结论,死腔分数的升高可能是COVID-19 ARDS的特定病理生理特征,因此由于肺灌注缺损导致的通气血流比失调,即使在没有背部肺塌陷区域的COVID-19 ARDS患者中,也会观察到明显的低氧血症。该团队的学者还发现COVID-19患者俯卧30 min后,通气分布的变化使得腹侧的死腔区域减少[41]。对于通气正常,血流分布缺损的机械通气患者,增大呼吸支持力度或PEEP水平并不能有效改善通气血流比,反而可能会增加呼吸机相关性肺损伤的风险。有效的肺通气、血流监测可以帮助我们进行更安全的肺保护性通气,指导治疗措施。
2. 探究ARDS的分型及预后:He等[42]纳入93例ARDS患者和15例非ARDS患者,验证了EIT可以识别ARDS的3种病理生理表现(肺血栓形成、弥漫性肺病变、局灶性肺病变),EIT监测发现肺血栓形成的ARDS亚组有更高的死腔分数和更多的肺血流缺损;弥漫性肺病变的ARDS亚组则有更少的通气血流不匹配;而局灶性肺病变的ARDS亚组有更多的肺通气缺损。关于3种病理生理表现的EIT监测指标阈值仍需要更多大样本的临床研究去验证。Elena等[43]进行了一项50例ARDS患者的前瞻性观察性研究,结果发现EIT监测的区域通气血流不匹配分数是预测死亡的独立风险因素。将EIT监测纳入ARDS患者的常规管理,有助于更好地了解ARDS的病理生理变化以及个性化指导治疗。
EIT是一种功能学评估手段,其结果受绑带位置、胸廓、心脏、膈肌等结构的影响;另外,使用单环外部电极,仅允许1次监测1个圆柱形肺部截面,暂不能提供像CT和MRI这样的整体肺图像。并且三维成像方法目前尚不成熟,仍需结合临床其他监测方法实现对肺脏的全面评估;以及肺血流监测相关的操作方法和重建算法也都需要进一步优化,以提供临床应用中的稳健评估。EIT作为一个新型的床旁监测肺通气、肺血流的成像技术,像给了重症医生一双可视化的眼睛,监测患者通气、血流的动态分布,可以更好地了解患者病理生理变化,对于指导评估治疗有很大帮助,但这也无疑对重症医生对于肺部的病理生理变化的认识提出了更高的要求。
肺血流的评估和干预在ARDS治疗中起至关重要的作用,EIT的优势在于利用生物阻抗所携带的丰富的病理生理信息,实现无创的功能性成像。医疗技术的发展速度超乎我们的想象,相信先进的EIT技术会在未来带给我们更多的惊喜和帮助,进一步提高我们对危重症患者的精细化、个体化救治。
所有作者均声明不存在利益冲突



























