
构建慢性阻塞性肺疾病(COPD)合并肺动脉高压(PH)诊断预测模型并评估其效果。
回顾性收集2014年1月1日至2019年12月31日于5家医院就诊的1 514例COPD患者,根据纳入时间排序,将患者按7∶3的比例分为训练集(1 072例)和验证集(442例)。通过患者病历和电子病历系统收集相关资料,包括人口学资料、吸烟情况、疾病既往史和临床检查资料。采用多因素logistic回归模型分析COPD合并PH的相关因素,采用“rms”程序包构建列线图模型。采用Calibration校准曲线评估模型预测概率与实际结果的一致性,采用C 指数、受试者工作特征(ROC)曲线下面积(AUC)评价模型的区分度,采用决策分析曲线(DCA)评估模型的临床实用性。
训练集年龄为50~59、60~69和≥70岁者分别占3.7%、15.2%和81.1%,与验证集的年龄构成(分别占7.9%、27.8%和64.3%)差异有统计学意义(P=0.041)。训练集男性占79.4%,与验证集(84.6%)差异无统计学意义(P=0.243)。对训练集的多因素logistic回归模型分析显示:年龄≥70岁[OR(95%CI):3.32(1.49~7.36)]、吸烟状态[曾经、目前吸烟OR(95%CI)分别为3.67(2.51~5.37)和2.04(1.44~2.90)]、N末端B型利钠肽前体(NT-proBNP)≥1 400 ng/L[OR(95%CI):9.88(6.23~15.66)]、右心房直径[OR(95%CI):1.11(1.07~1.15)]是COPD合并PH的相关因素,基于以上因素建立COPD合并PH列线图模型并开发为在线工具(https://ph-666.shinyapps.io/zhonghua-PH/)。训练集和验证集的偏差校正后C指数(95%CI)分别为0.82(0.77~0.87)和0.77(0.68~0.86),Calibration校准曲线在训练集与验证集中均接近于对角线。训练集和验证集列线图模型AUC(95%CI)分别为0.82(0.80~0.85)和0.77(0.73~0.82)。通过ROC曲线得出训练集中最佳阈值为0.60,该值下的灵敏度、特异度分别为0.74、0.78;验证集最佳阈值为0.70,该值下的灵敏度和特异度分别为0.76和0.65。DCA分析显示:列线图模型分别在训练集和验证集中以阈概率>15.0%和>13.0%提供了优于变量全选和变量均不选策略的净效益。
建立COPD合并PH诊断预测列线图模型简便、准确,具有良好的临床应用前景。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
截至2020年,慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)已成为全球第3大死亡原因[1]。2018年中国40岁及以上人群COPD患病率为13.7%,患者达9 900万例[2]。肺动脉高压(pulmonary hypertension,PH)是COPD常见并发症,发生率为30%~70%,是COPD患者预后不良和死亡的危险因素[3, 4, 5, 6],早期识别和治疗PH对COPD患者病情控制具有重要意义。然而,COPD合并PH血流动力学改变小,症状不明显,隐匿性较强,临床易漏诊[7]。本研究基于5家医院COPD患者临床资料,建立并验证了COPD合并PH预测模型。
源自2014年1月1日至2019年12月31日于国内5家医院就诊的COPD患者。(1)纳入标准:①年龄≥18岁;②第一秒用力呼气容积/用力肺活量(forced expiratory volume in 1 second/forced vital capacity,FEV1/FVC)<70%[8];③至少完成1项肺功能和超声心动图检查。(2)排除标准:①妊娠期女性;②超声心动图资料不全;③患有先天性心脏病、瓣膜性心脏病、心力衰竭或导致毛细血管后PH的其他心血管疾病;④患有其他肺部疾病;⑤确诊特发性PH;⑥具有肾功能不全、血液病或免疫缺陷病史;⑦患有恶性肿瘤。最终将符合条件的1 514例患者纳入研究,分别来自广州医科大学附属第一医院(780例)、广州市第一人民医院(200例)、广州医科大学附属第二医院(50例)、河南省人民医院(100例)和内蒙古医科大学附属医院(384例)。根据纳入时间排序,将患者按7∶3的比例分为训练集(1 072例)和验证集(422例)。本研究通过了广州医科大学附属第一医院医学伦理委员会批准(批号:2021-09);知情同意豁免。
1. 资料收集:通过患者病历和电子病历系统收集相关资料,包括人口学资料(年龄和性别)、吸烟情况、疾病既往史(高血压和糖尿病史)和临床检查资料[动脉血氧饱和度、血清N 末端B 型利钠肽前体(N-terminal pro-B-type natriuretic peptide,NT-proBNP)、第一秒用力呼气容积占预计值百分比(FEV1%pred)、FEV1/FVC、左(右)心房(室)直径、左心室舒张(收缩)末期内径、肺(主)动脉直径和肺动脉收缩压等]。
2. COPD合并PH列线图模型的建立和评价:按照是否合并PH将训练集对象分为单纯COPD组(肺动脉收缩压≤35 mm Hg,1 mmHg=0.133 kPa)和COPD合并PH组(肺动脉收缩压>35 mm Hg)[9, 10]。采用单因素logistic回归模型筛选COPD合并 PH 的相关因素并纳入多因素logistic回归模型。采用R软件“rms”程序包构建预测COPD合并PH的列线图模型,采用“regplot”程序包绘制交互式列线图模型,采用验证集对列线图模型进行外部验证并构建网络软件。采用偏差校正的C 指数、受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)、Calibration校准曲线评估和决策曲线分析(decision curve analysis,DCA)等方法评估列线图模型预测的准确性、区分度、校准度和临床应用价值。
采用SPSS 26.0和R 4.0.2软件进行统计学描述和分析。数值变量均不符合正态分布,以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验;分类变量以例(%)表示,组间比较采用χ2检验。双侧检验,检验水准α=0.05。
训练集年龄为50~59、60~69和≥70岁者分别占3.7%、15.2%和81.1%,与验证集的年龄构成(分别占7.9%、27.8%和64.3%)差异有统计学意义(P=0.041)。训练集男性占79.4%,与验证集(84.6%)差异无统计学意义(P<0.05)。此外,训练集的吸烟年限、NT-proBNP、动脉血氧分压、FEV1/FVC、慢性阻塞性肺疾病全球倡议(Global Initiative Forchronic Obstructive Lung Disease,GOLD)分级、右心房(室)直径、左心房直径、左心室收缩末期内径、肺(主)动脉直径与验证集差异均有统计学意义(均P<0.05),吸烟状态、高血压(糖尿病)病史、左心室舒张末期内径、肺动脉/主动脉直径比值与验证集差异无统计学意义(均P>0.05)。详见表1。
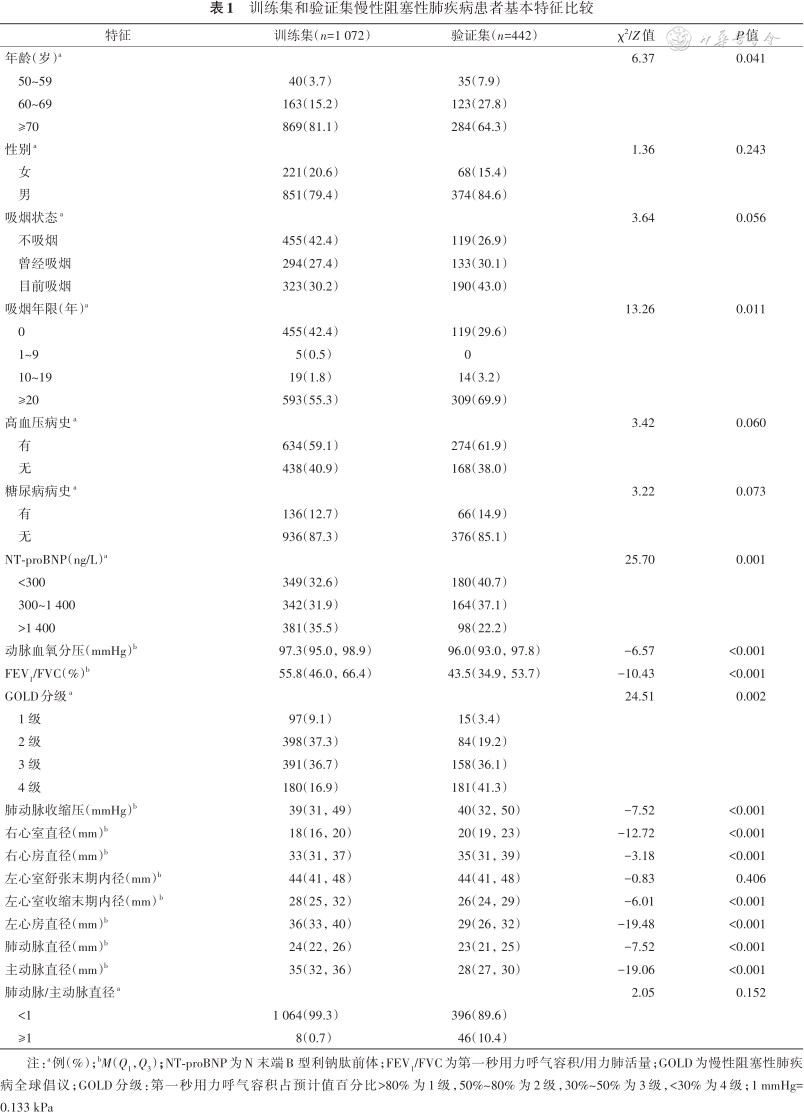
训练集和验证集慢性阻塞性肺疾病患者基本特征比较
训练集和验证集慢性阻塞性肺疾病患者基本特征比较
| 特征 | 训练集(n=1 072) | 验证集(n=442) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 6.37 | 0.041 | ||
| 50~59 | 40(3.7) | 35(7.9) | ||
| 60~69 | 163(15.2) | 123(27.8) | ||
| ≥70 | 869(81.1) | 284(64.3) | ||
| 性别a | 1.36 | 0.243 | ||
| 女 | 221(20.6) | 68(15.4) | ||
| 男 | 851(79.4) | 374(84.6) | ||
| 吸烟状态a | 3.64 | 0.056 | ||
| 不吸烟 | 455(42.4) | 119(26.9) | ||
| 曾经吸烟 | 294(27.4) | 133(30.1) | ||
| 目前吸烟 | 323(30.2) | 190(43.0) | ||
| 吸烟年限(年)a | 13.26 | 0.011 | ||
| 0 | 455(42.4) | 119(29.6) | ||
| 1~9 | 5(0.5) | 0 | ||
| 10~19 | 19(1.8) | 14(3.2) | ||
| ≥20 | 593(55.3) | 309(69.9) | ||
| 高血压病史a | 3.42 | 0.060 | ||
| 有 | 634(59.1) | 274(61.9) | ||
| 无 | 438(40.9) | 168(38.0) | ||
| 糖尿病病史a | 3.22 | 0.073 | ||
| 有 | 136(12.7) | 66(14.9) | ||
| 无 | 936(87.3) | 376(85.1) | ||
| NT-proBNP(ng/L)a | 25.70 | 0.001 | ||
| <300 | 349(32.6) | 180(40.7) | ||
| 300~1 400 | 342(31.9) | 164(37.1) | ||
| >1 400 | 381(35.5) | 98(22.2) | ||
| 动脉血氧分压(mmHg)b | 97.3(95.0,98.9) | 96.0(93.0,97.8) | -6.57 | <0.001 |
| FEV1/FVC(%)b | 55.8(46.0,66.4) | 43.5(34.9,53.7) | -10.43 | <0.001 |
| GOLD分级a | 24.51 | 0.002 | ||
| 1 级 | 97(9.1) | 15(3.4) | ||
| 2 级 | 398(37.3) | 84(19.2) | ||
| 3 级 | 391(36.7) | 158(36.1) | ||
| 4 级 | 180(16.9) | 181(41.3) | ||
| 肺动脉收缩压(mmHg)b | 39(31,49) | 40(32,50) | -7.52 | <0.001 |
| 右心室直径(mm)b | 18(16,20) | 20(19,23) | -12.72 | <0.001 |
| 右心房直径(mm)b | 33(31,37) | 35(31,39) | -3.18 | <0.001 |
| 左心室舒张末期内径(mm)b | 44(41,48) | 44(41,48) | -0.83 | 0.406 |
| 左心室收缩末期内径(mm)b | 28(25,32) | 26(24,29) | -6.01 | <0.001 |
| 左心房直径(mm)b | 36(33,40) | 29(26,32) | -19.48 | <0.001 |
| 肺动脉直径(mm)b | 24(22,26) | 23(21,25) | -7.52 | <0.001 |
| 主动脉直径(mm)b | 35(32,36) | 28(27,30) | -19.06 | <0.001 |
| 肺动脉/主动脉直径a | 2.05 | 0.152 | ||
| <1 | 1 064(99.3) | 396(89.6) | ||
| ≥1 | 8(0.7) | 46(10.4) |
注:a例(%);bM(Q1,Q3);NT-proBNP为N 末端B 型利钠肽前体;FEV1/FVC为第一秒用力呼气容积/用力肺活量;GOLD为慢性阻塞性肺疾病全球倡议;GOLD分级:第一秒用力呼气容积占预计值百分比>80%为1级,50%~80%为2级,30%~50%为3级,<30%为4级;1 mmHg=0.133 kPa
对训练集进行的单因素logistic回归模型分析显示:年龄>70岁、右心房直径、左心房直径、右心室直径、肺动脉直径和主动脉直径为COPD合并PH的相关因素(表2)。将以上因素纳入多因素 logistic回归模型分析显示:年龄≥70岁[OR(95%CI):3.32(1.49~7.36)]、吸烟状态[曾经、目前吸烟OR(95%CI)分别为3.67(2.51~5.37)和2.04(1.44~2.90)]、NT-proBNP≥1 400 ng/L[OR(95%CI):9.88(6.23~15.66)]、右心房直径[OR(95%CI):1.11(1.07~1.15)]是COPD合并PH的相关因素(表3)。
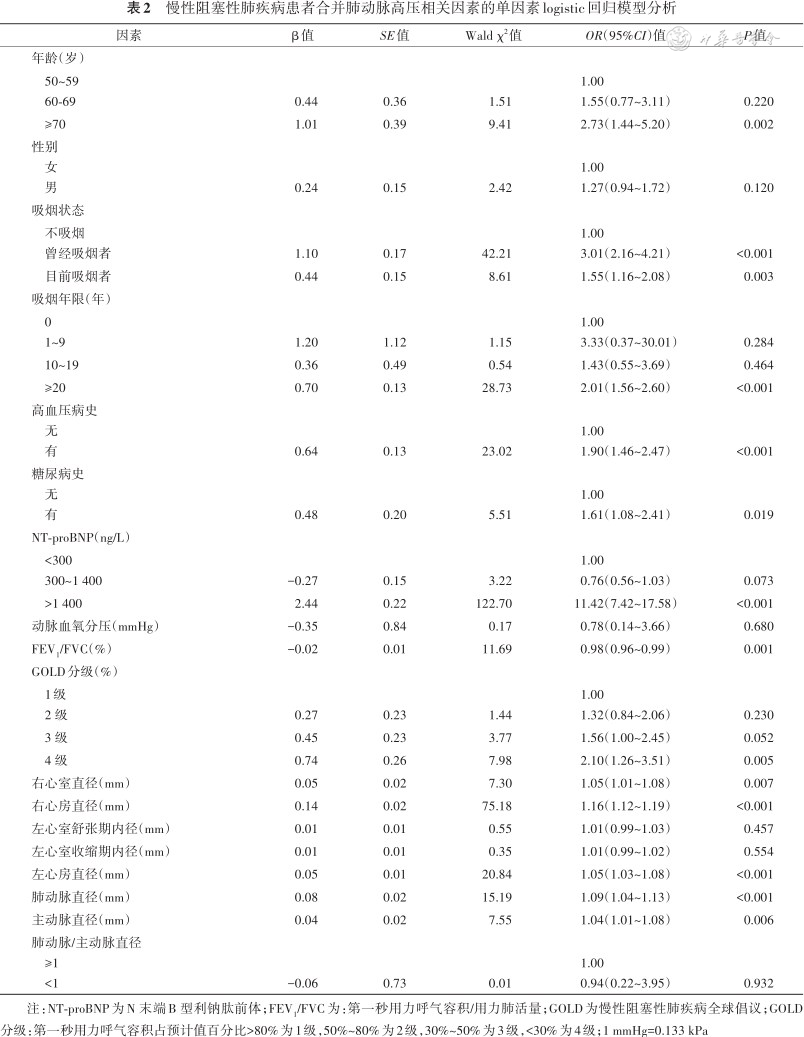
慢性阻塞性肺疾病患者合并肺动脉高压相关因素的单因素logistic回归模型分析
慢性阻塞性肺疾病患者合并肺动脉高压相关因素的单因素logistic回归模型分析
| 因素 | β值 | SE值 | Wald χ2值 | OR(95%CI)值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁) | |||||
50~59 60-69 | 0.44 | 0.36 | 1.51 | 1.00 1.55(0.77~3.11) | 0.220 |
| ≥70 | 1.01 | 0.39 | 9.41 | 2.73(1.44~5.20) | 0.002 |
性别 女 男 | 0.24 | 0.15 | 2.42 | 1.00 1.27(0.94~1.72) | 0.120 |
| 吸烟状态 | |||||
不吸烟 曾经吸烟者 | 1.10 | 0.17 | 42.21 | 1.00 3.01(2.16~4.21) | <0.001 |
| 目前吸烟者 | 0.44 | 0.15 | 8.61 | 1.55(1.16~2.08) | 0.003 |
| 吸烟年限(年) | |||||
0 1~9 | 1.20 | 1.12 | 1.15 | 1.00 3.33(0.37~30.01) | 0.284 |
| 10~19 | 0.36 | 0.49 | 0.54 | 1.43(0.55~3.69) | 0.464 |
| ≥20 | 0.70 | 0.13 | 28.73 | 2.01(1.56~2.60) | <0.001 |
高血压病史 无 有 | 0.64 | 0.13 | 23.02 | 1.00 1.90(1.46~2.47) | <0.001 |
糖尿病史 无 有 | 0.48 | 0.20 | 5.51 | 1.00 1.61(1.08~2.41) | 0.019 |
| NT-proBNP(ng/L) | |||||
<300 300~1 400 | -0.27 | 0.15 | 3.22 | 1.00 0.76(0.56~1.03) | 0.073 |
| >1 400 | 2.44 | 0.22 | 122.70 | 11.42(7.42~17.58) | <0.001 |
| 动脉血氧分压(mmHg) | -0.35 | 0.84 | 0.17 | 0.78(0.14~3.66) | 0.680 |
| FEV1/FVC(%) | -0.02 | 0.01 | 11.69 | 0.98(0.96~0.99) | 0.001 |
| GOLD分级(%) | |||||
1级 2 级 | 0.27 | 0.23 | 1.44 | 1.00 1.32(0.84~2.06) | 0.230 |
| 3 级 | 0.45 | 0.23 | 3.77 | 1.56(1.00~2.45) | 0.052 |
| 4 级 | 0.74 | 0.26 | 7.98 | 2.10(1.26~3.51) | 0.005 |
| 右心室直径(mm) | 0.05 | 0.02 | 7.30 | 1.05(1.01~1.08) | 0.007 |
| 右心房直径(mm) | 0.14 | 0.02 | 75.18 | 1.16(1.12~1.19) | <0.001 |
| 左心室舒张期内径(mm) | 0.01 | 0.01 | 0.55 | 1.01(0.99~1.03) | 0.457 |
| 左心室收缩期内径(mm) | 0.01 | 0.01 | 0.35 | 1.01(0.99~1.02) | 0.554 |
| 左心房直径(mm) | 0.05 | 0.01 | 20.84 | 1.05(1.03~1.08) | <0.001 |
| 肺动脉直径(mm) | 0.08 | 0.02 | 15.19 | 1.09(1.04~1.13) | <0.001 |
| 主动脉直径(mm) | 0.04 | 0.02 | 7.55 | 1.04(1.01~1.08) | 0.006 |
肺动脉/主动脉直径 ≥1 <1 | -0.06 | 0.73 | 0.01 | 1.00 0.94(0.22~3.95) | 0.932 |
注:NT-proBNP为N 末端B 型利钠肽前体;FEV1/FVC为:第一秒用力呼气容积/用力肺活量;GOLD为慢性阻塞性肺疾病全球倡议;GOLD分级:第一秒用力呼气容积占预计值百分比>80%为1级,50%~80%为2级,30%~50%为3级,<30%为4级;1 mmHg=0.133 kPa
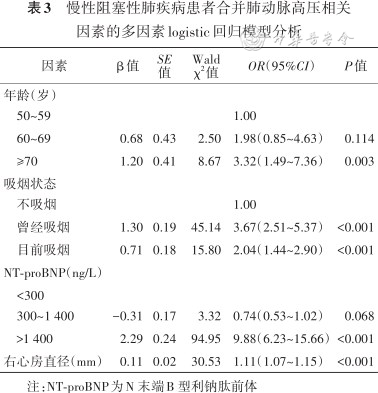
慢性阻塞性肺疾病患者合并肺动脉高压相关因素的多因素logistic回归模型分析
慢性阻塞性肺疾病患者合并肺动脉高压相关因素的多因素logistic回归模型分析
| 因素 | β值 | SE 值 | Wald χ2值 | OR(95%CI) | P值 |
|---|---|---|---|---|---|
年龄(岁) 50~59 | 1.00 | ||||
| 60~69 | 0.68 | 0.43 | 2.50 | 1.98(0.85~4.63) | 0.114 |
| ≥70 | 1.20 | 0.41 | 8.67 | 3.32(1.49~7.36) | 0.003 |
吸烟状态 不吸烟 | 1.00 | ||||
| 曾经吸烟 | 1.30 | 0.19 | 45.14 | 3.67(2.51~5.37) | <0.001 |
| 目前吸烟 | 0.71 | 0.18 | 15.80 | 2.04(1.44~2.90) | <0.001 |
| NT-proBNP(ng/L) | |||||
<300 300~1 400 | -0.31 | 0.17 | 3.32 | 0.74(0.53~1.02) | 0.068 |
| 1 400 | 2.29 | 0.24 | 94.95 | 9.88(6.23~15.66) | <0.001 |
| 右心房直径(mm) | 0.11 | 0.02 | 30.53 | 1.11(1.07~1.15) | <0.001 |
注:NT-proBNP为N 末端B 型利钠肽前体
根据多因素logistic回归分析筛选出来的4个因素,建立COPD合并PH列线图模型:每个变量的分值对应最上方评分轴的得分,将每个变量得分的总和记录为总得分,总得分对应在最下面轴上的值即为发生COPD合并PH的风险概率(图1)。假设1例COPD患者62岁,目前吸烟,右心房直径43 mm,NT-proBNP>1 400 ng/L,则其合并PH的概率为0.959
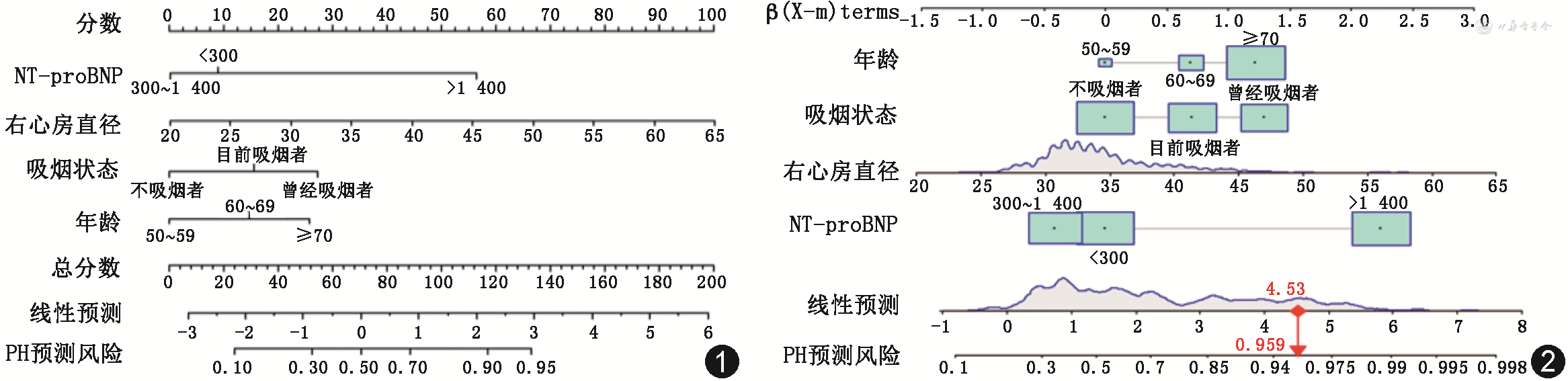

注:NT-proBNP为N末端前体脑利钠肽
训练集和验证集的偏差校正后C指数(95%CI)分别为0.82(0.77~0.87)和0.77(0.68~0.86),Calibration校准曲线在训练集(图3A)与验证集(图3B)均接近于对角线。列线图模型的AUC(95%CI)在训练集和验证集分别为0.82(0.80~0.85)(图3C)和0.77(0.73~0.82)(图3D)。通过ROC曲线得出训练集中最佳阈值为0.60,该值下的灵敏度、特异度分别为0.74、0.78;验证集最佳阈值为0.70,该值下的灵敏度和特异度分别为0.76和0.65。DCA分析显示:列线图模型分别在训练集和验证集中以阈概率>15.0%和>13.0%提供了优于变量全选和变量均不选策略的净效益。
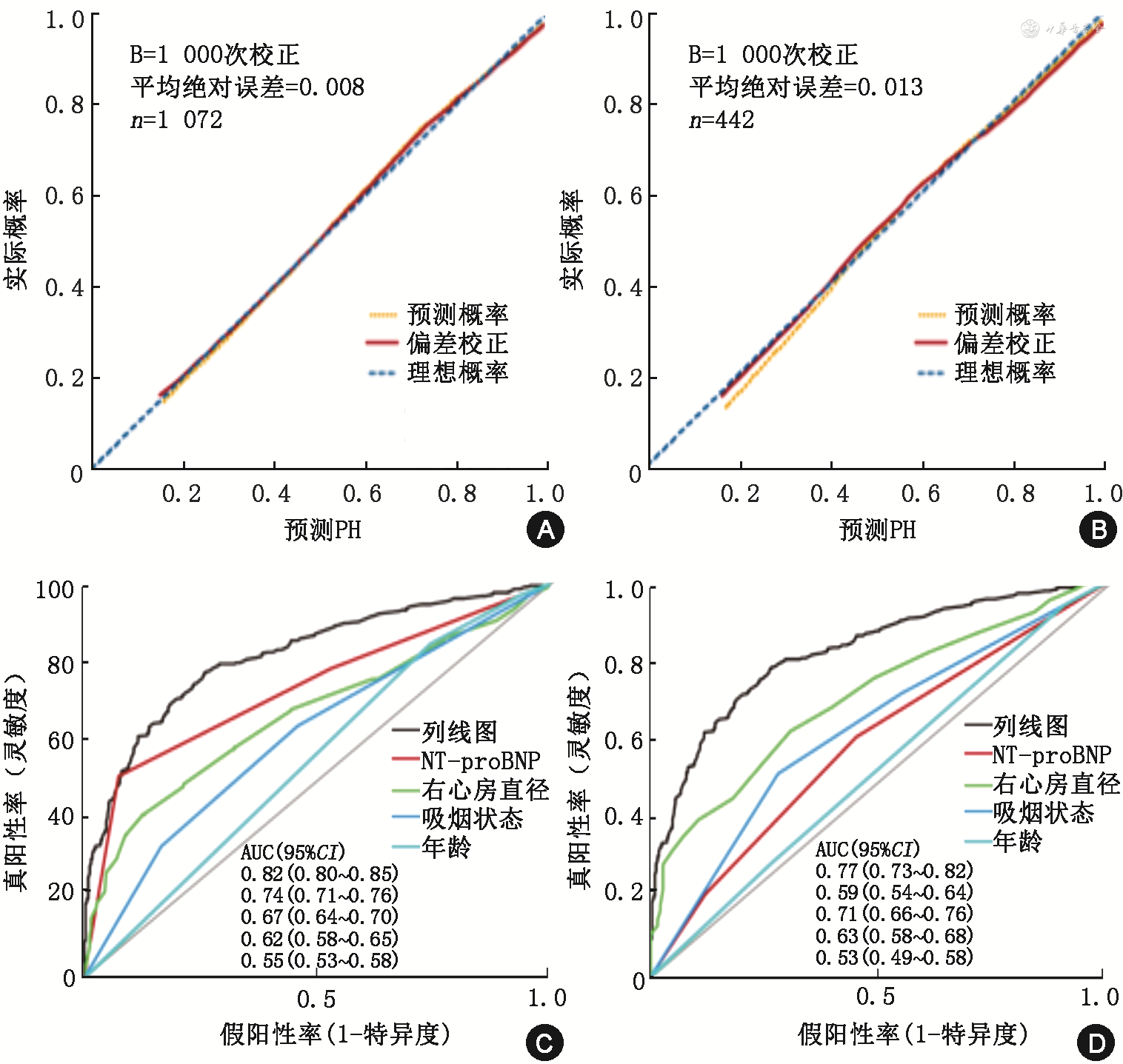

注:AUC为曲线下面积;NT⁃proBNP为N末端B型利钠肽前体
列线图模型基于大规模数据分析,其直观的图标式模型便于临床应用,还可转化为在线应用程序,应用于智能化患者管理及辅助诊疗,在肿瘤、心血管疾病等多种疾病领域,均取得了较好的临床应用效果[11, 12, 13]。
本研究基于超声心动图、血清学指标和临床特征构建并验证了预测COPD合并PH诊断预测的列线图模型。基于该模型,可识别高危COPD患者,便于进行个体化管理、风险评价及制定治疗策略。本研究筛选出的COPD合并PH的相关因素包括年龄、NT-proBNP、右心房直径和吸烟状态,与既往研究结论一致[14];NT-proBNP可预测重症PH患者[15];超声心动图评估估计的右心房压力和直径可预测PH患者的死亡[16];长期接触香烟烟雾是COPD患者发展为PH的主要危险因素[17]。以上因素与COPD合并PH的相关性虽有报道,但仍不足以作为单一因素用于预测COPD合并PH,本研究所采用的列线图模型预测效能明显高于单一因素预测效果,DCA曲线的阈值概率较大并且显示出明显的净效益,提示该模型具有较好的临床实用性。
近年来PH领域取得了许多进展,诊断及治疗策略不断更新[18]。本研究所构建的列线图模型具有良好的应用场景,包括:基层医疗机构对COPD患者的长期管理、早期识别出高危患者以便尽早转诊、评估和治疗;基于本模型所开发的在线工具(https://ph-666.shinyapps.io/zhonghua-PH/)可通过智能化通信终端操作程序用于COPD患者的自我管理;与医院病例管理系统进行整合,用于人工智能辅助诊断等。后期应用过程中的机器学习和反馈优化将进一步提高其临床预测效能和准确性。
本研究的训练集和验证集年龄构成、吸烟年限、NT-proBNP和右心房直径等多项资料均衡性较差,尚需大样本、多中心、前瞻性研究加以验证。
所有作者均声明不存在利益冲突



























