
探讨胰腺肿瘤切除术中阿片类药物用量对患者术后生存期的影响。
回顾性分析2013年9月至2018年8月于哈尔滨医科大学附属肿瘤医院行胰腺肿瘤切除术的95例胰腺癌患者的临床资料。患者术中阿片类药物用量经换算,统一表示为芬太尼用量,并通过芬太尼用量将患者分为高剂量组(芬太尼用量≥2.21 mg,n=46)和低剂量组(芬太尼用量<2.21 mg,n=49)。比较两组患者无复发生存时间(RFS)和总生存时间(OS)的差异。采用Cox回归分析影响患者RFS和OS的因素。
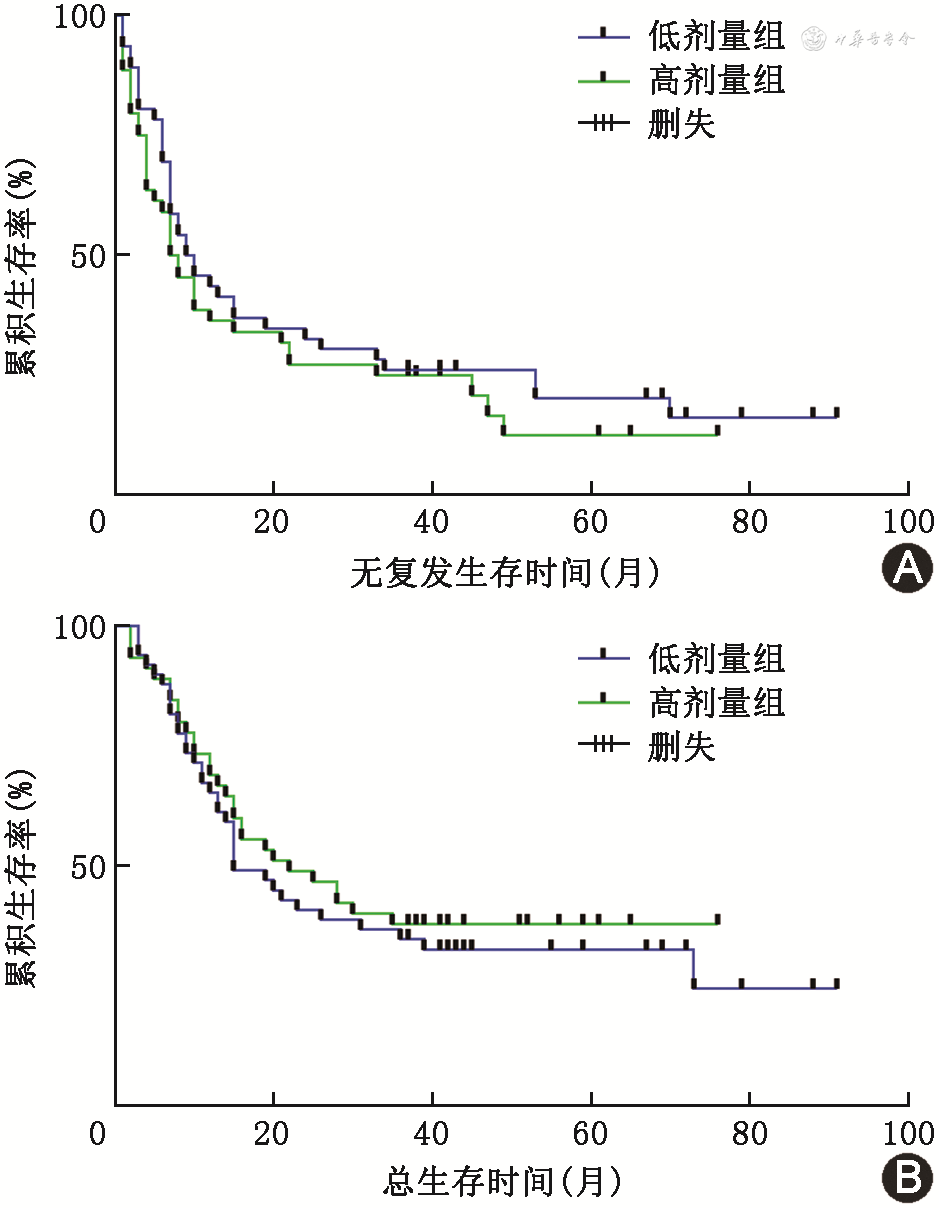
低剂量组患者1、3、5年RFS率分别为75.5%、26.5%、15.2%,OS率分别为77.6%、32.5%、24.4%;高剂量组患者1、3、5年RFS率分别为76.1%、23.9%、12.0%,OS率分别为76.1%、37.0%、15.0%;两组患者间RFS率和OS率差异均无统计学意义(均P>0.05)。多因素Cox分析显示,术中芬太尼用量不会影响患者的RFS(HR=1.205,95%CI:0.737~1.970,P=0.456)和OS(HR=1.062,95%CI:0.634~1.778,P=0.818)。
术中阿片类药物用量对胰腺癌患者术后RFS率和OS率无影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰腺癌是一种死亡率很高的恶性肿瘤,5年生存率仅为9%左右[1],预后较差。手术切除是胰腺癌的主要治疗方法,但术后近80%的患者发生局部复发或远处转移[2]。手术治疗可能引起胰腺癌患者神经内分泌和肿瘤细胞代谢改变,进而可能导致细胞介导的免疫功能受损并促进肿瘤细胞扩散[3]。肿瘤细胞播散和免疫功能受损使得手术治疗的肿瘤患者术后发生转移的可能性增高。因此越来越多的研究聚焦在围手术期各因素(如麻醉用药、术中输血等)对肿瘤进展的影响。关于术中相关因素对患者生存期和预后的影响,其机制可能在于:首先,围手术期的一些因素,如应对损伤的炎症反应、术中生理应激反应、高血糖、低体温等,导致辅助型T细胞1(T helper 1 cell,Th1)和辅助型T细胞2(T helper 2 cell,Th2)的反应失衡,构成一个促瘤环境[4]。其次,术中挥发性麻醉药和阿片类药物的使用可能会抑制宿主细胞防御功能,尤其是自然杀伤细胞(natural killer cell,NK)、自然杀伤T细胞(Natural killer T cell,NKT)和细胞毒性淋巴细胞[5]。有关胰腺癌患者术中阿片类药物用量对术后生存期有无影响尚未见报道,本研究旨在通过分析术中阿片类药物剂量和胰腺癌患者术后生存率的关系,为临床上制定合适麻醉方案、治疗策略及评估预后提供依据。
1.对象:本研究为回顾性队列研究,符合《赫尔辛基宣言》中的伦理学标准,所有患者均签署知情同意书。收集2013年9月至2018年8月期间于哈尔滨医科大学附属肿瘤医院行胰腺肿瘤切除术的95例患者的临床资料,均由术后病理明确诊断为胰腺癌。其中男49例、女46例,年龄14~78(55±11)岁;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅲ级;病理分期:Ⅰ期34例、Ⅱ期56例、Ⅲ期5例。根据患者术中阿片类药物用量,将患者分为高剂量组(芬太尼用量≥2.21 mg,n=46)和低剂量组(芬太尼用量<2.21 mg,n=49)。
2. 纳入标准:(1)患者经组织病理学检查确诊为胰腺癌,符合中国临床肿瘤学会的相关诊断标准;(2)术前未发生远处转移;(3)患者首次行手术治疗;(4)麻醉方式为静脉-吸入复合麻醉或全凭静脉麻醉。
3. 排除标准:(1)患者并发其他部位肿瘤;(2)患者基础资料、手术或麻醉记录缺失或不完善;(3)随访期间失访的患者。
1. 资料收集:收集每例胰腺癌患者的一般临床资料,包括性别、年龄、体质指数(body mass index,BMI)、基础疾病(如高血压和糖尿病),肿瘤位置、长径、TNM分期,以及术中资料,包括手术时长,术中阿片类药物用量,非甾体抗炎药物、丙泊酚、输血制品的使用率。
2. 麻醉方案:采用舒芬太尼0.4 μg/kg或芬太尼4 μg/kg、丙泊酚2 mg/kg、咪达唑仑0.05 mg/kg行麻醉诱导。肌肉松弛药使用罗库溴铵0.3 mg/kg或顺阿曲库铵0.6 mg/kg。术中麻醉维持采用瑞芬太尼0.3 μg·kg-1·min-1联合异丙酚4 mg·kg-1·h-1或七氟醚1%~3%。阿片类药物均换算成芬太尼用量,芬太尼等效换算系数为:1 μg芬太尼=0.1 μg舒芬太尼=1 μg瑞芬太尼 [6]。
3. 随访:采用查阅病历和电话联系的方式进行随访调查。随访截止时间为2020年10月31日。本研究预后评价指标包括无复发生存时间(relapse-free survival,RFS)和总生存时间(overall survival,OS)。RFS定义为胰腺癌患者手术治疗后至最早出现局部复发、远处转移或死亡的时间。OS是指从患者确诊胰腺癌开始至任何原因导致死亡的时间或至随访时间。
采用SPSS 26.0统计软件进行数据分析,正态分布计量资料以表示,组间比较采用独立样本t检验;计数资料以频数及百分率表示,组间比较采用χ2检验。采用Kaplan-Meier曲线进行生存分析,组间比较采用Log-rank检验。用Cox回归模型分析相关变量与预后的关系,分析影响患者生存的危险因素。双侧检验,检验水准α=0.05。
两组患者间术中丙泊酚使用率、麻醉方式及术中血制品使用率差异有统计学意义(均P<0.05),其余各因素差异均无统计学意义(均P>0.05),结果见表1。
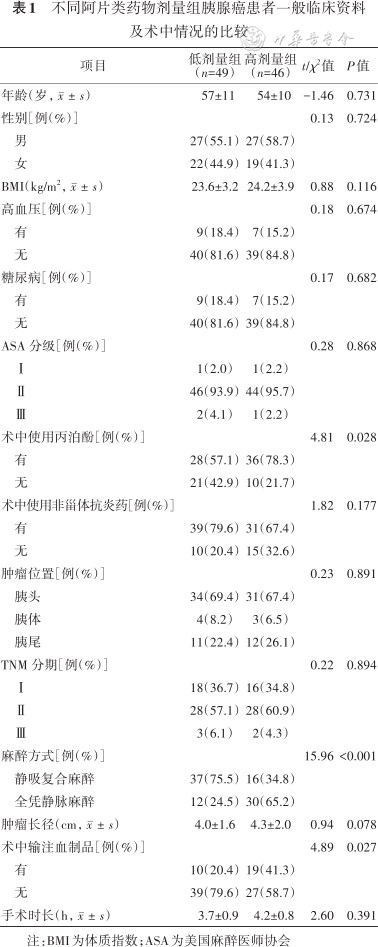
不同阿片类药物剂量组胰腺癌患者一般临床资料及术中情况的比较
不同阿片类药物剂量组胰腺癌患者一般临床资料及术中情况的比较
| 项目 | 低剂量组 (n=49) | 高剂量组 (n=46) | t/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 57±11 | 54±10 | -1.46 | 0.731 |
| 性别[例(%)] | 0.13 | 0.724 | ||
| 男 | 27(55.1) | 27(58.7) | ||
| 女 | 22(44.9) | 19(41.3) | ||
| BMI(kg/m2,) | 23.6±3.2 | 24.2±3.9 | 0.88 | 0.116 |
| 高血压[例(%)] | 0.18 | 0.674 | ||
| 有 | 9(18.4) | 7(15.2) | ||
| 无 | 40(81.6) | 39(84.8) | ||
| 糖尿病[例(%)] | 0.17 | 0.682 | ||
| 有 | 9(18.4) | 7(15.2) | ||
| 无 | 40(81.6) | 39(84.8) | ||
| ASA 分级[例(%)] | 0.28 | 0.868 | ||
| Ⅰ | 1(2.0) | 1(2.2) | ||
| Ⅱ | 46(93.9) | 44(95.7) | ||
| Ⅲ | 2(4.1) | 1(2.2) | ||
| 术中使用丙泊酚[例(%)] | 4.81 | 0.028 | ||
| 有 | 28(57.1) | 36(78.3) | ||
| 无 | 21(42.9) | 10(21.7) | ||
| 术中使用非甾体抗炎药[例(%)] | 1.82 | 0.177 | ||
| 有 | 39(79.6) | 31(67.4) | ||
| 无 | 10(20.4) | 15(32.6) | ||
| 肿瘤位置[例(%)] | 0.23 | 0.891 | ||
| 胰头 | 34(69.4) | 31(67.4) | ||
| 胰体 | 4(8.2) | 3(6.5) | ||
| 胰尾 | 11(22.4) | 12(26.1) | ||
| TNM 分期[例(%)] | 0.22 | 0.894 | ||
| Ⅰ | 18(36.7) | 16(34.8) | ||
| Ⅱ | 28(57.1) | 28(60.9) | ||
| Ⅲ | 3(6.1) | 2(4.3) | ||
| 麻醉方式[例(%)] | 15.96 | <0.001 | ||
| 静吸复合麻醉 | 37(75.5) | 16(34.8) | ||
| 全凭静脉麻醉 | 12(24.5) | 30(65.2) | ||
| 肿瘤长径(cm,) | 4.0±1.6 | 4.3±2.0 | 0.94 | 0.078 |
| 术中输注血制品[例(%)] | 4.89 | 0.027 | ||
| 有 | 10(20.4) | 19(41.3) | ||
| 无 | 39(79.6) | 27(58.7) | ||
| 手术时长(h,) | 3.7±0.9 | 4.2±0.8 | 2.60 | 0.391 |
注:BMI为体质指数;ASA为美国麻醉医师协会
低剂量组中,患者1、3、5年RFS率分别为75.5%、26.5%、15.2%,OS率分别为77.6%、32.5%、24.4%;高剂量组中,患者1、3、5年RFS率分别为76.1%、23.9%、12.0%,OS率分别为76.1%、37.0%、15.0%,经Log-rank检验,两组间RFS率和OS率差异均无统计学意义(均P>0.05),Kaplan-Meier生存曲线见图1。

患者年龄(P=0.007)、肿瘤位置(胰体:P=0.019)、TNM分期(Ⅲ期:P=0.001)和手术时长(P<0.001)是影响胰腺癌患者RFS较短的危险因素。年龄(P=0.013)、BMI(P=0.014)和TNM分期(Ⅱ期:P=0.008、Ⅲ期:P<0.001)是影响胰腺癌患者OS较短的危险因素,结果见表2。
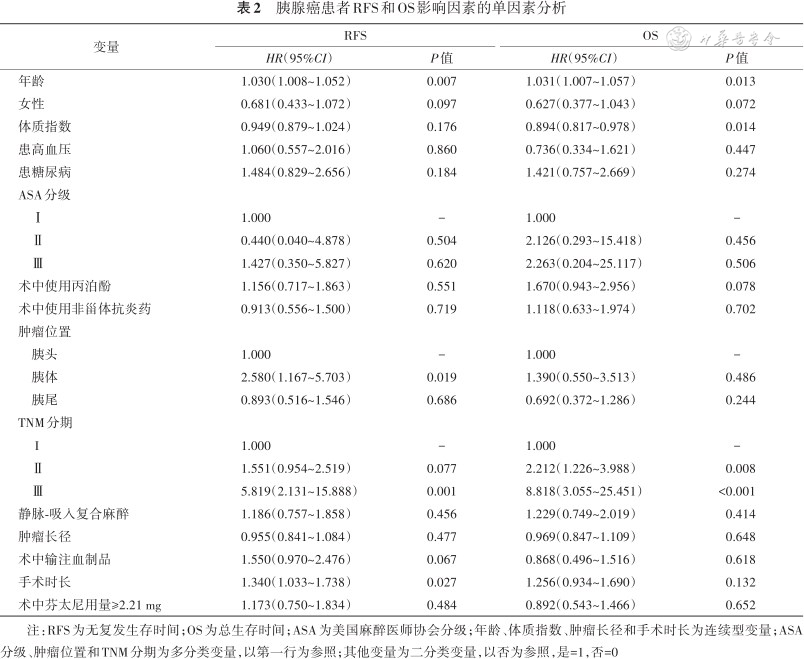
胰腺癌患者RFS和OS影响因素的单因素分析
胰腺癌患者RFS和OS影响因素的单因素分析
| 变量 | RFS | OS | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 年龄 | 1.030(1.008~1.052) | 0.007 | 1.031(1.007~1.057) | 0.013 |
| 女性 | 0.681(0.433~1.072) | 0.097 | 0.627(0.377~1.043) | 0.072 |
| 体质指数 | 0.949(0.879~1.024) | 0.176 | 0.894(0.817~0.978) | 0.014 |
| 患高血压 | 1.060(0.557~2.016) | 0.860 | 0.736(0.334~1.621) | 0.447 |
| 患糖尿病 | 1.484(0.829~2.656) | 0.184 | 1.421(0.757~2.669) | 0.274 |
| ASA分级 | ||||
| Ⅰ | 1.000 | - | 1.000 | - |
| Ⅱ | 0.440(0.040~4.878) | 0.504 | 2.126(0.293~15.418) | 0.456 |
| Ⅲ | 1.427(0.350~5.827) | 0.620 | 2.263(0.204~25.117) | 0.506 |
| 术中使用丙泊酚 | 1.156(0.717~1.863) | 0.551 | 1.670(0.943~2.956) | 0.078 |
| 术中使用非甾体抗炎药 | 0.913(0.556~1.500) | 0.719 | 1.118(0.633~1.974) | 0.702 |
| 肿瘤位置 | ||||
| 胰头 | 1.000 | - | 1.000 | - |
| 胰体 | 2.580(1.167~5.703) | 0.019 | 1.390(0.550~3.513) | 0.486 |
| 胰尾 | 0.893(0.516~1.546) | 0.686 | 0.692(0.372~1.286) | 0.244 |
| TNM分期 | ||||
| I | 1.000 | - | 1.000 | - |
| Ⅱ | 1.551(0.954~2.519) | 0.077 | 2.212(1.226~3.988) | 0.008 |
| Ⅲ | 5.819(2.131~15.888) | 0.001 | 8.818(3.055~25.451) | <0.001 |
| 静脉-吸入复合麻醉 | 1.186(0.757~1.858) | 0.456 | 1.229(0.749~2.019) | 0.414 |
| 肿瘤长径 | 0.955(0.841~1.084) | 0.477 | 0.969(0.847~1.109) | 0.648 |
| 术中输注血制品 | 1.550(0.970~2.476) | 0.067 | 0.868(0.496~1.516) | 0.618 |
| 手术时长 | 1.340(1.033~1.738) | 0.027 | 1.256(0.934~1.690) | 0.132 |
| 术中芬太尼用量≥2.21 mg | 1.173(0.750~1.834) | 0.484 | 0.892(0.543~1.466) | 0.652 |
注:RFS为无复发生存时间;OS为总生存时间;ASA为美国麻醉医师协会分级;年龄、体质指数、肿瘤长径和手术时长为连续型变量;ASA分级、肿瘤位置和TNM分期为多分类变量,以第一行为参照;其他变量为二分类变量,以否为参照,是=1,否=0
将单因素分析中差异有统计学意义的因素和胰腺癌相关性较强的因素列入Cox多因素回归分析中,结果显示患者年龄(P=0.002)、TNM分期(Ⅱ期:P=0.026、Ⅲ期:P=0.033)和手术时长(P=0.001)是胰腺癌患者RFS较短的预测因素,而术中芬太尼用量不会影响胰腺癌患者的RFS(P=0.456),结果见表3。患者年龄(P=0.006)、BMI(P=0.004)和TNM分期(Ⅱ期:P=0.008、Ⅲ期:P<0.001)是胰腺癌患者OS较短的预测因素,而术中芬太尼用量不会影响胰腺癌患者的OS(P=0.818),结果见表4。
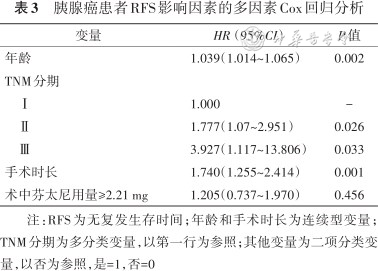
胰腺癌患者RFS影响因素的多因素Cox回归分析
胰腺癌患者RFS影响因素的多因素Cox回归分析
| 变量 | HR(95%CI) | P值 |
|---|---|---|
| 年龄 | 1.039(1.014~1.065) | 0.002 |
| TNM分期 | ||
| Ⅰ | 1.000 | - |
| Ⅱ | 1.777(1.07~2.951) | 0.026 |
| Ⅲ | 3.927(1.117~13.806) | 0.033 |
| 手术时长 | 1.740(1.255~2.414) | 0.001 |
| 术中芬太尼用量≥2.21 mg | 1.205(0.737~1.970) | 0.456 |
注:RFS为无复发生存时间;年龄和手术时长为连续型变量;TNM分期为多分类变量,以第一行为参照;其他变量为二项分类变量,以否为参照,是=1,否=0
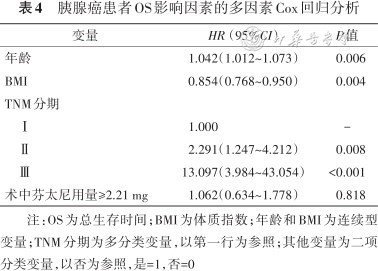
胰腺癌患者OS影响因素的多因素Cox回归分析
胰腺癌患者OS影响因素的多因素Cox回归分析
| 变量 | HR(95%CI) | P值 |
|---|---|---|
| 年龄 | 1.042(1.012~1.073) | 0.006 |
| BMI | 0.854(0.768~0.950) | 0.004 |
| TNM分期 | ||
| Ⅰ | 1.000 | - |
| Ⅱ | 2.291(1.247~4.212) | 0.008 |
| Ⅲ | 13.097(3.984~43.054) | <0.001 |
| 术中芬太尼用量≥2.21 mg | 1.062(0.634~1.778) | 0.818 |
注:OS为总生存时间;BMI为体质指数;年龄和BMI为连续型变量;TNM分期为多分类变量,以第一行为参照;其他变量为二项分类变量,以否为参照,是=1,否=0
本研究结果显示,术中不同剂量阿片类药物组间患者的RFS和OS率差异均无统计学意义,这与之前其他大多数研究的结果不符,如有研究表明在口腔癌[6]、前列腺癌[7]、食管鳞状细胞癌[8]患者中,术中应用阿片类药物均与患者术后复发和死亡率升高相关。然而也有研究表明,术中阿片类药物的使用与患者术后生存率降低无关。Forget等[9]研究发现乳腺癌患者术中使用阿片类药物不会影响患者术后生存期;同样Tai等[10]和Du等[11]的研究分别显示术中阿片类药物的使用对直肠癌和食管腺癌患者术后的生存期无影响。
关于阿片类药物对肿瘤患者的生存期的影响,其中一种可能的机制为阿片类药物的免疫抑制作用使肿瘤更易发生转移。免疫系统在肿瘤发生发展过程中起着至关重要的作用,特别是监视肿瘤细胞的免疫逃避[12]。Shavit等[13]研究表明,芬太尼对巨噬细胞和NK细胞有抑制作用。Beilin等[14]比较高剂量和低剂量芬太尼两种麻醉方案对围手术期NK细胞的影响,结果显示两种麻醉方案都能抑制NK细胞,并在术后24 h达到峰值。其次,血管生成可使肿瘤组织建立自身血液供应[15],阿片类药物可以通过诱导血管生成来促进肿瘤生长和转移[16]。已有研究表明吗啡可以通过促进肿瘤细胞微血管内皮细胞的增殖和细胞周期的进展,诱导血管生成[17]。此外,有研究结果显示吗啡通过激活肿瘤细胞及内皮细胞内环氧化酶-2(cyclooxygenase 2,COX-2)和酪氨酸激酶促进肿瘤进展[18, 19]。几项研究表明吗啡可通过μ-阿片受体(Mu opioid receptor,MOR)激活这些信号通路[19, 20]。同样,Zylla等[21]在一项对转移性前列腺癌患者的回顾性分析中,发现MOR的表达和较高剂量的阿片类药物的使用与较短的OS和RFS相关。Zhang等[22]观察到术中使用高剂量舒芬太尼的患者以及高水平表达MOR的胰腺癌患者的生存率较差,这一结果表明阿片类药物使用和MOR表达之间存在交互作用。
本研究结果显示术中阿片类药物的用量与胰腺癌患者术后RFS和OS无关,可能是由于各试验研究的肿瘤类型不同,其研究要点及收集的相关因素不尽相同,因此混杂因素较多,得出的结论可能存在差异。分析这种研究结果的差异可能有以下几点原因:首先,MOR在不同种类癌症患者中表达情况不同,因此阿片类药物对于不同肿瘤的促进作用存在差异性;其次,与胰腺癌患者预后及生存相关的因素较多[23],如切缘状态、淋巴结转移、术中血制品的输注、术后并发症和辅助治疗的应用,可能比手术中使用阿片类药物在研究的生存结果中发挥更重要的作用。
本研究存在一定局限性:首先,本研究为回顾性分析,因此围手术期不可控因素较多,如手术范围、手术时长、术中用药方案等,对结论存在一定干扰。另一方面,无法收集患者术后放化疗等后续治疗的资料及术后阿片类药物的用量。最后,本研究无法直接观察阿片类药物对于胰腺癌患者免疫系统的影响情况,因此无法确定其二者的相关性。
综上所述,在阿片类药物对胰腺癌患者生存及预后的影响未得到证实之前,其仍需作为胰腺癌患者手术过程中镇痛的主要用药。
所有作者均声明不存在利益冲突



























