
探讨低剂量利妥昔单抗(RTX)对原发性膜性肾病(PMN)的长期疗效。
纳入2018年8月至2020年5月就诊于天津医科大学总医院肾内科,经肾穿刺活检确诊为PMN且尿蛋白>3.5 g/24 h、血白蛋白<30 g/L、估算肾小球滤过率(eGFR)>20 ml·min-1·(1.73 m2)-1的患者,低剂量RTX为初始或二线治疗方案。随访24个月时PMN患者的缓解情况,并分析尿蛋白<8 g/24 h及≥8 g/24 h、抗M型磷脂酶A2受体(PLA2R)抗体<150 RU/ml及≥150 RU/ml、eGFR≥60 ml·min-1·(1.73 m2)-1 及<60 ml·min-1·(1.73 m2)-1等亚组缓解情况。
共纳入40例患者,男26例,女14例,年龄(53±15)岁。RTX初始及二线治疗分别为14例和26例,RTX首疗程总量800(425,1 075)mg。RTX治疗后第1、3、6、12、24个月缓解率分别为12.5%(5/40)、17.5%(7/40)、47.5%(19/40)、57.5%(23/40)、60%(24/40),缓解时间6.0(3.0,7.5)个月,随访期间复发2例。与24个月时未缓解者(16例)相比,缓解者(24例)基线eGFR更高[(93.9±28.0)比(62.4±28.1)ml·min-1·(1.73 m2)-1,P=0.001],尿蛋白[5.9(5.0,6.5)比11.7(8.6,15.5)g/24 h,P<0.001]及抗PLA2R抗体水平[73(29,132)比453(182,950)RU/ml,P=0.004]均更低。RTX初始治疗组与二线治疗组相比,缓解率差异无统计学意义(P=0.101)。各亚组对比结果显示,低剂量RTX治疗后,尿蛋白<8 g/24 h组(21/26比3/14,P<0.001)、抗PLA2R抗体<150 RU/ml组(16/19比5/16,P=0.002)及eGFR ≥60 ml·min-1·(1.73 m2)-1组(22/29比2/11,P=0.003)缓解率更高。
低剂量RTX对PMN长期疗效较好,复发率低,且更适用于基线尿蛋白<8 g/24 h、抗PLA2R<150 RU/ml及eGFR≥60 ml·min-1·(1.73 m2)-1的患者。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性膜性肾病(primary membranous nephropathy,PMN)是由自身抗体介导的肾脏特异性自身免疫性疾病。对于中高危PMN患者,既往指南推荐糖皮质激素加环磷酰胺作为一线治疗方案,其疗效肯定,但不良反应较多。目前,钙调磷酸酶抑制剂也已成为一线治疗,但其停药后复发率高,且长期使用可能引起肾间质损害。利妥昔单抗(rituximab,RTX)是一种人鼠嵌合单克隆抗体,最早应用于淋巴瘤患者的治疗,目前证实对PMN患者有效,改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)推荐RTX作为一线治疗。RTX治疗PMN的用药方案多样,目前常用方案多为375 mg/m2静脉滴注,1次/周,共4次,或1 g/2周,共2次。有研究显示,低剂量RTX治疗PMN有效,但其随访时间较短,病例数也较少[1, 2]。因此,本研究拟探讨低剂量RTX对PMN的长期疗效。
纳入2018年8月至2020年5月就诊于天津医科大学总医院肾内科的PMN患者。纳入标准:(1)年龄>18岁;(2)经肾穿刺活检病理确诊为PMN;(3)尿蛋白>3.5 g/24 h,血白蛋白<30 g/L,估算肾小球滤过率(estimated glomerular filtration rate,eGFR)>20 ml·min-1·(1.73 m2)-1[慢性肾脏病流行病合作研究(chronic kidney disease epidemiology collaboration,CKD-EPI)公式计算];(4)接受低剂量RTX治疗(参照文献[1, 2, 3],将低剂量RTX定义为首疗程总量≤1 200 mg);(5)RTX作为初始或二线治疗方案。排除标准:(1)继发性膜性肾病;(2)曾应用抗CD20单抗;(3)应用RTX后加用糖皮质激素或其他免疫抑制剂。本研究符合赫尔辛基宣言原则及相关伦理要求。
1. RTX用药方法:每次给予RTX 200(100,300)mg,1次/周静脉滴注,共2~4次,RTX输注总量≤1 200 mg,同时静脉滴注抗过敏药物。对于尿蛋白持续>3.5 g/24 h或CD19+B细胞数>5个/μl的患者[3]在第6~18个月行第2轮RTX治疗,剂量及疗程参照第1轮RTX方案。
2. 相关定义:(1)疾病缓解情况:尿蛋白<0.3 g/24 h定义为完全缓解;尿蛋白0.3~3.5 g/24 h且下降至基线水平50%以下,血白蛋白升高、血肌酐稳定或下降定义为部分缓解;否则定义为无反应(no respond,NR);(2)复发:完全缓解或部分缓解后尿蛋白再次>3.5 g/24 h定义为复发[4, 5]。(3)实验室指标:B淋巴细胞绝对数<5个/μl 定义为CD19+B细胞耗竭;抗M型磷脂酶A2受体(phospholipase A2 receptor,PLA2R)抗体检测,量子点荧光免疫法,≥14 RU/ml为阳性。
3. 观察指标和分组方法:输注RTX后第1、3、6、12、24个月时复查血常规、肝肾功能、尿蛋白、CD19+B细胞计数,并观察患者输注RTX后24个月时尿蛋白缓解与复发情况。比较RTX初始及二线治疗患者缓解及复发情况。比较缓解组与未缓解组患者主要基线指标。根据患者基线尿蛋白(<8 g/24 h和≥8 g/24 h)、抗PLA2R抗体水平(阴性或<150 RU/ml和≥150 RU/ml)、eGFR[<60 ml·min-1·(1.73 m2)-1和≥60 ml·min-1·(1.73 m2)-1]进行分组[6, 7, 8, 9],比较各亚组患者的缓解情况。
应用SPSS 26.0统计软件进行数据分析。正态分布的计量资料采用表示,组间比较采用独立样本t检验,重复测量资料采用重复测量方差分析;非正态分布资料采用M(Q1,Q3)表示,并用非参数检验(Mann-Whitney U检验及Friedman检验)进行分析;组内比较采用Bonferroni法调整检验水准;计数资料用例数和百分比表示,组间比较采用χ2检验;采用多因素logistic回归模型分析与缓解相关的独立影响因素。均为双侧检验,检验水准α=0.05。
共纳入40例患者,男26例,女14例,年龄21~78(53±15)岁。其中26例患者曾接受多种免疫抑制剂,包括糖皮质激素、环磷酰胺、环孢素、他克莫司、雷公藤、吗替麦考酚、来氟米特等治疗至少6个月,无缓解者19例,缓解后复发者7例,病程17.5(9.8,30.8)个月。所有患者均接受最大可耐受剂量血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂。RTX首疗程总量为800(425,1 075)mg。在输注RTX后6~18个月时,有16例患者接受第2轮RTX治疗,输注量为800(450,1 150)mg。患者基线抗PLA2R抗体水平174(71,563)RU/ml,基线CD19+B细胞绝对数196(83,406)个/μl,基线血总蛋白、白蛋白、血肌酐、eGFR和24 h尿蛋白见表1。
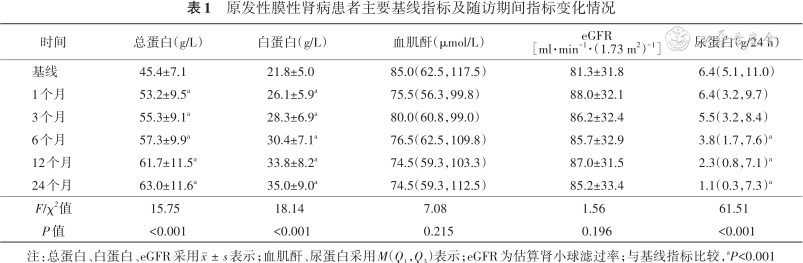
原发性膜性肾病患者主要基线指标及随访期间指标变化情况
原发性膜性肾病患者主要基线指标及随访期间指标变化情况
| 时间 | 总蛋白(g/L) | 白蛋白(g/L) | 血肌酐(μmol/L) | eGFR [ml·min-1·(1.73 m2)-1] | 尿蛋白(g/24 h) |
|---|---|---|---|---|---|
| 基线 | 45.4±7.1 | 21.8±5.0 | 85.0(62.5,117.5) | 81.3±31.8 | 6.4(5.1,11.0) |
| 1个月 | 53.2±9.5a | 26.1±5.9a | 75.5(56.3,99.8) | 88.0±32.1 | 6.4(3.2,9.7) |
| 3个月 | 55.3±9.1a | 28.3±6.9a | 80.0(60.8,99.0) | 86.2±32.4 | 5.5(3.2,8.4) |
| 6个月 | 57.3±9.9a | 30.4±7.1a | 76.5(62.5,109.8) | 85.7±32.9 | 3.8(1.7,7.6)a |
| 12个月 | 61.7±11.5a | 33.8±8.2a | 74.5(59.3,103.3) | 87.0±31.5 | 2.3(0.8,7.1)a |
| 24个月 | 63.0±11.6a | 35.0±9.0a | 74.5(59.3,112.5) | 85.2±33.4 | 1.1(0.3,7.3)a |
| F/χ2值 | 15.75 | 18.14 | 7.08 | 1.56 | 61.51 |
| P值 | <0.001 | <0.001 | 0.215 | 0.196 | <0.001 |
注:总蛋白、白蛋白、eGFR采用表示;血肌酐、尿蛋白采用M(Q1,Q3)表示;eGFR为估算肾小球滤过率;与基线指标比较,aP<0.001
患者输注RTX后第1、3、6、12、24个月的完全缓解及总体缓解率分别为0、12.5%(5/40),0、17.5%(7/40),2.5%(1/40)、47.5%(19/40),7.5%(3/40)、57.5%(23/40),32.5%(13/40)、60%(24/40),总体缓解时间为6.0(3.0,7.5)个月。第24个月时,13例达到完全缓解,11例达到部分缓解,2例部分缓解患者分别于第12和24个月因劳累和呼吸道感染后复发,总体复发率5%(此2例患者基线抗PLA2R抗体水平分别为616 RU/ml、10 RU/ml,基线尿蛋白均>8 g/24 h且均为慢性肾脏病3期),14例始终无反应(表2)。RTX治疗后,患者血总蛋白、血白蛋白较输注前明显升高,肾功能稳定,24 h尿蛋白量较前下降(表1),且随访过程中缓解组患者的血白蛋白、eGFR均高于未缓解组(均P<0.05),24 h尿蛋白量低于未缓解组(均P<0.05),输注RTX后抗PLA2R抗体水平下降,随访过程中缓解组患者抗体水平低于未缓解组(均P<0.05,图1)。与输注RTX前相比,第1个月时血CD19+B细胞计数明显下降[196(83,406)比1(1,2)个/μl,P<0.001]。第6个月时,血CD19+B细胞数较第1个月明显升高[28(14,246)比1(1,2)个/μl,P=0.008]。
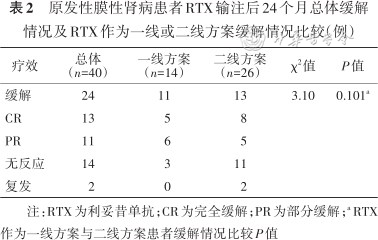
原发性膜性肾病患者RTX输注后24个月总体缓解情况及RTX作为一线或二线方案缓解情况比较(例)
原发性膜性肾病患者RTX输注后24个月总体缓解情况及RTX作为一线或二线方案缓解情况比较(例)
| 疗效 | 总体 (n=40) | 一线方案(n=14) | 二线方案(n=26) | χ2值 | P值 |
|---|---|---|---|---|---|
| 缓解 | 24 | 11 | 13 | 3.10 | 0.101a |
| CR | 13 | 5 | 8 | ||
| PR | 11 | 6 | 5 | ||
| 无反应 | 14 | 3 | 11 | ||
| 复发 | 2 | 0 | 2 |
注:RTX为利妥昔单抗;CR为完全缓解;PR为部分缓解;a RTX作为一线方案与二线方案患者缓解情况比较P值
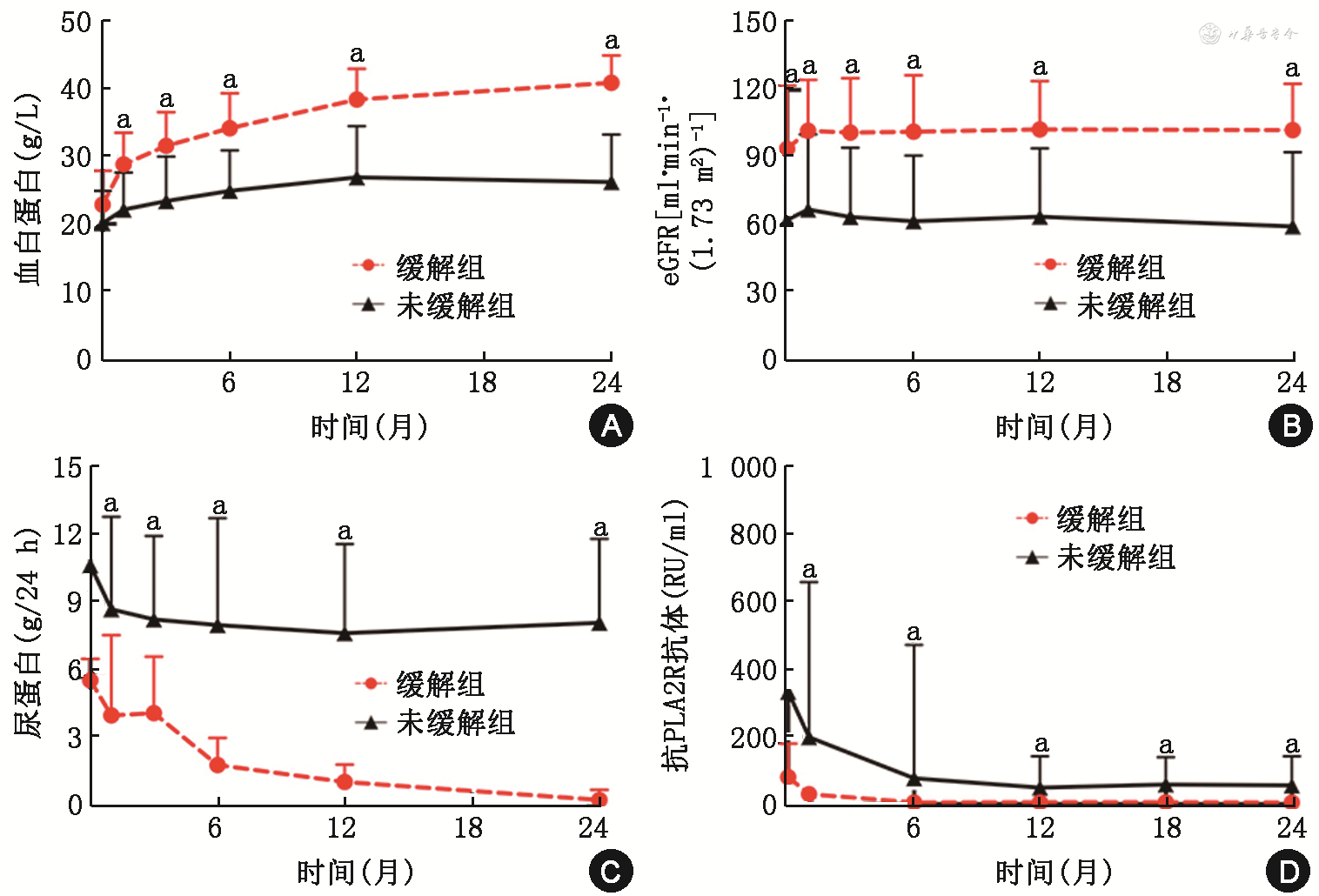

注:与无缓解组比较,a P<0.05;eGFR为估算肾小球滤过率;PLA2R为磷脂酶A2受体
40例患者中,有14例将RTX作为初始治疗,26例为二线治疗,RTX输注后第24个月初始治疗组中有11例缓解(完全缓解5例,部分缓解6例),二线治疗组中有13例缓解(完全缓解8例,部分缓解5例),缓解率差异无统计学意义(χ2=3.10,P=0.101,表2)。初始治疗组与二线治疗组相比,年龄[(53±13)比(53±17)岁]、RTX首疗程剂量[1 000(550,1 100)比750(400,1 000)mg]、基线血白蛋白[(23.3±5.7)比(20.9±4.5)g/L)、eGFR[(90.6±23.4)比(76.7±34.1)ml·min-1·(1.73 m2)-1]、尿蛋白[5.6(4.8,8.3)比7.1(5.6,11.5)g/24 h]、抗PLA2R抗体[192(70,469)比155(70,661)RU/ml]及缓解时间[6(1,6)比6(6,12)个月]差异均无统计学意义(均P>0.05)。
与无缓解组相比,缓解组患者的年龄、基线血总蛋白、白蛋白、CD19+B细胞数及输注RTX首疗程剂量差异均无统计学意义,但基线eGFR更高(P=0.001),尿蛋白(P<0.001)及抗PLA2R抗体水平更低(P=0.004)(表3)。

原发性膜性肾病患者输注RTX后24个月缓解组与无缓解组患者基线指标比较及亚组比较
原发性膜性肾病患者输注RTX后24个月缓解组与无缓解组患者基线指标比较及亚组比较
| 项目 | 缓解组(n=24) | 无缓解组(n=16) | t/χ2/Z值 | P值 |
|---|---|---|---|---|
| 性别(男/女)a | 13/11 | 13/3 | 3.10 | 0.101 |
| 年龄(岁)b | 51±16 | 56±14 | -1.12 | 0.271 |
| RTX总量(mg)c | 850(600,1 100) | 600(400,1 000) | -1.51 | 0.141 |
| 总蛋白(g/L)b | 46.2±7.2 | 44.2±6.9 | 0.88 | 0.383 |
| 血白蛋白(g/L)b | 22.8±5.0 | 20.1±4.7 | 1.71 | 0.095 |
| CD19+B细胞数(个/μl)c | 270(124,444) | 133(74,220) | -1.32 | 0.207 |
| 血肌酐(μmol/L)c | 66.0(55.2,94.8) | 114.0(84.5,147.8) | -3.55 | <0.001 |
| eGFR[ml·min-1·(1.73 m2)-1]b | 93.9±28.0 | 62.4±28.1 | 3.48 | 0.001 |
| <60a | 2 | 9 | 11.06 | 0.003 |
| ≥60a | 22 | 7 | ||
| 尿蛋白(g/24 h)c | 5.9(5.0,6.5) | 11.7(8.6,15.5) | -3.69 | <0.001 |
| <8a | 21 | 5 | 13.35 | <0.001 |
| ≥8a | 3 | 11 | ||
| 抗PLA2R抗体(RU/ml)c | 73(29,132) | 453(182,950) | -2.78 | 0.004 |
| <150a | 16 | 3 | 10.15 | 0.002 |
| ≥150a | 5 | 11 | ||
| 未检测a | 3 | 2 |
注:a例;b;cM(Q1,Q3);RTX为利妥昔单抗;eGFR为估算肾小球滤过率;PLA2R为磷脂酶A2受体
与尿蛋白≥8 g/24 h患者相比,尿蛋白<8 g/24 h缓解率更高(χ2=13.35,P<0.001);与抗PLA2R抗体≥150 RU/ml患者相比,抗PLA2R抗体<150 RU/ml者缓解率更高(χ2=10.15,P=0.002);与eGFR<60 ml·min-1·(1.73 m2)-1患者相比,eGFR≥60 ml·min-1·(1.73 m2)-1 患者缓解率更高(χ2=11.06,P=0.003)(表3)。
将可能影响患者缓解的因素,包括性别、年龄、血白蛋白、eGFR、尿蛋白、抗PLA2R抗体纳入多因素logistic回归模型分析,结果显示抗PLA2R抗体<150 RU/ml是与疾病缓解的独立相关因素(OR=16.92,95%CI:1.45~197.22,P=0.024)(表4)。
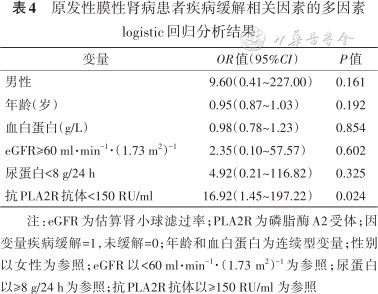
原发性膜性肾病患者疾病缓解相关因素的多因素logistic回归分析结果
原发性膜性肾病患者疾病缓解相关因素的多因素logistic回归分析结果
| 变量 | OR值(95%CI) | P值 |
|---|---|---|
| 男性 | 9.60(0.41~227.00) | 0.161 |
| 年龄(岁) | 0.95(0.87~1.03) | 0.192 |
| 血白蛋白(g/L) | 0.98(0.78~1.23) | 0.854 |
| eGFR≥60 ml·min-1·(1.73 m2)-1 | 2.35(0.10~57.57) | 0.602 |
| 尿蛋白<8 g/24 h | 4.92(0.21~116.82) | 0.325 |
| 抗PLA2R抗体<150 RU/ml | 16.92(1.45~197.22) | 0.024 |
注:eGFR为估算肾小球滤过率;PLA2R为磷脂酶A2受体;因变量疾病缓解=1,未缓解=0;年龄和血白蛋白为连续型变量;性别以女性为参照;eGFR以<60 ml·min-1·(1.73 m2)-1为参照;尿蛋白以≥8 g/24 h为参照;抗PLA2R抗体以≥150 RU/ml 为参照
40例患者中有8例出现肾病综合征相关并发症,包括感染5例(3例肺部感染,2例下肢软组织感染)、急性肾衰竭1例、下肢静脉血栓1例、脑梗死1例,经过治疗后均缓解。4例患者在首次输注RTX过程中出现皮疹,2例患者出现寒战、恶心,暂停输注后逐渐缓解,后续输注时未再出现。随访过程中,所有患者均未出现严重不良反应。
RTX治疗PMN的疗效已经得到广泛认可。2002年,Remuzzi等[10]首次将RTX应用于PMN患者的治疗,其RTX剂量参考淋巴瘤标准治疗剂量。有文献报道,低剂量RTX对PMN有效,但多为短期研究或个案报道[1, 2]。本研究对低剂量RTX治疗的PMN患者进行了24个月的随访,结果发现总体缓解率为60%,复发率为5%。在基线尿蛋白、抗PLA2R抗体水平较低及eGFR较高的患者中,低剂量RTX疗效更优。
本研究中,低剂量RTX定义为≤1 200 mg,与其他研究基本一致[1, 2]。结果显示,随访24个月的完全缓解率32.5%,部分缓解率27.5%,总缓解率60%,与标准剂量RTX治疗PMN研究结果相似[2,11, 12]。本研究PMN患者总体缓解率及完全缓解率随观察时间的延长有升高趋势。有研究报道,当延长随访时间后,低剂量及标准剂量RTX在PMN患者中缓解率相当,均可达60%以上[2,11]。但也有研究显示,低剂量RTX在PMN患者中的缓解率较低[13]。笔者推测这可能与随访时间短、入选患者基线肾功能较差等因素有关。在本研究中,缓解组基线eGFR>60 ml·min-1·(1.73 m2)-1的患者占91.7%,而未缓解组中有超过半数患者eGFR<60 ml·min-1·(1.73 m2)-1,支持以上假设。
本研究结果显示,与未缓解组比较,缓解组患者基线尿蛋白、抗PLA2R抗体水平较低,基线eGFR较高,提示低剂量RTX对此类PMN患者疗效较好。而在基线尿蛋白≥8 g/24 h、抗PLA2R抗体≥150 RU/ml及基线eGFR<60 ml·min-1·(1.73 m2)-1的患者中,缓解率仅分别为3/14、5/16、2/11。对于此类病情较重的PMN患者,RTX疗效报道不一。Aleš Rigler等[6]采用低剂量或标准剂量RTX治疗PMN的研究结果显示,12个月时,尿蛋白4~8 g/24 h的患者缓解率约50%,尿蛋白>8 g/24 h的患者缓解率仅为7.7%。相反,Gao等[5]的研究结果显示,标准剂量RTX在尿蛋白4~8 g/24 h、8~12 g/24 h的PMN患者缓解率分别为67.9%、52.4%。因此,对于尿蛋白>8 g/24 h的患者,建议采用标准剂量RTX,并根据患者尿蛋白缓解情况追加RTX。
多因素分析结果显示,抗PLA2R抗体是疾病缓解的独立相关因素。既往研究也表明,抗PLA2R抗体水平与尿蛋白相关[14],抗体水平越高,患者病情越重[15],对治疗反应也越差。笔者考虑对此类患者也应加大RTX剂量,并定期监测抗PLA2R抗体水平,必要时可追加RTX治疗。目前关于RTX在基线eGFR较低的PMN患者中的疗效研究较少,本研究显示,小剂量RTX在此类患者中疗效欠佳。因此,随访过程中应严密监测患者的临床及生化指标,必要时改变治疗方案以免延误病情。
有研究显示RTX作为PMN患者的初始治疗方案效果优于二线治疗者(88.2%比47.1%,P=0.009)[5],而本研究结果显示,在随访第24个月时低剂量RTX作为初始治疗方案缓解率为11/14,二线治疗组缓解率为50%(13/26)。虽然二线治疗组缓解率有低于初始治疗组的趋势,但两组相比差异无统计学意义(P=0.101)。因此,应加大样本量后再进行分析。
文献报道RTX治疗PMN的复发率在5%~30%,复发时间为7~116个月(中位时间42个月)[11, 12]。本研究随访24个月时,有2例患者复发,总体复发率为5%,与以上研究相符。复发患者尿蛋白均>8 g/24 h,其中1例属于高水平基线抗PLA2R抗体,另1例基线抗PLA2R抗体<14 RU/ml。因此,笔者认为,对于抗PLA2R抗体阳性的PMN患者在缓解后应动态监测该抗体水平变化,对于抗PLA2R抗体阴性的PMN患者缓解后应监测CD19+B细胞数及24 h尿蛋白情况,以警惕疾病复发,并根据情况重复输注RTX。
本研究存在一些不足之处。首先,入选例数较少,且为单中心研究,可能存在一定偏倚,在后续工作中需扩大样本量,延长随访时间,以进一步观察低剂量RTX的长期疗效及复发情况。其次,受限于研究条件,未能纳入糖皮质激素加环磷酰胺治疗组及RTX标准治疗组进行对照,有待日后补充。
综上所述,本研究通过对低剂量RTX治疗的PMN患者进行24个月随访观察发现,该方案疗效肯定,复发率低,尤其适用于基线尿蛋白<8 g/24 h、抗PLA2R抗体<150 RU/ml及eGFR≥60 ml·min-1·(1.73 m2)-1的非重症患者,这一结果有待日后大样本前瞻性研究验证。后期本课题组会继续延长观察时间,并与传统糖皮质激素加环磷酰胺及RTX标准剂量治疗方案相比较,进一步明确PMN患者采用小剂量RTX治疗方案的长远获益及复发情况。
所有作者均声明不存在利益冲突



























