
2型炎症是以Th2细胞、2型固有淋巴样细胞及相关细胞因子为主所介导的炎症。2型炎症性疾病涉及多个领域,病种繁多,且常见多种2型炎症性疾病共存的情况,给患者带来沉重负担,但目前基础和临床研究工作对于2型炎症及相关疾病的发病机制仍存在跨领域认知的空白。近年来新兴的靶向治疗已成为2型炎症性疾病有效的治疗手段。本共识阐述了2型炎症及相关疾病的机制,总结了近年来针对2型炎症性疾病靶向治疗的临床研究成果,期望能为临床医生认识和治疗2型炎症性疾病提供参考依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着现代医学对免疫系统认识的深入,2型免疫应答及2型炎症反应(简称2型炎症)机制被不断深入挖掘,相关免疫细胞及细胞因子之间的相互作用更加明确。该类反应具有对多种过敏原敏感,应答迅速,且分布于多种屏障组织等特点。目前,2型炎症已被认为是多种疾病的免疫病理机制,这些疾病涉及皮肤、呼吸、消化等多个系统。由于2型炎症这一共同的内在机制,导致患者常合并多种2型炎症性疾病,在医院不同科室间寻求治疗,这无疑给患者造成了严重的疾病负担,也给这些疾病的精确诊治带来严峻挑战。此外,2型炎症靶向治疗的理念不断成熟,越来越多的靶向药物研发成功并投入临床应用,取得了良好的治疗效果。但截至目前,国内外并无有关2型炎症性疾病与其靶向治疗的共识性文章。因此,为了填补基础研究和临床诊疗层面对于2型炎症及相关疾病发病机制和相关靶向治疗中跨领域认知的空白,本共识结合基础研究的最新进展,阐述2型炎症及其主要相关疾病的发病机制,并综合已经应用和正在研究中的2型炎症通路及靶向治疗的循证医学证据和专家观点,形成融合基础认识和临床证据的专家共识。
免疫应答是免疫系统识别及清除“非己”抗原性异物(外界入侵的病原体、过敏原、异物或自体异常的细胞等)的过程。根据免疫细胞种类及其对抗原性异物的识别特点和效应机制,分为固有免疫应答(又称非特异性/先天性免疫应答)和适应性免疫应答(又称特异性/获得性免疫应答)2类。前者先天即存在,通过模式识别受体或有限多样性抗原识别受体等直接识别“非己”抗原性异物的共有特定模式或表位分子而被激活产生应答,具有发生时相早、反应迅速的特点;后者需通过抗原提呈,经T、B细胞特异性识别后介导相应的免疫应答,再根据应答机制不同,又可分为细胞免疫(T细胞介导)和体液免疫(B细胞介导)。
1.免疫应答的类型:近年来,基于对不同效应T细胞以及固有淋巴样细胞(innate lymphoid cell,ILC)的新认识,可将固有免疫和适应性免疫归纳为3种主要的免疫效应类型,即1、2、3型。其中参与1型免疫应答的细胞主要由T-bet+CD4+1型辅助性T细胞1(Th1)、ILC1、自然杀伤细胞(NK)和CD8+1型细胞毒性T细胞(Tc1)组成,产生并释放干扰素-γ(IFN-γ),进而通过激活单核/巨噬细胞帮助机体抵御微生物;2型免疫应答主要由GATA-3+Th2和2型天然淋巴细胞(ILC2)以及Tc2细胞组成,此类细胞均可产生白细胞介素(IL)-4、IL-5和IL-13等2型细胞因子,这些细胞因子一方面能诱导肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞(EOS)活化,另一方面也能促使B细胞产生免疫球蛋白E(IgE),生理状态下用以抵御寄生虫感染;3型免疫应答主要由RORγt+Th17细胞和ILC3介导,它们主要通过分泌IL-17和(或)IL-22,募集中性粒细胞并诱导上皮细胞抵御微生物的侵袭,从而防止细胞外细菌和真菌入侵。1型和3型免疫应答过强则可诱导自身免疫性疾病,而过度的2型免疫应答可引起过敏性疾病[1]。
2.2型免疫应答的两条途径:2型免疫应答的特点为启动快,高效性,其刺激源极为广泛,从纳米级的抗原分子至肉眼可见的寄生虫及多种理化因素均可诱发2型免疫应答及其炎症反应,而且包含固有免疫和适应性免疫之间交互应答[2]。一方面,属于经典抗原提呈细胞(APC)之一的树突细胞(DC)可加工、提呈抗原给CD4+初始T细胞并使之活化。CD4+初始T细胞可分化为高表达GATA-3的Th2细胞,继而分泌相关细胞因子以参与免疫应答炎症反应的形成[2]。另一方面,ILC2是启动2型免疫应答的早期效应细胞[3, 4]。其机制为:在过敏原及其他因素刺激机体并破坏机体内稳态时——在传统认知的经典2型免疫应答发生之前,ILC2已经能感知该区域内多种细胞所释放的细胞因子[5, 6],从而开始分泌2型细胞因子(如IL-5、IL-13等)。由Th2和ILC2细胞所产生并分泌的2型细胞因子,既可以促进Th2细胞的增殖,同时也能辅助体液免疫和固有免疫应答,参与2型炎症反应的形成[2](表1)。

Th2细胞及相关细胞因子的功能
Th2细胞及相关细胞因子的功能
| 功能 | 描述 | 作用环境 |
|---|---|---|
| 增殖和调节 | (1)辅助性T细胞2(Th2)细胞分泌白细胞介素(IL)-4能促进T细胞的成熟及辅助性T细胞的选择性增殖,并促进B细胞增殖和抗体的类别转换 (2)IL-4参与调节巨噬细胞、粒细胞及肥大细胞的固有免疫功能 | 胸腺区、外周免疫器官及相关淋巴组织 |
| 辅助体液免疫应答 | (1)Th2细胞表面表达CD40L与B细胞表面CD40结合,为后者提供活化的第二信号 (2)Th2细胞分泌的细胞因子群辅助B细胞的增殖和活化 | 外周免疫器官、B细胞区 |
| 诱导固有免疫细胞的活化 | Th2细胞所分泌IL-5、IL-9、IL-13等,可促进如嗜酸性粒细胞(EOS)的分化、发育、成熟,并可促进EOS及肥大细胞活化释放炎症介质;促进B细胞增殖和分化,引起2型炎症反应 | 组织 |
ILC2激活的信号主要来源于预警素(alarmin)家族中的IL-25、IL-33和胸腺基质淋巴细胞生成素(TSLP)[7],而上皮组织是这些预警素合成和分泌的重要部位之一,因此上皮组织是2型免疫应答的重要“前哨”。现已有证据证明肺泡Ⅱ型细胞是IL-33和TSLP的重要来源[8, 9],而在肠上皮中的簇状细胞(tuft cell)可能是IL-25的来源[10]。此外,在2型免疫应答的早期,多种细胞释放细胞因子及脂类介质,如上皮源性转化生长因子(TGF)[11]、前列腺素D2(PGD2)[12, 13, 14]、白三烯(LTs)等亦可活化ILC2[15, 16]。这些预警素样细胞因子也可促进Th2细胞的分化、发育及活化[8]。另一些研究中还发现ILC2应答与神经系统存在相关性。如目前已证实支配某些黏膜的神经元释放的神经介素U(NMU)通过与ILC2表面的NMU受体结合来调节ILC2的活性,促进2型免疫应答相关的细胞因子分泌,参与过敏性炎症及肠道寄生虫的免疫应答[17, 18, 19]。
2型免疫应答的慢性失衡可触发一系列炎症反应。一方面上皮源性预警素样细胞因子IL-25、IL-33和TSLP等不仅可以激活ILC2,也可参与调节CD4+T细胞分化成熟,从而诱导Th2细胞介导的适应性免疫应答[20]。Th2细胞迁移至上皮及上皮下层,与ILC2一起分泌多种2型细胞因子,如IL-4、IL-5、IL-13等[20],其中IL-4能够促进B细胞的成熟和分化,诱导产生免疫球蛋白的类别转换,当过敏原存在的情况下,最终使效应B细胞(浆细胞)分泌特异性IgE抗体。IgE通过其Fc段与肥大细胞、嗜碱性粒细胞表面的高亲和力受体(FcεRI)结合,使机体处于致敏状态。当致敏机体再次暴露在相应过敏原时,结合在致敏细胞表面的IgE可识别和结合相应过敏原,导致IgE-FcεRI复合物交联,促进肥大细胞、嗜碱性粒细胞活化和脱颗粒,分泌血管活性胺类(如组胺)、酶类、脂类分子(如PGD2、LTs)以及IL-5、IL-13等细胞因子参与炎症反应。其中,组胺和LTs能扩张局部毛细血管及微静脉使其通透性增加,从而导致局部组织的炎症反应,组胺和LTs还能促进炎性细胞的募集及增加黏液分泌。活化的肥大细胞还能分泌中性粒细胞及EOS趋化因子,加速此两种细胞向炎症发生部位的募集,进一步引发炎症反应。此外肥大细胞及嗜碱性粒细胞分泌的脂质分子如PGD2、LTs等,以及细胞因子(IL-4、IL-13等)也参与引发Ⅰ型超敏反应。另一方面,Th2和ILC2细胞分泌的IL-4、IL-5、IL-13等细胞因子也可激活肥大细胞、嗜碱性粒细胞及EOS使其发挥作用(图1)。
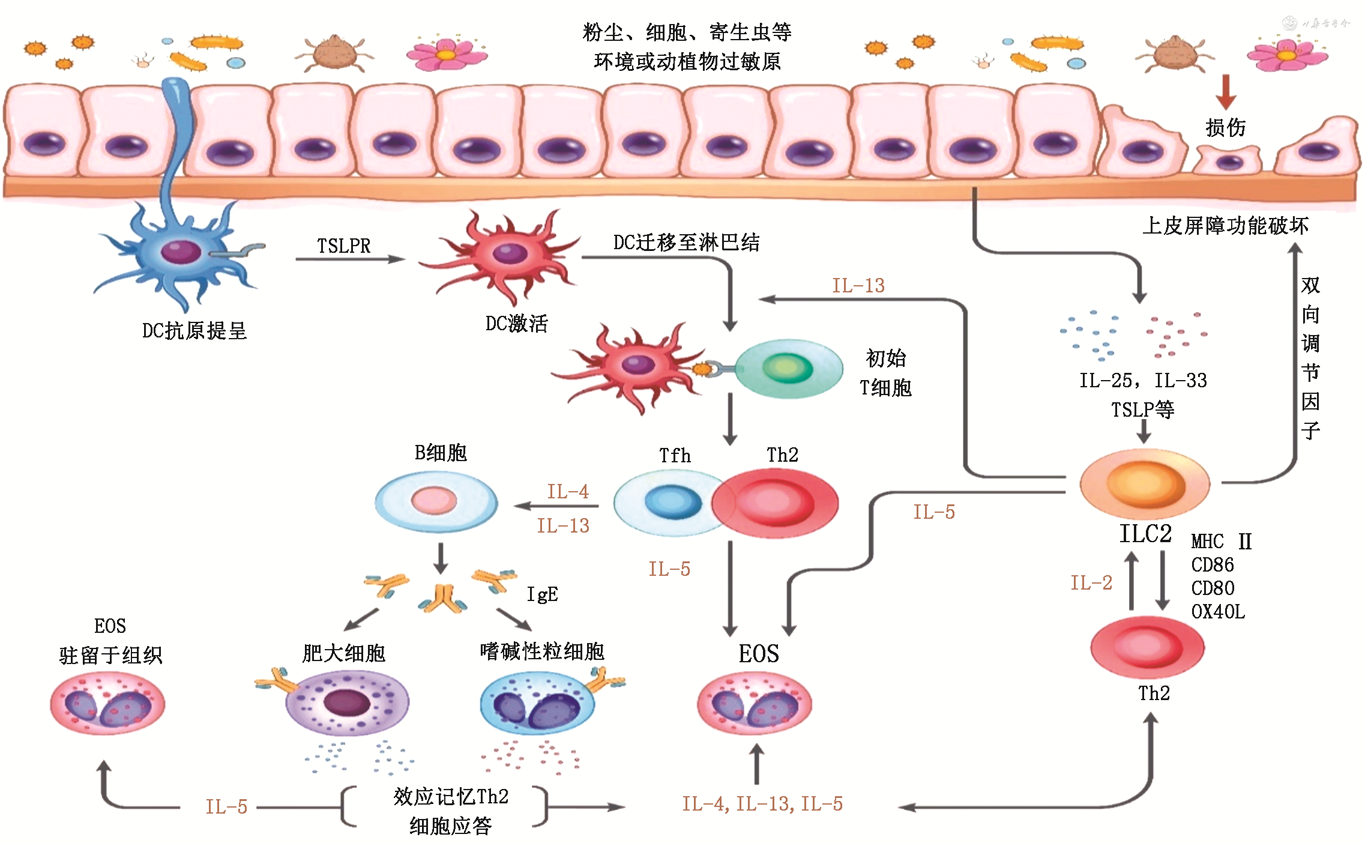

注:TSLPR为胸腺基质淋巴细胞生成素受体;Tfh为滤泡性辅助T细胞;MHC为主要组织相容性复合体;OX40L为OX40基因配体;CD86/80为白细胞表面分化抗原86/80;DC为树突细胞;Th2为辅助性T细胞2;EOS为嗜酸性粒细胞;ILC2为2型天然淋巴细胞
EOS募集及激活的方式不同于肥大细胞及嗜碱性粒细胞。2型细胞因子是其增殖、活化、趋化和延缓凋亡的重要物质,当受到过敏原刺激时,由肥大细胞、嗜碱性粒细胞和血管内皮细胞及ILC2所产生的趋化因子、局部血小板活化因子(platelet activating factor,PAF)及IL-5等细胞因子的作用下,EOS被募集至炎症反应区域并活化。EOS脱颗粒后分泌的碱性蛋白、阳离子蛋白和过氧化物酶参与过敏的免疫反应应答。此外,EOS亦可以分泌炎症介质如LTs、PAF以及IL-3、IL-5等细胞因子参与过敏性炎症反应。
此外,2型炎症的特征性细胞及细胞因子在所涉组织中分布不均,如在支气管黏膜中,IL-4、IL-5呈高度表达,而其基底膜增厚和杯状细胞增生提示IL-13的活性增加,在血液中则可检测到IgE,而EOS常聚集于黏膜下和痰液中[21]。
推荐意见1∶2型炎症是以Th2细胞、ILC2细胞及相关细胞因子为主所介导的炎症。
推荐意见2∶2型炎症的免疫学机制简单概括如下:以机体所暴露在不同环境或动植物过敏原为触发点,通过DC等抗原提呈细胞,使初始T细胞分化为Th2细胞并分泌2型细胞因子;或通过促进上皮细胞分泌预警素,活化ILC2细胞产生2型细胞因子。这些细胞因子可激活相关免疫细胞分泌炎性介质及趋化因子,最终形成2型炎症反应。
推荐意见3∶2型炎症性疾病是2型免疫应答过强所导致的一类炎症性疾病,在受累组织/器官中具有以下免疫病理学特征:
1. 2型免疫细胞(Th2和ILC2细胞等)增多,相关细胞因子(IL-4、IL-5、IL-13、IL-25、IL-31、IL-33、TSLP等)表达增高。
2.效应细胞活化增殖(如B细胞活化成浆细胞)或被募集活化(如肥大细胞、嗜碱性粒细胞及EOS)。
3.可伴有总IgE和(或)特异性IgE增加。
4.表现为局部受累器官微循环扩张,通透性增加,渗出增多,相关细胞浸润等炎症反应。
推荐意见4:以下疾病为常见的2型炎症性疾病(表2)。

常见的2型炎症性疾病的相关证据和研究治疗靶点
常见的2型炎症性疾病的相关证据和研究治疗靶点
| 系统 | 疾病 | 2型炎症相关性的部分证据 | 现有研究的治疗靶点 |
|---|---|---|---|
| 皮肤 | 特应性皮炎 | 辅助性T细胞2(Th2)亚群比例增高并伴有细胞因子白细胞介素(IL)-4、IL-5和IL-13的产生[36] | IL-4受体α(IL-4Rα),IL-13,IL-31Rα、胸腺基质淋巴细胞生成素(TSLP)等 |
| 慢性自发性荨麻疹 | 肥大细胞作为发病的关键效应细胞。其脱颗粒后分泌IL-2、3、5、13等多种细胞因子[22] | IgE,IL-4 Rα | |
| 结节性痒疹 | Th2细胞分泌的IL-31、IL-4、IL-17和IL-22等上调,加重瘙痒和皮肤损害[23] | IL-4Rα,IL-31Rα | |
| 大疱性类天疱疮 | 患者体内针对BP180抗体的反应性T细胞产生2型细胞因子(IL-4、IL-5、IL-6、IL-10和IL-13),诱导Th2细胞依赖性自身抗体IgG4亚型产生[24] | IL-4Rα,IgE | |
| 上呼吸道 | 慢性鼻窦炎伴或不伴鼻息肉 | IL-4和IL-13与编码黏蛋白生成的基因表达相关。黏液生成增加诱导局部组织缺氧,继续加重局部炎症反应[25] | IL-4Rα,IgE,IL-5等 |
| 过敏性鼻炎 | 过敏性鼻炎的早发、迟发相反应均与2型炎症相关,均有IL-4、IL-5、IL-13的参与[26, 27] | IL-4Rα,IgE等 | |
| 下呼吸道 | 哮喘 | Th2和2型天然淋巴细胞分泌关键的2型细胞因子IL-4、IL-5和IL-13,引发上皮屏障的破坏和通透性增加,嗜酸性粒细胞(EOS)浸润、IgE产生增高及呼出气一氧化氮(FeNO)产生增加[28] | IL-4Rα,IgE,IL-5/5R,IL-33,TSLP等 |
| 过敏性支气管肺曲霉菌病 | 曲霉菌被哮喘及囊性纤维化患者吸入后,T淋巴细胞被激活,致敏的CD4+Th2 细胞介导炎症反应,释放IL-4、IL-5及IL-13,并分泌IgE、IgG抗体,作用于肥大细胞、EOS及肺泡巨噬细胞等[29] | IL-4Rα,IgE,IL5/5R | |
| 慢性阻塞性肺疾病 | 慢性阻塞性肺疾病患者中存在EOS增高及2型炎症表现为主的临床表型[30] | IL-5、IL-4Rα、IL-33 | |
| 嗜酸性肉芽肿性多血管炎 | IL-5通过活化EOS使其释放细胞毒性蛋白颗粒和脂质介质发挥促炎作用,引起组织损伤。激活的EOS通过释放细胞毒性颗粒蛋白和脂质介质发挥促炎作用,从而导致组织炎症损伤 | IL-5[31] | |
| 消化道 | 食物过敏 | 存在IgE介导的Ⅰ型超敏反应;Th2细胞驱动的反应,被认为是其炎症反应的主要驱动因素[32] | IL-4Rα,IgE,IL-33等 |
| 嗜酸性粒细胞性食管炎 | 抗原蛋白经抗原提呈细胞(APC)刺激后,食管上皮细胞产生IL-5、IL-13,参与EOS的成熟和迁移[33] | IL-4Rα |
除以上疾病外,2型炎症性疾病还包括过敏性结膜炎及部分EOS增多性疾病,如EOS增多性皮炎、EOS胃肠炎[34]、EOS肺部浸润等。而一部分药物过敏和严重过敏反应(anaphylaxis)也被认为有2型炎症的参与[35]。
1.AD的临床体征与诊断:AD是一种慢性、复发性、炎症性皮肤病。由于患者常合并过敏性鼻炎(AR)、过敏性结膜炎、哮喘等,故被认为是一种系统性疾病。
AD的临床体征取决于年龄、疾病阶段、种族和环境。患者多有皮肤干燥,典型的皮损表现为湿疹样改变,急性期可表现为弥漫的红斑、丘疱疹伴渗出结痂,慢性期常表现为红斑、斑块伴苔藓样变。瘙痒是AD的重要标志,且瘙痒的程度大致与疾病的严重程度相对应。2型炎症反应参与了AD发病的整个过程。
AD的临床诊断基于皮肤病变的形态特征、分布、相关临床症状以及特征性病史。目前国际常用的诊断标准包括Hanifin-Rajka标准和Williams标准;张建中等提出中国AD青少年和成人诊断标准,其敏感性高于Hanifin-Rajka标准和Williams标准;姚志荣等提出的中国儿童AD诊断标准。AD严重程度的评价方法较多,常用的有AD评估指数(SCORAD)评分、湿疹面积和严重程度指数(EASI)评分、研究者整体评分法(IGA)、瘙痒程度视觉模拟评分(VAS)、峰值瘙痒数字评价量表(NRS)、体表面积(BSA)评估、患者湿疹自我检查评分量表(POEM)等。根据SCORAD评分,可将病情分为轻度(SCORAD:0~24分)、中度(SCORAD:25~50分)、重度(SCORAD:>50分)。
2.2型炎症在AD发病机制中的作用:AD的发病是由遗传和环境因素之间的相互作用所致。皮肤屏障功能障碍、免疫异常、皮肤菌群紊乱等因素是本病发病的重要环节。2型炎症反应是AD免疫异常的基本特征,且与其他致病环节相互作用(图2)。聚丝蛋白(filaggrin)缺乏(遗传因素)导致的皮肤屏障破坏可引起金黄色葡萄球菌等微生物定植,进一步破坏皮肤屏障,促进炎症细胞和T细胞浸润;局部Th2细胞免疫反应会进一步削弱皮肤屏障功能。
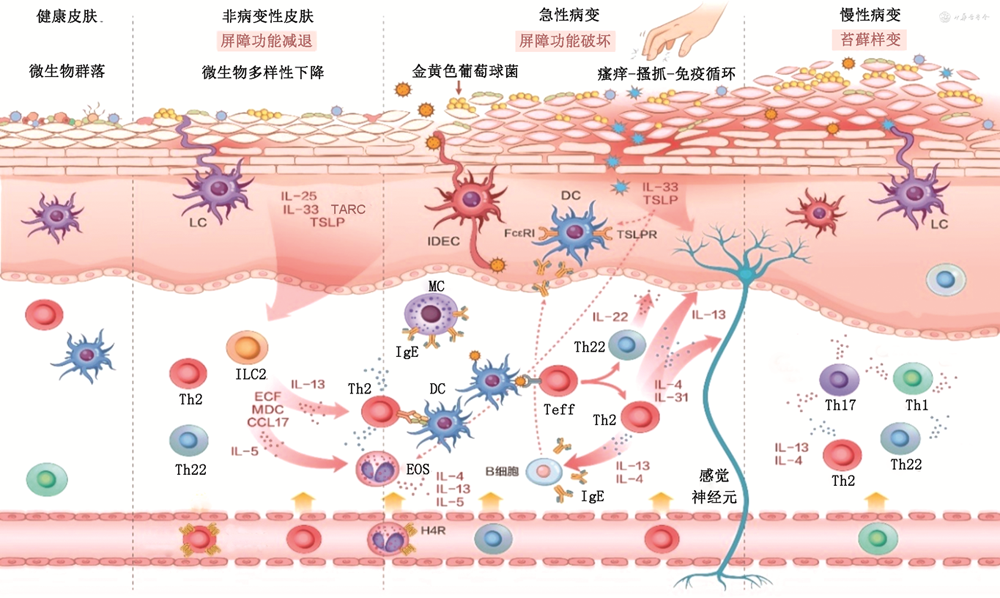

注:LC为朗格汉斯细胞(专职皮肤抗原提呈细胞);IDEC为炎症性树突状表皮细胞;Teff为效应T细胞;H4R为组胺H4受体;ECF为嗜酸性粒细胞(EOS)趋化因子;MDC为巨噬细胞来源趋化因子;TARC为胸腺活化调节趋化因子;IL为白细胞介素;DC为树突细胞;Th为辅助性T细胞;MC为单核细胞
AD免疫调节的异常始于固有免疫系统,由表皮屏障、免疫细胞、细胞因子、模式识别受体(PRR)、抗菌肽(AMP)和皮肤微生物组成,是人体的第一道防线,负责对外界致病因素进行快速和非特异性的保护[36]。表皮屏障的破坏、DC和ILC等的激活引起AD的2型炎症反应,包括来自ILC2的IL-5和IL-13,来自嗜碱性粒细胞的IL-4,以及来自上皮细胞的IL-25、IL-33和TSLP。这些因素引起了Th2细胞细胞募集并激活Th2介导的免疫反应[37]。
其中,TSLP通过其受体(TSLPR)激活未成熟DC,促进APC的成熟。此外,TSLP还能促进EOS的活性和趋化性,增强IL-4、IL-5和IL-13的表达。IL-25诱导多种趋化因子的表达,如EOS趋化因子(ECF)、胸腺活化调节趋化因子(TARC:即CCL17)和巨噬细胞来源趋化因子(MDC),它们是EOS和Th2细胞募集所必需的。IL-33通过受体激活活化B细胞的核因子κ-轻链增强子(NF-κB)和丝裂原活化蛋白激酶(MAPK),刺激Th2细胞反应相关细胞因子的产生,如IL-4、IL-5和IL-13。
这些细胞因子会导致炎症、瘙痒,并通过STAT通路促使B淋巴细胞产生特异性IgE抗体,免疫球蛋白与皮肤DC上的FcεRI结合,增强免疫反应和皮肤炎症,进一步加重皮肤屏障的破坏。
AD的2型免疫不仅导致了炎症反应,也导致了瘙痒的发生。由于皮肤屏障损伤,使粉尘、细菌、寄生虫等环境或动植物致敏物质更容易刺激皮肤,进而激活免疫,产生瘙痒-抓挠-免疫循环。AD的主要症状是慢性瘙痒,是基于角质形成细胞、肥大细胞、T细胞、EOS和皮肤中的神经纤维释放的致痒原(pruritogens)之间相互作用产生的结果。这些致痒原包括Th2细胞因子(尤其是IL-4、IL-13、IL-31)、TSLP、IL-33、组胺、蛋白酶和神经肽等,它们会与皮肤中部分感觉神经相结合。
人类感觉神经元上存在IL-4Rα和IL-13Rα1,IL-13和IL-4都与由IL-4Rα链和IL-13Rα1链组成的Ⅱ型受体结合,直接刺激神经元引起瘙痒。IL-4的另一个作用是通过使神经元对其他刺激敏感而进一步增加瘙痒。TSLP和IL-33可直接刺激TRPA1+感觉神经元,产生瘙痒、灼痛等不适。主要由肥大细胞和嗜碱性粒细胞释放的组胺,能够刺激神经元中组胺H1和H4受体和TRPV1通道,但目前尚无有力证据表明抗组胺药能有效改善AD的瘙痒。此外,免疫细胞及感觉神经元上的Mas相关G蛋白偶联受体(Mrgprs)和蛋白酶激活受体-2(PAR-2),也在一定程度上参与AD相关的炎症和非组胺依赖性的慢性瘙痒[38]。
AD存在“瘙痒-搔抓-免疫循环”,搔抓会损伤表皮角质形成细胞,导致炎症细胞因子的释放,直接和间接激活2型免疫应答,后者又反过来刺激角质形成细胞和免疫系统细胞的瘙痒细胞因子的释放,与感觉神经的重新结合触发了继续抓挠的冲动,形成恶性循环。
3.AD的靶向治疗:AD的治疗方案包括患者教育、避免环境致敏因素、恢复皮肤屏障功能、控制瘙痒、局部治疗、系统治疗、光疗、抗感染治疗等[39]。AD的治疗方案根据疾病的年龄、疾病的临床阶段、严重程度评估进行选择。中外指南均建议根据轻中重度病情不同,采取阶梯治疗方案。一般的治疗措施有使用润肤剂、避免诱发因素及感染。对于轻度患者,首先推荐基础皮肤护理,根据皮损状态采用外用药物治疗;对于中重度慢性期、苔藓化皮损,在外用治疗基础上可应用紫外线光疗,但应注意其适用范围。重度患者可以系统用免疫抑制剂或短期用糖皮质激素(TCS)(控制急性严重难治性皮损)和(或)度普利尤单抗(dupilumab)等。但在目前接受系统性免疫抑制剂治疗的患者中,仍有部分患者无法控制病情,或因不良反应无法耐受长期治疗。
尽管研究显示多条免疫途径参与AD发生,但2型免疫反应的过度激活被认为是主要机制。目前,针对2型炎症反应的靶向治疗已取得了很大进展,如单克隆IL-4、IL-13、IL-22和IL-31受体抗体、磷酸二酯酶-4(PDE4)抑制剂和JAK抑制剂等。目前美国食品药品管理局(FDA)已批准用于AD治疗的生物制剂分别是度普利尤单抗和曲罗芦单抗(tralokinumab)。另外两类是小分子药物,分别为JAK抑制剂和PDE4抑制剂。
度普利尤单抗是IL-4受体α亚基的全人源单克隆抗体(IgG4型),能够抑制IL-4/IL-13信号传导,是我国首个批准上市治疗中重度AD的生物制剂。曲罗芦单抗是一种全人源IgG4单克隆抗体,与IL-13高亲和力特异性结合,于2021年先后被欧盟和美国批准用于外用药控制不佳或不建议使用外用药的中重度成人AD。
JAK-STAT是一条细胞内信号通路,多种炎症性皮肤病是由依赖JAK-STAT信号通路的炎症介质(如IL、IFN等)驱动的。因此,普遍认为JAK抑制剂可通过调节免疫功能治疗免疫性疾病。小分子药物JAK抑制剂托法替尼(tofacitinib)、巴瑞替尼(baricitinib)、阿布昔替尼(abrocitinib)和乌帕替尼(upadacitinib)等正被研究用于治疗AD。其中乌帕替尼和阿布昔替尼分别于2022年2月和4月在我国获批,用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜采用上述治疗的难治性、中重度AD患者。其中,乌帕替尼被批准用于成人和12岁及以上青少年,阿布昔替尼被批准用于成人患者。目前国内外已获批适应证的针对2型炎症为靶点的生物制剂和小分子药物主要临床试验总结见表3。

国内外已获批中重度特应性皮炎(AD)适应证的生物制剂和小分子药物的部分研究a
国内外已获批中重度特应性皮炎(AD)适应证的生物制剂和小分子药物的部分研究a
| 靶点及药物 | 研究描述 | 主要研究结果 |
|---|---|---|
IL-4/13 度普利尤单抗 | SOLO1&2[40],一项针对中重度成人AD 的Ⅲ期研究,治疗16周,n=1 379 | 与安慰剂相比,度普利尤单抗q2w IGA 0/1应答率更高(SOLO1 38% 与10%;SOLO2 36% 与8%);严重程度指数(EASI)-75应答率更高(SOLO1 51% 与15%;SOLO2 44% 与12%) |
| LIBERTY AD PEDS[41],一项针对12~18岁中重度AD的Ⅲ期临床研究,治疗16周,n=251 | 与安慰剂相比,度普利尤单抗EASI-75 应答率更高(q2w 41.5%,q4w 38.1% 与 8.2%) | |
| LIBERTY AD PEDS[42],一项针对6~11岁中重度AD的Ⅲ期临床研究,治疗16周,n=367 | 与安慰剂+TCS 相比,度普利尤单抗q4w+TCS 组IGA 0/1率更高(32.8% 与 11.4%);EASI-75应答率更高(69.7% 与26.8%) | |
| LIBERTY AD PRESCHOOL[43],一项针对6个月至6岁中重度AD的Ⅲ期临床研究,治疗16周,n=157 | 与安慰剂相比,度普利尤单抗IGA 0/1应答率更高(27.7% 与 3.9%);EASI-75应答率更高(53.0% 与10.7%) | |
IL-13 曲罗芦单抗 | ECZTRA 1&2[44],一项针对中重度成人AD的Ⅲ期临床研究,治疗16周,n=1 596 | 与安慰剂相比,曲罗芦单抗 IGA 0/1应答率更高(ECZTRA1 15.8%与7.1%,ECZTRA2 22.2%与10.9%);EASI-75应答率更高(ECZTRA1 25.0%与12.7%,ECZTRA2 33.2% 与11.4%) |
| ECZTRA 3[45],一项针对中重度成人AD的双盲、随机、安慰剂对照研究,联合TCS治疗16周,n=380 | 与安慰剂相比,曲罗芦单抗 IGA 0/1应答率更高(38.9% 与26.2%);EASI-75应答率更高(56.0% 与35.7%) | |
JAK1 乌帕替尼 | Measure Up 1&2[46],一项针对≥12岁青少年和成人中重度AD的Ⅲ期临床研究,治疗16周,n=1 683 | 与安慰剂相比,乌帕替尼15 mg EASI-75 应答率更高(Measure Up 1 70% 与16%,Measure Up 260.0% 与13.0%) |
| AD Up[47]一项针对≥12岁青少年和成人中重度AD的Ⅲ期临床研究,联合TCS治疗16周,n=901 | 与安慰剂+TCS相比,乌帕替尼15 mg+TCS EASI-75 应答率更高(65% 与26%) | |
JAK1 阿布昔替尼 | JADE MONO-1[48],一项针对≥12岁青少年和成人中重度AD的Ⅲ期临床研究,治疗12周,n=156 | 与安慰剂相比,阿布昔替尼100 mg IGA0/1 应答率更高(24.0% 与 8.0%);EASI-75应答率更高(40% 与12%) |
| JADE TEEN[49],一项针对12~17岁中重度AD的Ⅲ期临床研究,治疗12周,n=285 | 与安慰剂相比,阿布昔替尼100 mg IGA 0/1 应答率更高(41.6% 与24.5%);EASI-75应答率更高(68.5% 与41.5%) |
注:q2w为每2周用药1次;q4w为每4周用药1次;a获批信息参考自美国食品药品监督管理局、欧盟药品管理局以及中国药品监督管理局,截至2022年5月;IGA为整体评分法;TCS为糖皮质激素
此外,一些针对其他靶点的生物制剂仍在研究中。
Lebrikizumab是一种抗IL-13单克隆抗体,与可溶性IL-13高亲和力结合。在Ⅱb期临床试验中,lebrikizumab组在主要终点第16周的EASI显示出显著的剂量依赖性降低:每4周125 mg,-62.3%;每4周250 mg,-69.2%;每2周250 mg,-72.1%;安慰剂,-41.1%[50]。
Nemolizumab是一种针对神经元表面IL-31Rα的单克隆抗体。在Ⅲ期研究中,第16周时,nemolizumab组VAS平均下降42.8%,显著高于安慰剂组的21.4%[51]。Nemolizumab显示出对AD患者的瘙痒有显著的益处,但对皮肤炎症只有很少或几乎没有疗效。
GBR 830(ISB 830)是一种可特异性抑制OX40的单克隆抗体。一项已完成的Ⅱa期研究显示,在第71天,GBR 830组达到EASI 50的患者比例(76.9%)明显高于安慰剂组(37.5%)[52]。KHK4083/AMG 451是一种非耗竭性抗OX40配体的单克隆抗体,Ⅱ期研究结果也显示出显著疗效。
Fezakinumab是针对IL-22的单克隆抗体。Ⅱa期显示,12周时,fezakinumab组SCORAD评分相比基线的平均降幅大于安慰剂组(13.8分 与 8分),20周时为18.8分 与11.7分[53]。
Etokimab(ANB020)是一种特异性地抑制IL-33的单克隆抗体。在Ⅱa期试验中,在第29天,83%的患者达到EASI 50,外周EOS减少[54]。然而,另一项Ⅱb期临床试验(NCT03533751),初步分析显示未达到主要终点,但这项试验仍在进行中。
Tezepelumab是一种抗TSLP单克隆抗体。在Ⅱa期试验中,虽然接受tezepelumab联合TCS治疗的患者达到EASI 50的比例更高,但与安慰剂相比差异无统计学意义(64.7%比48.2%;P=0.091)[55]。而Ⅱb期试验(NCT03809663)已经终止。
1.哮喘的临床体征与流行病学:哮喘是一种以慢性气道炎症及气道高反应性(AHR)为特征的异质性疾病,气道上皮炎性细胞浸润-气道重塑是其特征性病理学表现。从临床角度看,反复发作性、可逆性气流受限引起的喘息、胸闷、气短和咳嗽等症状是其标志性的临床表现。
哮喘是全球最常见的慢性呼吸道疾病之一。2012—2015年“中国肺健康研究”调查显示,我国20岁及以上的成年人的哮喘患病率为4.2%,这些哮喘患者中的26.2%已经存在气流受限[56]。国外的调查研究反映出哮喘的控制情况同样不甚理想。2012年一项欧洲11个国家8 000例哮喘患者的问卷调查统计结果显示,按照全球哮喘防治倡议组织(GINA)指南评估标准,45.1%的哮喘患者未达到控制[57]。而在2022年发布的中国C-Biopred重症哮喘登记研究中显示,中-重度哮喘的比例为3.4%~8.3%,按照诱导痰中EOS≥2.5%为EOS型哮喘的标准,我国重度哮喘中EOS型哮喘高达78.6%[58]。
由于2型免疫应答及其炎症机制的特性,2型炎症性疾病常存在共病的情况。对哮喘而言,儿童期发病(早发性)的哮喘患者同质性相对较高,常常有明确的过敏史和哮喘家族史。成年期发病(迟发性)的哮喘患者临床表型构成多样,异质性更高。部分成年期发病的重度哮喘患者需使用全身性糖皮质激素来维持哮喘控制。
控制不佳的哮喘患者往往存在肺功能受损,血液和支气管肺泡灌洗液中持续存在EOS的增多,以及存在更多的共存疾病,如慢性鼻窦炎(CRS)、反复呼吸道感染、肥胖、阻塞性睡眠呼吸暂停及心理-社会问题。
既往对哮喘的类别划分或从达到哮喘控制所采用的治疗级别入手,分为轻-中-重度哮喘;或根据疾病的发展和转归分为急性发作期-慢性持续期-临床控制期[59]。随着认识的深入,2型炎症和哮喘发生发展表现出密切关联。自2019年开始GINA指南便以2型炎症对哮喘发病进行分类(表4)[60],分为2型/非2型哮喘。研究结果表明,轻度及中度哮喘患者中有50%~70%是2型免疫反应异常引起的[61, 62],而一项关于用IL-13刺激支气管上皮基因表达的研究中发现2型哮喘炎症患者占比约50%[63]。另外一项中国单中心住院后缓解期的重度哮喘患者的研究发现有38.5%的患者是以EOS为主要气道炎症类型[64],但在C-Biopred研究中发现EOS表型占78.6%,较国外研究队列更高[58]。
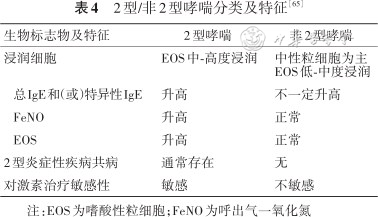
2型/非2型哮喘分类及特征[65]
2型/非2型哮喘分类及特征[65]
| 生物标志物及特征 | 2型哮喘 | 非2型哮喘 | |
|---|---|---|---|
| 浸润细胞 | EOS中-高度浸润 | 中性粒细胞为主 EOS低-中度浸润 | |
| 总IgE和(或)特异性IgE | 升高 | 不一定升高 | |
| FeNO | 升高 | 正常 | |
| EOS | 升高 | 正常 | |
| 2型炎症性疾病共病 | 通常存在 | 无 | |
| 对激素治疗敏感性 | 敏感 | 不敏感 | |
注:EOS为嗜酸性粒细胞;FeNO为呼出气一氧化氮
2.2型炎症在哮喘发病机制中的作用:大部分哮喘的免疫-炎症机制主要为2型免疫应答机制诱发的炎症反应,即哮喘的2型炎症以气道上皮为主要发生部位,由Th2及ILC2细胞共同驱动(图3)。以过敏性气道炎症为例,当过敏原再次入侵时,上述反应会因这种记忆机制被快速地激活,表现为哮喘反复发作的状态。
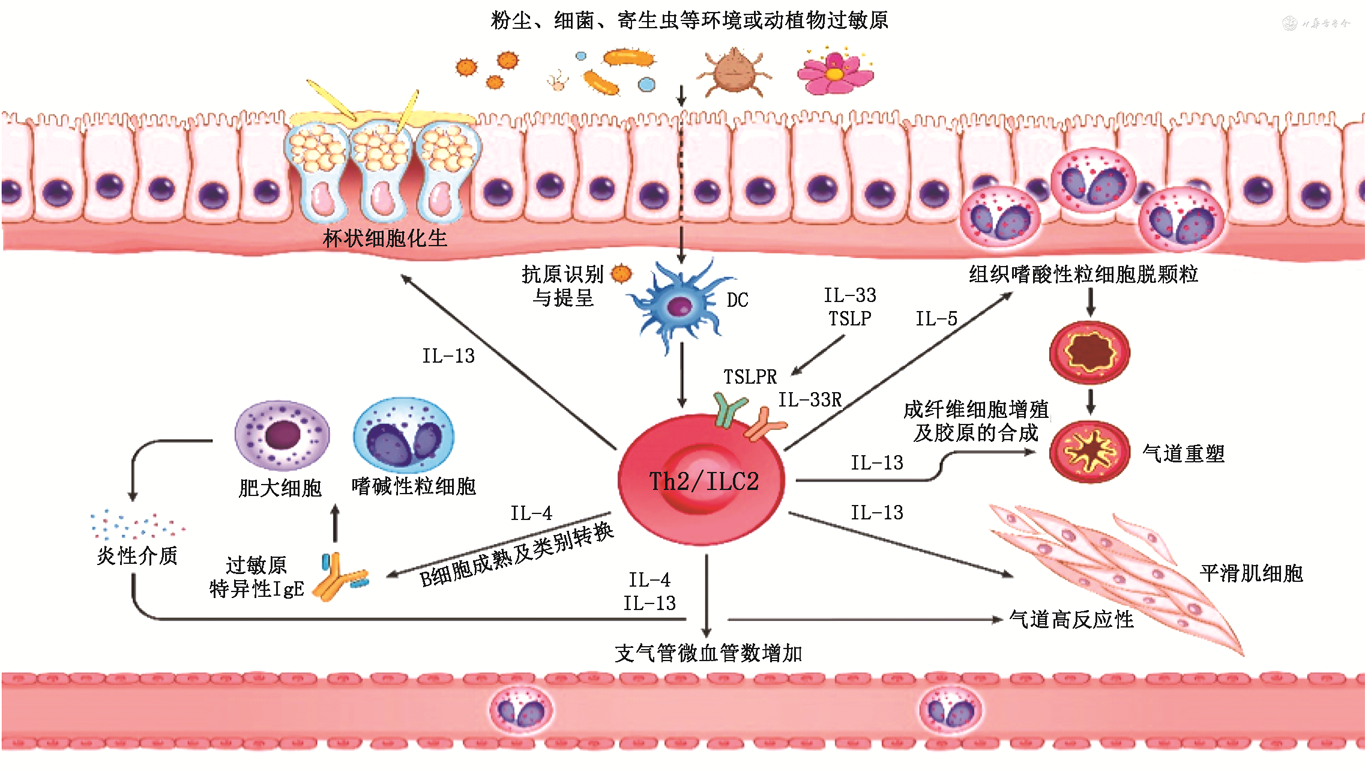

注:IL为白细胞介素;ILC2为2型天然淋巴细胞;TSLPR为胸腺基质淋巴细胞生成素受体;DC为树突细胞;Th为辅助性T细胞
(1)上皮屏障功能障碍:这是2型炎症性气道疾病的共有病理生理学特征。气道上皮屏障的破坏使环境因子(细菌、病毒、真菌、污染物及过敏原等)更易通过上皮组织引发免疫应答,在环境因素刺激下,受到损伤的上皮细胞释放TSLP、IL-25和IL-33等预警素样细胞因子[20,66]。这些细胞因子一方面可以募集DC提呈抗原,再与DC共同作用激活T淋巴细胞,诱导T淋巴细胞分化为Th2细胞;另一方面,也可作为EOS和中性粒细胞的趋化因子直接发挥作用;同时预警素样细胞因子也能激活ILC2,Th2和ILC2细胞进一步分泌关键的2型细胞因子IL-4、IL-5和IL-13。这些2型细胞因子还会继续引发上皮屏障的破坏和血管通透性增加[67];ILC2分泌的IL-13还能刺激上皮细胞分泌IL-33,形成2型炎症的正反馈循环[68]。在相关研究中:支气管上皮细胞体外暴露于IL-4和IL-13后,以JAK依赖的方式严重损害气道上皮细胞连接复合体的结构和功能,表明2型细胞因子依赖的屏障破坏可能是过敏性哮喘的屏障功能缺陷的基础[67]。
(2)黏液腺高分泌:慢性气道炎症使Th2细胞、ILC2及EOS在气道上皮下聚集并分泌2型细胞因子,促使杯状细胞增生,进而导致表面上皮黏蛋白分泌增多,一项小鼠模型研究表明:IL-13信号能对杯状细胞计数造成影响[69]。这些病理生理机制最终表现为杯状细胞化生和支气管微血管数增加,这种表现既参与气道重塑,也是黏液功能障碍的易感因素。
(3)平滑肌功能改变:IL-13在改变气道平滑肌功能上发挥重要作用。气道平滑肌细胞可表达的CD4+T细胞的细胞因子受体可与IL-13结合,产生的效应为平滑肌收缩和舒张运动,平滑肌细胞增殖,分泌、活化、调节趋化因子等。
(4)气道重塑:气道重塑是一个统称,代表哮喘患者气道上皮和黏膜下层发生的多种病理变化,并导致气道的永久性结构改变[70]。除黏液分泌机制参与气道重塑外,还有研究表明IL-13诱导成纤维细胞增殖并促进胶原的合成[20],进而促进气道纤维化过程。此外,EOS在浸润气道组织后,也能分泌大量促气道纤维化的相关分子,如EOS阳离子蛋白(ECP)等,参与气道重塑[71]。
(5)EOS活化和增殖:IL-5是诱导EOS在骨髓中成熟的关键细胞因子,这一过程通过其与骨髓中EOS细胞膜表面的IL-5R结合而实现,在2型炎症性哮喘发病机制中,IL-5可以动员骨髓中EOS活化、增殖并维持其存活,而且这一反应不仅仅发生于骨髓,也发生于存在EOS的外周组织中[72]。这些EOS在气道组织中浸润,参与气道重塑等病理改变。
(6)肥大细胞/嗜碱性粒细胞的活化:当2型炎症性哮喘患者接触到足以致敏的过敏原时,2型炎症反应启动,分泌的2型细胞因子促使效应B细胞成熟和类别转换,后者分泌特异性抗体IgE。IgE进而与肥大细胞及嗜碱性粒细胞表面的受体交联,激活肥大细胞及嗜碱性粒细胞脱颗粒,并释放PGD2、组胺等介质,这些介质可以导致支气管平滑肌收缩,引发哮喘症状。
过敏性气道炎症是典型2型炎症的免疫过程。气道暴露于过敏原后被DC捕获激活初始T细胞活化为Th2细胞,Th2细胞继而激活B细胞转化为浆细胞产生IgE,导致机体致敏。致敏的个体再次暴露的过敏原与肥大细胞和(或)嗜碱性粒细胞表面的IgE与高亲和力FcεRI桥联后1 h内迅速发生大气道的收缩,出现支气管痉挛、平滑肌水肿、黏液分泌,导致肺功能出现急性快速地下降,临床表现为喘息、气短、痰液增多[速发相反应(EPR)];IgE还可与DC上的高亲和力FcεRI受体结合,促使Th2细胞分化及分泌IL-5细胞因子,促进EOS的浸润,合并其他炎性介质一起导致气道的慢性EOS炎症、支气管狭窄等[迟发相反应(LPR)]。此外,最近有研究发现,IgE可能直接作用于平滑肌细胞促进气道重塑[73]。
4.哮喘的靶向治疗:GINA 2022指南将阶梯用药方案作为治疗哮喘的基础[74]。其核心理念为控制当前症状,预防急性发作,从而达到控制哮喘的目的。其中,对于重度且难以控制的哮喘患者建议参考炎症表型考虑生物制剂治疗。对比GINA 2022指南,2020年中国支气管哮喘防治指南[59]在用药方案及等级上基本相似。
传统治疗哮喘的药物多作用于2型炎症机制终末端,抑制已活化的炎症细胞分泌炎症因子(激素类、LTs调节剂等),或是改善气道炎症所导致的平滑肌增生、痉挛和气道反应性增高(β受体激动剂及抗胆碱能药物),而生物制剂精准作用于2型炎症通路,阻断免疫应答的关键环节。在GINA 2022指南中,对不同种类的生物制剂给出不同的推荐意见(表5)[74]。近年来有关生物制剂靶向治疗哮喘的研究汇总如下(表6)。

全球哮喘防治倡议组织 2022对不同类型生物制剂的推荐意见
全球哮喘防治倡议组织 2022对不同类型生物制剂的推荐意见
| 靶点 | 生物制剂 | 适应证 | 推荐意见 |
|---|---|---|---|
| IgE | 奥马珠单抗(omalizumab) | ≥6岁 | 经4~5级阶梯治疗后仍无法控制的中度或重度过敏性哮喘患者 |
| IL-5 | 美泊利珠单抗(mepolizumab) | ≥6岁a-皮下注射 | 经4级阶梯治疗后仍无法控制的重度嗜酸粒细胞性哮喘患者 |
| 瑞替珠单抗(reslizumab) | ≥12岁-皮下注射 | ||
| IL-5R | 贝那利珠单抗(benralizumab) | ≥18岁-静脉注射 | 经4~5级阶梯治疗后仍无法控制的重度嗜酸粒细胞性哮喘患者 |
| IL-4Rα | 度普利尤单抗 (dupilumab) | ≥6岁 | ≥6岁的重度嗜酸粒细胞性/2型哮喘患者或需要口服糖皮质激素维持的成人及青少年哮喘患者 |
| TSLP | Tezepelumab | ≥12岁 | 重度哮喘患者 |
注:IL为白细胞介素;TSLP为胸腺基质淋巴细胞生成素;a美泊利珠单抗在6~11岁儿童中的疗效数据来源于一项极小型开放标签非对照研究
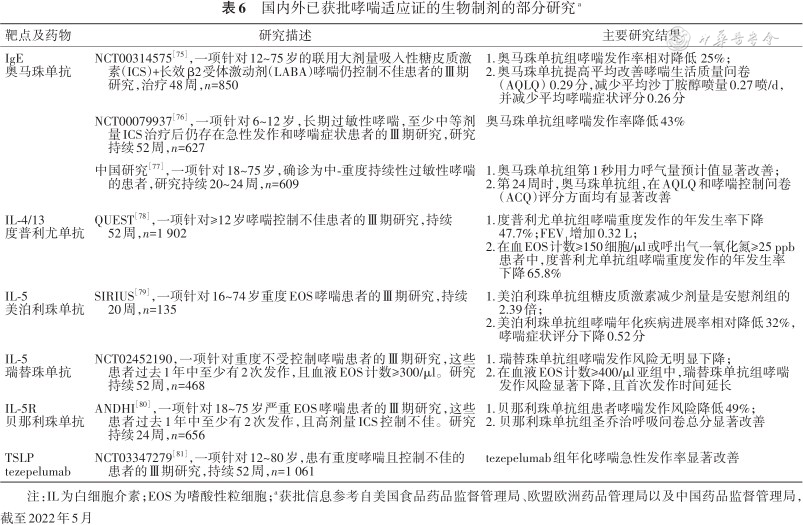
国内外已获批哮喘适应证的生物制剂的部分研究a
国内外已获批哮喘适应证的生物制剂的部分研究a
| 靶点及药物 | 研究描述 | 主要研究结果 |
|---|---|---|
IgE 奥马珠单抗 | NCT00314575[75],一项针对12~75岁的联用大剂量吸入性糖皮质激素(ICS)+长效β2受体激动剂(LABA)哮喘仍控制不佳患者的Ⅲ期研究,治疗48周,n=850 | 1.奥马珠单抗组哮喘发作率相对降低 25%; 2.奥马珠单抗提高平均改善哮喘生活质量问卷(AQLQ)0.29分,减少平均沙丁胺醇喷量0.27喷/d,并减少平均哮喘症状评分0.26分 |
| NCT00079937[76],一项针对6~12岁,长期过敏性哮喘,至少中等剂量ICS治疗后仍存在急性发作和哮喘症状患者的Ⅲ期研究,研究持续52周,n=627 | 奥马珠单抗组哮喘发作率降低43% | |
| 中国研究[77],一项针对18~75岁,确诊为中-重度持续性过敏性哮喘的患者,研究持续20~24周,n=609 | 1.奥马珠单抗组第1秒用力呼气量预计值显著改善; 2.第24周时,奥马珠单抗组,在AQLQ和哮喘控制问卷(ACQ)评分方面均有显著改善 | |
IL-4/13 度普利尤单抗 | QUEST[78],一项针对≥12岁哮喘控制不佳患者的Ⅲ期研究,持续52周,n=1 902 | 1.度普利尤单抗组哮喘重度发作的年发生率下降47.7%;FEV1增加0.32 L; 2.在血EOS计数≥150细胞/μl或呼出气一氧化氮≥25 ppb患者中,度普利尤单抗组哮喘重度发作的年发生率下降65.8% |
IL-5 美泊利珠单抗 | SIRIUS[79],一项针对16~74岁重度EOS哮喘患者的Ⅲ期研究,持续20周,n=135 | 1.美泊利珠单抗组糖皮质激素减少剂量是安慰剂组的2.39倍; 2.美泊利珠单抗组哮喘年化疾病进展率相对降低32%,哮喘症状评分下降0.52分 |
IL-5 瑞替珠单抗 | NCT02452190,一项针对重度不受控制哮喘患者的Ⅲ期研究,这些患者过去1年中至少有2次发作,且血液EOS计数≥300/μl。研究持续52周,n=468 | 1. 瑞替珠单抗组哮喘发作风险无明显下降; 2.在血液EOS计数≥400/μl亚组中,瑞替珠单抗组哮喘发作风险显著下降,且首次发作时间延长 |
IL-5R 贝那利珠单抗 | ANDHI[80],一项针对18~75岁严重EOS哮喘患者的Ⅲ期研究,这些患者过去1年中至少有2次发作,且高剂量ICS控制不佳。研究持续24周,n=656 | 1.贝那利珠单抗组患者哮喘发作风险降低49%; 2. 贝那利珠单抗组圣乔治呼吸问卷总分显著改善 |
TSLP tezepelumab | NCT03347279[81],一项针对12~80岁,患有重度哮喘且控制不佳的患者的Ⅲ期研究,持续52周,n=1 061 | tezepelumab组年化哮喘急性发作率显著改善 |
注:IL为白细胞介素;EOS为嗜酸性粒细胞;a获批信息参考自美国食品药品监督管理局、欧盟欧洲药品管理局以及中国药品监督管理局,截至2022年5月
表6中的生物制剂中仅tezepelumab不限制哮喘患者是否有2型炎症表现(FDA批准适应症)。此外,一项Ⅱ期研究表明,靶向IL-33的itepekimab对中-重度成人哮喘患者有效[82]。
1.CRS的临床体征与流行病学:CRS是发生于鼻窦黏膜的慢性炎症性疾病。其发病与微生物、鼻腔局部功能异常、呼吸道和消化道疾病以及免疫功能异常等因素相关。根据《中国慢性鼻窦炎诊断和治疗指南(2018)》(简称CPOS-2018)的分类法[83],将CRS分为伴鼻息肉(CRSwNP)及不伴鼻息肉(CRSsNP)两种临床类型。一项全国多中心CRS流行病学调查数据表明,中国人群CRS总体患病率为8%[83]。儿童及成人均可罹患CRS,但多见于中、青年人群[84]。
CRS作为一种慢性疾病,给患者造成经济、学习、工作以及对身心健康方面的沉重负担。而在共患疾病方面,CRS与AR及哮喘的关系密切。全球变态反应与哮喘欧洲协作网(GA2LEN)2012年在欧洲12个国家进行的流行病学调查发现,CRS患者哮喘的患病率比非CRS患者高2倍以上[85]。而中国流行病学调查数据统计显示,CRS患者中11.2%伴哮喘,27.3%伴AHR[83]。
CRS的主要病理表现为炎性细胞浸润、组织水肿、胶原沉积、黏液腺体增生、鳞状上皮化生。目前越来越多的研究表明CRSwNP和CRSsNP二者在免疫病理学、治疗及预后方面有很大差异。不同病理分型具体浸润细胞的区别如表7所示。

不同类型慢性鼻窦炎(CRS)浸润炎症细胞比较
不同类型慢性鼻窦炎(CRS)浸润炎症细胞比较
| 组别 | 总计数 | 中性粒 细胞 | 嗜酸性 粒细胞 | 浆细胞 | CD8+T 细胞 | B细胞 | 巨噬细胞 | 胶原 |
|---|---|---|---|---|---|---|---|---|
| 伴鼻息肉CRS | 多 | 少 | 多 | 多 | 多 | 多 | 多 | 少 |
| 不伴鼻息肉CRS | 少 | 多 | 少 | 少 | 少 | 少 | 少 | 多 |
由于CRS各型之间存在一定的联系,故从CRSwNP和CRSsNP两种类型综合比较其临床表现的相似性和差异性如表8所示。

慢性鼻窦炎(CRS)各型的临床表现
慢性鼻窦炎(CRS)各型的临床表现
| 项目 | 伴鼻息肉CRS | 不伴鼻息肉CRS |
|---|---|---|
| 鼻塞 | 双侧进行性鼻塞 | 可为单侧,无进行性 |
| 鼻涕 | 清水样鼻涕、黏性鼻涕 | 多为黏性或脓性鼻涕,可伴鼻后滴漏 |
| 嗅觉减退 | 可有,部分病例明显 | 可有 |
| 头面胀痛 | 可有 | 可有,压痛阳性可用于定位 |
| 体征 | 鼻腔内可见灰白色或荔枝肉样新生物,多来源于双侧中鼻甲、中鼻道黏膜;部分可来自嗅裂区及上鼻道 | 中鼻道、嗅裂区黏性或脓性分泌物,鼻黏膜充血、水肿、增厚,鼻道狭窄 |
| 鼻窦CT | 炎症累及处鼻腔、鼻窦软组织密度影 | 炎症累及处鼻腔、鼻窦软组织密度影 |
| MRI | 具体明确病变性质 | 具体明确病变性质 |
2.2型炎症在CRS发病机制中的作用:“欧洲鼻窦炎及鼻息肉意见书2020年版”(简称EPOS-2020)中将是否存在2型炎症作为CRS的分类标准之一[86],而涉及2型炎症的CRS包括CRSwNP、嗜酸性粒细胞性CRS(eCRS)、过敏性真菌性鼻窦炎(AFRS)等。综合国内及国外的分类法,可以发现eCRS和CRSsNP、CRSwNP之间存在交叉。即无论是CRSwNP或CRSsNP,其上皮下均可以表现为2型炎症,但就CRSwNP而言,有些微生物组释放的超抗原(如金黄色葡萄球菌超抗原)可以跳过APC抗原提呈环节而直接激活T细胞,且2型炎症激活后对鼻上皮屏障的破坏更加促进了ILC2对外界抗原的敏感性(图4)。这也是CRSwNP相比CRSsNP 2型炎症反应更加明显的原因。换言之,以2型炎症反应为主的CRS大多数为CRSwNP。
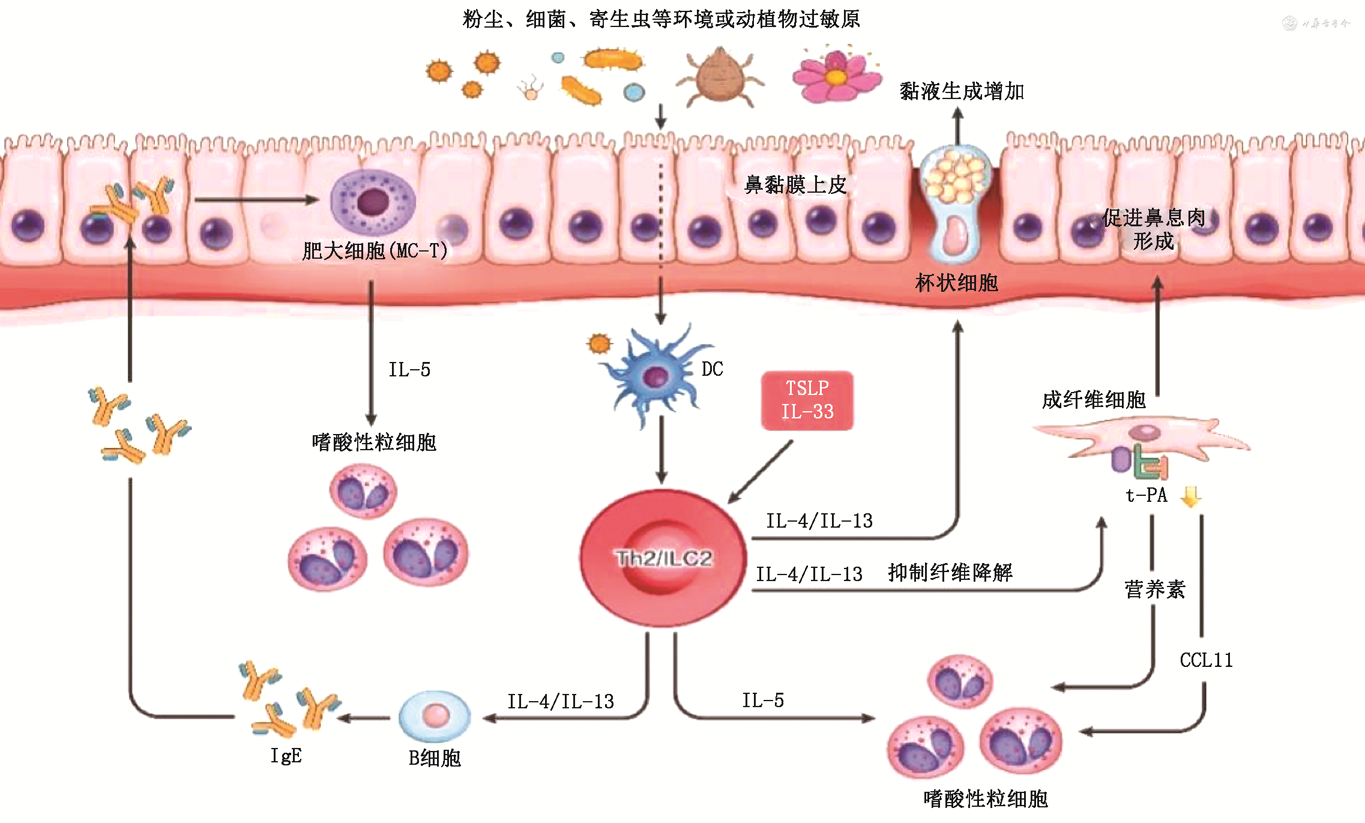

注:CCL11为趋化因子配体11;t-PA为组织型纤溶酶原激活物;IL为白细胞介素;ILC2为2型天然淋巴细胞;Th2为辅助性T细胞2;TSLP为胸腺基质淋巴细胞生成素
CRS组织中EOS增多与2型炎症存在相关性。2型炎症参与CRS的主要病理生理学机制为呼吸道上皮屏障功能破坏。与2型炎症型哮喘类似:在受到环境中某些因素的影响时(致病微生物、过敏原等),鼻腔黏膜上皮细胞受到刺激分泌释放上皮源性细胞因子,即预警素(如TSLP、IL-25和IL-33),以非抗原依赖性方式驱动ILC2活化并释放2型细胞因子[87];同时,这些预警素可以激活固有免疫及适应性免疫系统并募集EOS和中性粒细胞[20]。
与哮喘有所不同的是,IL-5在EOS浸润中发挥主要作用,导致产生EOS外的相关炎症产物和毒性蛋白,如ECP、主要碱性蛋白(MBP)等。IL-4和IL-13与编码黏蛋白生成的基因MUC5AC、MUC5B上调及上皮阴离子转运蛋白pendrin(也称非钠依赖性氯/碘转运蛋白)的生成增加相关。黏液生成增加后,通过诱导局部组织缺氧,从而加重局部炎症反应的程度,这也是CRS表现症状的重要因素[88]。另外,相关研究表明CRS患者在合并鼻息肉的情况下成纤维细胞增殖明显,并且其增殖程度与CRSwNP的严重程度有关。而在CRSwNP中,IL-4和IL-13降低了上皮细胞中组织纤维溶酶原激活物(t-PA)的表达[88],从而减缓病变周围区域的纤维降解。
除EOS外,IgE和肥大细胞在与CRS相关的2型炎症反应中同样起重要作用。有研究表明,伴EOS增多的CRSwNP患者肥大细胞水平高于不伴EOS增多的CRSwNP患者[86]。另一项研究发现,eCRS患者病变部位IgE及合成IgE的细胞转换重组均有上调,一方面可以激活肥大细胞,另一方面也可以募集EOS,增强2型炎症反应的程度[86]。
CRS病理生理学特征存在人种和地域的差异性。多项研究表明,欧美地区70%~90%的CRSwNP患者在鼻息肉组织中表现出EOS增多的情况。而同样的调查研究在东亚地区却得出矛盾的结论。既往一项研究表明,我国CRSwNP患者50%以上为非EOS增多型,但另一项研究统计出76.5%患者的鼻息肉中检出EOS增多。实际上,上述差异是由于不同研究团队对EOS测定的指标不同而出现的[88]。总体而言,eCRS是欧美CRS患者的常见类型,而东亚人种CRS患者的EOS增多的比例相对较少。而最近的相关研究显示,eCRS在亚洲的流行病学趋势正在增加[88],值得临床进一步关注。
3.CRS的靶向治疗:CRS的诊疗方案指导意见来源于CPOS-2020[83]和EPOS-2020[86],常规治疗方案包括鼻用糖皮质激素、鼻内镜手术、抗感染及抗过敏对症治疗、黏液促排剂、盐水鼻腔冲洗等治疗。有关应用生物制剂靶向治疗CRS的问题,在EPOS-2020中有较详细说明,其主要评估的条件在于双侧鼻息肉且有鼻内镜手术史的患者。以此为基础,EPOS-2020对CRSwNP患者生物制剂的应用标准提出详细评估指标(表9)。目前各类生物制剂对CRSwNP的疗效和安全性评价信息如表10所示。

EPOS-2020对伴鼻息肉慢性鼻窦炎(CRSwNP)患者应用生物制剂的评估标准
EPOS-2020对伴鼻息肉慢性鼻窦炎(CRSwNP)患者应用生物制剂的评估标准
| 项目 | 评估指标 |
|---|---|
| 2型炎症证据 | 组织嗜酸性粒细胞(EOS)≥10/高倍视野,或血液EOS≥250 U/L,或总IgE≥100 U/ml,持续时间>2个疗程/年,或长期(>3个月) |
| 糖皮质激素应用 | 需应用口服糖皮质激素控制者:≥2个疗程/年,或长期(>3个月)使用低剂量糖皮质激素;或存在使用全身性糖皮质激素禁忌者 |
| 生活质量 | 鼻腔-鼻窦结局测试22项量表(SNOT-22)评分≥40 |
| 明确的嗅觉丧失 | 取决于嗅觉丧失试验评分 |
| 哮喘共病情况 | 需要定期吸入糖皮质激素的哮喘患者 |

国内外已获批伴鼻息肉慢性鼻窦炎(CRSwNP)适应证的生物制剂主要研究a
国内外已获批伴鼻息肉慢性鼻窦炎(CRSwNP)适应证的生物制剂主要研究a
| 靶点及药物 | 研究描述 | 主要研究结果 |
|---|---|---|
IL-4/13 度普利尤单抗 | LIBERTY NP SINUS-24/52[89]:Ⅲ期研究,针对年龄≥18 岁,伴双侧CRSwNP,使用鼻内糖皮质激素治疗后仍存在症状,在过去 2 年内接受过全身糖皮质激素治疗或有鼻窦手术史的患者。研究持续24~52周,n=724 | 1.度普利尤单抗组NPS、鼻塞及鼻腔梗阻评分有显著改善; 2. 度普利尤单抗组不良事件整体的发生率低于安慰剂组 |
IgE 奥马珠单抗 | POLYP1&2[90]:一项Ⅲ期研究,针对鼻内糖皮质激素敏感性不足的成人CRS患者,n=265 | 奥马珠单抗组NPS、鼻塞评分、SNOT-22 评分均有明显改善 |
IL-5 美泊利珠单抗 | SYNAPSE[91]:Ⅲ期研究,针对年龄≥18岁的重度复发性、难治性双侧鼻息肉,并有再次行鼻腔手术适应证的患者,研究持续49~52周,n=407 | 美泊利珠单抗组内镜下总体NPS相较于基线期显著改善;鼻塞症状VAS显著改善 |
注:NPS为鼻息肉评分;VAS为视觉模拟评分;SNOT-22为鼻腔-鼻窦结局测试22项量表;a获批信息参考自美国FDA、欧盟EMA以及中国药监局,截至2022年5月
此外,一些临床研究表明:贝那利珠单抗、瑞替珠单抗在CRSwNP患者中有疗效[92]。在一项贝那利珠单抗治疗重度CRSwNP患者的临床Ⅲ期试验中,经过40周的治疗,贝那利珠单抗组相比安慰剂组,鼻息肉评分(NPS评分)和鼻塞评分(NBS)均得到显著改善;此外,第40周时贝那利珠单抗组患者嗅觉评分的改善也具有统计学意义[93]。但截至2022年6月,对于贝那利珠单抗和瑞替珠单抗,尚未有相关适应证获批。
4.AFRS:AFRS被认为是CRSwNP的一个亚型。AFRS与一般的真菌性鼻窦炎不同,一般的真菌性鼻窦炎好发于长期应用抗生素或TCS的人群,或糖尿病等慢性疾病而免疫力低下的人群,而AFRS多发生于免疫功能正常的青年及成人,多有特应性体质——长期反复发作的CRSwNP(可能有一次以上的鼻窦手术史)或哮喘。目前大多数AFRS病例报道来自美国南部[94]。
对于AFRS患者而言,特异性诱发2型免疫应答及2型炎症反应的主要过敏原为真菌菌丝[95]。已有研究表明AFRS为一种剧烈的过敏性-EOS浸润炎症。病理表现为大量EOS浸润、嗜酸性黏蛋白(包裹真菌菌丝及大量EOS的黏稠分泌物)蓄积[96, 97]。
AFRS在症状上与CRS相似,均以鼻塞、流涕、头面部胀痛、嗅觉减退等为主要表现,体征上也多数类似CRS,部分患者表现为鼻窦肿物,可压迫眶侧或颌面部至隆起,严重时可能出现眼球突出。鼻窦CT除可见软组织密度影外,可能出现真菌团块的高亮影。
在治疗方面,AFRS不伴鼻息肉的患者的TCS应用同CRSsNP,如合并鼻息肉则参考CRSwNP的用药方案。手术方案同样首选鼻内镜手术。EPOS-2020不建议全身或局部应用抗真菌药物。
对于生物制剂治疗AFRS,一项纳入7例AFRS及中重度哮喘的患者的回顾性分析表明,皮下注射奥马珠单抗(平均剂量287 mg,平均注射频次7.57次)1年后其SNOT-22评分改善31%,内镜检查相关评分改善61%[98]。此外,目前已有随机、双盲、安慰剂对照、平行组研究正在进行中,该研究用以评估度普利尤单抗在AFRS患者中的疗效和安全性。
1.AR的分类:AR是特应性个体暴露于过敏原后发生的、主要由IgE介导的鼻黏膜非感染性慢性炎症性疾病,临床症状包括阵发性喷嚏、清水样涕、鼻痒、鼻塞等。AR可以按3种方式进行临床分类,如表11所示。

过敏性鼻炎(AR)的临床分类
过敏性鼻炎(AR)的临床分类
| 分类方式 | 分类 | 特点 |
|---|---|---|
| 按过敏原种类 | 季节性AR | 发作呈季节性,常见的过敏原包括花粉、真菌等季节性吸入物过敏原 |
| 常年性AR | 发作呈常年性,常见过敏原包括尘螨、蟑螂、动物皮屑等室内常年性吸入物过敏原,以及某些职业性过敏原 | |
| 按症状发作时间 | 间歇性AR | 症状发作<4 d/周,或<4周/年 |
| 持续性AR | 症状发作≥4 d/周,且≥4周/年 | |
| 按症状严重程度 | 轻度AR | 症状轻,对生活质量(包括睡眠、日常生活、学习,下同)未产生明显影响 |
| 中-重度AR | 症状较重或严重,对生活质量产生明显影响 |
2.2型炎症在AR发病机制中的作用:Ⅰ型变态反应一般可分为两个阶段,即EPR和LPR。鼻痒、打喷嚏、流鼻涕主要是由组胺释放所引起,为典型的EPR,通常发生在接触过敏原几分钟内。LPR的症状(特别是鼻塞)主要是由EOS释放的炎性介质所引起,这些介质被2型细胞因子(如IL-4、IL-5和IL-13)募集和激活。
(1)EPR:AR患者鼻黏膜上皮内有丰富的肥大细胞,当再次接触过敏原时肥大细胞很容易被激活。肥大细胞和嗜碱性粒细胞表面的过敏原特异性IgE-FcεRI复合物被特定的过敏原交联,触发炎性介质(储存在细胞质颗粒中的介质如组胺)的分泌,这些介质共同导致血管扩张、血管通透性增加、黏液分泌,以及刺激感觉神经。
(2)LPR:组胺等炎性介质的释放诱导血管内皮细胞、上皮细胞等表达或分泌黏附分子、趋化因子及细胞因子等,募集和活化EOS等免疫细胞,导致炎性介质的进一步释放,炎症反应持续和加重,鼻黏膜出现明显组织水肿导致鼻塞,这一过程称为LPR。MBP诱导上皮细胞损伤,而Th2细胞因子(IL-4、IL-5和IL-9)刺激更多的IgE产生、杯状细胞增生和黏液产生。当鼻黏膜暴露于过敏原时,过敏原被APC(主要是DC)捕获和处理,并提呈给幼稚的T细胞。然后,幼稚的T细胞分化成Th2细胞,产生IL-4、IL-5和IL-13等细胞因子。IL-4、IL-13以及Th2细胞和B细胞中匹配的共刺激分子,促进B细胞类型转换,产生过敏原特异性IgE。IgE与肥大细胞和嗜碱性粒细胞表面的FcεRI结合,导致这两种细胞产生LTs、PGD2和PAF等炎性介质。
(3)AR的靶向治疗:AR的现有治疗方法包括避免接触过敏原、药物治疗(鼻用TCS、抗组胺药、TLs受体拮抗剂等)和特异性免疫治疗等。近年来开始尝试生物制剂治疗,以期为上述疗法效果不佳的难治性AR患者提供新的治疗选择。
奥马珠单抗已在治疗AR方面进行了较深入的研究。一篇荟萃分析纳入了83项关于奥马珠单抗治疗AR的研究,其中16项是随机对照试验,对3 458例AR患者(试验组1 931例、对照组1 527例)的分析显示:奥马珠单抗组可明显改善AR患者的症状和生活质量,而且在不良事件方面差异无统计学意义[99]。
一项Ⅲ期随机、双盲、安慰剂对照临床研究(NCT02414854),评估了度普利尤单抗在12岁以上未控制、轻度至重度哮喘患者合并常年性AR患者的亚组中的疗效,结果显示:度普利尤单抗治疗重度哮喘伴常年性AR患者,血液中EOS、2型炎症生物标志物(总IgE、FeNO、CCL17或TARC)和特异性IgE水平、以及鼻结膜炎生活质量调查问卷(RQLQ)评分有明显改善;200 mg 每2周1次度普利尤单抗针对鼻部症状也有改善[100]。另一项Ⅱb期临床试验(NCT01854047)表明,度普利尤单抗 300 mg每2周1次作为中到高剂量吸入糖皮质激素+长效β2激动剂补充治疗,可以缓解未控制的持续性哮喘和合并常年性AR患者的鼻部症状[101]。
一项Ⅱa期随机、双盲、安慰剂对照、3组平行设计的研究(NCT01018693)利用过敏原诱导的皮肤迟发反应和探索性免疫监测作为治疗反应的替代标志物,评估抗IL-4与皮下免疫治疗联合使用时对过敏原诱导的持续耐受情况,结果表明:在抑制过敏原诱导的皮肤迟发反应方面,抗IL-4联合皮下免疫治疗没有额外的获益[102]。
需要指出的是,单纯AR的生物制剂靶向治疗尚未获得国家药品监督管理局的批准,目前处于临床探索阶段。今后一段时间国内外将会有新的临床研究结果发表,值得进一步关注。
1.FA的分类:2010年世界过敏组织对FA的定义是暴露于食物时重复出现的、由免疫学机制介导的食物不良反应[103]。
FA反应从发病机制上可分为由IgE介导、非IgE介导及两者混合介导的三类(表12)[104]。
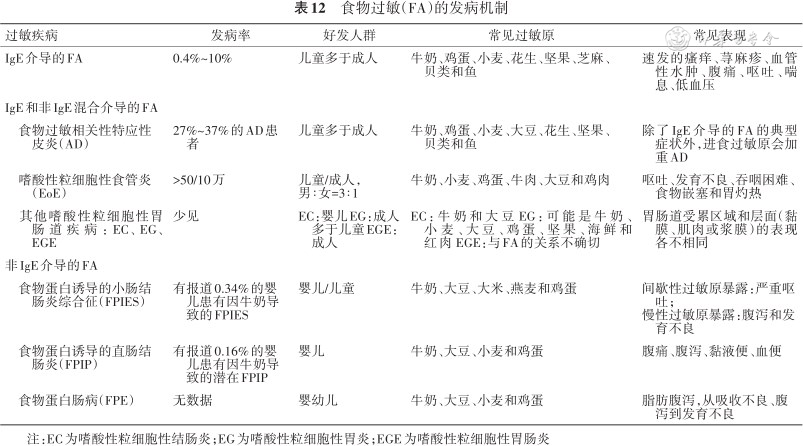
食物过敏(FA)的发病机制
食物过敏(FA)的发病机制
| 过敏疾病 | 发病率 | 好发人群 | 常见过敏原 | 常见表现 | |
|---|---|---|---|---|---|
| IgE介导的FA | 0.4%~10% | 儿童多于成人 | 牛奶、鸡蛋、小麦、花生、坚果、芝麻、贝类和鱼 | 速发的瘙痒、荨麻疹、血管性水肿、腹痛、呕吐、喘息、低血压 | |
| IgE和非IgE混合介导的FA | |||||
| 食物过敏相关性特应性皮炎(AD) | 27%~37%的AD患者 | 儿童多于成人 | 牛奶、鸡蛋、小麦、大豆、花生、坚果、贝类和鱼 | 除了IgE介导的FA的典型症状外,进食过敏原会加重AD | |
| 嗜酸性粒细胞性食管炎(EoE) | >50/10万 | 儿童/成人, 男∶女=3∶1 | 牛奶、小麦、鸡蛋、牛肉、大豆和鸡肉 | 呕吐、发育不良、吞咽困难、食物嵌塞和胃灼热 | |
| 其他嗜酸性粒细胞性胃肠道疾病:EC、EG、EGE | 少见 | EC:婴儿EG:成人多于儿童EGE:成人 | EC:牛奶和大豆EG:可能是牛奶、小麦、大豆、鸡蛋、坚果、海鲜和红肉EGE:与FA的关系不确切 | 胃肠道受累区域和层面(黏膜、肌肉或浆膜)的表现各不相同 | |
| 非IgE介导的FA | |||||
| 食物蛋白诱导的小肠结肠炎综合征(FPIES) | 有报道0.34%的婴儿患有因牛奶导致的FPIES | 婴儿/儿童 | 牛奶、大豆、大米、燕麦和鸡蛋 | 间歇性过敏原暴露:严重呕吐; 慢性过敏原暴露:腹泻和发育不良 | |
| 食物蛋白诱导的直肠结肠炎(FPIP) | 有报道0.16%的婴儿患有因牛奶导致的潜在FPIP | 婴儿 | 牛奶、大豆、小麦和鸡蛋 | 腹痛、腹泻、黏液便、血便 | |
| 食物蛋白肠病(FPE) | 无数据 | 婴幼儿 | 牛奶、大豆、小麦和鸡蛋 | 脂肪腹泻,从吸收不良、腹泻到发育不良 | |
注:EC为嗜酸性粒细胞性结肠炎;EG为嗜酸性粒细胞性胃炎;EGE为嗜酸性粒细胞性胃肠炎
诊断IgE介导的FA主要依赖于有特征性的病史、避免食用可疑过敏原后症状是否好转(母乳喂养婴儿需排查母亲饮食)、可疑过敏原皮肤点刺试验、可疑食物特异性IgE检测等方法。双盲安慰剂对照食物激发试验(DBPCFC)是诊断的金标准。非IgE介导的FA由于发病延迟和缺乏特异的实验室检测,诊断上有相当大的挑战,根据病史可以用食物排除-再引入试验和食物激发试验进行诊断。
2.2型炎症在FA发病机制中的作用:IgE介导的FA是由摄入的食物过敏原与肥大细胞上的IgE及其FcεRI相互作用,导致肥大细胞活化脱颗粒,释放胞内预存的过敏性介质(包括组胺、类胰蛋白酶和糜蛋白酶)的颗粒。这些介质可引起一系列生理反应,如血管扩张、血管通透性增加、瘙痒和平滑肌收缩[105]。
食物过敏原暴露和免疫激活后,DC诱导Treg细胞转变成Th2细胞。Th2细胞群的扩大提供了IL-4的局部储存库,IL-4是关键的细胞因子,进一步维持Th2细胞的反应,推动B细胞中IgE的转换,促进肥大细胞存活,并增强组织对肥大细胞介质作用的敏感性。此外,2型固有淋巴样细胞增殖也能产生细胞因子IL-4和IL-13[105]。
3.FA的靶向治疗:目前FA主要治疗方法是回避过敏原、对症治疗和食物脱敏治疗,但并不是所有人都可以尝试脱敏治疗。
抗IgE治疗,如奥马珠单抗和口服免疫治疗联合应用于FA的治疗,但是尚未得到FDA批准。两项Ⅱ期临床研究显示,与单纯使用口服免疫治疗的患者相比,联合使用奥马珠单抗,脱敏成功率更高,分别为55%与85%、33%与83%,且耐受过敏原的剂量更大,达到维持剂量所需时间更短[106, 107, 108]。
度普利尤单抗也显示出治疗FA的作用,2019年有1例报告称,1例30岁的女性患者在度普利尤单抗治疗严重AD期间,发现对开心果和玉米的过敏症状消失[109]。
Etokimab是一种抗IL-33单克隆抗体,在一项小型Ⅱa期临床研究中在对花生过敏的成人使用单剂15 d后,73%受试者耐受累计剂量为275 mg的花生蛋白,而安慰剂组的耐受率为0[110]。
1.EoE的临床体征和诊断:EoE是一种慢性、由来自食物或吸入的过敏原触发、Th2细胞介导的食管疾病,临床上以食管功能障碍相关症状为主要临床表现,组织学表现为食管黏膜以EOS浸润为主的炎症,如果不治疗,最终会发展为食管纤维狭窄。
EoE的临床表现随年龄而变化。成人和青少年患者常表现为吞咽困难、食物嵌塞、灼热感、胸痛,年幼儿表现为喂养困难、拒食、生长缓慢、恶心呕吐、反流症状和腹痛。
EoE诊断标准:(1)食管功能障碍相关的症状;(2)伴随的特应性疾病;(3)内镜检查发现食管环、沟槽、渗出物、管腔狭窄、黏膜脆性及黏膜裂隙;(4)食管黏膜活检中EOS≥15个/HPF;(5)黏膜EOS增多局限于食管;(6)评估EoE以外的可能导致EOS浸润的疾病。
2.2型炎症在EoE发病机制中的作用:EoE的发病机制被认为是多因素的,涉及遗传、免疫和环境因素。EoE的免疫反应机制介于纯IgE介导的过敏反应与迟发性2型炎症反应之间[111]。Th2细胞驱动并涉及IL-13、IL-5和IL-15的适应性T细胞免疫应答,在EoE的发病机制中发挥主要作用[112]。抗原蛋白经抗原呈递细胞递呈后,食管上皮细胞产生IL-5、IL-13和粒-巨噬细胞集落刺激因子(GM-CSF),它们在EOS成熟和迁移中起作用[113]。IL-5是EOS活化的关键介导因子,似乎会介导EOS诱导的食管重塑和胶原沉积,Th2细胞和EOS都可以表达IL-5[114]。TSLP是IL-7家族的一种细胞因子,由上皮细胞分泌,可能通过嗜碱性粒细胞促进2型炎症[115]。
3.EoE的靶向治疗:目前EoE的治疗主要包括饮食治疗、药物治疗(质子泵抑制剂、TCS)、食管扩张及生活方式的调节。针对2型炎症因子的靶向治疗药物正在探索中。
度普利尤单抗在2022年5月被FDA批准用于成人和12岁及以上(体重40 kg以上)的EoE患者。一项纳入47例中重度EoE的临床试验中发现:与安慰剂组相比,治疗第10周时EoE患者的吞咽困难症状、内镜下表现、食管EOS计数及食管的扩张性有明显的改善。Straumann吞咽困难工具(SDI)患者报告结果(PRO)评分从基线到第10周变化,度普利尤单抗组减少3分,安慰剂减少1.3分[116]。
针对靶向IL-5的研究中,美泊利珠单抗的临床研究有不同的结果[117, 118, 119]。因此治疗作用尚不确定。瑞替珠单抗正在进行临床试验探索,在一项226例儿童和青少年EoE患者的对照试验中,与安慰剂相比,EOS峰值计数显著降低(3种测试剂量分别为59%、67%和64%,而安慰剂为24%),所有治疗组的症状都有显著改善,但是医生总体评估评分与安慰剂没有显著差异[120]。因此,其作用仍然不确定。
1.慢性自发性荨麻疹(CSU):荨麻疹是由于皮肤、黏膜小血管扩张及渗透性增加出现的一种局限性水肿反应。临床上表现为大小不等的风团伴瘙痒,约20%的患者伴有血管性水肿。其中CSU是指自发性风团和(或)血管性水肿发作≥6周。CSU在世界范围内的统计数据显示,其患病率为0.5%~1.0%[121]。在大多数患者中,CSU是一种发作性、自限性疾病;CSU的病程与多种因素相关,既往认为伴血管性水肿、严重疾病特征、自体血清皮肤试验(ASST)阳性和甲状腺自身免疫的患者CSU病程可能更长。而最近的研究发现,高血压和疾病严重程度同样与其存在相关性[122, 123]。另外77% 的CSU患者在确诊后10年内患上一种或以上自身免疫性疾病[124];35%~70%患者合并可诱导性荨麻疹[125]。
CSU临床局部表现为皮肤大小不等的风团伴瘙痒,可伴或不伴血管性水肿,后者通常呈非对称分布且累及皮肤松弛部位,例如唇、颊、面部、眶周区域、四肢及生殖器[126]。风团通常持续数分钟至数小时,并在24 h内逐渐消退。当合并血管性水肿时,患区常有轻微疼痛、麻木或麻刺感,在72 h内消退。—部分CSU患者报告有全身症状,包括头痛、乏力、关节疼痛/肿胀等症状。CSU的瘙痒可能会严重到干扰工作、学习或睡眠,而且往往在夜间最明显。
多数CSU患者不能找到明确诱因,常见的诱因包括食物、药物、呼吸道吸入物及皮肤接触物(花粉、尘螨、动物毛发及皮屑等)、微生物(病毒、寄生虫等)、物理因素(温度、光照、压力及摩擦等)和一些系统性疾病(肿瘤、内分泌疾病、风湿免疫疾病等)。一些研究表明,CSU与多种特应性和自身免疫性疾病有关[127, 128]。
肥大细胞是荨麻疹发病中关键的效应细胞,通过免疫和非免疫机制被诱导活化。在Th2免疫反应轴中,IL-4及其他2型细胞因子大量分泌,可以直接引起或间接通过IgE途径诱导肥大细胞活化。此外,在IgE的刺激作用下,CSU患者的嗜碱性粒细胞产生和释放IL-31,而后者能反过来激活嗜碱性粒细胞和促进IL-4和IL-13的释放,形成反馈环路[129]。还有研究发现,IL-33、IL-25、TSLP等细胞因子在患者皮损中比患者非病变处皮肤和对照组皮肤中表达上调[130]。肥大细胞脱颗粒后,导致组胺、多种炎症因子及LTs等的产生,影响荨麻疹发生、发展、预后和治疗反应。少数荨麻疹患者肥大细胞活化的机制并不清楚,甚至其发病可能不依赖肥大细胞[131]。
CSU的标准治疗主要为第二代H1抗组胺药,现有资料表明,标准剂量的H1抗组胺药治疗仅能完全控制不足50%患者的CSU症状[132]。当患者的症状无法经较高剂量抗组胺药或更换药品种类达到充分控制时,中国荨麻疹诊疗指南(2018版)推荐可以使用生物制剂如奥马珠单抗治疗[133],奥马珠单抗是一种抗IgE单克隆抗体,2014年在美国获准用于标准剂量H1抗组胺药无法控制的12岁及以上CSU患者,2022年4月,奥马珠单抗在我国获批上市用于采用H1抗组胺药治疗后仍有症状的成人和青少年(12岁及以上)CSU患者的治疗。此外,也有关于高亲和力抗IgE单克隆抗体ligelizumab[134]以及抗IL-4Rα单克隆抗体度普利尤单抗[135]治疗难治性CSU的临床研究。一项纳入382例中重度慢性CSU患者的Ⅱ期研究结果表明,ligelizumab 72 mg或240 mg剂量相较于奥马珠单抗或安慰剂而言,完全控制CSU症状的患者比例更高,但存在轻-中度注射部位反应。另一项国际多中心Ⅲ期研究中,纳入138例中-重度CSU患者,在第24周时,联用度普利尤单抗及抗组胺药组较单独应用抗组胺药组降低的瘙痒严重程度评分近2倍。
此外,IL-5也是CSU的潜在治疗靶点,但目前这类药物临床试验均未完成[136]。而2型炎症的启动细胞因子IL-33、IL-25和TSLP能够影响肥大细胞活化,并参与CSU的发病机制,也是CSU未来治疗的一个研究方向。
2.结节性痒疹(PN):PN是一组以瘙痒性丘疹、结节、斑块为特征的慢性炎性皮肤病。通常发生在中年以后,女性比男性更易发病。但目前我国PN患病率尚未有明确数据。
该病瘙痒剧烈,可呈阵发性、偶发性或持续性;遇热、出汗或衣物刺激均可使其加重。临床表现为结节性损害,好发于四肢,尤以小腿伸面多见。皮损初起为水肿性红色坚实丘疹,很快呈黄豆或更大的半球状结节,顶部角化明显,可见疣状增生,暗褐色,触之有坚实感,常散在分布,偶见密集成群。少数患者发作期长达数年[137]。皮损特征以及剧烈瘙痒是PN临床诊断的首要依据。
PN病因尚未完全清楚,但多数学者认为与超敏反应、神经精神因素、遗传、过敏等有关。一些研究表明:大约半数PN病例有AD病史[138]。AD患者发生PN的年龄可能早于无AD的患者[139]。
PN的发病机制尚不完全明确,目前认为2型炎症是PN发病机制的核心。组织病理学特征包括表皮角化过度且棘层肥厚;角质形成细胞坏死;T淋巴细胞、肥大细胞和EOS浸润。后3种免疫细胞通过释放IL-31、胰蛋白酶、ECP、组胺、前列腺素和神经肽等,产生强烈的炎症反应和瘙痒。由于组织中浸润的EOS脱颗粒并分泌ECP,可能会激活周围神经传递瘙痒的感觉信号。此外由Th2细胞分泌的IL-31、IL-4、IL-17和IL-22等上调,也会加重瘙痒和皮肤损害[23]。
PN的治疗比较困难,综合中国2018年慢性瘙痒管理指南、欧洲EDF/EADV指南及2020年美国结节性痒疹治疗的专家共识等意见[140, 141, 142],治疗方案包括:患者宣教(避免干、热环境刺激,减少洗浴时间,避免使用非碱性洗浴用品,减少搔抓等),外用药物治疗(外用TCS等),系统药物治疗(系统性抗组胺药物及TCS)和紫外光疗。
在生物制剂的使用方面,我国2018指南中提及抗IL-31单克隆抗体,而美国共识则将度普利尤单抗和抗IL-31单抗归类为尚未完善及实验性治疗的范畴。一项度普利尤单抗治疗控制不佳的PN成人患者的Ⅲ期临床试验初步结果显示:度普利尤单抗组较安慰剂组显著改善患者的峰值瘙痒评分(WI-NRS)(均P<0.000 1),且达到皮损完全清除或几乎完全清除的患者比例为45%[143]。一项评估nemolizumab(抗IL-31)对PN患者的Ⅱ期临床试验显示,第4周时,nemolizumab组WI-NRS较基线减少4.5分(P<0.001)。同时该研究也报道了使用nemolizumab与胃肠道症状(腹痛和腹泻)和肌肉骨骼症状相关[144]。
除上述生物制剂涉及的靶点以外,致痒细胞因子IL-31及其同源细胞因子抑癌蛋白M(oncostatin M)和IL-31受体复合物(IL-31RA/OSMRβ)在PN患者瘙痒皮肤中的表达增加,成为潜在的治疗靶点。靶向抑制IL-31RA和OSMRβ目前正在研究中[145]。
3.大疱性类天疱疮(BP):最新的研究报道以2型炎症反应引起的瘙痒为分类依据,归纳分析了多种皮肤疾病,BP也在此列。BP是自身免疫性大疱性疾病,临床表现为在外观正常或红斑基础上紧张性水疱和大疱,尼氏征多为阴性,伴有不同程度的瘙痒,部分患者伴黏膜损害(特别是疤痕型类天疱疮患者)。BP病程多呈慢性、复发性,有研究显示BP患者较对照组易伴发至少2种其他慢性病[146],患有神经内科疾病(如卒中、痴呆等)的老年人此病发生率更高[147]。有因严重BP致患者死亡(以中老年患者为主)的报道[148],在既往研究中,BP死亡率最低为11%,最高为41%[149],系统性的免疫治疗在挽救患者生命的同时,也是导致BP高共病发生率和高死亡率的重要因素[150]。
抗BP180抗体是BP的致病性抗体,并已证实在BP患者体内存在针对BP180的自身反应型T细胞。有研究表明,与健康个体相比,70%~85%的BP患者可观察到外周血中EOS数量增加[151]。在组织学上,BP常表现为EOS浸润,提示与2型炎症相关。BP反应性T细胞产生Th2细胞因子(IL-4、IL-5、IL-6、IL-10和IL-13),诱导Th2细胞依赖性自身抗体IgG4亚型产生。Th2细胞因子进一步激活EOS,导致EOS浸润,同时伴有IL-5的升高。这些自身抗体连同炎症级联反应导致细胞与基底膜间的黏附力减弱,造成真皮-表皮交界处分离,继而形成表皮下大疱[152, 153]。
而2型炎症反应发生时角质形成细胞释放TSLP、IL-25、IL-33等预警素,这些预警素可直接激活皮肤瘙痒感受器,从而诱导瘙痒症状出现。此外,这些预警素与其他经典2型细胞因子通过旁分泌的方式,刺激角质形成细胞分泌骨膜蛋白。这些骨膜蛋白在体内作为致痒原诱导瘙痒症状[154]。另一项实验发现,与健康人群相比,BP患者体内IL-13、IL-31、EOS及嗜碱性粒细胞水平升高,与严重的瘙痒相关[155]。
BP的治疗通常根据其病情严重程度采用不同的治疗方案。2022年版《自身免疫性表皮下大疱病诊疗共识》中的治疗方案包括皮肤创面保护、清创预防感染、抽吸疱液、系统使用TCS、免疫抑制剂治疗、血浆置换、免疫球蛋白和生物制剂治疗。
对于顽固性BP,目前临床研究中涉及多种生物制剂,例如度普利尤单抗、奥马珠单抗等。前者在一项小样本多中心病例系列研究(n=13)中取得良好疗效,93%的患者病情改善并希望继续度普利尤单抗治疗[156]。后者同样在一项小样本临床研究(n=6)中给患者带来良好的临床获益,其中5例患者因奥马珠单抗治疗而降低了其他免疫抑制剂的剂量,同时瘙痒症状和新发大疱也得到抑制[157]。除以上治疗外,美泊利珠单抗和贝那利珠单抗也正在临床研究中[158, 159]。
4.慢性阻塞性肺疾病(COPD):COPD是一种常见的、可预防和治疗的疾病,其特征是持续的呼吸道症状和气流受限,其病理改变是气道和(或)肺泡的异常,通常由大量接触有害颗粒或气体引起,并与宿主因素(包括肺发育异常)有关,严重的合并症可能会影响疾病的表现和病死率[160]。
COPD的发病机制复杂、尚未完全阐明。吸入烟草烟雾等有害颗粒或气体可引起气道氧化应激、炎症反应以及蛋白酶/抗蛋白酶失衡等多种途径参与COPD发病。多种炎症细胞参与COPD的气道炎症,包括巨噬细胞、中性粒细胞,以及Tc1、Th1、Th17和ILC3淋巴细胞等。在一些患者中,EOS、Th2细胞或ILC2细胞也可能增加。所有这些炎症细胞与上皮细胞和其他结构细胞一起释放多种炎症介质,造成肺损伤[160]。
虽然大多数COPD患者以中性粒细胞炎症为主,但也有一部分患者EOS增多,对1 483例COPD患者分析发现,37.4%的患者的EOS计数持续≥2%,只有13.6%在所有就诊期间EOS计数持续<2%,而剩下的49%则在2%上下波动。健康对照组也观察到类似现象,36%的患者EOS计数持续≥2%[161]。这可能是由Th2和ILC2细胞通过从上皮细胞释放IL-33来调控的。
目前,COPD的治疗主要包括氧疗和支气管舒张剂、TCS、PDE4抑制剂及抗生素等药物治疗[160]。随着人们对EOS和2型炎症在COPD患者亚群中所起到作用的认识,2型炎症靶向的生物制剂,如IL-5抑制剂、IL-4/13抑制剂等,已经进行了临床试验,并显示出在急性发作频率降低等临床改善。
贝那利珠单抗的Ⅱa期研究纳入上1年痰EOS计数≥3.0%的中重度COPD患者82例,结果发现COPD中重度急性加重未减少[162]。在Ⅲ期临床研究(NCT02155660,n=2 255;NCT02138916,n=1 656)中仍未能减少中重度COPD急性发作年率[163]。美泊利珠单抗先导性临床研究针对在过去2年中至少1次痰EOS>3%的COPD合并嗜酸性支气管炎患者,纳入18例患者,发现痰EOS减少[164]在两项针对过去12个月内外周血EOS计数≥300个/μl,或第一次访问时基线血EOS计数≥150个/μl的COPD患者的Ⅲ期研究中,得到了不一致的结果,NCT02105961(n=674)发现急性发作未减少,而NCT02105948(n=837)发现在EOS表型亚组(n=462)中急性发作年率减少[165]。
度普利尤单抗针对第一次访视时血液EOS≥300个/μl的COPD患者进行为期 52 周的Ⅲ期研究(NCT03930732,NCT04456673),结果尚未发表。
IL-33抑制剂itepekimab针对中重度COPD患者的研究(NCT03546907,n=343)结果发现在既往吸烟者亚组中,可减少52周中重度COPD急性发作年率[166]。而另一种IL-33抑制剂MSTT1041A也进行了针对中重度COPD患者的研究(NCT03615040,n=81),结果尚未发表。
5.过敏性支气管肺曲霉菌病(ABPA):ABPA是指人体吸入曲霉菌后诱发的一种疾病,常作为一种进展性疾病,继发于慢性肺部基础疾病,如哮喘和囊性纤维化(cystic fibrosis,CF)患者。在全球范围内,分别有1%~5%的哮喘患者和2%~15%的CF患者合并ABPA。ABPA临床体征无特异性,多伴有支气管扩张,诊断和治疗不及时可导致不可逆的肺实质损伤。但ABPA相对少见,早期易漏诊、误诊,影响患者预后[29]。
曲霉菌被哮喘及CF患者吸入后发生变态反应,T淋巴细胞被激活,致敏的CD4+T 淋巴细胞激活Th2细胞介导的炎性反应,释放IL-4、IL-5及IL-13,并分泌IgE、IgG抗体,作用于肥大细胞、EOS及肺泡巨噬细胞等,导致血清总IgE和曲霉特异性抗体水平升高、局部EOS浸润,引起气道及周围肺组织慢性炎性反应;曲霉菌的分生孢子进入气道后长出菌丝,继而释放过敏原和蛋白酶,损伤黏液纤毛,破坏气道上皮细胞,抑制吞噬细胞活性,使其在气道中长期定植,促进ABPA发生[29]。
ABPA的传统治疗药物为TCS和抗真菌药物,但TCS长期治疗对患者造成许多不良反应,并且产生依赖性及耐药性,而抗真菌药物价格昂贵,长期服用对肝肾功能造成影响;此外,这两类药物存在诱发其他疾病的风险及不良反应,且并非所有患者用药后均可取得良好的临床治疗效果[29]。
近年来,生物制剂治疗ABPA的研究取得了一些进展。首先是有关奥马珠单抗的一项小型研究,纳入25例哮喘并发ABPA患者,研究持续 16周,结果显示奥马珠单抗显著改善患者疾病急性加重的频率和TCS使用量[167];而另一项研究结果表明,CF并发ABPA患者使用奥马珠单抗治疗可出现病情加重,需进一步研究其安全性[168]。其次,度普利尤单抗的研究显示:哮喘并发ABPA患者经度普利尤单抗治疗2个月后,呼吸道症状明显缓解,但有1例患者在治疗期间出现哮喘加重,考虑可能与度普利尤单抗诱导EOS增多有关[169]。此外,也有关于美泊利珠单抗[170]以及贝那利珠单抗[171]治疗ABPA有效的病例报道。
本文详述了2型炎症的免疫机制、部分常见的2型炎症性疾病及靶向治疗药物,但由于篇幅限制,仍有更多的相关疾病未详细阐述。对于部分异质性比较强的2型炎症性疾病,目前尚缺乏针对其炎症表型的直接判断依据及相应的用药指导。随着对2型炎症性疾病的深入研究,相信会有更清晰的证据揭示2型炎症是如何参与这些疾病的发病机制,也会有更多的靶向药物问世,可为临床治疗、疾病管理和预后评估带来巨大获益。
参加本共识撰写的专家名单(按姓氏汉语拼音首字母排序):程雷(江苏省人民医院耳鼻咽喉科);耿松梅(西安交通大学附属第二医院皮肤科);郭胤仕(上海交通大学医学院附属仁济医院过敏科);金美玲(复旦大学附属中山医院呼吸科);李靖(广州医科大学附属第一医院变态反应科);刘春涛(四川大学华西医院呼吸与危重症医学科);刘光辉(武汉大学中南医院过敏反应科);骆肖群(复旦大学附属华山医院变态反应科);邵洁(上海交通大学医学院附属瑞金医院儿内科);孙英(首都医科大学基础医学院免疫学系);王成硕(首都医科大学附属北京同仁医院鼻科);王良录(北京协和医院变态反应科);王炜(首都医科大学基础医学院免疫学系);徐金华(复旦大学附属华山医院皮肤科);赵京(首都儿科研究所附属儿童医院变态反应科)
参与本共识审阅及讨论的专家名单(按姓氏汉语拼音首字母排序):鲍一笑(上海童杏儿科过敏性咳嗽门诊);蒋萍(天津市第一中心医院呼吸科);赖荷(广州医科大学附属第二医院过敏反应科);李冬芹(郑州大学第一附属医院皮肤科);刘昀(西安交通大学第二附属医院呼吸内科);魏庆宇(中国医科大学附属盛京医院过敏反应科);谢华(北部战区总医院呼吸内科);张焕萍(山西白求恩医院过敏反应科)
所有作者均声明不存在利益冲突


























