
分析 2019年3至7月首都医科大学附属北京安贞医院心内科行心腔内超声指导下的室间隔射频消融术的肥厚性梗阻型心肌病(HOCM)患者的临床资料。所有患者术前测量左心室流出道压力阶差(LVOTG)均>50 mmHg(1 mmHg=0.133 kPa),且药物控制效果不佳,经腔内超声重建相关结构后,应用盐水灌注压力导管在超声指导下放电消融。本研究共纳入HOCM患者9例,其中男6例,平均年龄(51.7±12.2)岁,所有患者均成功接受间隔射频消融术,手术时间为(152.2±31.9)min,放电时间(838.4±227.3)s;除1例患者外,其余患者术后复测LVOTG较术前有所下降(P=0.001),且均<50 mmHg;所有患者术后二尖瓣收缩期前向运动消失,无围手术期严重并发症发生;随访过程中患者LVOTG保持稳定。本研究发现心腔内超声指导的室间隔射频消融可安全有效地降低HOCM患者的LVOTG,并可产生较持久的效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肥厚性梗阻型心肌病(HOCM)是一种以室间隔或心尖部心肌非对称性肥厚,且左室流出道存在显著压力阶差(≥30 mmHg,1 mmHg=0.133 kPa)为主要特征的遗传性心肌病,该疾病严重困扰患者生活,并可导致胸痛、晕厥,甚至猝死等临床不良结局[1]。尽管外科室间隔切除术被认为是治疗HOCM的金标准,但因手术创伤大、术后存在症状性残存梗阻的可能,限制了该术式的广泛应用。室间隔化学消融作为微创介入治疗方式,可缓解左心室流出道压力阶差(LVOTG),但仍存在梗死范围不易控制、房室传导阻滞风险高以及起搏术后无应答等问题。导管消融技术既往被广泛用于治疗快速型心律失常,近年来随着心腔内超声的应用,经导管室间隔射频消融术成为治疗HOCM的一项重要治疗手段。上述两种技术的应用结合,可实现室间隔靶点的准确定位和实时评估,并可避免对希氏(His)束以及束支传导系统造成损伤。迄今为止,已有多项研究对HOCM室间隔射频消融术的有效性与安全性结果进行了报道[2],但从消融数据来看,目前尚无该术式统一标准化的流程,且各中心的消融方法存在较大差别。本研究就首都医科大学附属北京安贞医院心内科的9例HOCM室间隔射频消融病例进行总结,以期提供该术式操作的初期经验,进一步推动该术式在HOCM诊疗中的应用。
1. 研究对象:本研究为回顾性随访研究。收集 2019年3至7月首都医科大学附属北京安贞医院心内科行心腔内超声指导下的室间隔射频消融术的HOCM患者的临床资料。纳入标准:(1)年龄≥18岁;(2)明确诊断为HOCM的患者;(3)采用连续多普勒超声评估,静息状态下或活动后LVOTG≥50 mmHg;(4)在使用最大可耐受剂量的药物(β受体阻滞剂及钙通道拮抗剂)后症状控制效果不佳。排除标准:既往有接受外科室间隔切除术或室间隔酒精消融术史的患者。
本研究获得首都医科大学附属北京安贞医院医学伦理委员会批准(批号:2022179X),所有受试者均在研究前签署知情同意书。
2. 手术策略:所有患者于局部麻醉镇静状态下行室间隔射频消融术,术中穿刺双侧股动、静脉,经股静脉途径置入4极导管于右心室心尖部作起搏备用。经股动脉途径分别置入6F猪尾导管两根于主动脉窦底以及左心室心尖部,分别接入压力传感器复测LVOTG水平(图1)。如静息状态下LVOTG≤50 mmHg则静脉泵入多巴酚丁胺(起始剂量5 μg·min-1·kg-1,最大剂量20 μg·min-1·kg-1)行激发试验。


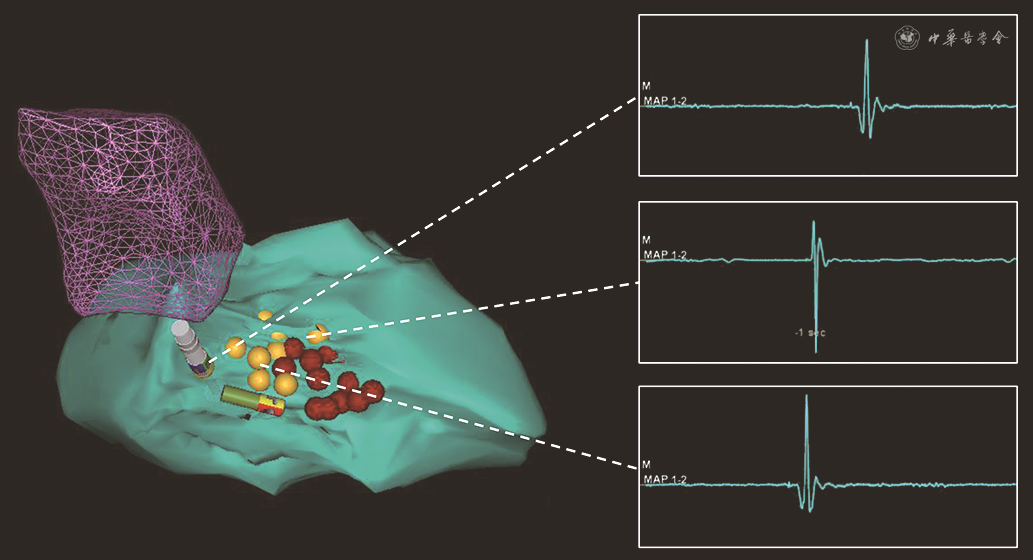
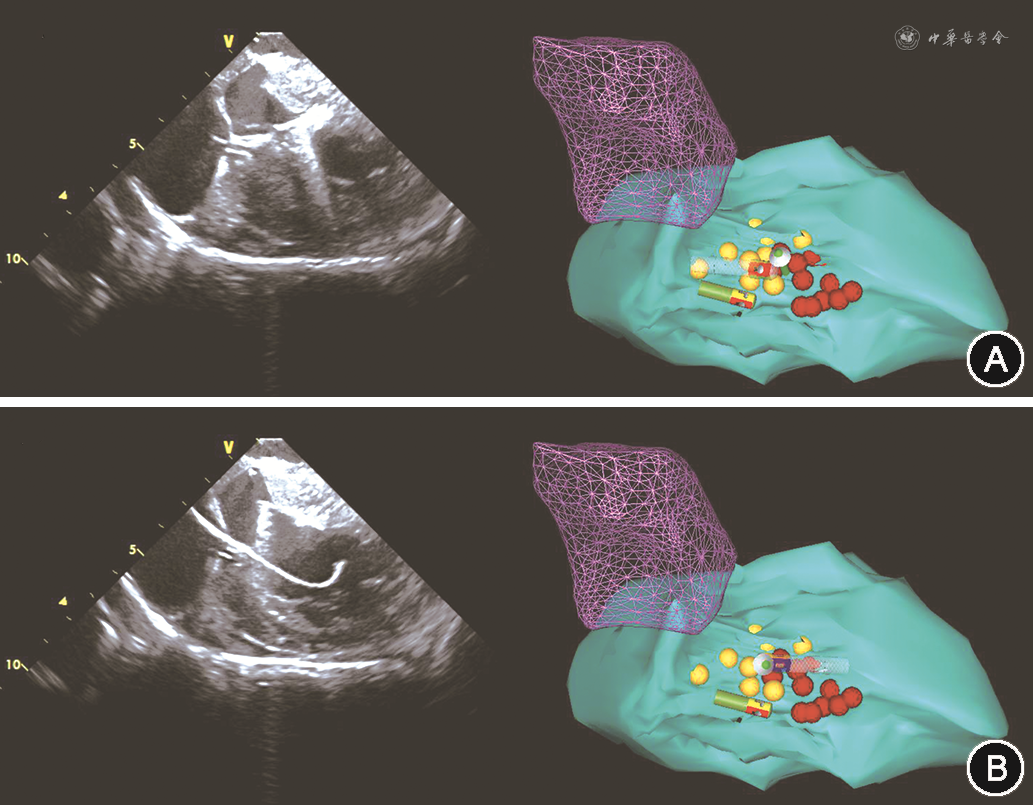
如HOCM诊断无误后,则经左侧股静脉置入心腔内超声导管(美国Biosense Webster公司,规格型号:CartoSound)行左右心室以及流出道等结构的三维重建,重点重建左心室流出道、室间隔以及二尖瓣后叶,并在左心室长轴切面观察二尖瓣收缩期前向运动(SAM征)(图2)。完成超声指导的心腔三维重建后,经右侧股动脉经主动脉逆行途径送入4 mm冷盐水灌注导管(美国Biosense Webster公司,规格型号:Navi-Star Thermo-CoolTM)至左心室,在Carto3标测系统指导下首先在原左心室解剖上标记His束以及分支走形的空间位置(图3)。随后超声扇面调整至与左心室长轴平行以显露梗阻位置,顺时针转动消融导管贴靠室间隔。使用40 W功率模式(初始盐水流速20 ml/min,温度上限45 ℃)逐点放电消融,保证压力贴靠在10~15 g,每点放电时间40 s(图4)。在完成10~15个局灶消融点,同时心腔内超声提示局部(最厚)室间隔处回声增强且梗阻解除(SAM征消失)后撤出消融导管,复测LVOTG。如复测LVOTG不满意,则在原消融部位及周边巩固消融放电10~12次后结束手术。


注:绿色结构为左心室;暗紫色网格结构为主动脉窦;棕色网格结构为右心室

注:绿色结构为左心室;暗紫色网格结构为主动脉窦

注:绿色结构为左心室;暗紫色网格结构为主动脉窦;黄色为可记录到束支电位点;红色为消融点
为防止术中发生流出道急性梗阻,术中持续予以心电血压监测。术中一次性予以肝素5 000 U并维持ACT>300 s,部分患者如经主动脉逆行途径贴靠不满意或梗阻严重导管无法顺利送至消融靶点,则穿刺房间隔在长鞘辅助下(美国St. Jude Medical公司,规格型号:SL1)经顺行途径进行直接贴靠,并适当补充肝素用量。
3. 术后治疗及随访策略:术后第2天复查超声心动图,评估并统计围手术期并发症。出院后维持原有药物治疗,并加用抗凝药物服用1个月。术后每个月进行随访,至少随访3个月,每次随访时进行超声心动图评估LVOTG变化。
4. 统计学分析:采用SPSS 21.0软件进行数据分析。符合正态分布的计量资料以表示,手术前后比较采用t检验,不符合正态分布的计量资料以M(Q1,Q3)表示。双侧检验,检验水准α=0.05。
1. 患者一般资料:本研究共纳入HOCM患者9例,年龄(51.7±12.2)岁,其中男6例。所有患者术前接受最大可耐受剂量的β受体阻滞剂或钙通道拮抗剂治疗6个月以上,仍存在显著症状,美国纽约心脏病学会(NYHA)分级为Ⅲ级。术前超声心动图提示患者平均室间隔厚度为(19.7±3.6)mm,静息LVTOG为(93.2±21.4)mmHg。
2.患者手术情况:除1(1/9)例患者外,其余患者术中复测静息LVOTG为(85.9±26.7)mmHg,均>50 mmHg。该患者进一步行异丙肾上腺素激发试验后提示LVOTG达到100 mmHg,符合行室间隔射频消融适应证。经过(22±6)次放电,所有患者均成功接受室间隔消融术,手术时间(152.2±31.9)min,放电时间(838.4±227.3)s,透视时间(565±181)s,其中3例患者同时经穿间隔途径和主动脉逆行途径进行消融。
3.患者手术后情况:除1例(1/9)患者外,其余患者术后复测平 均LVOTG为(44.0±15.0)mmHg,较术前平均LVOTG为(85.9±26.7)mmHg有所下降,差异有统计学意义(t=3.85,P=0.001),且均<50 mmHg。患者术后室间隔厚度为(18.4±3.4)mm,与术前相比,差异均无统计学意义(t=0.62,P=0.430)。所有患者SAM征均消失。术后1(1/9)例患者出现假性动脉瘤,其余患者均无围手术期并发症发生并于手术次日出院,所有患者术后继续维持原有药物治疗方案。
4. 术后随访情况:所有患者随访时间M(Q1,Q3)为4(3,6)个月,4(4/9)例患者心功能NYHA分级提高了1级,5(5/9)例患者心功能NYHA分级提高了2级。消融后,1(1/9)例患者术后即刻LVOTG变化不明显,其余患者均显著下降,平均下降(55.4±19.4)mmHg,随访3个月后,LVOTG较术前平均下降(68.7±27.6)mmHg。术后1个月和3个月行24 h动态心电图检查,所有患者未见房室传导阻滞或左束支传导阻滞。
本研究发现,心腔内超声与三维电解剖标测系统的联合应用可准确识别消融靶点,有效避免传导系统的损伤。该术式可安全有效地降低HOCM患者的LVOTG,并可产生较持久的效果。
HOCM的非药物治疗主要包括外科室间隔切除术和室间隔酒精消融术。其中外科室间隔切除术被视为治疗HOCM的金标准[3],但该术式创伤较大,在不同中心并发症及死亡率依术者经验而异[4, 5]。多项研究证实室间隔酒精消融与外科手术具有相似的临床结局[6, 7]。但对于某些特殊患者,如冠脉解剖特殊,间隔支细小、已存在束支传导阻滞、高龄虚弱合并症多或对造影剂过敏的患者,也存在诸多局限[8]。
经导管射频能量进行室间隔消融始于2004年,术后短期观察发现无论是心功能指标还是解剖参数均具有较明显的改善[9]。后期发表的文献在三维标测系统以及食道超声指导下消融,早期结果显示尽管该术式可较为稳定地降低LVOTG,但三度房室传导阻滞、心包填塞以及急性肺水肿等发生概率较高[2]。2015年Cooper等[10]首次报道了心腔内超声联合压力导管在HOCM患者中的初步应用结果,随着经验的积累,并发症的发生概率有所下降[11]。
在室间隔射频消融术中,心腔内超声发挥了重要的作用。首先,经心腔内超声重建后室间隔的空间位置可以直观展现。其次,心腔内超声扇面可以直接显示室间隔梗阻程度以及SAM征变化,评估患者整体心肌肥厚程度范围以及消融后效果。此外,在术中及术毕时心腔内超声还可对并发症进行实时评估,如心包积液、急性流出道梗阻、瓣膜反流以及急性血栓形成等需要紧急处理的并发症。此外,心腔内超声可最大限度减少射线暴露量。笔者对一名妊娠合并HOCM患者使用了心腔内超声指导的LVOTG测压,将超声扇面旋转至左室长轴并展示左心室最大展开切面,可顺利将导丝及猪尾导管送至心尖部,继而回撤猪尾导管至主动脉窦底完成测压,全程达到零射线暴露。
在有效性方面发现所纳入患者在术后即刻LVOTG下降显著,并可在术后的短期随访内保持稳定。既往研究提示,尽管部分患者在术后即刻的LVOTG仍>50 mmHg,但在随访过程中患者的症状和LVOTG可有显著改善[12]。虽然该术式仍缺乏长期随访数据,但因其可靠的安全性,可在随访中存在LVOTG进展或效果不佳的患者中再次行射频消融。值得注意的是,笔者发现手术本身并未对室间隔厚度造成明显的改变,推测可能原因在于:(1)消融能量直接对肥厚心肌产生损伤,导致收缩功能降低减轻局部梗阻;(2)消融后可造成局部心室收缩顺序的改变,从而达到解除梗阻的目的。此外,为减轻梗阻并不需要采取高功率长时间的消融策略,笔者认为消融成功的关键在于对局部梗阻心肌产生持久的深部损伤,而非大面积的片状消融。进一步通过降低功率、减少放电时间也有助于提高手术的安全性。
本研究的局限性主要在于样本量较小、随访时间较短,无法提供该术式安全性与有效性的确切数据,本研究仅对这一术式的可行性进行初步评估。此外未对患者的心功能进行系统性的评价,随访资料中缺乏心脏磁共振评估资料。期待未来大规模的前瞻性队列研究结果可以对上述问题进行解答。
所有作者均声明不存在利益冲突



























