
比较高敏定量粪便免疫化学试验(hs-qFIT)和定性粪便隐血试验(FOBT)对结直肠癌和进展期腺瘤的筛查价值。
连续纳入2020年4月至2021年4月在山东大学齐鲁医院行结肠镜检查的50~75岁的结直肠癌中高危人群,所有研究对象在结肠镜检查前完成hs-qFIT、胶体金法和免疫-化学双联法检测。通过灵敏度和特异度等指标比较hs-qFIT和2种定性FOBT检出结直肠癌和进展期腺瘤的效能。
共纳入910例研究对象,男451例,女459例,年龄(59.6±6.4)岁。包括结直肠癌22例(2.4%)、进展期腺瘤61例(6.7%)、非进展期腺瘤276例(30.3%)、非腺瘤性息肉194例(21.3%)、其他病变85例(9.3%)和无异常272例(29.9%)。hs-qFIT检测结直肠癌的截断值从200 ng/ml降至10 ng/ml时,灵敏度从72.7%(95%CI:49.6%~88.4%)升至100%(95%CI:81.5%~100%),胶体金法和免疫-化学双联法检出结直肠癌的灵敏度均为63.6%(95%CI:40.8%~82.0%),低于hs-qFIT在10 ng/ml截断值时检出结直肠癌的灵敏度(P=0.008)。hs-qFIT检出结直肠癌的稳定性高于胶体金法(P=0.016)和免疫-化学双联法(P=0.031)。hs-qFIT在10 ng/ml时检出进展期腺瘤的灵敏度为52.5%(95%CI:39.4%~65.2%),高于胶体金法的13.1%(95%CI:6.2%~24.8%)(P<0.001)和免疫-化学双联法的6.6%(95%CI:2.1%~16.7%)(P<0.001)。
hs-qFIT检出结直肠癌的灵敏度高于定性FOBT,且稳定性更高;使用更低浓度的截断值可提高检出进展期腺瘤的灵敏度。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经济社会发展影响结直肠癌的发病率和死亡率[1],以中国为代表的中、高水平人类发展指数国家近年来结直肠癌发病率和死亡率不断升高,而以美国和日本为代表的极高水平人类发展指数国家,由于筛查的普及,发病率和死亡率均呈下降趋势[2]。粪便免疫隐血试验(fecal occult blood test,FOBT)是结直肠癌筛查的首选方式之一[3]。FOBT分为化学法(愈创木酯法)和粪便免疫化学试验(fecal immunochemical test,FIT)。FIT不受药物和饮食的影响,比化学法的准确性高。FIT分为定性法和定量法,定量FIT通过仪器检测血红蛋白浓度,结果的准确性和稳定性优于定性FIT[4, 5]。目前常规定量FIT的检测范围为50~800 ng/ml(10~160 μg/g)[6],高敏定量FIT(hypersensitive quantitative FIT,hs-qFIT)可将检测下限降至10 ng/ml。前期研究表明截断值降至10 ng/ml可提高对结直肠癌特别是进展期腺瘤的检出率,对促进结直肠癌筛查具有重要意义[7]。目前缺乏hs-qFIT对比定性法检出结直肠癌和进展期腺瘤的研究,本研究拟通过比较hs-qFIT、胶体金法和免疫-化学双联法对结直肠癌和进展期腺瘤的筛查效能,探究更有效的结直肠癌筛查方式。
横断面研究。连续纳入2020年4月至2021年4月于山东大学齐鲁医院进行结肠镜检查的受试者。纳入标准:(1)年龄50~75岁;(2)亚太结直肠肿瘤筛查评分系统(Asia-Pacific colorectal screening scoring system,APCS)评估为结直肠癌中、高危人群[8]。排除标准:(1)有结直肠癌病史和外科手术史,炎症性肠病或缺血性肠炎等可能导致结直肠出血的肠道疾病;(2)近期有血便、血尿、严重腹泻和水样便;(3)处于月经期、妊娠期或哺乳期的女性;(4)患有严重基础疾病导致难以耐受完整结肠镜检查。本研究通过山东大学齐鲁医院伦理委员会的审核和批准[批号KYLL-2019(KS)-348],所有研究对象均签署知情同意书。
所有研究对象均接受一对一的宣教,充分掌握样本采集要求。在进行结肠镜检查前的1周内,所有研究对象均需在同一次、完整的自然排便中,使用配备的采集盒获取3个样本,其中hs-qFIT使用样本采集管完成。完成hs-qFIT样本采集后,研究对象于4 h内将采集管和装有粪便的采集盒交给研究者。
研究者收到粪便样本后立刻对采集盒内的粪便样本完成2种FOBT检测,并在24 h内使用AC-Screen hs-qFIT分析系统(大连中孚生物工程有限公司)完成hs-qFIT检测[9]。2种定性FOBT分别为大便隐血检测试剂盒(胶体金法)(上海凯创生物技术有限公司)和大便隐血检测试剂盒(双联法)(天津中新科炬生物制药股份有限公司),分别简称为胶体金法和双联法,截断值均为200 ng/ml。其中,双联法为化学-免疫法联合使用,最终结果以免疫法为准;化学法用于防止钩状效应、排除假阴性结果,若化学法为阳性,需稀释样本至阴性后根据免疫法确定结果。hs-qFIT结果以数值表示,2种定性FOBT的结果以阳性/阴性表示。研究者在进行定性FOBT检测时不知道hs-qFIT和结肠镜结果。
所有的结肠镜由资深内镜医师(≥2 000例结肠镜经验)完成,内镜医师对粪便样本的检测结果不知情。肠道准备不合格(波士顿评分<6分)和没有完成完整结肠镜的研究对象被剔除。完整的结肠镜检查包括到达盲肠或由于恶性病变阻塞肠腔导致无法到达盲肠。检查过程中发现的病变均需明确病理性质,根据最严重的组织学特征,将研究对象分为结直肠癌、进展期腺瘤、非进展期腺瘤、非腺瘤性息肉、其他病变和无异常。其中,进展期腺瘤指腺瘤直径≥1 cm,为绒毛状腺瘤或绒毛成分≥25%,或具有高级别上皮瘤变;其他病变包括炎症性肠病、黏膜下病变、结肠憩室等。病理诊断由2位病理科主任医师独立判断,若结果矛盾则以第3位主任医师支持的结果为准。
使用SPSS 24.0进行统计学分析。计量资料符合正态分布以表示,不符合正态分布时以M(Q1,Q3)表示。以结肠镜和病理诊断为金标准,使用阳性率、灵敏度、特异度、阳性预测值和阴性预测值及其95%CI评价FOBT对结直肠癌和进展期腺瘤的筛查效能。使用McNemar检验评价定性FOBT与hs-qFIT筛查结直肠癌和进展期腺瘤的差异。均为双侧检验,检验水准α=0.05。
共有1 331例研究对象符合纳入标准,因结直肠癌病史(198例)、炎症性肠病病史(21例)和拒绝参与(171例)排除198例,纳入1 133例;剔除未返回粪便样本(158例)、肠道准备不合格(17例)、未完成完整结肠镜检查(5例)、取消结肠镜检查(43例)者,最终纳入910例研究对象,男451例(49.6%),女459例(50.4%),年龄(59.6±6.4)岁,体质指数(24.4±3.9)kg/m2。健康查体者452例(49.7%),腹痛或腹部不适292例(32.1%),腹泻51例(5.6%),便秘44例(4.8%),大便习惯改变者50例(5.5%),其他原因21例(2.3%)。糖尿病92例(10.1%),高血压219例(24.1%),有一级亲属结直肠癌家族史者44例(4.8%);有饮酒史226例(24.8%),吸烟史229例(25.2%)。
910例研究对象中包括22例(2.4%)结直肠癌,61例(6.7%)进展期腺瘤,276例(30.3%)非进展期腺瘤,194例(21.3%)非腺瘤性息肉,85例(9.3%)其他病变和272例(29.9%)无异常者。hs-qFIT的截断值为10、50、75、100和200 ng/ml时的阳性率分别为15.2%、7.0%、6.0%、5.3%和4.1%。胶体金法和双联法的阳性率分别为4.4%和5.1%。结直肠癌、进展期腺瘤、非进展期腺瘤、非腺瘤性息肉、其他病变和无异常者的粪便血红蛋白浓度分别为316.6(165.9,2 623.1)ng/ml、10.7(1.7,38.0)ng/ml、0.8(0,2.3)ng/ml、0.1(0,2.0)ng/ml、1.1(0,6.4)ng/ml和0.5(0,1.4)ng/ml。
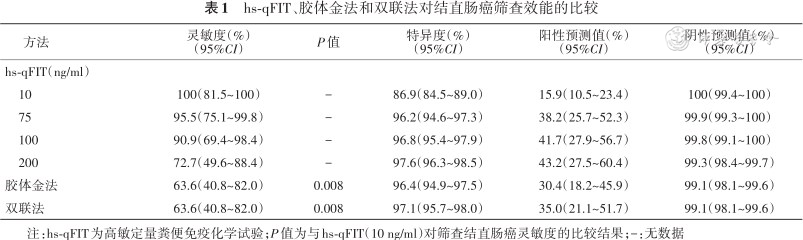
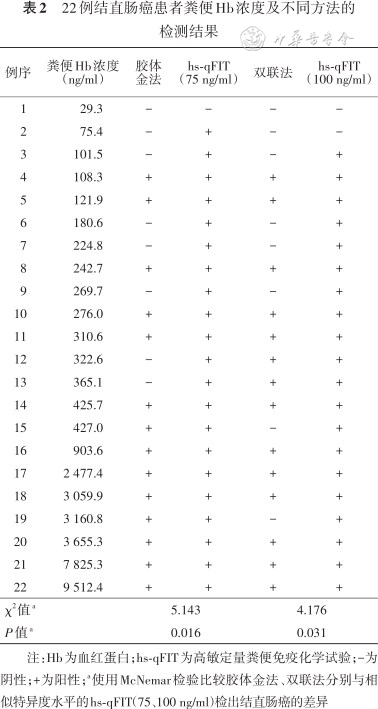
随着截断值从200 ng/ml降至10 ng/ml,hs-qFIT检出结直肠癌的灵敏度从72.7%(95%CI:49.6%~88.4%)升至100%(95%CI:81.5%~100%),特异度从97.6%(95%CI:96.3%~98.5%)降至86.9%(95%CI:84.5%~89.0%)。胶体金法和双联法检出结直肠癌的灵敏度均为63.6%(95%CI:40.8%~82.0%),低于hs-qFIT在10 ng/ml时检出结直肠癌的灵敏度(P=0.008)(表1);特异度分别为96.4%(95%CI:94.9%~97.5%)和97.1%(95%CI:95.7%~98.0%)。在相似特异度水平下,胶体金法和双联法检出结直肠癌的稳定性均低于hs-qFIT(均P<0.05)(表2)。
hs-qFIT、胶体金法和双联法对结直肠癌筛查效能的比较
hs-qFIT、胶体金法和双联法对结直肠癌筛查效能的比较
| 方法 | 灵敏度(%) (95%CI) | P值 | 特异度(%) (95%CI) | 阳性预测值(%) (95%CI) | 阴性预测值(%) (95%CI) |
|---|---|---|---|---|---|
| hs-qFIT(ng/ml) | |||||
| 10 | 100(81.5~100) | - | 86.9(84.5~89.0) | 15.9(10.5~23.4) | 100(99.4~100) |
| 75 | 95.5(75.1~99.8) | - | 96.2(94.6~97.3) | 38.2(25.7~52.3) | 99.9(99.3~100) |
| 100 | 90.9(69.4~98.4) | - | 96.8(95.4~97.9) | 41.7(27.9~56.7) | 99.8(99.1~100) |
| 200 | 72.7(49.6~88.4) | - | 97.6(96.3~98.5) | 43.2(27.5~60.4) | 99.3(98.4~99.7) |
| 胶体金法 | 63.6(40.8~82.0) | 0.008 | 96.4(94.9~97.5) | 30.4(18.2~45.9) | 99.1(98.1~99.6) |
| 双联法 | 63.6(40.8~82.0) | 0.008 | 97.1(95.7~98.0) | 35.0(21.1~51.7) | 99.1(98.1~99.6) |
注:hs-qFIT为高敏定量粪便免疫化学试验;P值为与hs-qFIT(10 ng/ml)对筛查结直肠癌灵敏度的比较结果;-:无数据
22例结直肠癌患者粪便Hb浓度及不同方法的检测结果
22例结直肠癌患者粪便Hb浓度及不同方法的检测结果
| 例序 | 粪便Hb浓度(ng/ml) | 胶体 金法 | hs-qFIT (75 ng/ml) | 双联法 | hs-qFIT (100 ng/ml) |
|---|---|---|---|---|---|
| 1 | 29.3 | - | - | - | - |
| 2 | 75.4 | - | + | - | - |
| 3 | 101.5 | - | + | - | + |
| 4 | 108.3 | + | + | + | + |
| 5 | 121.9 | + | + | + | + |
| 6 | 180.6 | - | + | - | + |
| 7 | 224.8 | - | + | - | + |
| 8 | 242.7 | + | + | + | + |
| 9 | 269.7 | - | + | - | + |
| 10 | 276.0 | + | + | + | + |
| 11 | 310.6 | + | + | + | + |
| 12 | 322.6 | - | + | + | + |
| 13 | 365.1 | - | + | + | + |
| 14 | 425.7 | + | + | + | + |
| 15 | 427.0 | + | + | - | + |
| 16 | 903.6 | + | + | + | + |
| 17 | 2 477.4 | + | + | + | + |
| 18 | 3 059.9 | + | + | + | + |
| 19 | 3 160.8 | + | + | - | + |
| 20 | 3 655.3 | + | + | + | + |
| 21 | 7 825.3 | + | + | + | + |
| 22 | 9 512.4 | + | + | + | + |
| χ2值a | 5.143 | 4.176 | |||
| P值a | 0.016 | 0.031 | |||
注:Hb为血红蛋白;hs-qFIT为高敏定量粪便免疫化学试验;-为阴性;+为阳性;a使用McNemar检验比较胶体金法、双联法分别与相似特异度水平的hs-qFIT(75、100 ng/ml)检出结直肠癌的差异
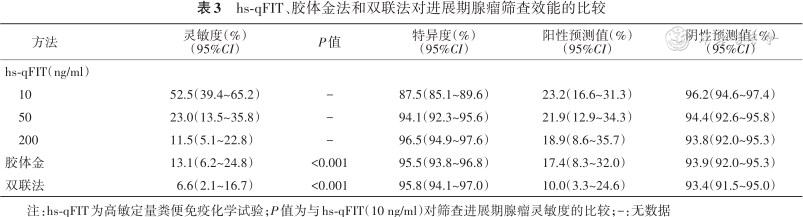
随着截断值从200 ng/ml降至10 ng/ml,hs-qFIT检出进展期腺瘤的灵敏度从11.5%(95%CI:5.1%~22.8%)升至52.5%(95%CI:39.4%~65.2%),特异度从96.5%(95%CI:94.9%~97.6%)降至87.5%(95%CI:85.1%~89.6%)。胶体金法和双联法检出进展期腺瘤的灵敏度分别为13.1%(95%CI:6.2%~24.8%)和6.6%(95%CI:2.1%~16.7%),均低于hs-qFIT在10 ng/ml时检出进展期腺瘤的灵敏度(均P<0.001)(表3)。
hs-qFIT、胶体金法和双联法对进展期腺瘤筛查效能的比较
hs-qFIT、胶体金法和双联法对进展期腺瘤筛查效能的比较
| 方法 | 灵敏度(%) (95%CI) | P值 | 特异度(%) (95%CI) | 阳性预测值(%) (95%CI) | 阴性预测值(%) (95%CI) |
|---|---|---|---|---|---|
| hs-qFIT(ng/ml) | |||||
| 10 | 52.5(39.4~65.2) | - | 87.5(85.1~89.6) | 23.2(16.6~31.3) | 96.2(94.6~97.4) |
| 50 | 23.0(13.5~35.8) | - | 94.1(92.3~95.6) | 21.9(12.9~34.3) | 94.4(92.6~95.8) |
| 200 | 11.5(5.1~22.8) | - | 96.5(94.9~97.6) | 18.9(8.6~35.7) | 93.8(92.0~95.3) |
| 胶体金 | 13.1(6.2~24.8) | <0.001 | 95.5(93.8~96.8) | 17.4(8.3~32.0) | 93.9(92.0~95.3) |
| 双联法 | 6.6(2.1~16.7) | <0.001 | 95.8(94.1~97.0) | 10.0(3.3~24.6) | 93.4(91.5~95.0) |
注:hs-qFIT为高敏定量粪便免疫化学试验;P值为与hs-qFIT(10 ng/ml)对筛查进展期腺瘤灵敏度的比较;-:无数据
本研究比较了hs-qFIT和2种定性FOBT对结直肠癌和进展期腺瘤的筛查效能,相比定性法,在相同特异度或截断值时hs-qFIT对结直肠癌的灵敏度更高,主要由于定性法检出结直肠癌的稳定性较差。在相同特异度或截断值时,定性法筛查进展期腺瘤的灵敏度极低,缺乏临床价值,而当hs-qFIT的截断值降至10 ng/ml时,可显著提高对进展期腺瘤的灵敏度。
随着筛查普及,使用FOBT进行筛查的人群结直肠癌死亡率下降[10],已逐渐成为结直肠癌筛查的首选方法之一[11, 12]。目前我国结直肠癌人群筛查最常使用的方法为定性FIT[13, 14, 15],但是定性FIT通过手工检测和肉眼读数,不适合在大范围的筛查中应用。现阶段定性FIT预设的截断值往往较高(≥200 ng/ml),同时由于检测的主观性,导致定性FIT检出结直肠癌的稳定性较差,筛查进展期腺瘤的效能较低。本研究中定性法筛查结直肠癌的灵敏度为63.6%~77.3%,特异度为92.6%~97.1%。由于不同品牌的检测难以直接进行结果比较[16],比较相同水平特异度下不同FOBT对结直肠癌和进展期腺瘤的灵敏度,定性法对结直肠癌的灵敏度明显低于hs-qFIT。常规定量FIT对结直肠癌的灵敏度可达到90%[10,17],但由于50 ng/ml的检测下限仍无法检出大部分出血较低的进展期腺瘤,hs-qFIT将检测下限进一步降至10 ng/ml,可为定量FIT的临床应用提供更大的参考范围,进一步提高对进展期腺瘤和结直肠癌的检出率。对于结直肠癌,hs-qFIT的灵敏度均优于定性法,这与既往在人群筛查中获得结论保持一致[18]。hs-qFIT在100 ng/ml及更低截断值对结直肠癌均有较高的灵敏度,同水平特异度(对应75和100 ng/ml截断值)下hs-qFIT检出结直肠癌的能力高于定性法,因此定性法检测结直肠癌的稳定性影响其筛查的效能[19]。对于进展期腺瘤,定性法和相同特异度时hs-qFIT的灵敏度均过低(6.6%~27.9%),缺乏临床应用价值。当hs-qFIT的截断值降低至10 ng/ml时对进展期腺瘤的灵敏度升至52.5%,具有应用意义[20]。因此,hs-qFIT筛查结直肠癌和进展期腺瘤的稳定性和效能整体优于定性法。
本研究使用一日法hs-qFIT筛查结直肠癌和进展期腺瘤,所有研究对象在样本采集前均掌握标准的样本采集手法。既往研究中进行粪便样本采集培训后定量FIT筛查结直肠癌可获得更加满意的灵敏度和特异度(50 ng/ml,96.0%和95.7%)[9],本研究在相同截断值时的灵敏度和特异度与之保持一致。因此,在充分掌握采便方法的前提下,仅进行一日法检测即可能实现对结直肠癌理想的检出能力。在截断值为10 ng/ml时,本研究中一日法hs-qFIT筛查进展期腺瘤的灵敏度为52.5%,低于既往研究中两日法hs-qFIT的灵敏度(66.0%)[7],这说明即使截断值低至10 ng/ml且保证高质量样本采集,也需要两日法才可以获得对进展期腺瘤更加满意的灵敏度。
本研究存在一些局限性。首先,本研究为单中心研究,研究结论需要通过更多中心的验证;此外,本研究的研究对象包括有消化道症状的人群,与无症状筛查人群相比患有结直肠癌的风险更高,更易被检出,因此本研究的结论需要在无症状的一般风险人群中进一步验证。
综上所述,在以中国为代表的国家,老龄化人口基数大,医疗资源相对短缺,需要一种有效的筛查方法来平衡筛查中沉重的人口负担和医疗资源,以实现更高的成本效益。除了无法进行批量自动化检测外,定性FIT筛查结直肠癌的不稳定性和筛查进展期腺瘤的低效能,都可能导致定性FIT在筛查中面临诸多困难。推动定量FIT,尤其是可以达到更低浓度截断值的hs-qFIT,更有助于结直肠癌筛查的推广和发展。
所有作者均声明不存在利益冲突



























