
了解中性粒细胞淋巴细胞比值联合患病年龄在同时期双表型肝细胞癌(DPHCC)患者与非双表型肝细胞癌(非DPHCC)患者中临床诊断价值,以寻求快捷有效的鉴别诊断生物标志物。
回顾性分析2017年5月至2020年5月南通大学附属医院行根治性肝癌切除术的患者164例,其中DPHCC共29例(17.7%),非DPHCC共135例(82.3%)。统计以上患者临床病历资料,包括患者基本信息、临床症状体征、传染病史、术前1 d实验室化验指标、术后病理报告等相关资料,术后随访时间18个月,资料完整。通过分析同时期DPHCC患者与非DPHCC患者的临床病历资料,以寻找快捷有效的鉴别诊断指标物,并探讨提示DPHCC患者预后不良的指标。
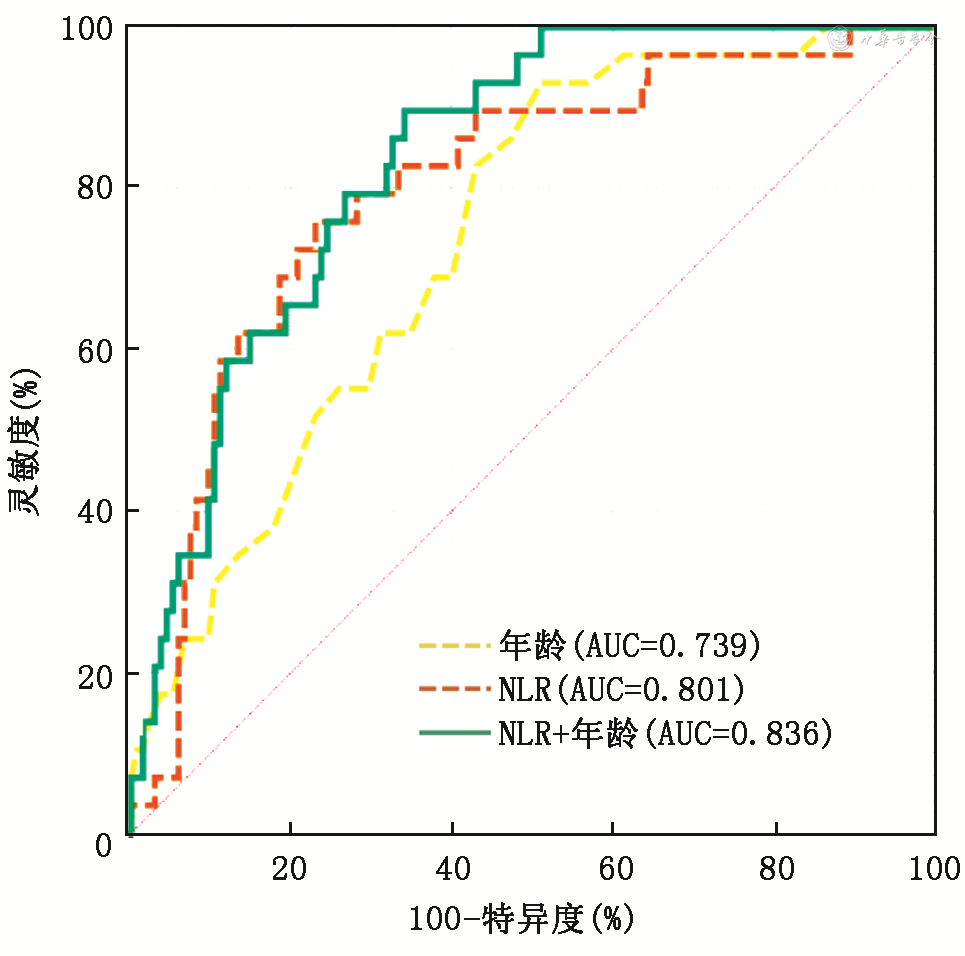
单因素方差分析显示,DPHCC和非DPHCC组患者患病年龄[(53.9±10.0)与(62.6±9.1)岁]、甲胎蛋白[143(4.8~984.8)与9.9(2.8~71.3)μg/L]、中性粒细胞淋巴细胞比值(NLR)(3.650±1.924与2.220±1.486)、中性粒细胞数、淋巴细胞数、脉管浸润率、TNM分期、中国肝癌分期(CNLC)、Child分级和日本综合分期评分(JIS)等方面差异均有统计学意义(均P<0.05)。多因素logistic回归分析确定患病年龄(OR值:0.967,95%CI:0.860~0.957)和NLR(OR值:1.564,95%CI:1.205~2.029)为DPHCC鉴别诊断的危险因素。利用受试者工作特征(ROC)曲线评价后发现NLR的诊断效能最大,最佳截断值为2.586。其联合患病年龄可提高鉴别诊断能效性,最大的诊断效能为曲线下面积(AUC)=0.836,灵敏度为89.66%,特异度为65.93%。
NLR联合患病年龄对预测DPHCC具有一定的可行性,或可成为鉴别DPHCC与非DPHCC患者的有效指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝癌是全球第六大常见癌症之一,也是第四大常见癌症死亡原因。肝细胞癌(hepatocellular carcinoma,HCC)和肝内胆管癌(intrahepatic cholangicarcinoma,iCCA)是原发性肝癌最常见的两个发展方向,其发病率分别占肝癌患者的70%和15%[1, 2]。随着研究的不断深入,双表型肝细胞癌(dual-phenotype hepatocellular carcinoma,DPHCC)作为肝细胞癌的一种新亚型,于2015年在《原发性肝癌规范化病理诊断指南(2015年版)》中作为病理常规诊断提出[3],这些肿瘤占所有原发性肝癌的1%~14%。DPHCC同时具有HCC和iCCA的双重表型特征,具有更强的侵袭性和更差的预后,术后复发率远高于非双表型肝细胞癌(non-dual-phenotype hepatocellular carcinoma,非DPHCC),且生存率较低[4]。不幸的是,DPHCC的术前诊断非常困难,缺乏特异性的非侵入性确诊手段。虽然DPHCC的肿瘤细胞可以同时产生甲胎蛋白(alpha fetoprotein,AFP)和糖类抗原199(carbohydrate antigens,CA199),血清中两种指标同时升高可提示为DPHCC。然而,在临床工作中只有少数的DPHCC患者表现出AFP和CA199同时升高[5]。最近的研究报告表明恶性肿瘤的发生发展,不仅与肿瘤细胞自身的特异性有关,还与机体对肿瘤细胞的反应有关,包括机体的炎症反应、免疫反应、营养状态和凝血功能等[6]。因此,本研究从较为容易获得的术前实验室检查项目中筛选具有诊断价值的生物标志物[如中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板淋巴细胞比值(platelet to lymphpcyte ratio,PLR)等],寻求新的对DPHCC具有诊断价值的无创、简便、准确性高的诊断标志物,同时探索DPHCC预后不良的相关因素。
选取2017年5月至2020年5月于南通大学附属医院行根治性肝癌切除术的患者164例。统计以上患者基本信息、临床症状体征、传染病史、术前1 d实验室化验指标、术后病理报告等相关资料,术后随访18个月,资料完整。该研究方案经南通大学附属医院伦理委员会审核通过(伦理审批号:2021-L112)。
纳入标准:(1)术前的影像学检查磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)或增强CT诊断为肝癌;术后的组织病理切片和免疫组织化学(免疫组化)染色证实为肝癌;(2)164例病例均为资料齐全、术后随访完整的初诊患者,患者均未接受过术前放化疗或其他转化治疗;(3)Child-Pugh肝功能分级为A或B级;(4)肝癌的诊断标准及分期按照最新的《原发性肝癌诊疗指南(2022年版)》[7];(5)双表型肝细胞癌的诊断主要依据病理学形态,具有肝细胞癌特征,同时表达HCC和胆管细胞癌的标志物,且细胞角质蛋白19片段(CK19)免疫组化染色呈强阳性[4,8]。
排除标准:(1)患者术前行局部消融治疗,乙醇注射或经动脉化疗栓塞术;(2)患者术前或术中发现多发转移,未行根治性切除;(3)Child-Pugh肝功能分级为C级;(4)其他系统患有严重的基础疾病;(5)临床资料不完整。
所有患者术后1个月进行复查,此后1年内每3个月复查1次,1年后每6个月复查1次。截至2021年12月,所有患者均随访至术后18个月,终点事件为患者复发、死亡或随访截止。将以上数据,分为DPHCC患者和非DPHCC患者两组,比较两组患者之间临床资料和实验室检查指标存在的差异;分析与DPHCC患者预后相关的指标;利用受试者工作特征(receiver operating characteristic curve,ROC)曲线探索有效鉴别DPHCC患者的诊断指标。
数据录入统一采用Epidata3.0 软件,应用SPSS 25.0.0.1、Medcalc 20.022、Graphpad Prism 8.0.2等软件对数据进行分析。应用p-p图检验计量资料是否符合正态分布,对于患病年龄、中性粒细胞、淋巴细胞等符合正态分布的计量资料以表示,两组间比较采用独立样本t检验;对于AFP、癌胚抗原(carcinoembryonic antigen,CEA)、CA199等不符合正态分布的数据采用M(Q1,Q3)进行表示,两组间比较采用Mann-Whitney U检验。计数资料以例(%)形式表示,组间比较采用χ2检验或 Fisher精确检验。同时利用ROC曲线评估生物指标单独或联合检测对DPHCC的诊断价值评价。总生存期(Overall Survival,OS)与无瘤生存期(disease free survival,DFS)采用Kaplan-Meier法进行检验分析。双侧检验,检验水准α=0.05。
本研究最终入组164例符合标准的患者,其中DPHCC共29例(17.7%),其中男26例(89.7%),女3例(10.3%),年龄(53.9±10.0)岁。非DPHCC共135例(82.3%),其中男108例(80.3%),女27例(19.7%),年龄(62.6±9.1)岁。两组在患病年龄、AFP、NLR、中性粒细胞数、淋巴细胞数、脉管浸润上差异均有统计学意义(均P<0.05)。DPHCC患者的AFP、中性粒细胞数、NLR高于非DPHCC患者,而患病年龄和淋巴细胞数均低于非DPHCC患者(均P<0.05),见表1。

双表型肝细胞癌(DPHCC)与非双表型肝细胞癌(非DPHCC)患者临床病例资料比较
双表型肝细胞癌(DPHCC)与非双表型肝细胞癌(非DPHCC)患者临床病例资料比较
| 项目 | DPHCC患者(n=29) | 非DPHCC患者(n=135) | t/Z/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 53.9±10.0 | 62.6±9.1 | -4.59 | <0.001 |
| 性别[例(%)] | 0.91 | 0.339 | ||
| 男 | 26(89.7) | 108(80.3) | ||
| 女 | 3(10.3) | 27(19.7) | ||
| AFP(μg/L) | 143(4.8~984.8) | 9.9(2.8~71.3) | -2.54 | 0.011 |
| CEA(μg/L) | 2.5(2.0~4.2) | 2.6(1.9~3.5) | -0.50 | 0.615 |
| CA199(μg/L) | 6.1(2.8~11.6) | 7.1(4.0~13.8) | -0.94 | 0.346 |
| APT(μg/L) | 96(34.5~477.5) | 90(34~776) | -0.06 | 0.952 |
| AST(U/L) | 32(22~45) | 32(24~47) | -0.62 | 0.537 |
| ALT(U/L) | 27(21~43) | 30(19~49) | -0.33 | 0.743 |
| ALP(U/L) | 97(87~114) | 75(96~119) | -0.76 | 0.447 |
| GGT(U/L) | 49(28~82) | 49(24~97) | -0.43 | 0.670 |
| FIB(g/L,) | 2.44±0.83 | 2.63±3.33 | -0.30 | 0.760 |
| PALB(g/L,) | 184.72±49.49 | 190.76±72.97 | -0.43 | 0.672 |
| ALB(g/L,) | 39.67±4.09 | 38.22±4.78 | 1.52 | 0.130 |
| PLT(×109/L,) | 134.72±59.27 | 143.11±62.37 | -0.61 | 0.545 |
| 淋巴细胞(×109/L,) | 1.16±0.45 | 1.50±0.66 | -2.66 | 0.009 |
| 中性粒细胞(×109/L,) | 3.83±1.67 | 2.81±1.32 | 3.57 | <0.001 |
| LSR() | 1.039±0.365 | 0.969±0.371 | 0.92 | 0.361 |
| FPR() | 0.016 1±0.013 9 | 0.015 8±0.017 9 | 0.07 | 0.943 |
| FAR | 0.554(0.425~0.682) | 0.566(0.479~0.685) | -0.16 | 0.873 |
| GPR() | 0.511±0.398 | 0.689±0.834 | -1.72 | 0.090 |
| PLR() | 122.863±50.130 | 104.168±52.920 | 1.74 | 0.083 |
| NLR() | 3.650±1.924 | 2.220±1.486 | 4.45 | <0.001 |
| 乙肝[例(%)] | 3.55 | 0.060a | ||
| 有 | 25(86.2) | 93(68.9) | ||
| 无 | 4(13.8) | 42(31.1) | ||
| 肝硬化[例(%)] | 0.26 | 0.607a | ||
| 有 | 12(41.4) | 49(36.3) | ||
| 无 | 17(58.6) | 86(63.7) | ||
| 腹水[例(%)] | - | 0.575b | ||
| 有 | 3(10.3) | 23(17.0) | ||
| 无 | 26(89.7) | 112(83.0) | ||
| 脉管浸润[例(%)] | 6.18 | 0.013a | ||
| 有 | 10(34.5) | 20(14.8) | ||
| 无 | 19(65.5) | 115(85.2) | ||
| 卫星结节[例(%)] | - | 1 | ||
| 有 | 1(3.4) | 6(4.4) | ||
| 无 | 28(96.6) | 129(95.6) | ||
| MVI[例(%)] | - | 0.307b | ||
| 有 | 4(13.8) | 11(8.1) | ||
| 无 | 25(86.2) | 124(91.9) | ||
| 肿瘤最大直径(cm,) | 4.631±3.49 | 4.087±2.57 | 0.97 | 0.335 |
| 肿瘤数目[n(%)] | - | 0.145b | ||
| 单个 | 22(75.9) | 118(87.4) | ||
| 多个 | 7(24.1) | 17(12.6) |
注:AFP为甲胎蛋白;CEA为癌胚抗原;CA199为糖类抗原199;APT为异常凝血酶原;AST为天冬氨酸转氨酶;ALT为丙氨酸转氨酶;ALP为碱性磷酸酶;GGT为谷氨酰转肽酶;FIB为纤维蛋白原;PALB为前白蛋白;ALB为白蛋白;PLT为血小板;LSR为丙氨酸转氨酶/天冬氨酸转氨酶比值;FPR为纤维蛋白原/前白蛋白比值;FAR为纤维蛋白原/白蛋白比值;GPR为谷氨酰转肽酶/血小板比值;PLR为血小板/淋巴细胞比值;NLR为中性粒细胞/淋巴细胞比值;MVI为微血管侵犯;aχ2检验;bFisher精确检验
术后随访18个月,分析结果发现,DPHCC较非DPHCC的术后短期复发率显著增高,差异有统计学意义(P<0.001),DFS明显缩短,两者差异有统计学意义(P<0.001)。此外,DPHCC患者短期内的死亡率高于非DPHCC患者(P=0.007),比较两者OS后发现DPHCC患者术后短期生存时间明显减少(P=0.001 6),见图1。通过Child分级、TNM分期、中国肝癌分期(China liver cancer staging,CNLC)、日本综合分期评分(JIS)评分系统对两种类型肝癌进行评价,结果显示在TNM分期、CNLC分期和JIS评分上,DPHCC与非DPHCC患者两者差异有统计学意义(P<0.05),见表2。
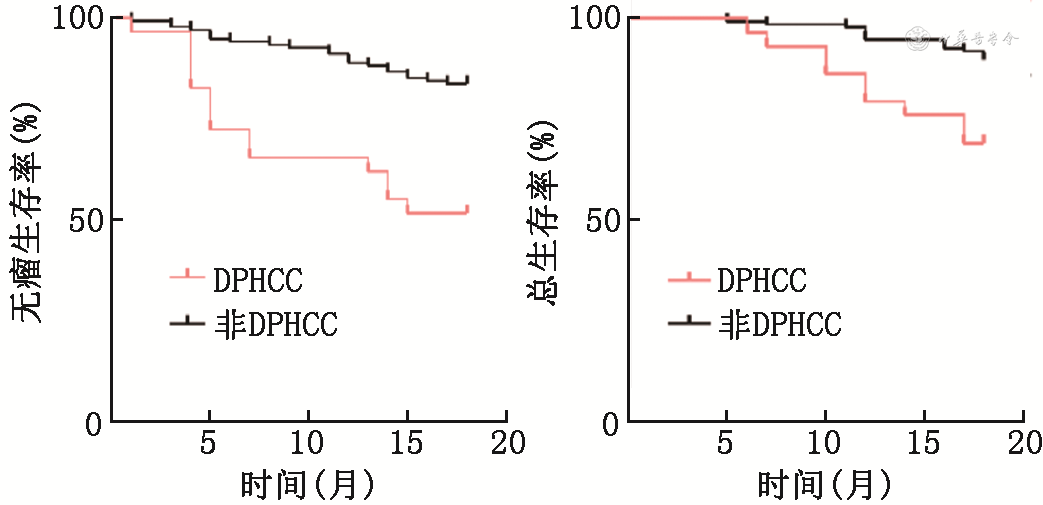

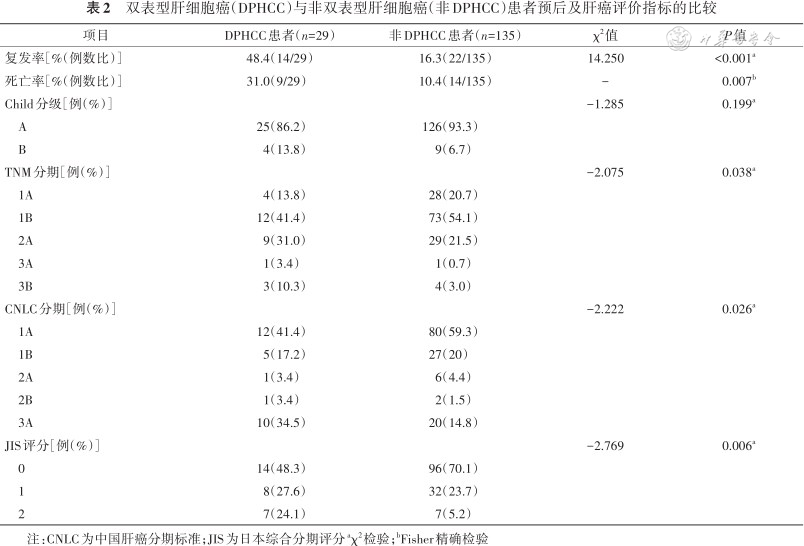
双表型肝细胞癌(DPHCC)与非双表型肝细胞癌(非DPHCC)患者预后及肝癌评价指标的比较
双表型肝细胞癌(DPHCC)与非双表型肝细胞癌(非DPHCC)患者预后及肝癌评价指标的比较
| 项目 | DPHCC患者(n=29) | 非DPHCC患者(n=135) | χ2值 | P值 |
|---|---|---|---|---|
| 复发率[%(例数比)] | 48.4(14/29) | 16.3(22/135) | 14.250 | <0.001a |
| 死亡率[%(例数比)] | 31.0(9/29) | 10.4(14/135) | - | 0.007b |
| Child分级[例(%)] | -1.285 | 0.199a | ||
| A | 25(86.2) | 126(93.3) | ||
| B | 4(13.8) | 9(6.7) | ||
| TNM分期[例(%)] | -2.075 | 0.038a | ||
| 1A | 4(13.8) | 28(20.7) | ||
| 1B | 12(41.4) | 73(54.1) | ||
| 2A | 9(31.0) | 29(21.5) | ||
| 3A | 1(3.4) | 1(0.7) | ||
| 3B | 3(10.3) | 4(3.0) | ||
| CNLC分期[例(%)] | -2.222 | 0.026a | ||
| 1A | 12(41.4) | 80(59.3) | ||
| 1B | 5(17.2) | 27(20) | ||
| 2A | 1(3.4) | 6(4.4) | ||
| 2B | 1(3.4) | 2(1.5) | ||
| 3A | 10(34.5) | 20(14.8) | ||
| JIS评分[例(%)] | -2.769 | 0.006a | ||
| 0 | 14(48.3) | 96(70.1) | ||
| 1 | 8(27.6) | 32(23.7) | ||
| 2 | 7(24.1) | 7(5.2) |
注:CNLC为中国肝癌分期标准;JIS为日本综合分期评分aχ2检验;bFisher精确检验
将表1中与DPHCC相关的实验室检查指标纳入到Spearman生存相关性分析中,发现DPHCC患者术后存活时间与碱性磷酸酶(alkaline phosphatase protein,ALP)、谷氨酰转肽酶(glutamyl transferase,GGT)、纤维蛋白原/前白蛋白(FPR)、谷氨酰转肽酶/血小板(GPR)呈负相关(P值分别为:0.015、<0.001、0.030、<0.001),其余指标未呈现出相关性,见图2。ALP、GGT、FPR、GPR值越高,患者术后存活时间越短。
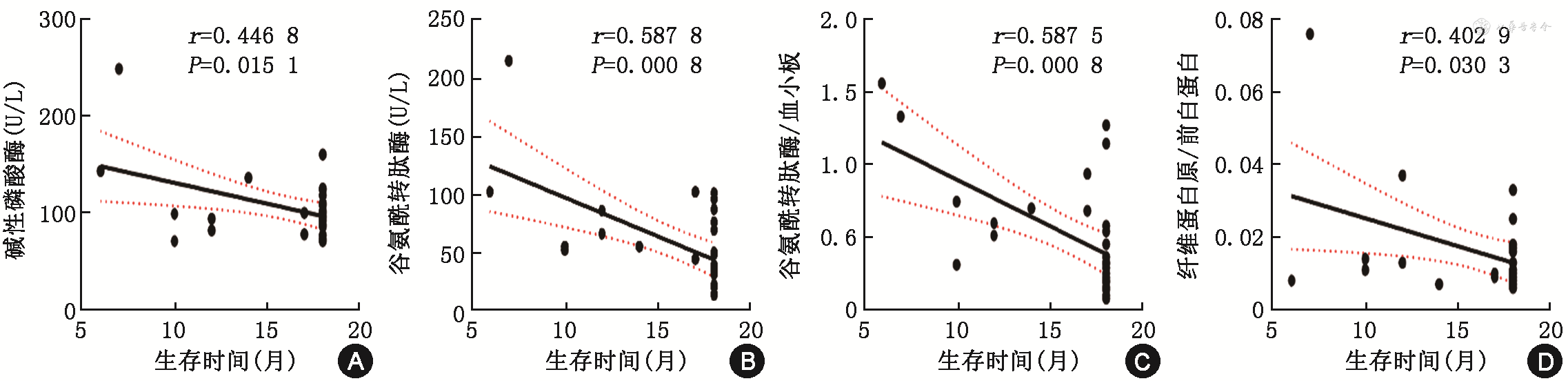

比较两组患者,筛选出存在显著差异的指标:患病年龄、NLR、AFP、中性粒细胞、淋巴细胞和脉管浸润,利用ROC曲线评估以上指标鉴别DPHCC患者与非DPHCC患者的效能。结果显示患病年龄、AFP和NLR的诊断性能较好,中性粒细胞和淋巴细胞两个变量已经包含在NLR中,所以未纳入后续研究。脉管浸润的曲线下面积(AUC)仅为0.598,约登指数为19.67,诊断效能较差,故仅选择患病年龄、AFP和NLR做后续研究。三者的cut-off值分别为63岁、284.4 μg/L、2.586,其中NLR的AUC最大,为0.801。在对DPHCC患者与非DPHCC患者的鉴别诊断上患病年龄、AFP和NLR的灵敏度分别为93.1%、48.28%、75.86%,特异度为48.89%、85.93%、77.04%。患病年龄的灵敏度最高,AFP的特异度最高,NLR的约登指数最高。表3。
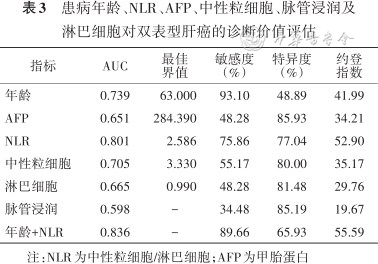
患病年龄、NLR、AFP、中性粒细胞、脉管浸润及淋巴细胞对双表型肝癌的诊断价值评估
患病年龄、NLR、AFP、中性粒细胞、脉管浸润及淋巴细胞对双表型肝癌的诊断价值评估
| 指标 | AUC | 最佳 界值 | 敏感度 (%) | 特异度 (%) | 约登 指数 |
|---|---|---|---|---|---|
| 年龄 | 0.739 | 63.000 | 93.10 | 48.89 | 41.99 |
| AFP | 0.651 | 284.390 | 48.28 | 85.93 | 34.21 |
| NLR | 0.801 | 2.586 | 75.86 | 77.04 | 52.90 |
| 中性粒细胞 | 0.705 | 3.330 | 55.17 | 80.00 | 35.17 |
| 淋巴细胞 | 0.665 | 0.990 | 48.28 | 81.48 | 29.76 |
| 脉管浸润 | 0.598 | - | 34.48 | 85.19 | 19.67 |
| 年龄+NLR | 0.836 | - | 89.66 | 65.93 | 55.59 |
注:NLR为中性粒细胞/淋巴细胞;AFP为甲胎蛋白
将单因素方差分析存在显著差异的指标纳入多因素logistic回归分析中,结果显示患者患病年龄和NLR是鉴别DPHCC的独立影响因素,见图3,表4。此外,NLR联合患病年龄后的AUC高达0.836,灵敏度为89.66%,特异度为65.93%。见表3。

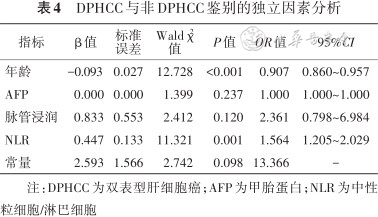
DPHCC与非DPHCC鉴别的独立因素分析
DPHCC与非DPHCC鉴别的独立因素分析
| 指标 | β值 | 标准 误差 | Wald χ2 值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| 年龄 | -0.093 | 0.027 | 12.728 | <0.001 | 0.907 | 0.860~0.957 |
| AFP | 0.000 | 0.000 | 1.399 | 0.237 | 1.000 | 1.000~1.000 |
| 脉管浸润 | 0.833 | 0.553 | 2.412 | 0.120 | 2.361 | 0.798~6.984 |
| NLR | 0.447 | 0.133 | 11.321 | 0.001 | 1.564 | 1.205~2.029 |
| 常量 | 2.593 | 1.566 | 2.742 | 0.098 | 13.366 | - |
注:DPHCC为双表型肝细胞癌;AFP为甲胎蛋白;NLR为中性粒细胞/淋巴细胞
正常肝脏细胞转变成肝癌细胞是一个复杂的反应过程,这一过程中不可否认的是机体基因组的不稳定和基因突变起了决定性作用。但是许多其他因素也起到了推波助澜的作用,比如免疫细胞与突变细胞的博弈[9],肿瘤急性炎症反应过程的结局[10],肿瘤微环境对血管生成的影响[11]等。这些改变为肿瘤细胞的生长增殖、免疫耐受及进一步的远处转移提供充足的条件。
DPHCC患者起病隐匿,早期无明显临床症状,仅有一小部分患者出现AFP和CA199同时升高对诊断DPHCC有提示作用[2,5]。本研究中发现部分患者术前AFP和(或)CA199升高,其中21例患者AFP增高,5例患者CA199升高,两者同时升高的患者仅有3例。幸运的是,在分析了DPHCC的临床数据后,笔者发现NLR对预测DPHCC有一定可行性,其AUC=0.801,灵敏度为75.86%、特异度为77.04%。当NLR联合患病年龄后诊断DPHCC的效能可提高至AUC=0.836,灵敏度为89.66%,灵敏度为65.93%。
在本次研究中笔者发现DPHCC患者的NLR往往高于非DPHCC患者,这可能是因为中性粒细胞参加了肿瘤发展中的慢性炎症过程[12],肿瘤微环境中的中性粒细胞通过释放细胞生长因子、中性粒细胞弹性蛋白酶和基质金属蛋白等促进了肿瘤细胞的侵袭、转移和血管生成[13]。此外,NLR中的淋巴细胞在抗肿瘤免疫应答中起着重要作用[14]。DPHCC患者的NLR升高说明患者机体对肿瘤细胞产生了慢性炎症反应,而机体的抗肿瘤免疫功能受到抑制,提示预后更差。
此外,笔者发现DPHCC患者术后存活时间与ALP、GGT、FPR、GPR存在显著负相关。阅读文献后得知,ALP作为一种水解酶,其可在细胞的周期以及肿瘤的形成过程中发挥作用[15]。GGT可为肿瘤细胞提供额外的半胱氨酸和胱氨酸来源,促进肿瘤细胞的生长[16]。本研究中ALP、GGT增高均提示DPHCC患者术后存活时间减少。在FPR中,纤维蛋白原可通过促进血管生成、促进血小板黏附运动等多种机制促进肿瘤的发展[17],前白蛋白则是肿瘤生长的重要能量和营养来源。FPR增高,则表示DPHCC患者肿瘤细胞增生活跃,营养物质被肿瘤细胞争夺消耗,提示预后更差。GPR是重要的肝纤维化和肝硬化程度的反应标志物指标[18],本次研究中随着GPR的增高DPHCC术后存活时间明显减少。这也解释了为什么ALP、GGT、FPR、GPR值越高,患者预后越差。
综上所述,尽管本次研究存在样本量小、基于单中心研究的部分局限性。但是经过探索发现多指标联合的诊断效能明显优于单一指标,故NLR联合患病年龄对预测DPHCC有一定可行性。因此,为提高对DPHCC的精准的诊断和个性化服务,在实际工作中不仅要对影像资料进行分析,还需结合患者患病年龄和实验室检查指标,若患者影像学提示肝癌,且年龄<63岁、NLR>2.586则应提高警惕,手术过程中应将肝门部淋巴结进行清扫,防止复发转移[19]。由于患病年龄和NLR均能在常规的术前资料中获取,具有方便、经济、快捷的优点,这为今后DPHCC患者的筛查提供了新的方向;也有助于对DPHCC有更精确的认识,提供更个性化的服务。
所有作者均声明不存在利益冲突































