
本文报道1例恶性肿瘤继发皮肌炎、肿瘤相关静脉血栓栓塞症患者的诊治经过。患者女,70岁,先后出现皮疹、肌无力、腹胀及呼吸困难,伴抗小泛素样修饰物活化酶(SAE)抗体阳性,糖类抗原19-9(CA19-9)显著升高,CT提示肺栓塞、肺部占位、胆囊底壁缩窄,后PET-CT提示胆囊为恶性病变,手术病理证实为胆囊癌伴肝转移,最终诊断为胆囊癌、肿瘤相关性皮肌炎、急性肺栓塞。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
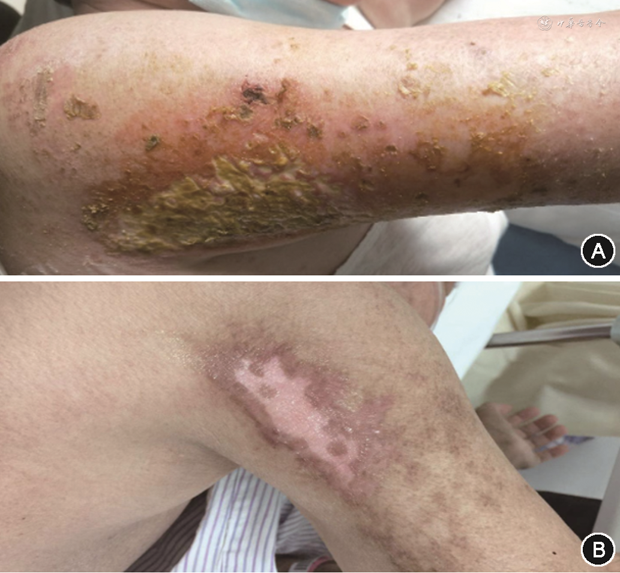
患者女,70岁,因“面部、四肢、躯干红斑4个月,肌力减退3个月”于2020年10月28日收入北京协和医院皮肤科病房。患者自2020年6月出现前额、双眼睑、颧部淡红斑,范围逐渐扩大,伴剧烈瘙痒;7月中旬双上臂(图1A)、背部、双大腿、双足逐渐出现大片紫红斑,伴双下肢近端乏力伴水肿;8月5日就诊于当地医院,查肌酸激酶(CK)364 U/L、丙氨酸转氨酶(ALT)53 U/L、天冬氨酸转氨酶(AST)72 U/L,抗核抗体(ANA)阴性,诊断“皮肌炎”,予甲泼尼龙40 mg/d静脉滴注1周,后序贯甲泼尼龙 8 mg/d口服,2周后因症状反复加量为泼尼松每日早晨25 mg、中午15 mg、晚上10 mg口服,皮肤破溃处予换药。患者周身红斑逐渐消退,瘙痒缓解,但乏力逐渐加重,出现腹胀,排气后减轻,无黄疸、腹痛、便秘、恶心、呕吐。2020年9月中旬患者出现双臂上举无力,梳头、蹲下站起困难。病程中无发热、关节痛、口腔溃疡,食欲可,精神一般,大小便正常,体重减轻约5 kg。既往史:10余年前行腰椎手术;否认肝炎、结核等传染病史。其他个人史、婚育史、月经史、家族史无特殊。入院查体:体温36 ℃,心率92 次/min,呼吸18 次/min,血压 156/104 mmHg(1 mmHg=0.133 kPa),血氧饱和度(SpO2)94%(未吸氧),双上臂和背部可见大片皮肤异色现象,双上臂见色素减退性瘢痕(图1B)。双上肢近远端肌力3级,双下肢近远端肌力2级。心律齐,各瓣膜区无杂音,双下肺呼吸音低,未闻及干湿啰音及爆裂音。腹软,无压痛,肝脾肋下、剑下未及,Murphy征阴性,移动性浊音阴性。辅助检查:血常规正常范围内,肝功能示ALT 142 U/L、AST 39 U/L,乳酸脱氢酶(LDH)563 U/L,余CK、CK同工酶(CK-MB)正常范围内。血清蛋白电泳、血清免疫固定电泳阴性。糖类抗原19-9(CA19-9)1 070 U/ml(参考范围:≤40 U/ml)。抗核抗体谱17项示抗Ro-52弱阳性。活化部分凝血活酶时间(APTT)22 s,D-二聚体 24.86 mg/L,纤维蛋白原1.10 g/L。

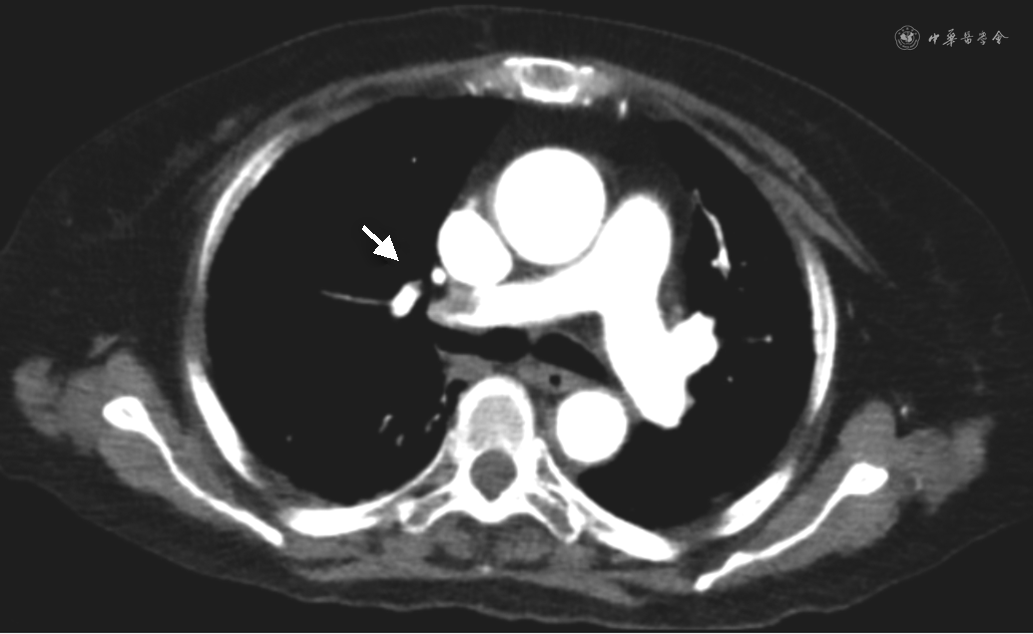
入院次日患者诉头晕、呼吸困难,测 SpO2 92%(未吸氧),血气示pH 7.45,氧分压 67 mmHg,二氧化碳分压32 mmHg,乳酸 4.4 mmol/L,心肌肌钙蛋白(cTnI)正常范围,N末端B型钠尿肽原(NT-proBNP)281 pg/ml,超声示双侧股浅静脉至胫后静脉起始段血栓形成。CT肺动脉造影(CTPA)示右肺动脉主干及双肺多发分支栓塞(图2),左肺下叶团片影伴小空泡(图3);胆囊底壁局限性缩窄(图4A)。监测患者血压显著降至85/63 mmHg,持续时间>15 min,心率90 次/min,呼吸25 次/min,意识清晰,考虑为急性肺栓塞,肺栓塞严重程度指数(PESI)评分至少为100分,简化的肺栓塞严重程度指数(sPESI)评分至少1分,血流动力学不稳定,危险分层为高危。转入监护病房后血压逐渐回升至125/66 mmHg,予普通肝素持续静脉泵入,维持APTT 50 s左右,呼吸困难缓解,3日后改为依诺肝素钠4 000 U每12小时皮下注射。

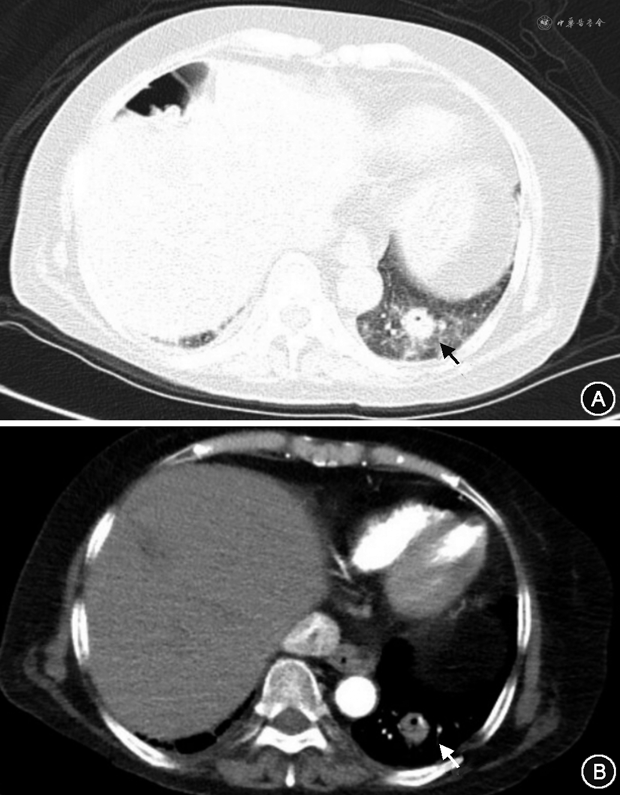


2020年11月11日转入呼吸内科继续治疗,皮肌炎方面维持甲泼尼龙20 mg/d口服。完善肌炎抗体谱示:抗伴抗小泛素样修饰物活化酶(SAE)抗体、抗Ro-52抗体阳性。腹部超声示脂肪肝,胆囊体部囊壁增厚;双大腿MRI示肌肉萎缩;肌电图示肌源性损害。考虑皮肌炎为肿瘤相关性皮肌炎可能性大,原发灶未明。多学科讨论认为患者肺部病变有恶性可能,但血供丰富不宜穿刺活检;而胆囊形态异常结合CA19-9明显升高,恶性病变可能性更大。进一步行腹部增强CT(图4B),见胆囊形态欠规则,壁不均匀增厚伴异常强化,考虑恶性可能;肝可疑低强化结节,转移待除外;胰头后方多发肿大淋巴结。PET-CT示胆囊底壁不规则增厚恶性可能性大,胰头后方淋巴结转移可能性大,肝脏未提示;左肺下叶片影炎性病变可能性大。综上,患者胆囊来源的恶性病变可以解释病情全貌。基本外科认为目前肿瘤所致症状及合并症突出,虽不能除外局部转移,但行胆囊切除手术方有根治机会。
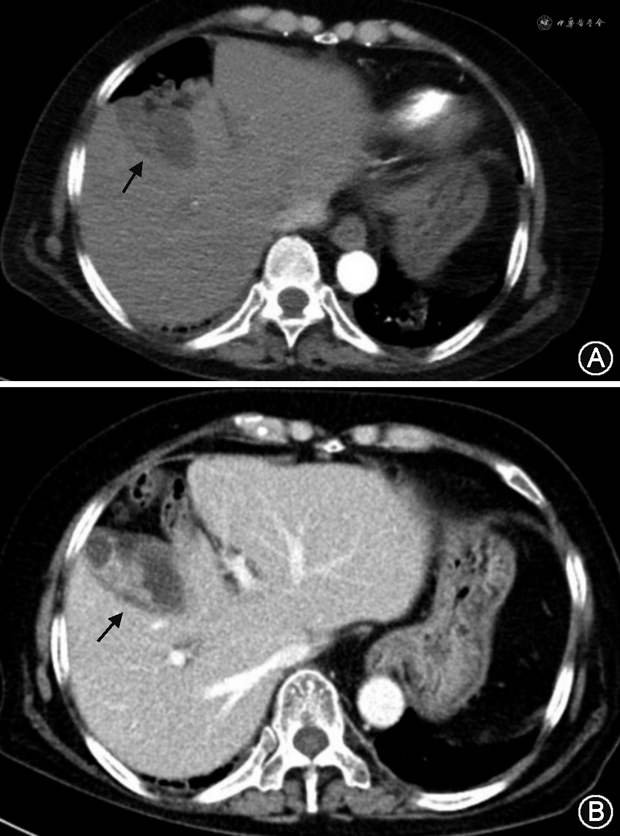
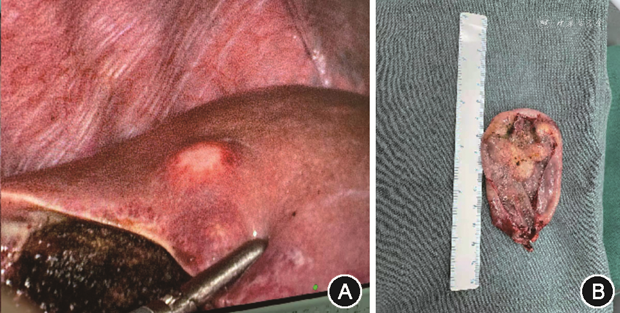
于2020年12月21日行腹腔镜手术,胆囊底表面可见质硬白色肿物,侵及胆囊浆膜面,胆囊管表面可见肿大淋巴结,质硬,肝脏表面可见两个直径约0.8 cm的白色质硬结节(图5A)。完整切除胆囊后取出,其内可见白色胆汁,壁不均匀增厚,呈白色鱼肉样(图5B),胆囊与肝脏结节切除后送冰冻病理均示中分化腺癌,结束手术。肿瘤内科会诊考虑该患者具有术后化疗指征,建议一般情况改善后再评估下一步治疗,总体预后不佳。

肺栓塞方面,患者外科手术前24 h停用低分子肝素,术后36 h启动普通肝素抗凝,维持APTT 30~35 s,2020年12月30日起改用利伐沙班15 mg每日2次口服,3周后改为20 mg每日1次口服。皮肌炎方面,泼尼松减量为20 mg每日1次口服,嘱其规律减量,1个月后减量为15 mg维持。住院期间患者下肢近远端肌力逐渐恢复至4级。腹胀缓解不明显。出院后未行肿瘤化疗,2021年2月患者因肿瘤进展死亡。
最终诊断为:胆囊中分化腺癌伴肝脏转移,肿瘤相关性皮肌炎,急性肺栓塞。
肿瘤相关性皮肌炎和急性肺栓塞同时发生于同一患者,临床过程重叠,增加了诊断难度。
本例患者胸部影像学表现对肿瘤原发灶的确认产生了误导。
胆囊癌临床表现不典型,常规腹部超声、CT平扫检查易漏诊。
诊断皮肌炎和肺栓塞的患者均需筛查是否继发于恶性肿瘤,尤其是合并抗SAE抗体者。
CA19-9升高常见于胰腺与胆系肿瘤,在肺癌患者中大幅升高并不常见。
患者腹胀症状出现较早且逐渐加重,提示临床对于持续不缓解的症状需特别关注,积极筛查病因。
该患者确诊为胆囊腺癌伴肝脏转移,肿瘤相关性皮肌炎,肿瘤相关静脉血栓栓塞症。虽然恶性肿瘤可合并皮肌炎或肺栓塞,但从文献报道来看,胆囊癌同时合并皮肌炎和肺栓塞罕见,且起病过程重叠在一起,给诊断带来了困难。
根据2019年欧洲神经肌肉疾病中心特发性炎性肌病的分类标准[1],患者以面部、躯干、四肢多发皮疹起病,伴双下肢无力,肌炎抗体谱示抗SAE抗体、抗Ro-52抗体阳性,肌电图及大腿MRI均符合炎性肌病表现,临床可确诊皮肌炎。皮肌炎患者中有15%~27%与肿瘤相关。抗SAE抗体是针对SAE的抗体,抗SAE抗体阳性的患者,恶性肿瘤发病率较高,弥漫的瘙痒性红斑也是此类患者的临床表现之一[2]。经手术治疗的肿瘤相关性皮肌炎患者,皮疹与肌无力症状的缓解率仅53%,肿瘤引起的交叉免疫反应在肌炎的发病中可能起到了重要的作用[3],即使肿瘤灶清除,免疫反应仍然可以保留并引起症状[4]。
患者持续存在腹胀,结合CA19-9大幅升高,应考虑到腹部肿瘤的可能。CA19-9可见于胰腺、胆系肿瘤等,在肺癌中升高不明显[5]。因前期的急性肺栓塞事件,临床医生注意力集中在肺内阴影上,容易先入为主误诊肺部肿瘤。后完善PET-CT示胆囊恶性肿瘤可能,手术病理示胆囊中分化腺癌伴肝转移,至此疾病的全貌得以显露。以皮肌炎为首发表现的胆囊癌目前仅有数例报道。2002年报道了1例75岁女性在皮肌炎随访期间发现胆囊癌,皮疹与肌无力在糖皮质激素治疗后缓解,但手术后10周死亡[6]。皮肌炎症状的出现与胆囊癌的诊断时间间隔在2周~2年,总体预后欠佳[7]。
手术决策依据如下:首先,术前腹部增强CT提示肝包膜下可疑低强化结节,但该结节在PET-CT上无高代谢,因此术前不能确定肝脏转移。其次,胆道恶性肿瘤预后极差,5年生存率仅为5%[8],根治性手术切除仍然是胆囊癌患者的唯一有效治疗手段[9, 10],且腹腔镜外科治疗较为安全[11]。最后,病理对诊断和后续治疗至关重要,其他渠道获得病理的可行性不高。
患者肺栓塞伴血流动力学不稳定,为高危[12],自身免疫性疾病与肿瘤均是静脉血栓栓塞症(VTE)的获得性危险因素[13]。VTE多发生在炎性肌病诊断的第1年内[14],特发性炎性肌病的患者发生VTE的风险是健康人群的2.85倍(95%CI:2.12~3.84)[15]。不同的肿瘤部位发生VTE的风险不同,依据2021年美国国立综合癌症网络(NCCN)肿瘤相关VTE指南,脑、胰腺、胃、胆囊等部位的肿瘤VTE发生风险更高[16]。
回顾诊治过程,皮肌炎诊治及时,高危VTE处理妥当,对肿瘤筛查保持高度警惕,多学科协作良好,但仍有进步空间。起初肿瘤筛查受到了肺部占位的影响,一度忽视了腹胀症状和CA19-9带来的提示,致使背后真正元凶——“胆囊癌”的诊断稍显波折。因此,多系统受累的复杂病例应该重视整体视角,既要发挥专科优势,又要避免思维被专科局限。笔者认为,疑难病不等于罕见病,而可以是常见疾病的排列组合。多种疾病的临床表现重叠时更需要医师缜密地抽丝剥茧获取疾病全貌。虽然患者出院后死于肿瘤进展,我们仍希望其诊治过程可以为类似患者的诊治提供经验和教训,以期缩短诊断时间,改善预后。
所有作者均声明不存在利益冲突



























