
心原性休克(CS)患者预后差,研究和总结心原性休克的救治意义重大。近年,美国心血管造影和介入学会(SCAI)分级、药物和容量选择、血运重建治疗、机械循环辅助(MCS)等方面研究取得了一些进展,指南更新的同时,网络化协作治疗已为大势所趋。本文将对心原性休克的发展现状,尤其是网络化协作治疗作一综述,重点阐述区域转诊中心应具备的职能和CS患者MCS下转诊的网络化协作及相关转诊流程。希望有助于更新治疗理念及启发今后的探索,在这些经验的基础上创建我国的综合救治体系,切实提升CS救治能力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心原性休克(CS)是指由于心脏功能受损,导致心输出量急剧降低,不能满足机体需要,引起重要器官和组织低氧、低灌注的一组临床综合征。CS主要表现为血压下降、全身循环功能障碍、缺氧、代谢障碍以及重要脏器功能损害,是心力衰竭(心衰)的终末期表现。尽管目前早期血运重建技术已取得长足进步,机械循环辅助(MCS)的应用也更为成熟,但是CS患者的预后依旧很差,住院死亡率仍有30%~50%[1, 2]。我国是心血管病大国,如何提高CS患者的救治成功率一直是研究和探索的重中之重。
CS病因很多,其中急性心肌梗死(acute myocardial infarction,AMI)是导致CS的主要原因,AMI患者约占CS患者的80%[3],反过来,6.6%的AMI患者会并发CS[4]。由于不同病因CS的治疗略有不同,本文将重点从AMI导致的 CS入手,综述CS诊治的最新发展和网络化协作治疗。
既往AMI引起的心衰采用1967年提出的分级法进行评定[5]。2019年SCAI结合当今诊疗现状,将CS分为5个阶段,即5期,帮助CS风险分层和指导CS治疗。大面积心肌梗死被分为A阶段即风险期,B阶段至E阶段,分别为开始期、典型期、恶化期、终末期。其中D和E阶段又被定义为难治性CS[6],是MCS的适应证。2022年SCAI又进行了修订、细化,新版分期更易于临床使用并得到了美国心脏病学会(ACC)、美国急诊医师学会(ACEP)、美国心脏协会(AHA)、欧洲心脏病学会(ESC)等多个学术组织的认可[7]。
早在2016年,ESC指南就明确推荐,立即对所有怀疑CS的患者行心电图和心脏超声,(无进一步诊治能力的单位)快速转运CS患者至上级医院,后者既有能够提供24 h/7 d诊治的心导管室又有能够实施短期MCS的重症监护病房(ICU)。推荐立即冠脉造影(2 h之内)并实现冠脉的再血管化。此外,推荐持续心电图和血压监测(有创监测);对于无液体超负荷表现的患者,可行液体负荷试验决定是否需要补液;考虑应用静脉正性肌力药物(多巴酚丁胺)提高心输出量和对持续低血压患者应用缩血管药物(去甲肾上腺素)维持收缩压[8]。
2020年ESC的当代CS管理立场声明强调:CS患者到达急诊要给予氧疗、稳定血流动力学(包括药物和辅助)、行心电图/心脏超声诊断以及积极对因治疗(Ⅰ/C)。立场声明指出:没有再血管化和MCS治疗能力的医院积极向有“休克中心”的上级医院转诊。熟悉各种救治手段的上级医院启动心脏团队的专业诊治,对AMI-CS合并机械并发症的患者,确定治疗时机和选择手术或介入的方法(Ⅱa/C),对不合并机械并发症的患者,视其是否适合经皮冠状动脉介入(PCI)而选择再血管化策略[1,9]。不适合PCI的患者需要急诊冠状动脉旁路移植术(CABG)(Ⅰ/B)[1]。对于右心室心肌梗死,声明提出在再血管化基础上避免容量过负荷,如果出现右心输出量不能满足左室前负荷所需,收缩压降低,则首选去甲肾上腺素提升血压[1]。
2021年全球跨学科专家通过德尔菲法共识过程对AMI-CS的PCI治疗提出了细化的专家建议,主要分为围PCI期、导管室-ICU转运之前、ICU管理、治疗72~96 h无缓解4个时期。在围PCI期,推荐实施动、静脉有创监测和右心导管监测,使用升压药物甚至MCS,不推荐过量液体治疗。在导管室,PCI只处理罪犯血管。在导管室-ICU转运之前期,专家建议了MCS的组织和插管方法,指出缺血缺氧性脑损伤、活动性出血、无插管入路、高龄和休克团队判断辅助无益者不应实施MCS。在ICU,不仅强调常规监测,包括化验结果、右心导管和心脏超声监测,还强调多种支持手段以及在右心导管指导下的降阶梯治疗。此时,SCAI分期作为变量,可能帮助判断治疗效果和指导下一步决策。如果患者经72~96 h治疗无缓解,则需要高级心衰救治团队参与决定治疗方式和实施治疗,例如长期心室辅助装置(VAD)和心脏移植等[10]。
虽然指南性声明或建议均有AMI管理策略的高级别推荐,但实践中的依从性还是有差异,一旦出现了CS,有些中心便会放弃进一步有创救治,CS患者依据指南治疗的比例更低[11]。笔者分析,其中一个原因是救治标准不统一、救治理念落后;第二个是AMI-CS完成了冠脉造影之后,并不是所有中心都有能力完成后续的再血管化、重症监护、并发症救治,包括MCS和外科手术等,既往报道也有类似的分析[1];救治费用等问题也会影响进一步的治疗。
指南或建议将MCS和辅助下的转诊放在了重要位置。MCS分为长期和短期,也可以分为植入型和非植入型,或分为搏动性血流和非搏动性血流[12, 13]。在CS抢救过程中一般选择短期辅助,在我国主要包括主动脉内球囊反搏(IABP)、Impella和体外膜氧合(ECMO)。
IABP是AMI-CS最常用的机械辅助,由股动脉或腋动脉置管,球囊在降主动脉充、放气,可以使主动脉根部的血液在舒张期因球囊充气灌注到冠状动脉,并因为收缩前期放气降低主动脉根部压力、减轻左室后负荷,进而减轻左室张力。但是,IABP辅助的作用有限[14]。Impella是小型经皮置入的VAD,左心辅助时,由动脉置管,跨越主动脉瓣进入左心室,将左心室血液持续泵入升主动脉。根据放置的部位和选择管径的不同,Impella可以提供不同的支持流量。但是,Impella需要在透视下确定导管位置,而且禁用于左室血栓和室间隔缺损的患者[14]。ECMO一般是股动、静脉插管,持续将静脉血引出、经过氧合器后回输动脉。ECMO置管不受场地限制,可以提供双心室辅助、保障氧合并适合患者转运。ECMO的局限在于损伤较大和可能增加左室后负荷。严重的主动脉瓣反流是IABP、Impella和ECMO的禁忌证[14, 15]。
虽然高质量的研究很难进行,但是回顾性观察性研究显示,ECMO挽救了濒死患者[16, 17]。ECMO是高风险、高花费的抢救技术,并不适合在所有级别的医院开展,最好的救治结果出现在经验丰富的大中心。移动ECMO,即大中心的ECMO团队到下级医院或者心肺复苏现场给危重患者施以ECMO辅助,再转运回大中心(也称区域转诊中心或综合治疗中心)进行后续治疗,可以扩大ECMO抢救范围。将ECMO用于转运呼吸道病毒感染并发严重呼吸衰竭患者以及辅助心肺复苏均显示出提高生存率的结果[18, 19, 20, 21]。这与ECMO转运的安全性、相关培训的不断推进[22],以及区域转诊中心或综合治疗中心更专业的救治能力相关。
以AMI患者为例,首诊医院应综合患者和医院的情况,立即进行再血管化或者转诊。在AMI-CS患者转诊之前,应对患者的病史和治疗用药有充分的了解;在血气分析的基础上给予患者吸氧、无创或有创机械通气;尽可能实施相关影像学检查;监测患者神志,必要时进行头颅CT;获得患者肝、肾功能以及炎症、感染相关的实验室结果;甚至了解患者家庭、医疗保险的情况[23]。区域转诊中心或综合治疗中心专业团队负责AMI-CS患者的转诊,除了保障转诊快速、安全,还应进行基于血流动力学的诊断和评估、选择和升级MCS、预备转入时的绿色通道、准备患者的再血管化和ICU监护[24]。
ECMO网络化协作出现在CS网络化协作之前,而出现最早的网络化是创伤救治协作网。在1976年,骨科医生James Styner的孩子被就近送往处置创伤经验非常薄弱的医院抢救,救治不力,Styner只能亲自指导并联系转运。Styner认为自己在设备缺乏的情况下实施救治,做得比当地的医疗团队更好,这正是医疗系统需要改进的地方,在Styner等的努力下,美国逐步形成了高级创伤生命支持(ATLS)培训和创伤救治协作网。
在创伤救治协作中,医院被分为3个等级,一级和二级的医院叫作卫星医院,三级医院叫作中心医院或区域转诊中心,为最高水平。一级医院需要分流、诊断、做基础治疗和向更高级的医院转运;二级医院能够处理腹部创伤;三级医院专科能力强,能全面处理特殊创伤。ATLS协作网使救治成功率大幅提高[25]。按照创伤的思路,2015年,美国的心脏外科医师Tchantchaleishvili等[25]呼吁组织建立AMI-CS救治协作网络。专业人员迅速接受这一观念并逐渐形成了救治协作雏形:一级医院在明确CS诊断后需要争分夺秒地识别患者风险并完成初步诊治;二级医院可以实施即刻PCI,但没有高级生命支持能力,和一级医院一样,诊治过程中出现了SCAI分级的进展需要转诊至上级中心;三级医院是实施高级生命支持及专业治疗的成熟CS救治中心[4,26](图1)。
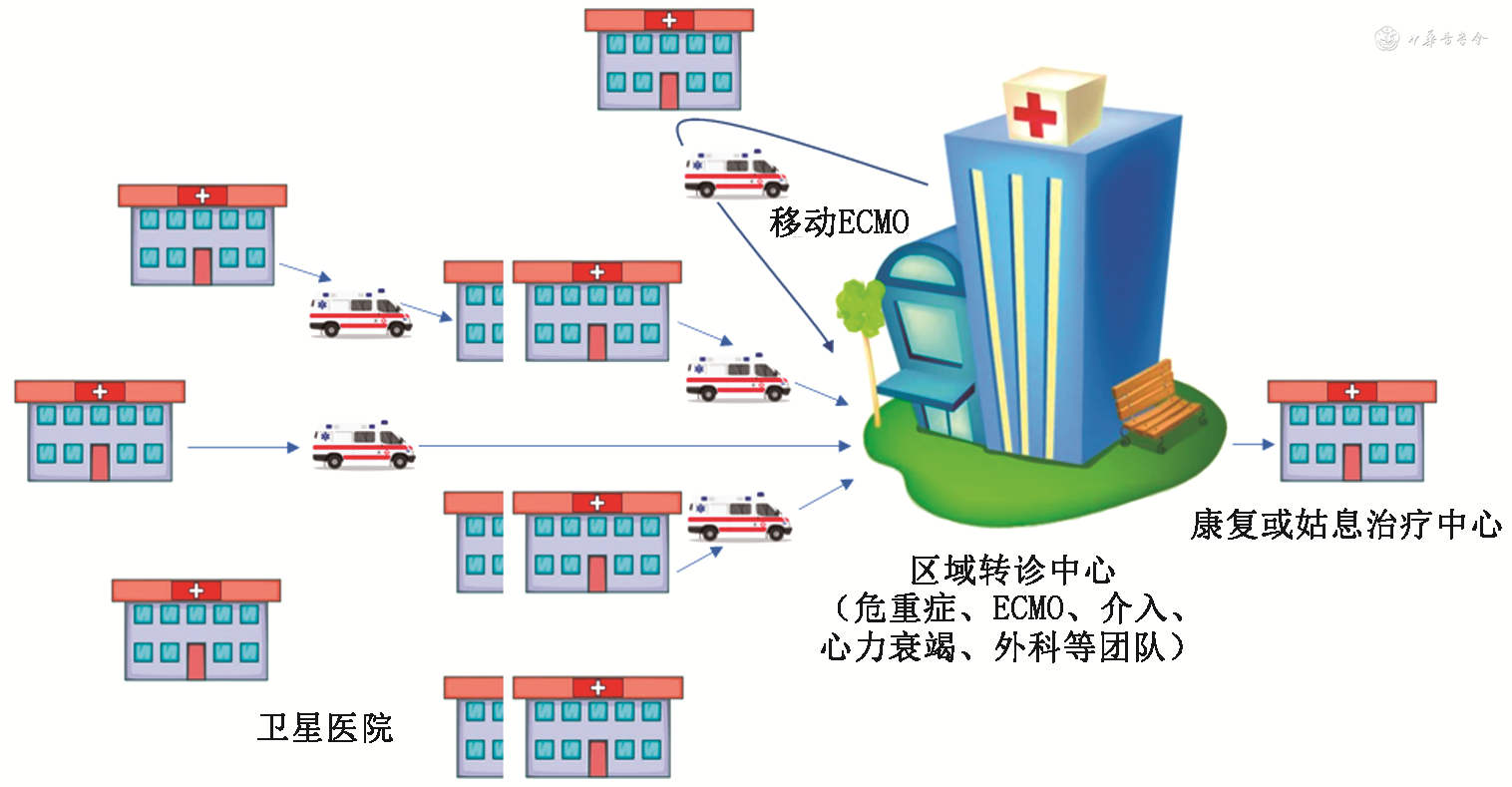

注:ECMO为体外膜氧合
区域转诊中心有以下特点或者要求:(1)因为研究发现医院CS患者数量增加与住院死亡率改善相关,所以区域转诊中心必须有丰富的AMI-CS的救治经验;(2)应当具备精通心血管诊治,且能多学科合作的CS团队;(3)硬件齐全,包括导管室、急诊手术室、ICU及长期MCS设备;(4)移动ECMO及24 h/7 d值班的MCS团队;(5)护理力量强大,每班床护比至少1∶1;(6)与卫星医院联系密切,还有康复流程[1](图1)。区域转诊中心内部需要在医院的组织下建立多种流程,利于抢救的实施和质量的提高。
除了卫星医院的协作,需要配合的方面还有很多。患者经初始优化药物治疗后血流动力学持续性不稳定、心电活动不稳定、呼吸功能衰竭、严重左心室功能受损患者,应积极考虑早期使用MCS支持[27]。类似于ST段抬高型心肌梗死(STEMI)患者急诊PCI的门球时间,现已提出了AMI-CS患者首次医疗接触到支持(FMC-to-support)时间,研究显示FMC-to-support时间超过90 min,患者的生存率显著下降,每延迟10 min,新增3.3%的死亡[24,26]。
移动ECMO和转运需要一支机动团队,向整个协作网提供24 h/7 d ECMO建立支持。团队成员接受特殊训练,具备利用各种交通工具转运危重患者和途中管理ECMO环路的能力(图1)。
PCI是运用最广泛的血运重建治疗,相比于单支血管病变,临床上超过70%的CS患者存在多支病变或左主干病变,导致了比单支病变更高的死亡率[2,28]。目前,推荐首先对罪犯病变进行介入治疗,并可能在以后的时间点择期对其他病变进行分期治疗[1]。STEMI患者确诊后120 min内若不能及时进行PCI应考虑启动溶栓治疗[2],这些治疗推荐和理念需要在网络中反复培训、加深理解。
CS团队包括心脏重症医师、介入医师、心衰专家、心外科医师,还有ECMO技术人员等。重症医师兼具心血管病学和重症医学经验,熟悉全身脏器支持的知识和方法,擅长抗血栓治疗、血流动力学监测、呼吸管理和辅助通气、MCS以及复苏等,以重症医师为主导、联合讨论制定诊疗策略是团队工作的重要体现[29]。单中心前瞻历史性对照研究发现,CS团队管理的患者住院死亡率(由54.2%降至33.9%)和包含出血、感染、缺血等在内的并发症发生率(由50.4%降至20.9%)均降低[30]。ICU的CS团队有效地筛选出了接受心脏移植、长期VAD、姑息治疗等的患者,而且,CS团队管理的患者血管活性药物量、有创通气时间、肾替代治疗比例、ICU时间和死亡率都有所减少或降低[31]。
经过以上救治后,如果患者不能回家或不能回归社会,康复和姑息治疗中心应支持过渡阶段的医疗[1,4]。康复或姑息治疗中心与CS区域医疗中心之间也应该有顺畅的转诊,让患者得到专业的指导和需要的治疗,让医疗支出花在最紧急的地方。
近年来,某些发达国家进行了CS 协作的探索,在德国的一项单中心回顾研究中,转运至区域医疗中心的CS患者死亡率仍然很高。这项研究的局限性在于没有非转运的对照组患者、对死亡风险的评估不足,影响研究结果[23]。美国进行的多中心回顾研究显示,卫星医院及时诊疗+中心医院转运的患者预后良好(直接在卫星医院死亡率47.8%,直接在中心医院39.3%,转运33.4%,P<0.01),MCS、VAD植入和CABG等均明显增多[32]。
结合MCS转诊的现状和经验[19, 20],考虑目前CS网络化协作还存在一些问题:(1)如何实现网络的信息化管理、有机调度和顺畅转运?(2)依靠什么持续进行网络单位人员教育,真正实现标准化救治?(3)怎样避免无效转运?(4)如何培育和建设CS中心的团队?(5)怎样促进医保赔付、医疗保险等的进阶?如不充分预估和准备,或将影响网络化救治的效果。
综上,CS网络化协作有多方面的意义。医学方面,快速、高效的专业治疗可以改善患者临床结局;地区协作利于统一标准、规模化研究并创新未来策略。社会方面,网络化协作不仅促进基层救治水平的提升,而且优化分级诊疗制度,促进患者健康和回归社会;完善的救治网络还可使患者在区域内得到恰当的救治,减少不必要诊治带来的经济损失。最近,“如何创建CS的综合救治体系”入选中国科协评出的30项科学技术领域重大问题难题,CS的网络化协作治疗已势在必行。
所有作者均声明不存在利益冲突



























