
由于各种原因导致的颅眶部骨骼缺损,可能影响患者的美观,甚至引起严重的并发症。国内神经外科、眼科领域的专家借鉴国外指南和相关循证医学证据,以牛津大学循证医学中心临床证据水平分级和推荐级别为依据,围绕各种重建修复材料性能、不同疾病和情况下材料的选择和应用、材料相关并发症等问题,对不同原因造成的颅眶缺损下的修补策略制定和材料选择等问题进行反复讨论,采用改良德尔菲法征集专家建议,形成3个方面共计23条共识推荐意见,为颅眶重建修复的规范化诊疗方案提供科学和切实可行的临床指导。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颅眶骨骼的完整性对于保护颅和眶内容物、维持颅面外形均具有重要的临床意义。多种因素会导致颅眶部位的骨质破坏,进而产生骨骼缺损,例如肿瘤性病变、外伤导致的骨折、颅眶部位手术等。对于不同原因造成的颅眶部骨缺损需要尽早采用适当的手术方法予以修补,否则可能引起内容物损伤、患者面容畸形等一系列并发症。
对于颅眶部位骨缺损的修补,修补策略和修补材料的选择,是决定手术成功的前提,也是所有神经外科和眼科医师对于手术质量控制的关键环节。目前临床应用最广泛的修补材料包括金属、可吸收材料和不可吸收聚合物,帮助手术医师进行缺损修补和骨瓣回纳固定。由于颅眶骨缺损的情况个体差异性大,选择合适的修补材料以及掌握正确的使用方法至关重要,目前缺乏针对这一领域的专家建议或共识,因此有必要对颅眶骨重建修复材料、技术和应用进行讨论,指导颅眶骨重建修复诊疗工作的开展。
中华医学会神经外科学分会和眼科学分会眼整形眼眶病学组联合国内相关领域专家以借鉴国外指南推荐、复习相关文献、采集商业数据为基础,以MeSH主题词加自由词相结合的方式检索PubMed、Embase、Cochrane Library、中国知网、万方数据库、维普网等数据库,检索时间窗为2012年1月至2021年12月。专家核心组结合循证医学证据和相关意见,在颅眶重建修复的材料选择、适应证、应用方法、材料相关并发症等内容上形成推荐意见。2022年1月和2022年6月,邀请神经外科与眼科领域内的41名专家采用改进的德尔菲法对23条推荐意见进行了2轮评价。本次德尔菲法的调查问卷设计、问卷内容均由中国医学科学院循证评价与指南研究创新单元的工作人员指导秘书组成员撰写,由专家组成员审核通过并发表。问卷内容主要包括针对每个推荐意见的李克特量表(LIKERT)评分及可自由填写的意见和建议区域。针对每一条推荐意见,专家采用李克特五分量表评分,满分5分,5分表示非常同意,4分表示同意,3分表示不确定,2分表示不同意,1分表示完全不同意。本共识设定评分≥4分的专家超过70%,则为达成共识。专家推荐程度以“共识度”标注,共识度=评分≥4分的专家/总参评专家人数×100%。本次专家共识共达成3部分23条推荐意见,旨在为颅眶重建修复过程中的规范化诊疗方案提供指导性意见。
人体颅骨分为脑颅和面颅两部分,脑颅呈卵圆形并围成颅腔,容纳并保护脑组织,面颅形成颜面的基本轮廓,例如构成眼眶、口腔和鼻腔等。颅骨和眼眶相互比邻,构成的骨板均为非承重骨,表面具有一定弧度且相对不规则,通常无法进行自我修复,需要使用辅助材料进行修补和重建,这就要求神经外科医师和眼科医师了解和熟悉材料本身的属性,才能制定合理的重建方案,实现个性化修补。目前应用于颅眶临床修补和重建的常用材料属性汇总见表1。
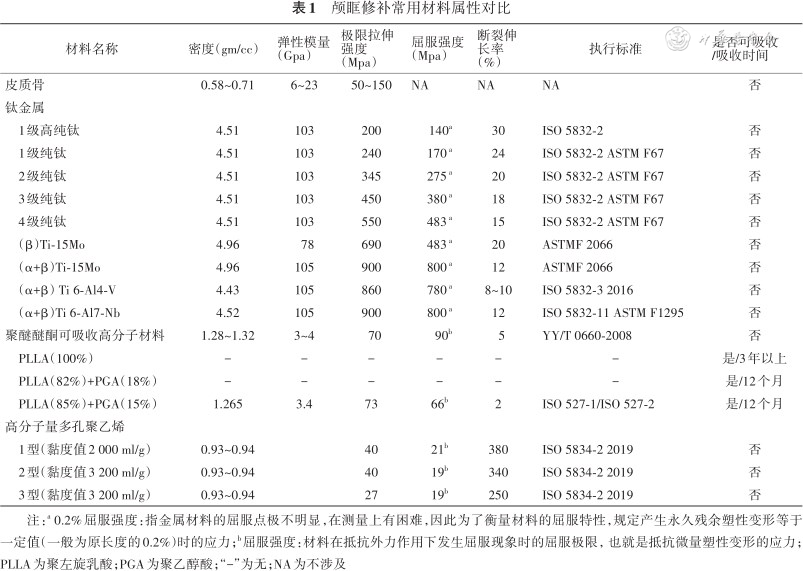
颅眶修补常用材料属性对比
颅眶修补常用材料属性对比
| 材料名称 | 密度(gm/cc) | 弹性模量 (Gpa) | 极限拉伸强度(Mpa) | 屈服强度(Mpa) | 断裂伸长率(%) | 执行标准 | 是否可吸收 /吸收时间 |
|---|---|---|---|---|---|---|---|
| 皮质骨 | 0.58~0.71 | 6~23 | 50~150 | NA | NA | NA | 否 |
| 钛金属 | |||||||
| 1级高纯钛 | 4.51 | 103 | 200 | 140a | 30 | ISO 5832-2 | 否 |
| 1级纯钛 | 4.51 | 103 | 240 | 170 a | 24 | ISO 5832-2 ASTM F67 | 否 |
| 2级纯钛 | 4.51 | 103 | 345 | 275 a | 20 | ISO 5832-2 ASTM F67 | 否 |
| 3级纯钛 | 4.51 | 103 | 450 | 380 a | 18 | ISO 5832-2 ASTM F67 | 否 |
| 4级纯钛 | 4.51 | 103 | 550 | 483 a | 15 | ISO 5832-2 ASTM F67 | 否 |
| (β)Ti-15Mo | 4.96 | 78 | 690 | 483 a | 20 | ASTMF 2066 | 否 |
| (α+β)Ti-15Mo | 4.96 | 105 | 900 | 800 a | 12 | ASTMF 2066 | 否 |
| (α+β)Ti 6-Al4-V | 4.43 | 105 | 860 | 780 a | 8~10 | ISO 5832-3 2016 | 否 |
| (α+β)Ti 6-Al7-Nb | 4.52 | 105 | 900 | 800 a | 12 | ISO 5832-11 ASTM F1295 | 否 |
| 聚醚醚酮可吸收高分子材料 | 1.28~1.32 | 3~4 | 70 | 90b | 5 | YY/T 0660-2008 | 否 |
| PLLA(100%) | - | - | - | - | - | - | 是/3年以上 |
| PLLA(82%)+PGA(18%) | - | - | - | - | - | - | 是/12个月 |
| PLLA(85%)+PGA(15%) | 1.265 | 3.4 | 73 | 66b | 2 | ISO 527-1/ISO 527-2 | 是/12个月 |
| 高分子量多孔聚乙烯 | |||||||
| 1型(黏度值2 000 ml/g) | 0.93~0.94 | 40 | 21b | 380 | ISO 5834-2 2019 | 否 | |
| 2型(黏度值3 200 ml/g) | 0.93~0.94 | 40 | 19b | 340 | ISO 5834-2 2019 | 否 | |
| 3型(黏度值3 200 ml/g) | 0.93~0.94 | 27 | 19b | 250 | ISO 5834-2 2019 | 否 | |
注:a 0.2%屈服强度:指金属材料的屈服点极不明显,在测量上有困难,因此为了衡量材料的屈服特性,规定产生永久残余塑性变形等于一定值(一般为原长度的0.2%)时的应力;b屈服强度:材料在抵抗外力作用下发生屈服现象时的屈服极限,也就是抵抗微量塑性变形的应力;PLLA为聚左旋乳酸;PGA为聚乙醇酸;“-”为无;NA为不涉及
钛金属生物相容性好、机械性能强,是临床应用最广泛的植入物材料。目前常用的钛金属有纯钛和钛合金,钛合金包括Ti 6-Al7-Nb和Ti 6-Al4-V等,纯钛具有较好的延展性和可塑性,可满足3D打印、计算机辅助设计(computer aided design,CAD)塑形等个体化颅眶骨的重建、修补与固定。而钛合金机械强度更高,主要作为对强度性能要求较高的植入物。
钛金属广泛用于钉、板和网等植入物,可以制作成具有一定弧度和形状的颅眶重建和修补材料。颅骨重建和修复中使用的接骨板主要为固定骨瓣的2孔、4孔、雪花状盖孔板,在选择时应关注钛板厚度和板钉切迹,越低的切迹能够带来越好的术后美观度并减少术后并发症;钛网则包括二维和三维钛网(厚度约为 0.6 mm),其中二维钛网常用于额部、颞顶部等部位缺损的颅骨修补;三维钛网结合计算机辅助技术高度还原了缺损颅骨处三维解剖立体形态,塑形满意度较高,可帮助缩短手术时间[1]。眶周骨重建和修复中使用的钛板主要是12孔弧形眶缘板及6、8、20孔的直型板,钛网常常会根据眼眶骨壁的生理形态进行预塑形,厚度较薄(0.4 mm)。但钛金属也存在“应力遮挡”、温度易感等缺点[2]。目前临床常用钛金属材料规格可见表2。
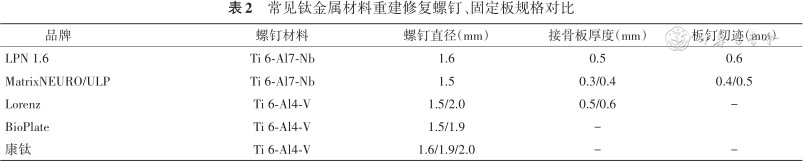
常见钛金属材料重建修复螺钉、固定板规格对比
常见钛金属材料重建修复螺钉、固定板规格对比
| 品牌 | 螺钉材料 | 螺钉直径(mm) | 接骨板厚度(mm) | 板钉切迹(mm) |
|---|---|---|---|---|
| LPN 1.6 | Ti 6-Al7-Nb | 1.6 | 0.5 | 0.6 |
| MatrixNEURO/ULP | Ti 6-Al7-Nb | 1.5 | 0.3/0.4 | 0.4/0.5 |
| Lorenz | Ti 6-Al4-V | 1.5/2.0 | 0.5/0.6 | - |
| BioPlate | Ti 6-Al4-V | 1.5/1.9 | - | |
| 康钛 | Ti 6-Al4-V | 1.6/1.9/2.0 | - | - |
可吸收材料包括高分子材料、无机材料和复合材料等[3],其中可吸收高分子材料是颅眶植入物应用最多的材料,常见有聚乙醇酸(polyglycolic acid,PGA,又称为聚乙交酯)、聚乳酸(polylactide,PLA,又称为聚丙交酯)以及聚乳酸-乙醇酸[poly(lactic-co-glycolic acid),PLGA]。PGA为亲水性材料,植入体内后2~4周后会降解;PLA具有较高结晶度和机械强度,完全降解或吸收需要5~6年[3]。PGA与PLA结合时,形成具有良好力学性能的复合材料PLGA。一般情况下,PLGA中PGA的占比越高,降解速度越快,但实际情况并非如此。一项研究发现,从降解特性的角度,PLA含量在75%~100%,PGA含量在0~25%是最理想的配比[4]。为了兼顾颅眶重建和修复过程中对于机械支撑度和材料吸收降解的时间需求,目前多采用不同配比的PLA和PGA,在骨愈合关键时期(前8周)提供较高的(>80%)初始固定力以保障愈合,超过1年时间降解,既保证了正常颅眶部骨骼的生长发育,同时不干扰CT、MRI等影像学检查,实现“无痕”愈合。
在颅骨修补和固定中使用较广泛的规格是0.8 mm或1.2 mm 厚度的2孔和4孔连接片,而8孔/20孔连接片常用于狭颅症。眼眶手术中使用较广泛的是厚度0.5 mm 的水滴型眶底板(35 mm×35 mm或30 mm×30 mm),0.8 mm或1.2 mm厚度的4孔、8孔、20孔连接片,以及弧形眶缘板,常用于各类眼眶骨折、肿瘤重建及开眶术后骨组织内固定等(表3)。
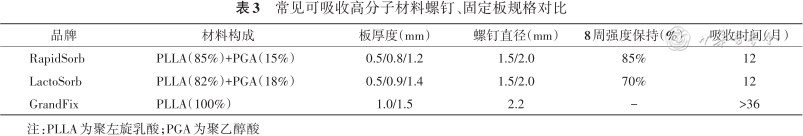
常见可吸收高分子材料螺钉、固定板规格对比
常见可吸收高分子材料螺钉、固定板规格对比
| 品牌 | 材料构成 | 板厚度(mm) | 螺钉直径(mm) | 8周强度保持(%) | 吸收时间(月) |
|---|---|---|---|---|---|
| RapidSorb | PLLA(85%)+PGA(15%) | 0.5/0.8/1.2 | 1.5/2.0 | 85% | 12 |
| LactoSorb | PLLA(82%)+PGA(18%) | 0.5/0.9/1.4 | 1.5/2.0 | 70% | 12 |
| GrandFix | PLLA(100%) | 1.0/1.5 | 2.2 | - | >36 |
注:PLLA为聚左旋乳酸;PGA为聚乙醇酸
PEEK与人体皮质骨的弹性模量接近(3~4 Gpa比6~23 Gpa),在强度和延展性上差于钛金属,但优于可吸收高分子材料和超高分子量聚乙烯,可耐受134 ℃下的3 000次循环高压灭菌。PEEK可根据患者CT数据来定制植入物,适合颅骨天然转角较大的部位的修补,如额骨颧突、眉弓及颞窝等部位[5, 6, 7],嵌入式修补,与边缘骨窗的嵌合更好,能够获得更好的美观效果。另外,PEEK可有效减少应力造成的骨吸收和骨萎缩,生物相容性和可塑性较钛金属材料更好,同时热传导性差,应用于颅眶修复和重建中可避免组织受到热传导灼伤[8]。
HDPE是一种新型人工合成材料,具有开放和相互交通的多孔结构,有利于受体血管和纤维组织长入,修剪塑形操作方便,整体的机械强度较低,对周围正常骨组织压迫程度小,可用于眼眶骨折后的修复与填充。
高分子量多孔聚乙烯的强度和稳定性好,与钛金属结合的复合材料能进一步提升强度且维持塑形,能够与相邻软组织结构融合生长[9]。目前主流应用材料的分子量为100万~500万,保证了材料的灵活性和柔韧性,两面为不同材料,能够减少与软组织的粘连,保证眼外肌、眼球等眼眶内组织的正常活动度。目前临床常用高密度聚乙烯材料规格见表4。
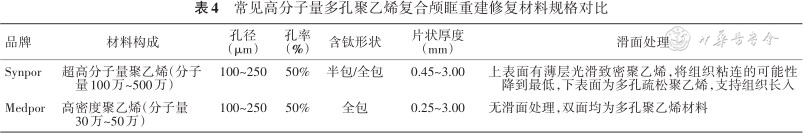
常见高分子量多孔聚乙烯复合颅眶重建修复材料规格对比
常见高分子量多孔聚乙烯复合颅眶重建修复材料规格对比
| 品牌 | 材料构成 | 孔径 (μm) | 孔率(%) | 含钛形状 | 片状厚度(mm) | 滑面处理 |
|---|---|---|---|---|---|---|
| Synpor | 超高分子量聚乙烯(分子量100万~500万) | 100~250 | 50% | 半包/全包 | 0.45~3.00 | 上表面有薄层光滑致密聚乙烯,将组织粘连的可能性降到最低,下表面为多孔疏松聚乙烯,支持组织长入 |
| Medpor | 高密度聚乙烯(分子量30万~50万) | 100~250 | 50% | 全包 | 0.25~3.00 | 无滑面处理,双面均为多孔聚乙烯材料 |
自体组织材料包括患者自体黏膜、筋膜、骨膜组织;带蒂骨膜瓣、带蒂骨瓣;脂肪组织和自体颅骨等。具有材料经济、无排异、愈合时间短等优点,但是操作过程中应注意严格无菌及取材位置的选择[10],主要应用于颅底及颅眶沟通处的硬脑膜的修补重建(膜性重建)和组织填塞。同时既往研究显示自体骨的保存要求较高,存在骨质吸收导致颅眶骨缺损复发的问题,目前已经应用较少[11]。
临床常应用于颅眶修补重建的材料还包括羟基磷灰石、聚甲基丙烯酸甲酯(有机玻璃)等材料[12]。但是鉴于相对较高的感染风险、自体排异及操作复杂等缺点,目前临床工作中应用比较少。
推荐意见1:颅眶缺损的修复和重建最常用的人工材料包括:钛合金、生物可吸收材料、PEEK以及高密度聚乙烯材料等,但尚无最优材料。(共识度:100%)
推荐意见2:对于颅底、眶顶、颅眶沟通处,如发生复杂前颅底粉碎性骨折需修补重建硬膜脑(膜性重建)的患者,推荐使用自体筋膜、肌肉、骨膜、带蒂骨膜瓣、带蒂骨瓣或脂肪等自体组织,在生物胶等辅助措施配合下完成修复重建。(共识度:100%)
推荐意见3:需根据患者颅眶缺损的类型、材料本身可能引发的并发症、材料本身性价比、可获取性及患者经济条件等因素,综合考虑选择最适合患者的重建和修复材料。(共识度:97.3%)
颅眶骨缺损进行修复和重建时,材料的选择除了综合考量材料本身的优缺点,还需要根据颅眶骨缺损后患者颅内和(或)眼眶内容物的病变情况,进一步制定颅眶骨修复和重建的目标和计划。临床证据显示颅眶骨缺损后,可发生外力、气压等原因产生的二次损伤,以及引起血液、脑脊液循环障碍,严重时甚至引发眼球和(或)脑组织外疝。因此,颅眶重建修复的标准主要包括两方面:(1)为颅眶内容物提供足够的保护,维持生物力学的稳定,保持眼球等重要结构稳定性,并恢复正常的解剖位置和功能;(2)保持颅眶骨质的连续性和完整性,修复影响功能和外观的骨质缺损,达到美学要求。因颅眶骨本身解剖结构存在异同点,修补和重建的需求与目标也有所异同,根据专家问卷意见将从颅骨、眶骨和颅眶沟通部三个解剖部位来做具体阐述。
1.颅骨的解剖特点:颅骨的主要组成包括额骨、顶骨、枕骨、颞骨。从生物力学角度来看属于非承重骨,平均厚度0.9~1.2 cm,额骨和顶结节处骨质最厚,颞骨鳞部骨质最薄。枕部骨质最大的特点在于骨质厚度不均匀,枕外隆凸处骨质最厚,平均厚度达14 mm,周围骨骼呈放射状减薄,最薄处亦有5.7 mm。枕部骨质与后颅窝相连,深部蕴含重要静脉窦汇聚处,因此枕部的骨质修复和重建对于保护静脉窦具有重要作用;同时还应该注意避免因修补整复造成的继发性颅颈交界区脑脊液循环障碍。
2.颅骨修补重建方法、材料选择和固定系统:颅骨修补重建的主要原则是恢复头颅正常形态,起到保护颅腔内容物的功能。额顶颞部骨质修补应注意确认置钉部位周围有无静脉窦、气房等重要结构;枕部骨质由于弧度较大且各处缘厚度不一致,修补前应做仔细评估,根据修补部位特点对固定材料进行预塑形避免固定材料穿透颅骨。对于肌肉覆盖多难以完全暴露骨面,应确保固定螺钉钻入颅骨起到固定效果。后颅窝骨质缺损大于3 cm×3 cm可进行修补重建,但是应密切随访,避免因修补引发的后颅窝脑脊液循环障碍、继发性Chiari畸形等并发症。
颅盖骨修补重建常用材料包括钛金属、PEEK以及PLGA等[13]。钛金属螺钉的安装过程最为便捷,常用自攻/自钻型螺钉,常用直径为1.5、1.6和2.0 mm,长度包括3、4、5和6 mm等,植入过程需注意颅骨厚度,避免穿透颅骨损伤脑组织、静脉窦等结构。PEEK材料属嵌入式修补,适用于钛金属过敏和对个性化定制需求较高的患者,因其不具备磁性,在CT及MRI扫描上均无伪影。可吸收高分子材料多应用于骨瓣回纳固定,不适用于大面积骨质缺损修补。
颅骨修补重建的固定系统也包括钛金属等不可吸收材料和高分子可吸收材料。对于硬度较高的钛钉在固定过程中应根据螺纹选择吸附力和应力对应的辅助设备。对于硬度较低的可吸收螺钉则需要提前进行钻孔和攻丝,在骨孔侧方压出螺纹提供抗脱位力。对张力较小的颅骨缺损,如颅骨的预成型钛网等,可使用自攻钉,免去钻孔环节。对于修补重建材料需要术中塑形时,可采用包括钛板剪、塑形钳、三头钳等工具,在水浴锅等设备辅助下完成塑形。
高分子可吸收固定系统包括钉、板、颅骨锁等,目前已经应用于额颞部、额顶部等多处骨瓣的固定,固定骨瓣范围从3 cm×2 cm至7 cm×5 cm不等;该可吸收固定系统优点包括固定效果满意、CT及MRI扫描上无伪影等[14]。颅骨锁使用时需避免悬吊的硬膜剥离,形成硬膜外血肿[15]。
推荐意见4:颅脑外伤后额颞大骨瓣减压术后,建议颅盖骨修补重建时间≤3个月,但最佳修补时间目前尚不确定。(共识度:78.9%)
推荐意见5:颅脑外伤后双侧额颞大骨瓣减压术后,可同时行双侧颅骨修补和重建,但需要根据患者对手术耐受情况、脑积水、硬膜下积液和头皮愈合等情况,综合判定是否行单侧或双侧修补重建。(共识度:78.9%)
推荐意见6:双侧额颞大骨瓣颅骨修补时,建议使用同种材料,但应根据患者自身经济条件、患者意愿等因素决定修补重建材料种类。(共识度:87.5%)
推荐意见7:颅骨骨瓣回纳、整复时与颅骨自身的连接片,可使用钛金属等材料,也可选择PLGA等可吸收材料连接片。(共识度:84.2%)
推荐意见8:后颅窝骨质缺损小于3 cm×3 cm无需修补,如出现硬膜下积液、脑膜膨出等不良并发症则需及时进行修补。(共识度:87.5%)
推荐意见9:后颅窝颅骨修补材料可使用可吸收修复重建材料。(共识度:100%)
1.颅眶沟通的解剖特点:颅眶沟通为颅骨和眶骨的结合部,涉及的骨性结构包括额骨、颞骨、眶骨、颧骨,前颅底和中颅底更是与眶顶和眶外侧壁关系密切,例如眶壁的骨折可累及额窦、海绵窦等关键颅脑结构,后方的骨折更容易直接损伤颅脑结构,轻则引起脑脊液漏,重则引起功能损伤。由于颅眶沟通解剖结构复杂,邻近腔窦较多,涉及到脑、眼重要器官,给治疗带来相当大的难度,此处的疾病往往需要神经外科和眼科医师共同协作完成。
2. 颅眶沟通修补重建方法、材料选择和固定系统:颅眶沟通处由于其解剖结构相对复杂,修补重建前应提前个性化地制定手术方案,准备合适的修补重建材料,以免去手术中手工塑形过程,缩短手术时间;同时通过CAD/计算机辅助制造(CAM)、3D打印等数字化技术辅助,为患者个性化预制例如钛网等修补重建材料,并经计算机导航辅助可实现修补材料高匹配度、低创伤性的植入。
颅底部分的修补多属于骨性修补,主要起到硬性支撑作用,必要时可同时行膜性修补,以减少脑脊液漏、脑组织疝出、颅内积气、眼球突出等症状的发生。在原有自体筋膜、脂肪组织、自体带蒂骨膜瓣基础上,钛网等材料也已经应用于患者,达到修补材料嵌合牢固,帮助颅底硬膜愈合,同时避免移位、形成缝隙及脑脊液漏等并发症[16, 17, 18]。目前可吸收材料在颅底鞍区的应用也有报道,包括经鼻蝶内镜切除垂体瘤等多种方面,均有预后满意的报道[19, 20]。而在颅眶沟通处眶顶及眶壁的骨性重建通常使用预成形钛网或高密度聚乙烯钛网恢复眶顶对颅底的支撑作用,防止术后发生脑膜脑膨出、额眶畸形、眼球内陷或突出,达到理想的面容整复[21, 22, 23]。此外,由于出血、水肿均可导致视神经管内压力增高,继发视神经损伤,因此解除颅眶骨折嵌压,去除继发性视神经损伤的病因也是颅眶沟通手术中至关重要的一点[24]。颅眶沟通处骨质修补重建时应慎重决定螺钉等植入物是否可进入并留置于气房、腔窦中[25, 26]。
推荐意见10:颅眶沟通处发生骨折需手术修复重建时,顺序建议为:Ⅰ期修复颅骨缺损,重建眶上缘和眶顶,复位眼球,Ⅱ期矫正上睑下垂等其他畸形。(共识度:71.1%)
推荐意见11:颅眶沟通处发生伴有眶骨和相邻颅面诸骨的畸形、移位和缺损时,在其整复手术中需要使用相应形状、大小的自体、异体材料来修补缺损,并使用钛钉、钛板或者钛网进行有效固定。(共识度:73.7%)
推荐意见12:颅眶修补中,螺钉应避免进入气房或者窦腔,避免潜在的感染、固定材料失稳的风险。如果出现下列情况且病情确实需要,可将螺钉植入气房或者窦腔:有正常引流开放;植入钉为钛金属;螺钉表面可用自体带蒂软组织覆盖;对于缺损面积大,且术前CT等影像学评估气房或者窦腔处骨质厚度足以承受螺钉牢固置入并根据实际情况咬除螺钉潜在的突出部分。(共识度:71.1%)
推荐意见13:颅眶沟通处骨质修补重建时,应以“外形佳、匹配度高、操作简单”为原则,提前制定手术方案,准备合适的修补重建材料,以免去手术中手工塑形过程,缩短手术时间。(共识度:85.6%)
1.眶骨的解剖特点:眼眶由眶壁和眶缘构成。眶壁是由眶顶、内壁、下壁、外壁四个壁组成的四棱锥形结构。其中内壁、下壁骨质菲薄,最薄处仅0.5 mm,周围是含气空腔,缺乏支撑,受外伤时易发生碎裂及移位,导致骨缺损,同时眶内软组织向筛窦、上颌窦疝出并发生嵌顿,伴随眼球凹陷、运动受限、复视等症状。眶缘是眼眶四棱锥结构的开口,也称为眶口,由上颌骨、颧骨、额骨、泪骨组成,相对坚固。下眶缘的薄弱处位于骨块发育融合的颧颌缝,眶外缘的薄弱处位于融合的颧额缝,两处均易发生骨折。又因颧骨受颞肌、咬肌牵拉,骨折后的骨块易发生移位。除了外伤造成的眼眶缺损之外,还有以下情况会造成眶骨缺损和畸形:先天性小眼球、无眼球患者会发生眼眶发育不良,眼眶神经纤维瘤常伴随蝶骨大翼缺损及眼眶扩大,骨源性肿瘤或者生长于眶骨内的肿瘤可导致眼眶畸形,眶周的恶性肿瘤手术(如上颌窦癌根治术)也可造成眼眶骨缺损。在这些情况下,都需要通过人工材料结合自体骨切割对眼眶进行修复和重建。
2.眶骨修补重建方法、材料选择和固定系统:对骨性眼眶进行重建的原则是:修复眶壁、恢复眼眶容积、重建眶缘及周围颅颌面骨,这三个步骤均需要应用修复材料,而且对材料的要求不尽相同。因此,眼眶修复材料的选择要根据骨折缺损的部位、大小、形状及临近组织的损伤程度等多种因素来综合考虑,有时还需要结合多种材料来优势互补。
(1)眶壁缺损的适应证、修补重建方法、材料选择和固定:单纯眶壁缺损的手术适应证为:①视觉障碍性复视持续存在;②被动牵拉试验阳性,CT扫描显示眼外肌嵌顿或陷入眶壁骨折处;③≥3 mm的眼球内陷;④>2 cm2的眶壁缺损。而对于被动牵拉试验阴性,无明显眼外肌嵌顿和陷入,无明显的眼球内陷者应该保守观察,对于外伤早期存在复视的患者可给予激素治疗[27]。
眼眶内壁、下壁非常菲薄,在修复时通常无法将碎裂的眶壁重新拼接,必须采用人工材料或者自体骨桥架于骨缺损上方来达到修复目的[27]。应用于修复眶壁的材料应具有以下特点:术中易塑形、易固定、能与周边正常眶壁良好接合,保证完全隔断眼眶与副鼻窦的非生理性沟通,且不残留死腔;具有良好的血管化能力,并能被鼻窦黏膜爬行覆盖,以降低由鼻窦来源的感染;与眶壁厚度相当且机械强度适宜的材料。例如,可采用厚度0.5~1.0 mm的预成型钛合金网、高密度多孔聚乙烯与钛合金的复合材料,骨缺损范围小的亦可选择可吸收材料。对于需要进行眼眶容积填充的患者可选择高密度多孔聚乙烯材料。采用预成型钛合金网等材料进行眶壁修复的时候,需加用钛钉固定于眶下缘或者眶壁,防止材料移位[28]。
(2)眶缘缺损的修补重建方法、材料选择和固定系统:累及眶缘的骨缺损通常发生于复合性眼眶骨折,眼眶发育性畸形、眼眶肿瘤或手术后,其中复合性眼眶骨折又包括眶额骨折、眶颧颌骨折和鼻眶筛骨折。眶缘缺损和畸形通常累及眶壁,不仅影响患者中面部外观,并且影响视功能,如全身情况许可,应该早期进行眼眶修复和重建,同时对眼球进行功能性复位手术。
眶缘及周围颅颌面骨的修复重建,是恢复面部形态对称的骨性基础。由于眼眶及面部骨骼的形态非常复杂,个体差异大,因此修复材料应具有以下特性:能够根据需要被预制成不同形状;具有良好的柔韧性,易塑形,不具备记忆性,便于手术中根据需要对材料的外形进行修整,使之与生理解剖形态相符,以恢复面部形态的对称;具有一定的力学强度,不易变形;易固定。对于眶缘骨折错位,可以将骨块复位,并采用钛合金固定系统来固定,例如0.7 mm或者0.8 mm厚度的接骨板,固定钉选择2 mm直径,5~6 mm长度较宜,注意避免穿透颧骨的髓腔和额窦[28, 29];也可以采用可以吸收接骨板和固定钉。对于眶缘和眶壁畸形,例如眼眶神经纤维瘤造成的眶缘畸形、蝶骨大翼缺如及眶壁畸形,需要根据患者CT数据采用CAD/CAM技术定制预成型钛合金网或PEEK材料,用于术中重建眼眶。但是,通常来说这些复杂病例所涉及的眶壁缺损,仍推荐采用钛合金和生物可吸收材料进行修复[30]。
眶骨缺损常会累及周边重要组织的结构和功能损伤,需要根据具体情况设计手术方案和手术顺序。例如:对于合并眼球破裂伤者,首先抢救眼球,Ⅱ期修复眼眶;如眼球破裂严重无法修复或者眼球丧失,则行眼座植入联合眼眶修复术[31]。在鼻眶筛骨折中,需要在眶缘复位固定和眶壁修复的同时,进行内眦畸形矫正和泪道损伤的修复和重建,其中内眦畸形矫正可以采用锚固钉将断裂移位的内眦韧带固定到眶内侧壁相应的位置(通常在泪前嵴)[32]。
推荐意见14:眶骨修补材料临床医师选择前三位为钛金属、生物可吸收材料和高密度聚乙烯材料。(共识度:97.4%)
推荐意见15:眼眶容积的增加量和眼球内陷度数呈高度正相关,眼眶容积增加1.0 cm3,眼球将内陷约0.9 mm。(共识度:94.7%)
推荐意见16:眼眶修复的标准为:双眼球突出度差异<2 mm,眼球运动无明显受限,复视改善及达到解剖复位。(共识度:89.5%)
推荐意见17:大面积眶外侧壁缺损建议重建,以获得良好外观,保护眶内组织。如有条件可进行一期修复,也可行二期修复,用钛网、可吸收材料、高密度聚乙烯材料重建眶外侧壁。可以用钛网、可吸收材料、高密度聚乙烯材料等重建外侧眶缘。(共识度:71.1%)
推荐意见18:眶内下壁修复中若残留眶壁充足,螺钉可固定在眶内,将螺钉自眶内打入眶缘或者残留的眶壁。若残留眶壁不足,螺钉可固定在眶缘,注意在螺钉表面覆盖软组织,避免皮下螺钉影响外观和引起不适。(共识度:100%)
推荐意见19:临床上眼眶骨修复时,骨折范围小(如面积<2.5 cm2的小范围单纯下壁或内壁骨折)可以选择可吸收材料。(共识度:73.7%)
颅眶修补和重建材料的相关感染是常报道的并发症之一,整体发生率为2.3%到20%。其中PEEK材料发生率为6%,钛金属为8%,与之相对应的自体骨也达到8%;感染率相对较高的是人工合成材料聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA,12%),其中以手工合成的PMMA(hand-moulded polymethylmethacrylate,hPMMA)材料感染风险性相对最高[33]。
手术操作不当是造成感染的主要原因,一旦发生感染,手术去除植入物是首先治疗方案,后续可根据细菌培养和药敏结果选择特异性抗生素治疗。
钛金属相关切口裂开和植入物暴露风险最高,发生率约为11%;hPMMA材料植入物暴露率最低,约为2%;其余植入物暴露风险依次为自体颅骨(3%)、PEEK材料(3%)、pPMMA材料(7%)。钛金属相关植入物的外露多为炎症反应的结果(10.5%),而与切口类型无关[34]。
植入物移位在自体骨材料中多由无菌性骨吸收造成(7%),并可能造成再次手术;在非自体骨材料中多与手术操作不当、固定不牢固相关。
植入物的断裂多由材料本身所致,表现为材料质地较脆、外部抗强力击打能力较弱,其他原因包括修补和重建位置的外部损伤和暴力。一旦出现植入物断裂和形变,应尽快由专业人士评估,是否会引起骨内容物损伤,制定植入物取出和再次重建修复方案,指导患者在后期生活中尽可能避免此类不良事件发生[35, 36]。
多由于机体对材料本身过敏而产生变态反应,钛金属过敏最为常见,有钛金属过敏证据的患者颅骨成形术失败率高达4%,因此建议考虑使用钛金属进行颅眶重建和修复患者,有条件的情况下建议先行钛金属过敏试验。如已发生过敏,应尽快二次手术取出植入物并制定再次重建修复方案[37]。
多发生于钛金属材料中,由于患者头皮和眼眶部位皮肤菲薄,在高温环境和阳光持续照射下,由于热传导直接造成金属植入物温度升高,损伤局部皮肤,严重者可造成伤口愈合不良甚至破溃[38]。
多由于植入物外露、移位、断裂所造成,损伤结构包括眶内容物、头皮、硬脑膜、脑组织及相关血管和神经。应通过二次手术取出肇事植入物避免损伤进一步恶化,积极处理出血、损伤等相关并发症。有报道眼眶下壁骨折修复术后的二次损伤,造成了眼眶内侧壁的新发骨折[39]。
包括脑积水(2%~9%)、脑脊液动力学障碍(3%~7%)以及意识功能障碍等[34]。
推荐意见20:植入物植入前,不强制性行钛过敏试验等预防性措施,但是如经济、技术条件允许,可在获得患者知情同意后开展。(共识度:78.9%)
推荐意见21:有明确的感染证据,且抗炎及对症治疗7 d无效甚至加重的患者,应及时取出植入物,感染证据包括但不限于:植入物及手术切口范围出现明显发热、化脓,切口愈合不良,且细菌学等病原学检查结果阳性;植入物周围组织器官功能受到影响,细菌学等病原学检查阳性,且与植入物处的病原学检查结果一致。(共识度:92.1%)
推荐意见22:植入物出现过敏,如出现以下情况,建议及时取出:局部刺激症状较大,如长期皮下积液、皮肤溃烂、植入物外露等;过敏症状经积极处理仍未缓解;需排除潜在的感染因素。(共识度:73.7%)
推荐意见23:当植入物出现排异、感染、外露,松动、断裂、对合吻合度欠佳、影响美观、患者诉出现难以忍受的局部紧绷感、针刺感等情况时,建议取出植入物,并重新制定修补重建方案。(共识度:100%)
本共识在制订过程中参考了国内外研究进展、相关指南以及市场数据采集,通过专家组问卷调查和讨论审阅而最终成稿,为临床医师在选择颅眶修复和重建材料以及临床应用提供了规范指导,也为相关基础研究和科学实验提供了参考依据。本共识的推荐意见并非是在各种情况下都必须遵循的医疗标准,临床工作中应根据实际情况灵活制定诊疗方案。同时,仍有诸多问题需要探索,特别是神经外科医师和眼科医师在部分临床实践中存在显著差异,期待未来开展前瞻性临床研究能够支持进一步证据,解决差异、统一方法,为需要接受颅眶修补和重建的患者带来临床获益。
本共识制定专家组成员:
执笔者(按姓氏拼音排序):史之峰(复旦大学附属华山医院神经外科);周慧芳(上海交通大学医学院附属第九人民医院眼科)
学术秘书组(按姓氏拼音排序):邓远(上海交通大学医学院附属第九人民医院眼科);李昊元(复旦大学附属华山医院神经外科);李寅炜(上海交通大学医学院附属第九人民医院眼科);张丹丹(上海交通大学医学院附属第九人民医院眼科);赵剑斓(复旦大学附属华山医院神经外科)
编审专家组成员名单(按姓氏首字母排序):卞留贯(上海瑞金医院神经外科);陈樱(武汉大学人民医院眼科);陈高(浙江大学医学院附属二院神经外科);邓跃飞(中山大学孙逸仙纪念医院神经外科);洪涛(南昌大学第一附属医院神经外科);侯立军(上海长征医院神经外科);胡锦(复旦大学附属华山医院神经外科);姜发纲(华中科技大学同济医学院附属协和医院眼科);康德智(福建医科大学附属第一医院神经外科);康军(首都医科大学附属北京同仁医院神经外科);李刚(山东大学齐鲁医院神经外科);李美华(南昌大学第一附属医院神经外科);梁平(重庆儿童医院神经外科);廖洪斐(南昌大学附属眼科医院眼科);林明(上海交通大学医学院附属第九人民医院眼科);刘洪雷(西安市人民医院眼科);刘劲芳(中南大学湘雅医院神经外科);卢苇(大连医科大学附属第二医院眼科);潘叶(天津市眼科医院眼科);钱江(复旦大学附属眼耳鼻喉科医院眼科);秦伟(陆军军医大学附属西南医院眼科);舒凯(华中科技大学同济医学院附属同济医院神经外科);孙丰源(天津医科大学眼科医院眼科);田彦杰(北京大学第三医院眼科);王毅(北京大学第三医院眼科);王中(苏州大学附属第一医院神经外科);魏锐利(海军军医大学附属长征医院眼科);吴安华(中国医科大学附属第一医院神经外科);肖利华(解放军总医院第三医学中心眼科);肖新如(首都医科大学宣武医院神经外科);熊炜(中南大学湘雅三医院眼科);徐建国(四川大学华西医院神经外科);杨华胜(中山大学中山眼科中心眼科);叶娟(浙江大学医学院附属第二医院眼科);岳树源(天津医科大学总医院神经外科);张积(苏州大学附属第二医院眼科);张黎(河南省人民医院眼科);张鸿祺(首都医科大学宣武医院神经外科);张剑宁(中国人民解放军总医院神经外科);张荣(复旦大学附属华山医院神经外科);赵元立(首都医科大学附属北京天坛医院神经外科);周东(广东省人民医院神经外科);朱豫(郑州大学第一附属医院眼科);朱巍(复旦大学附属华山医院神经外科)
所有作者均声明不存在利益冲突



























