
探讨胱天蛋白酶募集域蛋白9(CARD9)在C57BL/6小鼠激素抵抗型哮喘气道损伤和炎症中的作用。
采用随机数字表法,将6~8周龄无特定病原体(SPF)级C57BL/6雌性小鼠分为A组(对照组)、B组(模型组)和C组(地塞米松治疗组),每组6只,B组及C组利用卵清白蛋白(OVA)/完全弗氏佐剂(CFA)腹部皮下注射,OVA雾化激发构建小鼠模型,C组每次致敏前30 min给予地塞米松,末次激发24 h后检测其病理变化及支气管肺泡灌洗液(BALF)细胞计数,进行肺组织炎症浸润情况评分,Western blot检测造模前后CARD9蛋白的变化;然后将雌性6~8周龄C57BL/6野生型小鼠12只和CARD9基因敲除型小鼠12只分为4组,每组6只,其中D组为野生型对照组,E组为野生型模型组,F组为CARD9基因敲除对照组,G组为CARD9基因敲除模型组,造模如上述对照组和模型组。苏木精-伊红染色观察肺组织病理变化,ELISA法检测BALF中白细胞介素(IL)-4、IL-5和IL-17,RT-PCR法检测CXC趋化因子配体10(CXCL-10)和IL-17 mRNA水平。
B组炎症浸润评分[(3.33±0.82)比(0.67±0.52)分]和BALF总细胞计数[(10.13±4.83)×105个/ml比(3.76±0.84)×105个/ml]均高于A组(均P<0.05);C组炎症浸润评分[(2.83±0.75)分]和BALF总细胞计数[(9.80±3.19)×105个/ml]与B组差异无统计学意义(P>0.05);B组CARD9蛋白表达高于A组(0.245±0.090比0.047±0.014,P=0.004);肺组织病理结果显示,与E组及F组相比,G组的肺组织炎症细胞浸润及组织结构破坏程度加重。与E组及F组相比,G组炎症细胞总数、中性粒细胞数量和嗜酸粒细胞数量均升高(均P<0.05);IL-4、IL-5及IL-17表达水平均升高(均P<0.05);支气管肺组织中IL-17及CXCL-10 mRNA表达水平亦均升高(均P<0.05)。
CARD9基因的缺失可能通过升高IL-17及CXCL-10等中性粒细胞趋化因子,增加中性粒细胞的浸润,从而加重C57BL/6小鼠激素抵抗型哮喘。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
哮喘是一种由多种细胞和细胞组分共同参与的慢性气道炎症性疾病,其发病机制复杂多样,临床表现也有明显的异质性[1]。重症难治性哮喘患者急诊就医率和住院率较轻、中度哮喘者明显增加[2, 3, 4]。现有研究表明,气道中性粒细胞大量浸润和活性增强是重症哮喘难治和激素抵抗的原因,但其具体机制未明,且现有药物控制不佳[5]。有研究指出重症哮喘患者外周血白细胞介素(interleukin,IL)-17和支气管肺泡灌洗液(broncho alveolar lavage fluid,BALF)中CXC趋化因子配体10(CXC motif chemokine ligand10,CXCL-10)水平增高[6, 7],提示其与激素抵抗及重症哮喘的发生密切相关。Bertin等[8]在研究半胱天冬酶募集结构域蛋白时发现胱天蛋白酶募集域蛋白9(easpase recruitment domain protein 9,CARD9)是其中一个重要衔接蛋白,通过促进中性粒细胞浸润和激活促进抗真菌免疫[9]。但CARD9在激素抵抗型哮喘中的作用尚不明确。因此,本研究利用C57BL/6野生型鼠和CARD9基因敲除小鼠构建激素抵抗型哮喘模型,观察 CARD9敲除对哮喘气道炎症的影响,并初步探讨其影响的可能机制。
1.实验动物:6~8周龄无特定病原体(specific pathogen free,SPF)级C57BL/6雌性野生型小鼠(上海斯莱克实验动物有限公司)30只和CARD9-/-小鼠(同济大学医学院贾鑫明教授馈赠)[10]12只,体重18~22 g,于温州医科大学实验动物中心SPF级实验室中饲养。
2.主要试剂和仪器:卵清蛋白(ovalbumin,OVA,美国Sigma公司),弗氏完全佐剂(complete freund adjuvant,CFA,美国Sigma公司),磷酸盐缓冲盐水(phosphate buffered saline,PBS,北京索莱宝科技有限公司),Giemsa染色液(南京建成生物工程研究所),苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(北京索莱宝科技有限公司),IL-4、IL-5、IL-17 ELISA试剂盒(美国Invitrogen公司),Taq酶[TB Green® Premix Ex Taq™ Ⅱ(Tli RNaseH Plus),宝日医生物技术(北京)有限公司],抗体CARD9(美国CST公司12283号)与内参甘油醛-3-磷酸脱氢酶(GAPDH)(美国Proteintech公司10017731号),便携式压缩式雾化仪及吸入装置(德国PARI公司),荧光定量PCR仪(美国Bio-rad公司),蛋白电泳、电转系统、凝胶成像系统(美国Bio-rad公司)。
1.分组与模型建立:采用随机数字表法,将18只SPF级C57BL/6雌性野生型小鼠分为A组(对照组)、B组(模型组)及C组(地塞米松治疗组),每组6只。B组及C组小鼠分别于第0天(实验开始当天)和第7天每次腹部皮下注射5 μl/g OVA/CFA混悬液(每100 μl含OVA 20 μg、CFA 75 μl、PBS 25 μl);第14天将小鼠置于自制的有机玻璃盒中,雾化吸入OVA(0.1%)进行激发,每天激发40 min,C组小鼠激发前30 min以每5 μl/g体重的剂量腹腔注射浓度为0.2 mg/ml的地塞米松溶液,对照组及模型组给予等量生理盐水,对照组致敏与激发均以生理盐水代替OVA/CFA或OVA,连续激发4 d[11]。激发结束24 h后处死小鼠,收集血清、肺泡灌洗液和肺组织。
将12只野生型雌性小鼠和12只CARD9基因敲除雌性小鼠用随机数字表法分为对照组和模型组,即为D组(野生型对照组),E组(野生型模型组),F组(CARD9基因敲除对照组),G组(CARD9基因敲除模型组),共4组,每组6只。造模方法同A组和B组。
2.BALF细胞计数及瑞姬染色:结扎右肺后,用0.2 ml PBS溶液灌洗小鼠左肺4次,收集BALF,在4 ℃以850×g离心15 min。收集沉淀物用适量的PBS重悬,混匀,取20 μl悬液进行细胞计数;另取10 μl悬液涂片,风干后瑞姬染色(玻片浸入试剂一45 s,浸入试剂二4 min 30 s,水洗30 s)。在光学显微镜下分类计数,由左往右,由上往下,挑选多个视野计数200个白细胞,并分别记录嗜酸粒细胞、中性粒细胞个数,计算各种类型细胞的百分比和绝对值。
3.肺组织HE染色:取左肺第二叶依次进行4%多聚甲醛溶液外固定、酒精顺序脱水、二甲苯透明、石蜡包埋、切片,再进行HE染色。每组小鼠观察10~12个小气道进行肺组织炎症浸润情况评分:0分:正常;1分:少量炎症细胞;2分:1层炎症细胞围绕气道;3分:2~4层炎症细胞围绕气道;4分:4层以上炎症细胞围绕气道。
4.ELISA检测BALF中IL-4、IL-5及IL-17浓度:上述BALF离心后取上清液,用ELISA试剂盒按照说明书检测BALF中IL-4、IL-5及IL-17,根据标准品的浓度与检测结果计算出待测样品中各细胞因子浓度。
5.RT-PCR检测IL-17和CXCL-10的mRNA表达:用RNA抽提试剂提取肺组织RNA,逆转录合成cDNA,然后应用TB Green® Premix Ex Taq™ Ⅱ(Tli RNaseH Plus)通过荧光定量PCR仪检测小鼠IL-17和CXCL-10的mRNA表达水平,选用β-肌动蛋白(β-actin)做内参。引物序列见表1。

逆转录-聚合酶链反应检测中所用引物序列
逆转录-聚合酶链反应检测中所用引物序列
| 名称 | 序列5′-3′ | 片段大小(bp) |
|---|---|---|
| β-actin | F:CCGTGAAAAGATGACCCAGA | 98 |
| R:TACGACCAGAGGCATACAG | ||
| CXCL-10 | F:ATCCACCGCTGAGAGACATCCC | 80 |
| R:AATGACGGCAGCACTTGGGTTC | ||
| IL-17 | F:CTCCAGAAGGCCCTCAGACTAC | 69 |
| R:GGGTCTTCATTGCGGTGG |
注:F为正义链;R为反义链;β-actin为β-肌动蛋白;CXCL-10为CXC趋化因子配体10;IL-17为白细胞介素17
6.Western blot蛋白印迹法检测CARD9与GAPDH蛋白:用哺乳动物组织蛋白提取剂提取各组小鼠肺组织总蛋白,检测总蛋白浓度,蛋白变性后,每个样本取60 μg总蛋白,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,聚偏二氟乙烯膜转膜。抗体CARD9与内参GAPDH稀释比例均为1∶1 000,二抗为山羊抗兔或抗鼠(1∶3 000),曝光显影。采用Image J 1.52图像分析软件以GAPDH为内参定量分析CARD9条带灰度值。
应用SPSS 26.0软件进行数据分析。符合正态分布的计量资料采用±表示,多组间比较采用单因素方差分析,若差异有统计学意义,则用LSD-t法进行组间两两比较。双侧检验,检验水准α=0.05。
1. HE染色结果:B组较A组炎症损伤及炎症细胞浸润明显,C组经治疗后炎症损伤和浸润情况改善不明显(图1)。
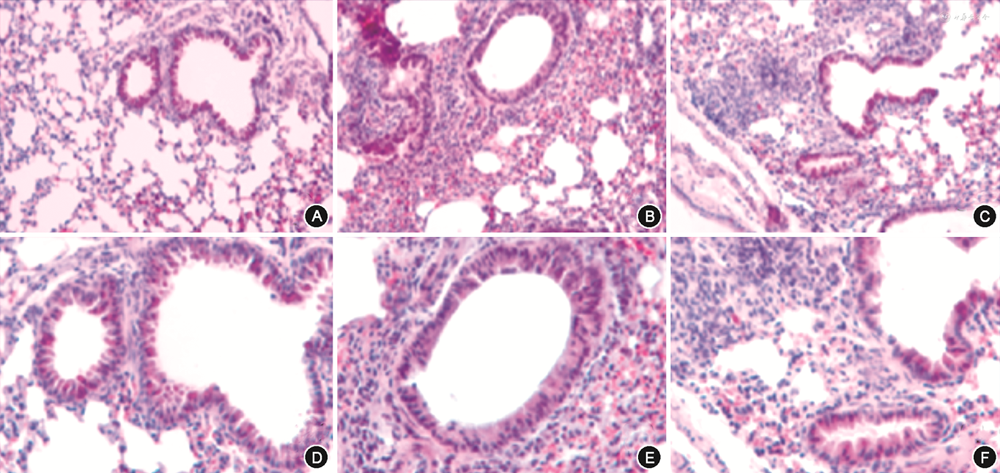

注:A、B、C的HE染色放大倍数为 ×200;D、E、F为A、B、C的局部放大,放大倍数为 ×400;A、D为对照组,B、E为激素抵抗型哮喘模型组,C、F为地塞米松治疗组
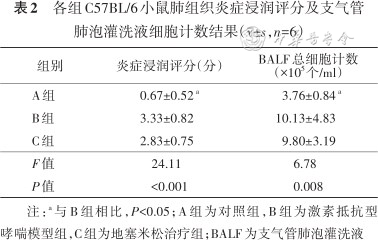
2.炎症浸润评分和BALF总细胞计数:3组小鼠炎症浸润评分和BALF总细胞计数组间比较差异具有统计学意义(均P<0.05);B组炎症浸润评分[(3.33±0.82)分比(0.67±0.52)分,P<0.001]高于A组,与C组差异无统计学意义(P=0.240);B组细胞计数(10.13±4.83比3.76±0.84)高于A组,差异有统计学意义(P=0.005),但与C组差异无统计学意义(P=0.865)。故可认为此模型为激素抵抗型哮喘模型(表2)。
各组C57BL/6小鼠肺组织炎症浸润评分及支气管肺泡灌洗液细胞计数结果(±,n=6)
各组C57BL/6小鼠肺组织炎症浸润评分及支气管肺泡灌洗液细胞计数结果(±,n=6)
| 组别 | 炎症浸润评分(分) | BALF总细胞计数 (×105个/ml) |
|---|---|---|
| A组 | 0.67±0.52 a | 3.76±0.84 a |
| B组 | 3.33±0.82 | 10.13±4.83 |
| C组 | 2.83±0.75 | 9.80±3.19 |
| F值 | 24.11 | 6.78 |
| P值 | <0.001 | 0.008 |
注:a与B组相比,P<0.05;A组为对照组,B组为激素抵抗型哮喘模型组,C组为地塞米松治疗组;BALF为支气管肺泡灌洗液
3.CARD9蛋白表达量的比较:Western blot检测结果显示,B组CARD9蛋白表达水平高于A组(0.245±0.090比0.047±0.014,P=0.004),提示CARD9在激素抵抗型哮喘的发生发展中有重要作用。
1.肺组织病理学改变:HE染色结果显示,E组小鼠肺组织及气管周围可见大量炎症细胞浸润及组织结构破坏;而G组小鼠较E组肺组织炎症细胞浸润及组织结构破坏程度加重;D组及 F组小鼠气道管腔及周围组织平滑,未见明显炎症细胞浸润(图2)。
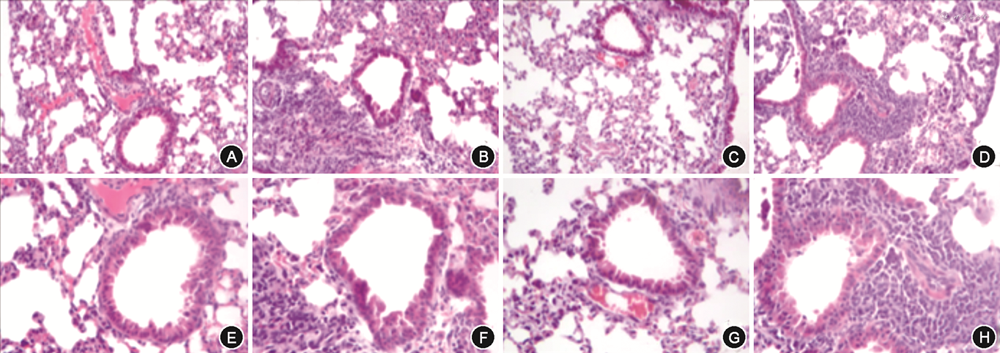

注:A、B、C、D的HE染色放大倍数为 ×200;E、F、G、H为A、B、C、D的局部放大,放大倍数为 ×400;A、E为野生型对照组;B、F为野生型模型组;C、G为CARD9基因敲除对照组;D、H为CARD9基因敲除模型组
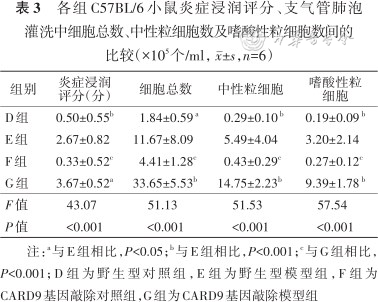
2.炎症细胞浸润情况:4组小鼠炎症浸润评分差异有统计学意义(P<0.001);E组炎症浸润评分高于D组,G组高于F组及E组,差异均有统计学意义(均P<0.05)(表3)。
各组C57BL/6小鼠炎症浸润评分、支气管肺泡灌洗中细胞总数、中性粒细胞数及嗜酸性粒细胞数间的比较(×105个/ml,±,n=6)
各组C57BL/6小鼠炎症浸润评分、支气管肺泡灌洗中细胞总数、中性粒细胞数及嗜酸性粒细胞数间的比较(×105个/ml,±,n=6)
| 组别 | 炎症浸润 评分(分) | 细胞总数 | 中性粒细胞 | 嗜酸性粒 细胞 |
|---|---|---|---|---|
| D组 | 0.50±0.55b | 1.84±0.59 a | 0.29±0.10 b | 0.19±0.09 b |
| E组 | 2.67±0.82 | 11.67±8.09 | 5.49±4.04 | 3.20±2.14 |
| F组 | 0.33±0.52c | 4.41±1.28c | 0.43±0.29c | 0.27±0.12c |
| G组 | 3.67±0.52a | 33.65±5.53b | 14.75±2.23b | 9.39±1.78 b |
| F值 | 43.07 | 51.13 | 51.53 | 57.54 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
注:a与E组相比,P<0.05;b与E组相比,P<0.001;c与G组相比,P<0.001;D组为野生型对照组,E组为野生型模型组,F组为CARD9基因敲除对照组,G组为CARD9基因敲除模型组
4组小鼠炎症细胞总数、中性粒细胞数量和嗜酸粒细胞数量差异均有统计学意义(均P<0.001);E组小鼠BALF中炎症细胞总数、中性粒细胞数量和嗜酸粒细胞数量均高于D组(均P<0.05);G组均高于F组及E组(均P<0.001)(表3)。
3.炎症因子表达水平比较:4组小鼠炎症IL-4、IL-5及IL-17表达水平差异有统计学意义(均P<0.001);E、G组的IL-4、IL-5及IL-17分别高于D、F组(均P<0.05);G组IL-4、IL-5及IL-17均高于E组(均P<0.05)(表4)。
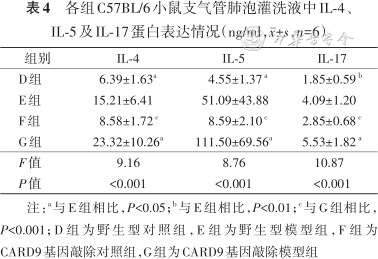
各组C57BL/6小鼠支气管肺泡灌洗液中IL-4、IL-5及IL-17蛋白表达情况(ng/ml,±,n=6)
各组C57BL/6小鼠支气管肺泡灌洗液中IL-4、IL-5及IL-17蛋白表达情况(ng/ml,±,n=6)
| 组别 | IL-4 | IL-5 | IL-17 |
|---|---|---|---|
| D组 | 6.39±1.63a | 4.55±1.37 a | 1.85±0.59 b |
| E组 | 15.21±6.41 | 51.09±43.88 | 4.09±1.20 |
| F组 | 8.58±1.72 c | 8.59±2.10 c | 2.85±0.68 c |
| G组 | 23.32±10.26a | 111.50±69.56a | 5.53±1.82 a |
| F值 | 9.16 | 8.76 | 10.87 |
| P值 | <0.001 | <0.001 | <0.001 |
注:a与E组相比,P<0.05;b与E组相比,P<0.01;c与G组相比,P<0.001;D组为野生型对照组,E组为野生型模型组,F组为CARD9基因敲除对照组,G组为CARD9基因敲除模型组
4.肺组织CXCL-10及IL-17mRNA水平比较:各组中性粒细胞趋化因子CXCL-10及IL-17的mRNA表达水平差异均有统计学意义(均P<0.001),E、G组的CXCL-10及IL-17的mRNA表达水平分别高于D、F组(均P<0.05),G组CXCL-10及IL-17的mRNA表达水平均高于E组(均P<0.05)(表5)。
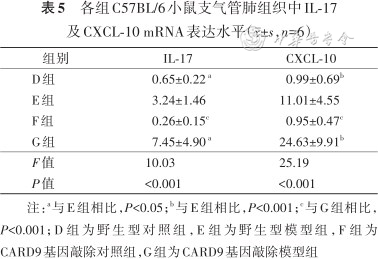
各组C57BL/6小鼠支气管肺组织中IL-17及CXCL-10 mRNA表达水平(±,n=6)
各组C57BL/6小鼠支气管肺组织中IL-17及CXCL-10 mRNA表达水平(±,n=6)
| 组别 | IL-17 | CXCL-10 |
|---|---|---|
| D组 | 0.65±0.22 a | 0.99±0.69b |
| E组 | 3.24±1.46 | 11.01±4.55 |
| F组 | 0.26±0.15c | 0.95±0.47c |
| G组 | 7.45±4.90 a | 24.63±9.91b |
| F值 | 10.03 | 25.19 |
| P值 | <0.001 | <0.001 |
注:a与E组相比,P<0.05;b与E组相比,P<0.001;c与G组相比,P<0.001;D组为野生型对照组,E组为野生型模型组,F组为CARD9基因敲除对照组,G组为CARD9基因敲除模型组
目前哮喘的治疗主要为针对辅助型T2细胞炎症为主的吸入激素治疗,而对于大部分激素不敏感的重症难治性哮喘,缺乏有效的治疗药物及治疗靶点[12]。临床上支气管哮喘患病率存在明显性别差异[13]。与男性哮喘患者相比,女性患者病情更严重,对糖皮质激素抵抗表型的发生率更高[14]。本研究构建了雌性小鼠激素抵抗型哮喘模型,并发现模型组CARD9表达量较对照组明显升高,在动物层面验证了CARD9的表达可能与激素抵抗型哮喘的发生发展密切相关。为了进一步验证该假设,本研究利用野生型小鼠和CARD9敲除小鼠同时构建激素抵抗型哮喘模型,结果发现CARD9基因敲除模型组比野生型模型组炎症更重,组织损伤更明显,据此,本课题组推断CARD9可能为激素抵抗型哮喘模型的保护性基因。
中性粒细胞浸润为大部分重症哮喘难治的主要原因[15, 16],CXCL-10及IL-17等中性粒细胞趋化因子的过度分泌会导致肺部中性粒细胞的浸润[17, 18]。本研究构建的模型中,相较于野生型模型组,CARD9基因敲除模型组有更严重的中性粒细胞浸润,且中性粒细胞趋化因子明显升高。据此,推断CARD9基因的缺失可能会导致中性粒细胞趋化因子升高,增加气道中性粒细胞的浸润,从而加重哮喘的严重程度。
有研究显示模式识别受体下游衔接分子,包括髓样分化因子88和CARD9,可以最终激活编码 IL-17基因的转录因子,故认为CARD9对于Th17 保护性免疫反应的发展是必不可少的[19, 20]。也有研究指出IL-17 反应在热带念珠菌感染后的 CARD9-/-小鼠中被正常诱导[21],CARD9基因(Q295X)纯合突变患者的TH17未见明显变化[22],可见IL-17与CARD9基因的关系仍无定论。本研究发现CARD9基因敲除模型组IL-17较野生型模型组明显升高,但CARD9基因的缺失或减少如何介导激素抵抗型哮喘模型中的IL-17等中性粒细胞趋化因子的升高,其相关分子机制仍需进一步研究。另外,本研究未对雄性野生型小鼠及CARD9-/-小鼠进行造模比较,仍需进行相关实验验证雄性小鼠中本研究相关结论是否依然成立。
综上所述,本研究发现在雌性小鼠激素抵抗型哮喘模型中,CARD9基因缺失可以显著加重雌鼠肺部炎症细胞浸润,特别是中性粒细胞的浸润,这可能与过度升高的中性粒细胞趋化因子有关。CARD9基因有望成为女性重症哮喘的重要治疗靶点,然而其与性别的关系及确切的分子机制有待下一步研究。
葛翔挺, 王美燕, 郑锐, 等. CARD9基因敲除对C57BL/6小鼠激素抵抗型哮喘模型气道炎症的影响[J]. 中华医学杂志, 2023, 103(10): 746-751. DOI: 10.3760/cma.j.cn112137-20220623-01386.
所有作者均声明不存在利益冲突



























