
先天性低促性腺激素性性腺功能减退症(CHH)的女性患者由于促性腺激素缺乏,导致第二性征不发育、原发闭经、不产生卵子和不能受孕。本文报道1例有生育需求的女性患者,32岁,2019年9月因“原发性闭经”就诊于北京协和医院,其雌二醇水平低且促性腺激素水平低,无其他垂体前叶激素分泌障碍,无其他慢性系统性疾病,嗅觉正常,CHH诊断明确,经雌、孕激素生理性替代治疗后第二性征发育,促性腺激素释放激素(GnRH)脉冲式皮下注射后成功妊娠并分娩。通过总结分析本病例的诊治过程,提高医务工作者对CHH女性患者从青春发育到成功生育全过程的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,32岁,2019年9月因“原发性闭经”于北京协和医院内分泌科门诊就诊。患者自2007年(17岁)因“青春期月经未来潮”就诊于外院,行雌、孕激素替代治疗,治疗过程中阴道有规律出血。2018年9月患者自行停药,停药后无月经来潮。2019年9月因有生育计划就诊于北京协和医院。患者嗅觉正常,家族中无类似疾病患者。
体格检查:身高173 cm,体重60 kg,青春发育Tanner分期双侧乳房Ⅳ期,阴毛Ⅲ期,面中线及四肢骨骼发育正常。
辅助检查:染色体:46,XX;黄体生成素(LH)<0.2 U/L,卵泡刺激素(FSH)<0.2 U/L,雌二醇(E2)<15 μg/L。曲普瑞林兴奋试验:LH峰值为1.2 U/L,FSH峰值为3.63 U/L。其他垂体前叶激素均在正常范围内。经腹子宫及双附件超声结果:子宫大小为3.8 cm×3.3 cm×2.1 cm,内膜厚约0.3 cm;左卵巢大小为2.8 cm×0.6 cm,右卵巢大小为2.2 cm×1.2 cm(图1A)。鞍区MRI提示未见占位性病变。嗅神经MRI可见正常的双侧嗅球和嗅束。
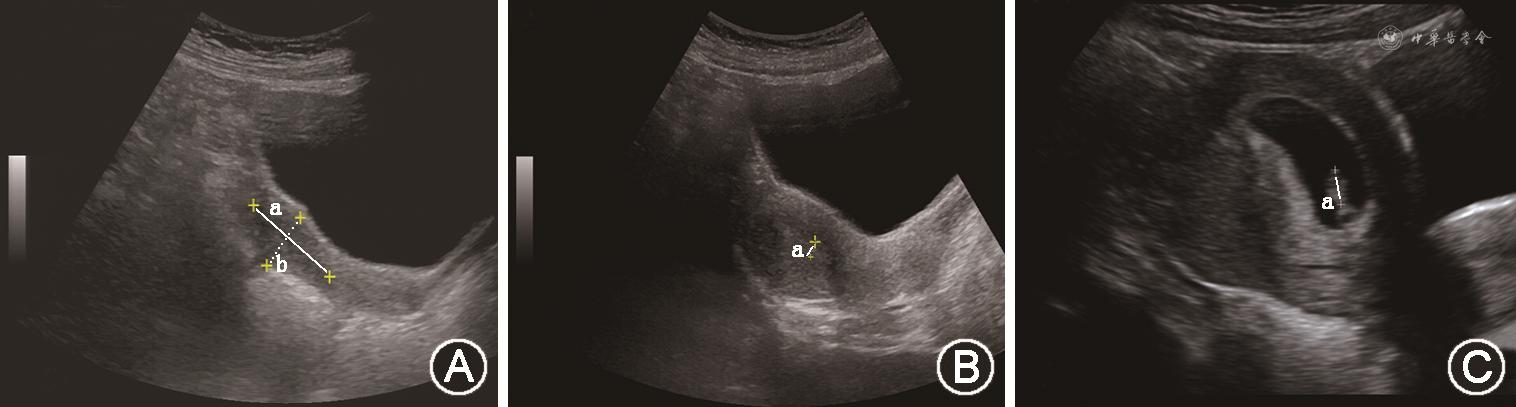

诊治经过:综合患者起病年龄、临床表现、体格检查及实验室检查,患者生物年龄>14岁,尚无青春发育和月经来潮,雌二醇水平低且促性腺激素水平低,无其他垂体前叶激素分泌障碍,无其他慢性系统性疾病,嗅觉正常,临床诊断先天性低促性腺激素性性腺功能减退症(CHH)较为明确。患者自2019年9月起予小剂量雌激素(戊酸雌二醇0.5 mg,1次/d)治疗9个月,后增加其剂量(1 mg,1次/d)治疗6个月,监测患者双乳发育达Tanner分期Ⅴ期,复查经腹子宫及双附件超声提示子宫较前明显增大,为5.2 cm×5.5 cm×3.6 cm(达成年生育期女性子宫大小),且子宫内膜清晰可见(图1B)。随后进行周期性雌、孕激素联合治疗(戊酸雌二醇2 mg,1次/d,连用11 d;戊酸雌二醇2 mg,醋酸环丙孕酮1 mg,均1次/d,连用10 d),连用6个月,期间可有撤退性阴道出血。因患者生育需求强烈,2021年6月开始予脉冲促性腺激素释放激素(GnRH)皮下输注治疗(凯联茵诺®泵ATA-S-1-0型,沪械注准20192140393),戈那瑞林(安徽丰原药业,国药准字:H10960064)脉冲间隔时间为90 min,脉冲剂量为10 μg。治疗1个月后患者否认过敏、活动受限等不良反应,复查LH为1.85 U/L,FSH为1.56 U/L,雌二醇为137 μg/L。治疗40 d后月经来潮,此后每隔30~35 d月经来潮1次,末次月经时间为2021年9月24日。患者治疗19周后监测尿绒毛膜促性腺激素(β-HCG)阳性,血β-HCG>1 050 U/L,经阴道子宫超声提示宫腔内见妊娠囊3.9 cm×4.6 cm×1.8 cm,内见胎芽与胎心搏动(图1C),提示宫内早孕。发现宫内妊娠后(孕6周时),停用脉冲GnRH注射,予黄体酮支持治疗。妊娠期间监测其他垂体前叶激素均处于正常范围内。妊娠25周时完善口服葡萄糖耐量试验:空腹、餐后1 h及餐后2 h血糖分别为5.7、6.5和7.3 mmol/L,诊断为“妊娠期糖尿病”,通过饮食和运动控制血糖,监测血糖控制良好。妊娠40周+2顺产分娩一女婴,身长50 cm,体重3 450 g,新生儿身体状况评分(Apgar评分)10分,幼女外阴无畸形。患者产后正常分泌乳汁,母乳喂养,产后1.5个月随诊LH<0.2 U/L,FSH为0.49 U/L,雌二醇<15 μg/L。整个诊疗过程中,下丘脑-垂体-性腺轴激素水平的变化见图2所示(GnRH脉冲泵治疗前的21个月周期性使用雌、孕激素联合治疗,期间患者外周血LH、FSH、雌二醇及β-HCG的水平无明显变化)。
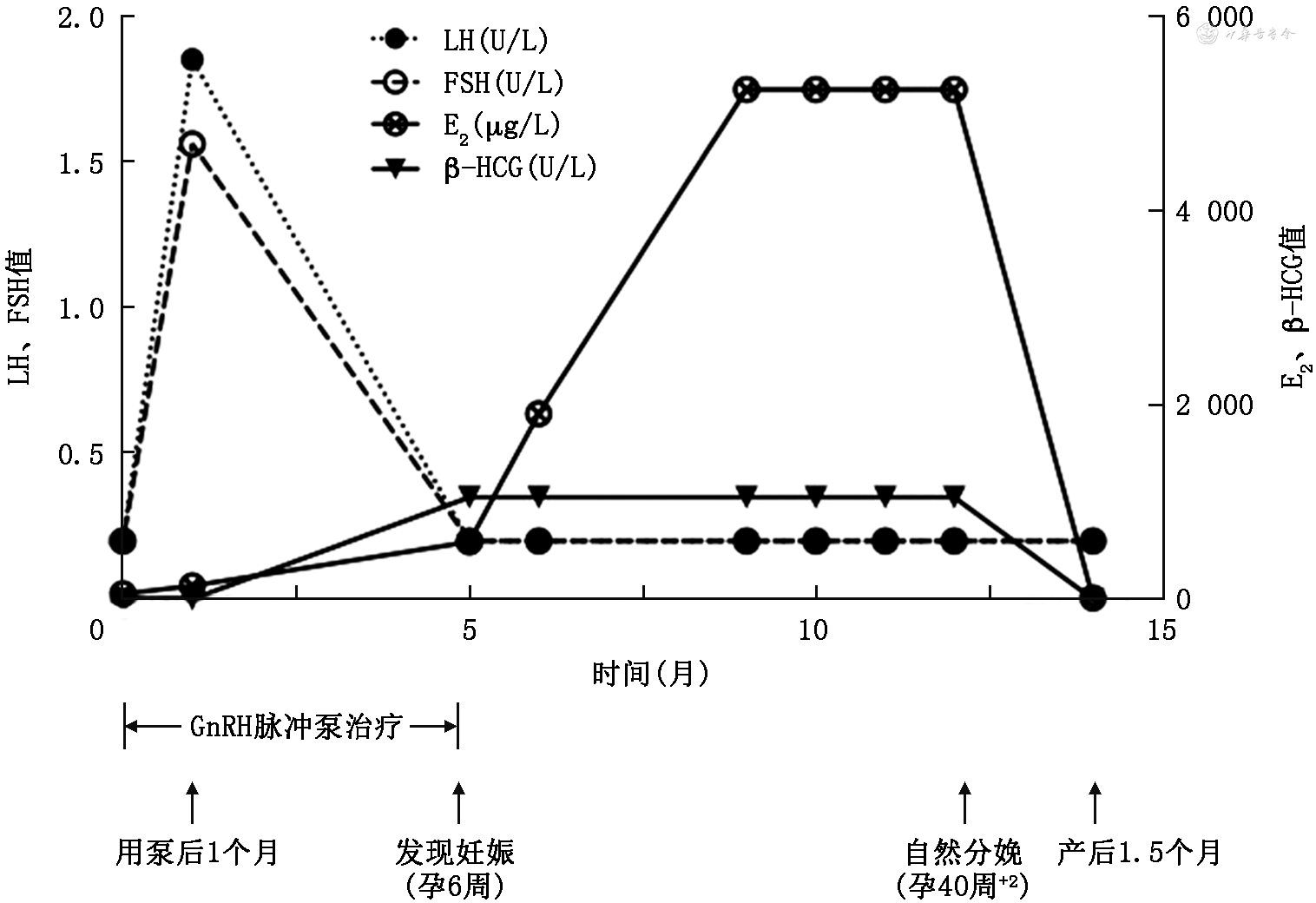

注:LH为黄体生成素;FSH为卵泡刺激素;E2为雌二醇;β-HCG为绒毛膜促性腺激素(血);GnRH为促性腺激素释放激素
原发性闭经的原因众多,但女性CHH的患者罕见,临床医师对其认识不足,难以早期识别及诊断。
针对CHH女性患者青春发育的诱导治疗,个体化的生理剂量的激素替代方案是关键,亦是难点。
CHH女性患者因生育需求启动脉冲GnRH治疗后,何时停泵及如何规避不良反应给成功妊娠带来挑战。
CHH女性患者青春发育的诱导治疗应尽量模拟正常青春发育过程,从单独雌激素起始治疗,逐渐过渡至周期性雌、孕激素联合治疗。
相较于促性腺激素治疗,脉冲GnRH治疗更符合生理激素分泌模式,降低多胎妊娠及卵巢过度刺激综合征的发生风险,且减少医疗花费。
CHH女性患者在脉冲GnRH治疗中需密切监测早孕指标,一旦成功妊娠,需及时终止脉冲GnRH治疗,避免潜在流产风险,必要时加用黄体酮保胎治疗。
CHH是指病因不明的下丘脑GnRH神经元功能受损,导致垂体促性腺激素分泌减少,引起性腺功能减退的一种罕见的先天性疾病,男性患病率约为1/8 000,女性患病率更低,是男性的1/5[1, 2]。GnRH缺乏会导致女性卵泡生长成熟障碍,临床表现为青春不发育和原发性闭经。通常情况下,促性腺激素或脉冲GnRH治疗后可诱导CHH女性患者排卵,甚至受孕[3]。截至目前,由于CHH病例数较少,脉冲GnRH诱导排卵和妊娠管理相关的临床经验不足,因此,本文报道1例有生育需求的CHH女性患者,经雌、孕激素生理替代治疗后第二性征发育,序贯脉冲GnRH治疗仅19周后即自然受孕,并顺利分娩。通过总结分析本病例的诊治过程,为今后此类患者从发育到生育提供宝贵的临床经验。
该患者CHH诊断明确,治疗上尽量模拟正常青春发育过程,补充性激素以诱导第二性征发育。治疗期间雌激素增量及雌、孕激素序贯治疗均需循序渐进,以免乳房发育不美观。此外,结合患者有生育需求,选择脉冲GnRH(10 μg/90 min)诱导排卵治疗。治疗期间患者有规律的月经周期(提示有排卵),治疗19周后成功自然妊娠,整个孕期及分娩过程均顺利。对于有生育需求的CHH女性患者,可行促性腺激素或脉冲GnRH诱导卵泡发育、排卵及妊娠[1]。脉冲GnRH治疗可重建CHH女性患者下丘脑-垂体-卵巢轴的功能。正常育龄期女性GnRH脉冲分泌频率在整个月经周期中会发生变化:当GnRH脉冲频率加快(>1脉冲/60 min)时,LH分泌增多;当GnRH脉冲频率减慢(<1脉冲/120~180 min)时,FSH分泌增多。因此,通过模拟生理性GnRH脉冲频率(卵泡早期:1次/90 min;卵泡中晚期:1次/60~70 min;排卵后黄体早期:1次/100 min;黄体晚期:1次/200 min),调节FSH/LH的释放比率,从而控制卵巢卵泡/黄体周期性转变[4]。此外,固定频率60或90 min的脉冲GnRH治疗也可出现良好的排卵和妊娠结局,这可能与靶器官分泌激素的负反馈调节参与GnRH脉冲调控相关[1,5]。荟萃分析显示,脉冲GnRH成功治疗下丘脑性闭经后卵巢的排卵率约为75.64%,每个排卵周期妊娠率约为38.46%,每个排卵周期活产率约为35.33%,提示脉冲GnRH治疗CHH有良好的妊娠结局[6]。
与促性腺激素相比,脉冲GnRH治疗CHH主要存在以下优势:(1)模拟下丘脑GnRH的脉冲释放,更符合生理状态,被誉为“人工下丘脑”;(2)治疗不会过度刺激卵巢,不会出现多胎妊娠的风险;(3)治疗过程中无需反复监测超声,减少就医次数;(4)避免体外受精,减少医疗花费。荟萃分析显示脉冲GnRH治疗出现多胎妊娠的比例仅为3.4%,明显低于促性腺激素治疗人群(约30%)[6]。此外,脉冲GnRH治疗发生卵巢过度刺激综合征的比例仅1.86%,且多为轻症。因此,脉冲GnRH诱导排卵是一种更接近生理状态、更简便、不良反应更少且更安全、有效的治疗方式,可以作为CHH女性患者诱导生育的一线治疗[7, 8]。
妊娠期间,下丘脑/垂体作为激素调节中枢,其适应性改变是维持母婴正常生理机能所必需的。胎盘细胞滋养层及合体滋养层合成并分泌的GnRH与下丘脑来源的GnRH有相同的化学结构与生物学活性,主要用于维持妊娠早期胎盘与黄体功能[9, 10]。垂体促性腺激素细胞对GnRH的反应在孕6~7周后显著降低,并在孕中期降低至接近0的水平。产后1个月垂体逐渐恢复对GnRH的反应,这可能是由于妊娠期卵巢及胎盘产生并分泌到循环中的高浓度雌二醇、孕酮及抑制素对垂体促性腺激素细胞的负反馈调控作用。因此,为模拟正常女性妊娠期内分泌激素的变化,CHH女性患者GnRH脉冲泵治疗后应密切监测早孕指标,一旦成功妊娠,及时终止脉冲GnRH治疗,必要时加用黄体酮保胎治疗。若不及时中止治疗,妊娠早期垂体对外源性持续泵入的GnRH仍存在反应,导致体内雌、孕激素水平出现波动,可能会出现子宫内膜剥脱,造成流产。既往本中心曾接诊1例GnRH脉冲泵治疗的CHH女性患者,因妊娠早期未及时停用GnRH脉冲泵,阴道出现少量流血,发现后及时停泵,最终阴道流血停止并成功妊娠。
综上,本文报道了1例罕见的CHH女性患者经生理性雌、孕激素替代治疗到脉冲GnRH治疗后出现青春期发育到成功生育的诊治经过。生理性雌、孕激素替代治疗需循序渐进,避免出现乳房发育不美观。脉冲GnRH治疗通过模拟正常GnRH脉冲释放模式,重启CHH女性患者下丘脑-垂体-卵巢轴的功能,诱导排卵并新建生育能力。一旦发现妊娠后,需及时暂停脉冲GnRH治疗,避免潜在流产风险。
朱伊祎, 王曦, 茅江峰, 等. 第571例 青年女性—原发性闭经—GnRH脉冲治疗—成功生育[J]. 中华医学杂志, 2023, 103(11): 850-852. DOI: 10.3760/cma.j.cn112137-20221116-02408.
所有作者均声明不存在利益冲突































