
利用自动脑分割技术分析颞叶癫痫伴海马硬化(TLE-HS)患者脑体积的不对称性,并探讨该技术在TLE-HS的诊断及对致痫灶定侧中的应用价值。
回顾性收集2019年4月至2020年10月就诊于郑州大学第一附属医院的TLE-HS患者28例,其中男15例,女13例,年龄18~63(30±12)岁,根据病灶侧别分为左侧TLE-HS(LTLE-HS)组11例和右侧TLE-HS(RTLE-HS)组17例;招募对照者28名,年龄18~49(29±10)岁。所有受试者进行三维T1加权像(3D T1WI)扫描。回顾性分析LTLE-HS和RTLE-HS和对照者左右侧脑结构体积的差异,并使用 Pearson相关系数评价左右侧体积的相关性,用效应值评价左右侧体积平均值的差。另计算每组左右侧体积的不对称指数(AI)并比较三组间的差异。
对照者、LTLE-HS、RTLE-HS组脑内各结构左右侧标准体积均具有不对称性,在LTLE-HS组和RTLE-HS组中患侧海马体积均小于对侧海马体积(分别为0.20%±0.03%比0.24%±0.02%,0.21%±0.03%比0.25%±0.02%;均P<0.001),LTLE-HS组患侧颞叶灰质和颞叶白质体积小于对侧(4.41%±0.38%比5.01%±0.43%,1.83%±0.22%比2.22%±0.14%;均P<0.001)。对照者、LTLE-HS、RTLE-HS三组左右侧体积呈中-强度的线性相关(0.553<r<0.964,均P<0.05)。三组均显示扣带回的效应值最大(效应值分别为:对照者3.07、LTLE-HS组4.85、RTLE-HS组4.22)。三组间海马、颞叶灰质、颞叶白质的AI值差异具有统计学意义(分别为-1.48±8.64比15.91±10.15比-17.59±10.00、7.46±2.67比12.67±6.67比3.67±6.15、6.53±3.71比19.91±9.85比1.57±8.38;均P<0.001)。
自动脑分割技术体积测量可在颞叶癫痫术前评估中发挥重要作用,脑体积的不对称性对致痫灶定侧及范围确定有一定的应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颞叶癫痫(temporal lobe epilepsy,TLE)是最常见的药物难治性癫痫之一[1],海马硬化(hippocampal sclerosis,HS)是TLE最常见的病理类型,病理上表现为海马体积缩小,神经元细胞丢失和神经胶质细胞增生[2]。颞叶癫痫伴海马硬化(temporal lobe epilepsy with hippocampal sclerosis,TLE-HS)患者可通过手术切除致痫灶,治愈率达70%以上,而手术的关键因素之一就是对致痫灶准确的定位[3, 4]。有研究发现,利用海马不对称指数(asymmetry index,AI)定量评估HS敏感性高[5],但目前多以影像学评估、脑电图、颅内电极等作为HS诊断的标准。随着技术的发展,将自动脑分割技术整合到磁化强度预备梯度回波序列(magnetization-prepared rapid acquisition gradient echo,MPRAGE)中,扫描结束直接自动生成脑内各种结构的形态学体积测量报告,直观快速,无需后处理,该技术目前已应用到阿尔兹海默病、帕金森等常见的中老年神经退行性疾病中[6]。本研究运用自动脑分割技术对TLE-HS患者全脑结构体积及左右侧不对称性进行分析,探讨该技术在TLE-HS的诊断及对致痫灶的准确定位中的应用价值。
回顾性收集2019年4月至2020年10月就诊于郑州大学第一附属医院的TLE-HS患者28例,其中男15例,女13例,年龄18~63(30±12)岁;包括左侧TLE-HS(left TLE-HS,LTLE-HS)组11例,年龄20~63岁,右侧TLE-HS(right TLE-HS,RTLE-HS)组17例,年龄18~45岁。同期招募年龄、性别、受教育年限匹配的对照者28名,其中男15名,女13名,年龄18~49(29±10)岁。
TLE-HS组纳入标准:(1)汉族、右利手、各受试者之间无血缘关系;(2)根据国际抗癫痫联盟(international league against epilepsy,ILAE)(2017年)诊断标准诊断为癫痫;(3)临床症状学符合颞叶起源性发作;(4)头皮脑电图或颅内电极脑电图显示发作或发作间期痫性放电源于颞叶;(5)头颅MRI检查提示单侧海马硬化。对照组纳入标准:(1)汉族、右利手、各受试者之间无血缘关系;(2)无颅脑损伤史、昏迷史及心脑血管疾病、糖尿病等慢性病史;(3)本人及家中三代以内亲属无癫痫、精神和神经疾病;(4)头颅MRI提示阴性结果;(5)无乙醇、毒品或药物依赖史;(6)无服用精神疾病类药物史。两组排除标准一样,均为:(1)具有全身性疾病、精神障碍、药物成瘾等患者;(2)有颅内占位性病变、脑外伤、脑梗死、脑出血、颅内感染等脑部疾病史;(3)体内携带金属支架、金属牙齿、金属瓣膜等易产生伪影的患者;(4)扫描时头部运动>3 mm。本研究经郑州大学第一附属医院研究伦理委员会批准(2019-KY-232),并已获得所有受试者的知情同意。
受试者影像资料通过3.0 T磁共振(Magnetom Prisma,德国西门子公司)64通道头颅线圈采集。采集时嘱受试者平躺,睁眼,平静呼吸,尽量不要进行自主思维活动。采集常规MRI序列以排除具有明显结构异常的受试者。扫描参数如表1所示。
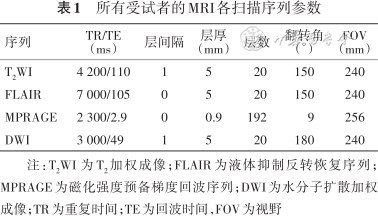
所有受试者的MRI各扫描序列参数
所有受试者的MRI各扫描序列参数
| 序列 | TR/TE (ms) | 层间隔 | 层厚 (mm) | 层数 | 翻转角 (°) | FOV (mm) |
|---|---|---|---|---|---|---|
| T2WI | 4 200/110 | 1 | 5 | 20 | 150 | 240 |
| FLAIR | 7 000/105 | 0 | 5 | 20 | 150 | 240 |
| MPRAGE | 2 300/2.9 | 0 | 0.9 | 192 | 9 | 256 |
| DWI | 3 000/49 | 1 | 5 | 20 | 180 | 240 |
注:T2WI 为T2加权成像;FLAIR为液体抑制反转恢复序列;MPRAGE为磁化强度预备梯度回波序列;DWI为水分子扩散加权成像;TR为重复时间;TE为回波时间,FOV为视野
MPRAGE扫描完成后得到原始图像(图1A)、脑体积分割图像(图1B、1C)和全脑结构体积报告。系统软件包自动进行去皮、头骨和脑膜,标准化校正,脑组织分类等过程,最后输出脑组织分割测量后的绝对体积、标准体积以及标准化范围。从结果报告中提取双侧丘脑、壳核、尾状核、苍白球、海马、额叶灰质、顶叶灰质、枕叶灰质、颞叶灰质、扣带回、岛叶、额叶白质、顶叶白质、枕叶白质、颞叶白质的标准体积值。标准体积值=绝对体积/颅脑总体积×100%。


采用SPSS 21.0统计分析软件。首先对数据进行Shapiro-Wilk正态性检验。符合正态分布的资料以表示,不符合正态分布者以M(Q1,Q3)表示。在对照者、LTLE-HS、RTLE-HS组之间,分别采用Kruskal-Wallis检验和χ2检验对年龄和性别进行比较,LTLE-HS和RTLE-HS组病程采用独立样本t检验进行比较。若数据满足正态分布,采用配对t检验分别对对照者、LTLE-HS、RTLE-HS组脑内各结构左右侧标准体积进行比较;若不满足正态分布则使用Wilcoxon检验。用Pearson相关系数评估左右侧标准体积之间的相关性,r<0.40为相关性较差,0.40≤r≤0.75为相关性一般,r>0.75为相关性较好。使用效应值评价左右侧体积的平均值的差异,效应值≥0.2为低效果,效应值≥0.5为中等效果,效应值≥0.8为高效果。效应值=2组平均值差/联合标准差。
计算AI值公式为:;其中V右表示右侧体积,V左代表左侧体积,V平均代表左右侧体积的平均值。
计算对照者、LTLE-HS、RTLE-HS 3组中脑内各结构左右侧标准体积的AI值,AI>0提示右侧体积大于左侧,表示右侧化不对称;反之,AI<0提示左侧体积大于右侧,提示左侧化不对称。对3组脑内各结构左右侧标准体积的AI值进行单因素方差分析或Kruskal-Wallis检验,并使用Bonferroni校正进行事后分析。双侧检验,检验水准α=0.05。
对照者共计28名,LTLE-HS组11例,RTLE-HS组17例。对照者、LTLE-HS组、RTLE-HS组3组间年龄[M(Q1,Q3)][(26(23,33)比(33.09±13.72)比(28.76±10.71)岁]和性别(男/女)(15/13比5/6比10/7)差异无统计学意义(均P>0.05)。LTLE-HS和RTLE-HS组病程[(17.59±14.52)比(10.55±7.76),t=1.67,P=0.106]差异无统计学意义(P>0.05)。
对照者壳核、尾状核、额叶灰质、枕叶灰质、颞叶灰质、扣带回、岛叶、额叶白质、顶叶白质、枕叶白质、颞叶白质的左右侧标准体积差异有统计学意义(均P<0.05),丘脑、苍白球、海马、顶叶灰质的左右侧标准体积差异无统计学意义(均P>0.05)(表2)。

对照者、LTLE-HS、RTLE-HS组脑内各结构左右侧标准体积比较(%)
对照者、LTLE-HS、RTLE-HS组脑内各结构左右侧标准体积比较(%)
| 组别 | 左侧 | 右侧 | 效应值 | t/Z值 | P值 | r值 | P值 |
|---|---|---|---|---|---|---|---|
| 丘脑 | |||||||
| 对照者 | 0.50±0.04a | 0.52(0.46,0.54)b | 0.31 | -0.74 | 0.462 | 0.819 | <0.001 |
| LTLE-HS a | 0.51±0.05 | 0.52±0.05 | 0.20 | -4.03 | 0.002 | 0.964 | <0.001 |
| RTLE-HS a | 0.50±0.04 | 0.50±0.03 | 0.00 | 0.56 | 0.585 | 0.386 | 0.126 |
| 壳核a | |||||||
| 对照者 | 0.56±0.03 | 0.51±0.03 | 1.67 | 15.21 | <0.001 | 0.872 | <0.001 |
| LTLE-HS | 0.54±0.04 | 0.51±0.04 | 0.75 | 2.37 | 0.040 | 0.593 | 0.055 |
| RTLE-HS | 0.55±0.05 | 0.49±0.04 | 1.33 | 9.33 | <0.001 | 0.889 | <0.001 |
| 尾状核a | |||||||
| 对照者 | 0.31±0.04 | 0.33±0.03 | 0.57 | -7.73 | <0.001 | 0.892 | <0.001 |
| LTLE-HS | 0.31±0.03 | 0.32±0.02 | 0.39 | -2.45 | 0.034 | 0.835 | 0.001 |
| RTLE-HS | 0.31±0.03 | 0.33±0.02 | 0.78 | -4.40 | <0.001 | 0.731 | 0.001 |
| 苍白球 | |||||||
| 对照者b | 0.15(0.14,0.16) | 0.15(0.13,0.16) | 0.00 | -1.50 | 0.135 | 0.812 | <0.001 |
| LTLE-HS | 0.14±0.01a | 0.14(0.14,0.14)b | 0.00 | -1.19 | 0.234 | 0.790 | <0.001 |
| RTLE-HSa | 0.15±0.02 | 0.14±0.01 | 0.63 | 0.81 | 0.431 | 0.749 | 0.001 |
| 海马a | |||||||
| 对照者 | 0.24±0.02 | 0.24±0.02 | 0.00 | 0.98 | 0.338 | 0.484 | 0.009 |
| LTLE-HS | 0.20±0.03 | 0.24±0.02 | 1.57 | -5.09 | <0.001 | 0.592 | 0.055 |
| RTLE-HS | 0.25±0.02 | 0.21±0.03 | 1.57 | 7.72 | <0.001 | 0.700 | 0.002 |
| 额叶灰质a | |||||||
| 对照者 | 7.24±0.33 | 6.86±0.37 | 1.08 | 9.02 | <0.001 | 0.799 | <0.001 |
| LTLE-HS | 7.13±0.63 | 6.87±0.67 | 0.40 | 4.49 | 0.001 | 0.959 | <0.001 |
| RTLE-HS | 7.32±0.52 | 6.93±0.52 | 0.75 | 4.62 | <0.001 | 0.775 | <0.001 |
| 顶叶灰质a | |||||||
| 对照者 | 4.93±0.35 | 4.84±0.31 | 0.27 | 1.93 | 0.064 | 0.733 | <0.001 |
| LTLE-HS | 4.92±0.45 | 4.70±0.32 | 0.56 | 2.76 | 0.020 | 0.823 | 0.002 |
| RTLE-HS | 4.90±0.40 | 4.84±0.38 | 0.15 | 1.20 | 0.248 | 0.854 | <0.001 |
| 枕叶灰质a | |||||||
| 对照者 | 2.05±0.18 | 2.18±0.19 | 0.70 | -7.15 | <0.001 | 0.846 | <0.001 |
| LTLE-HS | 1.95±0.16 | 2.13±0.22 | 0.94 | -4.29 | 0.002 | 0.783 | 0.004 |
| RTLE-HS | 1.98±0.14 | 2.19±0.15 | 1.44 | -6.25 | <0.001 | 0.580 | 0.015 |
| 颞叶灰质 | |||||||
| 对照者a | 4.69±0.25 | 5.05±0.24 | 1.47 | -14.99 | <0.001 | 0.863 | <0.001 |
| LTLE-HS a | 4.41±0.38 | 5.01±0.43 | 1.48 | -6.43 | <0.001 | 0.714 | 0.014 |
| RTLE-HS | 4.65±0.35a | 4.74(4.48,5.00)b | 0.20 | -2.11 | 0.035 | 0.569 | 0.017 |
| 扣带回a | |||||||
| 对照者 | 0.49±0.06 | 0.69±0.07 | 3.07 | -22.81 | <0.001 | 0.755 | <0.001 |
| LTLE-HS | 0.47±0.03 | 0.67±0.05 | 4.85 | -20.12 | <0.001 | 0.663 | 0.026 |
| RTLE-HS | 0.48±0.03 | 0.68±0.06 | 4.22 | -15.69 | <0.001 | 0.553 | 0.021 |
| 岛叶a | |||||||
| 对照者 | 0.45±0.03 | 0.48±0.03 | 1.00 | -6.78 | <0.001 | 0.798 | <0.001 |
| LTLE-HS | 0.42±0.05 | 0.45±0.03 | 0.73 | -3.74 | 0.004 | 0.865 | 0.001 |
| RTLE-HS | 0.42±0.04 | 0.46±0.05 | 0.88 | -5.37 | <0.001 | 0.818 | <0.001 |
| 额叶白质a | |||||||
| 对照者 | 5.66±0.41 | 5.49±0.40 | 0.42 | 5.38 | <0.001 | 0.920 | <0.001 |
| LTLE-HS | 5.32±0.45 | 5.22±0.46 | 0.22 | 2.09 | 0.063 | 0.946 | <0.001 |
| RTLE-HS | 5.58±0.35 | 5.38±0.39 | 0.54 | 4.07 | 0.001 | 0.858 | <0.001 |
| 顶叶白质a | |||||||
| 对照者 | 3.58±0.33 | 3.46±0.30 | 0.38 | 4.22 | <0.001 | 0.886 | <0.001 |
| LTLE-HS | 3.47±0.27 | 3.30±0.24 | 0.67 | 3.33 | 0.008 | 0.771 | 0.005 |
| RTLE-HS | 3.47±0.25 | 3.30±0.24 | 0.69 | 4.43 | <0.001 | 0.778 | <0.001 |
| 枕叶白质a | |||||||
| 对照者 | 0.96±0.15 | 1.07±0.12 | 0.81 | -6.43 | <0.001 | 0.765 | <0.001 |
| LTLE-HS | 0.89±0.12 | 1.02±0.15 | 0.96 | -4.23 | 0.002 | 0.698 | 0.017 |
| RTLE-HS | 0.94±0.15 | 1.08±0.15 | 0.93 | -4.91 | <0.001 | 0.703 | 0.002 |
| 颞叶白质a | |||||||
| 对照者 | 2.16±0.17 | 2.30±0.21 | 0.73 | -9.20 | <0.001 | 0.914 | <0.001 |
| LTLE-HS | 1.83±0.22 | 2.22±0.14 | 2.12 | -7.17 | <0.001 | 0.556 | 0.075 |
| RTLE-HS | 2.05±0.20 | 2.08±0.22 | 0.14 | -0.82 | 0.424 | 0.660 | <0.001 |
注:a;bM(Q1,Q3);LTLE-HS为左侧颞叶癫痫伴海马硬化;RTLE-HS为右侧颞叶癫痫伴海马硬化
LTLE-HS组丘脑、壳核、尾状核、海马、额叶灰质、顶叶灰质、枕叶灰质、颞叶灰质、扣带回、岛叶、顶叶白质、枕叶白质、颞叶白质的左右侧标准体积差异有统计学意义(均P<0.05),苍白球、额叶白质的左右侧标准体积差异无统计学意义(均P>0.05)(表2)。
RTLE-HS组壳核、尾状核、海马、额叶灰质、枕叶灰质、颞叶灰质、扣带回、岛叶、额叶白质、顶叶白质、枕叶白质左右侧标准体积差异有统计学意义(均P<0.05),丘脑、苍白球、顶叶灰质、颞叶白质左右侧标准体积差异无统计学意义(均P>0.05)(表2)。
在LTLE-HS组和RTLE-HS组中,患侧海马体积均小于对侧海马体积[(0.20±0.03)%比(0.24±0.02)%,t=-5.09,P<0.001;(0.21±0.03)%比(0.25±0.02)%,t=7.72,P<0.001],LTLE-HS组患侧颞叶灰质和颞叶白质体积小于对侧[(4.41±0.38)%比(5.01±0.43)%,t=-6.43,P<0.001;(1.83±0.22)%比(2.22±0.14)%,t=-7.17,P<0.001]。3组均显示左侧壳核、额叶灰质、顶叶白质体积大于右侧,右侧尾状核、颞叶灰质、枕叶灰质、扣带回、岛叶、枕叶白质体积大于左侧。另外,LTLE-HS组左侧丘脑体积小于右侧[(0.51±0.05)%比(0.52±0.05)%,t=-4.03,P=0.002],左侧顶叶灰质体积大于右侧[(4.92±0.45)%比(4.70±0.32)%,t=2.76,P=0.020];RTLE-HS组左侧额叶白质体积大于右侧[(5.58±0.35)%比(5.38±0.39)%,t=4.07,P=0.001](表2)。
Pearson相关分析显示:对照者、LTLE-HS、RTLE-HS 3组显示中-强度的线性相关。每一亚组线性相关性:对照组为0.733<r<0.920(海马除外,海马r=0.484,P=0.009),LTLE-HS组0.556<r<0.964(苍白球除外,苍白球r=0.371,P=0.262),RTLE-HS组0.553<r<0.889(丘脑除外,丘脑r=0.386,P=0.126)(表2)。
在效应值方面,3组中均表现为扣带回的效应值最大,对照组中从苍白球的0到扣带回3.07,LTLE-HS组从苍白球的0到扣带回4.85,RTLE-HS组从丘脑的0到扣带回4.22(表2)。
3组之间双侧大脑半球结构体积AI值的单因素方差分析结果显示,3组间海马、颞叶灰质、颞叶白质AI值差异具有统计学意义(分别为-1.48±8.64比15.91±10.15比-17.59±10.00、7.46±2.67比12.67±6.67比3.67±6.15、6.53±3.71比19.91±9.85比1.57±8.38;F=43.45、11.47、24.91,均P<0.001)(表3)。进一步事后检验发现对照组与LTLT-HS组的海马(平均值差值-17.39)、颞叶灰质(平均值差值-5.21)、颞叶白质(平均值差值-13.37)AI值差异均有统计学意义(均P<0.05);对照组与RTLT-HS组的海马(平均值差值16.12)、颞叶灰质(平均值差值3.79)、颞叶白质(平均值差值4.97)AI值差异均有统计学意义(均P<0.05);LTLT-HS组与RTLT-HS组的海马(平均值差值33.50)、颞叶灰质(平均值差值9.00)、颞叶白质(平均值差值18.34)AI值差异均有统计学意义(均P<0.05)(图2)。海马硬化患者海马、颞叶灰质AI值与病程之间无相关性,差异无统计学意义(r=-0.323、-0.248,均P>0.05),颞叶白质AI值与病程之间呈负相关,差异有统计学意义(r=-0.403,P=0.025)。
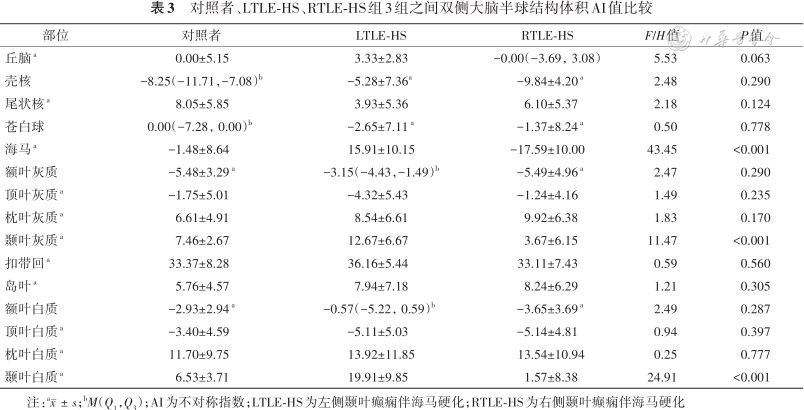
对照者、LTLE-HS、RTLE-HS组3组之间双侧大脑半球结构体积AI值比较
对照者、LTLE-HS、RTLE-HS组3组之间双侧大脑半球结构体积AI值比较
| 部位 | 对照者 | LTLE-HS | RTLE-HS | F/H值 | P值 |
|---|---|---|---|---|---|
| 丘脑a | 0.00±5.15 | 3.33±2.83 | -0.00(-3.69,3.08) | 5.53 | 0.063 |
| 壳核 | -8.25(-11.71,-7.08)b | -5.28±7.36a | -9.84±4.20 a | 2.48 | 0.290 |
| 尾状核a | 8.05±5.85 | 3.93±5.36 | 6.10±5.37 | 2.18 | 0.124 |
| 苍白球 | 0.00(-7.28,0.00)b | -2.65±7.11 a | -1.37±8.24 a | 0.50 | 0.778 |
| 海马a | -1.48±8.64 | 15.91±10.15 | -17.59±10.00 | 43.45 | <0.001 |
| 额叶灰质 | -5.48±3.29 a | -3.15(-4.43,-1.49)b | -5.49±4.96 a | 2.47 | 0.290 |
| 顶叶灰质a | -1.75±5.01 | -4.32±5.43 | -1.24±4.16 | 1.49 | 0.235 |
| 枕叶灰质a | 6.61±4.91 | 8.54±6.61 | 9.92±6.38 | 1.83 | 0.170 |
| 颞叶灰质a | 7.46±2.67 | 12.67±6.67 | 3.67±6.15 | 11.47 | <0.001 |
| 扣带回a | 33.37±8.28 | 36.16±5.44 | 33.11±7.43 | 0.59 | 0.560 |
| 岛叶a | 5.76±4.57 | 7.94±7.18 | 8.24±6.29 | 1.21 | 0.305 |
| 额叶白质 | -2.93±2.94 a | -0.57(-5.22,0.59)b | -3.65±3.69 a | 2.49 | 0.287 |
| 顶叶白质a | -3.40±4.59 | -5.11±5.03 | -5.14±4.81 | 0.94 | 0.397 |
| 枕叶白质a | 11.70±9.75 | 13.92±11.85 | 13.54±10.94 | 0.25 | 0.777 |
| 颞叶白质a | 6.53±3.71 | 19.91±9.85 | 1.57±8.38 | 24.91 | <0.001 |
注:a;bM(Q1,Q3);AI为不对称指数;LTLE-HS为左侧颞叶癫痫伴海马硬化;RTLE-HS为右侧颞叶癫痫伴海马硬化
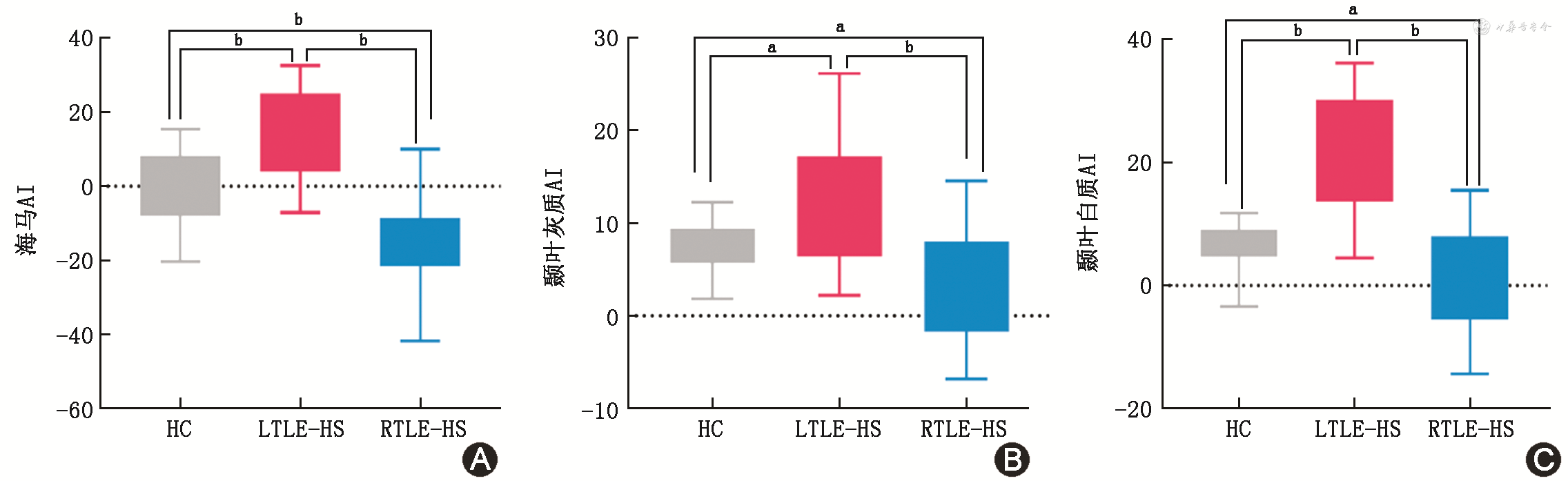

注:AI为不对称指数;HC为对照者;LTLE-HS为左侧颞叶癫痫伴海马硬化;RTLE-HS为右侧颞叶癫痫伴海马硬化
TLE-HS是难治性癫痫的主要原因,影像学上主要的表现是海马体积缩小,T2WI或FLAIR序列上出现信号增高[7],海马内部结构清晰度丧失[8],主要由于海马区海马层和分子层区域严重神经元丢失、胶质增生和纤维重组[9],还有其他继发征象如前颞叶信号改变[7],颞角扩大、穹隆及乳头体体积变小等[10]。目前影像科多由医师目测判断TLE-HS,受各种设备因素、序列因素、主观因素的影响,准确性难以把握。自动脑分割序列的应用,提高了放射科医生的工作效率和准确性。本研究利用自动脑分割序列对TLE-HS患者全脑结构体积及左右侧不对称性进行分析,探讨该技术在TLE-HS患者术前致痫灶评估中的作用。
本研究结果显示对照者、LTLE-HS、RTLE-HS组脑内各结构左右侧标准体积存在不对称性,对照者丘脑、苍白球、海马、顶叶灰质,LTLE-HS组苍白球、额叶白质,LTLE-HS组丘脑、苍白球、顶叶灰质、颞叶白质双侧体积对比差异无统计学意义,余指标差异均有统计学意义。这种改变与文献报道相符,大脑半球及其结构体积的不对称性在健康人群中普遍存在[11],3组均显示左侧壳核、额叶灰质、顶叶白质体积大于右侧,右侧尾状核、颞叶灰质、枕叶灰质、扣带回、岛叶、枕叶白质体积大于左侧。在LTLE-HS组和RTLE-HS组中患侧海马体积均小于对侧海马体积,自动化分割对海马体积进行量化,提高了癫痫定侧的敏感性[12]。笔者团队还观察到海马以外新皮层区体积的异常,包括颞叶灰质和颞叶白质体积缩小,而LTLE-HS组上述体积缩小更明显,这与文献报道一致[13],这也进一步印证了TLE-HS患者出现发作间期致痫灶同侧临近区域内神经突出活性下降[14, 15],导致皮层萎缩、神经细胞活动减少,从而引起18F-FDG PET-CT上致痫灶区域低代谢。有文献报道同侧杏仁核、丘脑、穹隆和小脑体积与TLE相关[16]。本研究中亦发现LTLE-HS组患侧丘脑体积小于对侧,再次印证了丘脑作为内侧颞叶边缘网络的一部分,在癫痫发作的产生和传播中起着关键作用[17]。此外,在LTLE-HS组和RTLE-HS组还发现了颞叶以外脑体积不对称,如顶叶灰质和额叶白质,这些广泛分布的脑体积改变,提示TLE不仅仅影响到颞叶,已经成为延伸到内侧颞叶以外的网络疾病[18]。
Pearson相关分析显示对照者、LTLE-HS、RTLE-HS 3组中-强度的线性相关,其中LTLE-HS和RTLE-HS丘脑、尾状核、苍白球等边缘系统脑区体积呈低度相关,主要原因可能是致痫灶的存在,长期异常放电刺激导致脑组织受损出现灰质-白质模糊[19],这些结构异常表明了海马致痫灶与癫痫网络中其他区域之间的相互作用[20]。在效应值方面,3组中均表现为扣带回的效应值最大,说明扣带回的体积左右侧差异较大,右侧明显大于左侧。有研究证明神经活性类固醇在扣带回、顶叶、枕叶等多个脑区,异丙孕酮和孕烯醇酮水平与灰质厚度呈正相关[21],主要由于神经活性类固醇的再生、神经保护和抗炎作用以及其他多效作用,神经活性类固醇对皮质厚度调节作用的可能机制过程是多方面的。
本研究发现对照者、LTLE-HS、RTLE-HS 3组之间海马、颞叶灰质、颞叶白质AI值差异具有统计学意义。先前的研究显示海马体积生理性不对称[22],大部分右利手者右侧海马体积大于左侧,本研究中发现LTLE-HS患者右侧半球优势更明显,左侧海马、左侧颞叶灰质及白质萎缩更明显。TLE患者存在双侧大脑半球广泛的结构损伤,但患侧区域的脑结构损害远较非致痫侧更严重[23]。此外,本研究还发现颞叶白质AI值与病程呈负相关,可能由于长期癫痫异常放电导致癫痫灶对侧的颞叶结构损伤所致[24]。全脑自动分割技术为TLE-HS患者提供全脑结构体积,海马的不对称性对TLE-HS的诊断起到重要作用,可联合SEEG、PET-CT进行综合术前评估[25, 26],最终确认致痫灶,为手术方案的制定提供指导。
本研究存在的局限性如下:(1)样本量小,下一步应该增加新病例进一步研究;(2)受试者都是右利手,虽然左利手人少,但仍具有重要意义;(3)本研究只局限关注TLE-HS,对癫痫共患病未列入研究。这些局限性尚需要今后的研究进一步完善。
综上所述,本研究采用全脑自动分割技术,对TLE-HS患者全脑体积及AI进行分析,发现TLE-HS患者患侧海马、颞叶灰质、颞叶白质体积缩小,LTLE-HS较RTLE-HS组改变更明显,提示自动脑分割技术体积测量可在TLE术前评估中发挥重要作用,对致痫灶定侧及范围确定有一定的应用价值。
张晓楠, 程敬亮, 张勇, 等. 基于自动脑分割技术对颞叶癫痫伴海马硬化患者脑体积的不对称性分析及其应用价值[J]. 中华医学杂志, 2023, 103(13): 991-998. DOI: 10.3760/cma.j.cn112137-20220801-01673.
所有作者均声明不存在利益冲突



























