
探究功能性下丘脑性闭经(FHA)合并雄激素过多患者的临床特征。
回顾性分析2022年1—9月在复旦大学附属妇产科医院就诊的56例FHA患者,根据FHA初诊时是否具有雄激素过多的临床或生化表现,分为高雄激素组(17例)和非高雄激素组(39例)。比较高雄激素和非高雄激素组之间在人体测量学、生殖激素、抗米勒管激素(AMH)、超声表现、进食态度问卷和情绪量表之间的差异及各项指标与问卷量表分数相关性。
56例FHA患者的年龄为15~32(23.36±4.90)岁,体质指数(BMI)为(18.91±2.49)kg/m2。高雄激素组和非高雄激素组患者年龄分别为(21.76±4.40)和(24.05±5.00)岁(P=0.109),BMI分别为(19.14±3.15)和(18.81±2.18)kg/m2(P=0.702)。39.3%(22例)的FHA患者有暴食经历,体脂不足者约占51.8%(29例),骨骼肌量不足者占53.6%(30例)。相比非高雄激素组,高雄激素组AMH(6.46比3.63 ng/ml,P=0.025)和催乳素(PRL)(278.78比149.46 mU/ml,P=0.002)更高。非高雄激素组广泛焦虑障碍量表(GAD-7)(r=0.455,P=0.005)、应用抑郁自评量表(PHQ-9)(r=0.664,P<0.001)评分均与进食态度自评问卷(EAT-26)评分相关,高雄激素FHA组中PHQ-9(r=0.091,P=0.766)和GAD-7(r=0.304,P=0.313)与EAT-26无相关性。
部分FHA患者具有高雄激素临床表现,且存在AMH和PRL轻度升高、潜在多囊卵巢综合征(PCOS)的内分泌特征。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
功能性下丘脑性闭经(functional hypothalamic amenorrhea,FHA)是指下丘脑分泌促性腺激素释放激素(gonadotropin releasing hormone,GnRH)功能下降,导致垂体促性腺激素(gonadotropins,Gn)和卵巢排卵障碍、雌激素分泌低下,但无中枢或内分泌腺器质性病变引起的一种可逆的低Gn性闭经。FHA可分为原发性和继发性,是除了多囊卵巢综合征(polycystic ovary syndrome,PCOS)和卵巢功能减退外最常见的排卵障碍因素,占闭经的15%~48%[1]。其发病机制与进食营养、体力活动和精神心理压力等因素密切相关,涉及能量摄入不足和(或)能量消耗过度导致机体能量失衡,并优化分配能量维持基本必需的生命活动,而生殖功能受到抑制并直接影响下丘脑-垂体-卵巢(hypothalamic pituitary ovary,HPO)轴功能[2],常合并进食障碍和抑郁、焦虑障碍等情绪障碍[3]。PCOS是青春期及育龄妇女最常见的妇科内分泌疾病之一,其发病机制复杂且临床表现异质性,以排卵障碍、雄激素过多和卵巢多囊样改变(polycystic ovarian morphology,PCOM)为主要特征,可伴有腹型肥胖、胰岛素抵抗等代谢紊乱表现,PCOS患者也可合并进食行为异常、情绪障碍[4]。
由于FHA和PCOS发病机制均涉及能量代谢和体脂异常、进食和情绪障碍等,都可有月经稀发、闭经和排卵障碍等表现。临床发现部分FHA患者和PCOS存在重叠特征,例如抗米勒管激素(anti-Mullerian hormone,AMH)升高、雄激素过多和超声下PCOM或多个小卵泡(multicystic ovarian morphology,MCOM)。为此本研究以FHA患者为研究对象,分析比较PCOS的雄激素过多这一重要特征在FHA中的表现,为具有潜在PCOS风险的FHA康复治疗提供依据。
本研究为横断面研究,收集自2022年1—9月在复旦大学附属妇产科医院生殖内分泌门诊诊断为FHA的患者56例。诊断标准参照2017年美国内分泌学会FHA诊治指南:(1)排除所有解剖学异常或器质性病变;(2)月经周期≥45 d和(或)月经周期已停止超过3个月及以上;(3)闭经前存在体重下降(10%左右)或饮食失调/进食障碍、过度运动或心理应激史等导致FHA的重要诱因。满足以上3个条件即可考虑诊断为FHA。其中17例FHA患者具有雄激素过多的体征[改良F-G(Ferriman-Gallwey)评分>6分,严重多毛或痤疮]和(或)生化高雄激素血症。因为不同的内分泌实验室诊断标准的差异性[5],根据复旦大学附属妇产科医院检验科的参考值范围,定义为血清总睾酮(total testosterone,TT)水平高于2.60 nmol/L和(或)血清硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAS)高于年龄对应范围上限(18~21岁:8.70 μmol/L;21~30岁:10.6 μmol/L;31~40岁:7.21 μmol/L),为高雄激素FHA组;其余39例不具备高雄激素血症或体征的患者为非高雄激素FHA组。
所有研究对象排除PCOS、创伤、明确的肿瘤、免疫性疾病及严重的精神疾病,3个月内无激素及降脂、降糖药物应用史,均签署书面的知情同意书。本研究已获得复旦大学附属妇产科医院伦理委员会批准(批号:kyy2022-144)。
1. 门诊评估:初诊时专人询问并记录病史,了解研究对象的年龄、生育史、月经史,包括初潮年龄、闭经前月经周期、经期及规律性、闭经时间、既往药物调经史(如单孕激素补充和雌孕激素序贯治疗等情况);既往体重增减幅度及诱因、饮食运动习惯和精神压力情况,以及有无其他疾病史(例如有进食障碍、抑郁、焦虑症等精神疾病史和糖尿病或糖耐量异常、高血压、高血脂和非酒精性脂肪肝等病史)和治疗情况。根据世界卫生组织(World Health Organization,WHO)规定进行人体测量学指标检查,完成身高(m)、体重(kg)、腰围(cm)和臀围(cm)的测量。据此计算体质指数(body mass index,BMI)和腰臀比(waist height ratio,WHR),并进行Ferriman Gallwey多毛和痤疮评分。运用InBody 570[拜斯倍斯医疗器械贸易(上海)有限公司]进行体成分分析仪检测,完成体脂率(%)、肌肉含量(kg)、基础代谢率(kcal)、骨矿物质含量(kg)和节段性脂肪分析等研究项目的测定,收集分析仪自动打印检测报告、记录数据。
应用抑郁自评量表(patient health questionnarie-9,PHQ-9)和广泛焦虑障碍量表(generalized anxiety disordes-7,GAD-7)进行抑郁、焦虑症状的筛查评估,每条目均按症状严重程度分为4等级:完全不会、几天、超过1周的天数和几乎每天。本研究采用的计分方式:完全不会=0,几天=1,超过1周的天数=2和几乎每天=3。得分越高,抑郁和焦虑症状越重。轻度抑郁(6~9分)、中度抑郁(10~14分)、重度抑郁(15~21分)、极重度抑郁(22~27分);轻度焦虑(6~9分)、中度焦虑(10~14分)、重度焦虑(15~21分)。
应用进食态度自评问卷(eating attitude test-26,EAT-26)进行进食障碍自评,调查被试在进食方面的认知、情感和行为倾向。该量表共26个条目,每条目按症状严重程度分为6等级:从不、很少、有时、经常、通常、总是。本研究采用的计分方式:总是=5,通常=4,经常=3,有时=2,很少=1,从不=0。得分越高,进食态度越偏离正常,发展为进食障碍的倾向性越大。本研究通过EAT-26的第四项条目“我不能控制地暴食”了解患者的暴食倾向,选择“从不”“很少”计为“无暴食经历”,选择“有时”“经常”“通常”和“总是”计为“有暴食经历”。
所有研究对象均于行经5 d之内(闭经者日期不限)抽取肘静脉血10 ml,离心10 min,测定黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇(oestradiol,E2)、孕酮(progesterone,P)、TT、催乳素(prolactin,PRL)、皮质醇(cortisol,C)、DHEAS、17-羟孕酮(17-hydroxyprogesterone,17-OHP)及AMH。其中,各项激素测定采用化学发光法进行,试剂盒购自美国贝克曼(Beckman)公司。AMH测定采用商品化的酶联免疫试剂盒(美国德克萨斯州韦伯斯特公司诊断系统实验室),检测结果组内和组间变异度分别小于5%和10%。操作按试剂盒和仪器说明书要求进行。临床常用的雄激素检测项目使用化学发光免疫测定法。
所有研究对象均于卵泡期(闭经者日期不限)专人经阴道或直肠行妇科超声检查(美国GE公司Voluson E8超声诊断仪),记录子宫大小、内膜情况、卵巢大小(长×宽×厚),并计算卵巢体积(计算公式:0.5×长×宽×厚),每侧卵泡大小及个数。PCOM评估标准:一侧卵巢有12个及以上直径2~9 mm的卵泡和(或)卵巢体积>10 ml。
应用SPSS 26.0软件进行整理和统计学分析。符合正态分布的计量资料描述用表示,采用独立样本t检验进行2组间比较;非正态分布描述用M(Q1,Q3)表示,采用Mann-Whitney U检验进行2组间比较。计数资料描述用例(%)表示,组间比较比较用χ2检验。相关分析采用Spearman相关分析。双侧检验,检验水准α=0.05。
56例FHA患者的年龄为15~32(23.36±4.90)岁;BMI为(18.91±2.49)kg/m2。高雄激素组和非高雄激素组患者年龄、BMI、减重幅度和减重方式占比差异均无统计学意义(均P>0.05),详见表1。
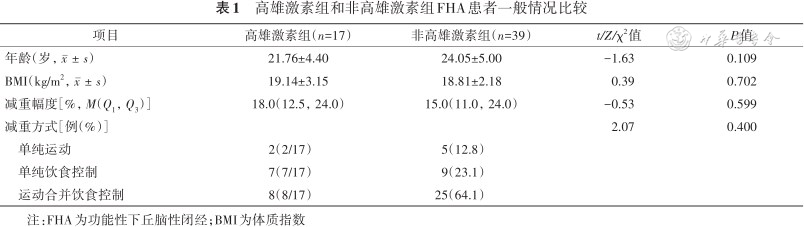
高雄激素组和非高雄激素组FHA患者一般情况比较
高雄激素组和非高雄激素组FHA患者一般情况比较
| 项目 | 高雄激素组(n=17) | 非高雄激素组(n=39) | t/Z/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 21.76±4.40 | 24.05±5.00 | -1.63 | 0.109 |
| BMI(kg/m2,) | 19.14±3.15 | 18.81±2.18 | 0.39 | 0.702 |
| 减重幅度[%,M(Q1,Q3)] | 18.0(12.5,24.0) | 15.0(11.0,24.0) | -0.53 | 0.599 |
| 减重方式[例(%)] | 2.07 | 0.400 | ||
| 单纯运动 | 2(2/17) | 5(12.8) | ||
| 单纯饮食控制 | 7(7/17) | 9(23.1) | ||
| 运动合并饮食控制 | 8(8/17) | 25(64.1) | ||
注:FHA为功能性下丘脑性闭经;BMI为体质指数
56例FHA患者初诊时均完成了人体体成分检测,2组患者间腰臀比、体脂率、骨骼肌量、基础代谢和骨矿物质含量差异均无统计学意义(均P>0.05),详见表2。
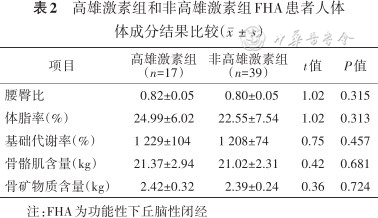
高雄激素组和非高雄激素组FHA患者人体体成分结果比较()
高雄激素组和非高雄激素组FHA患者人体体成分结果比较()
| 项目 | 高雄激素组 (n=17) | 非高雄激素组 (n=39) | t值 | P值 |
|---|---|---|---|---|
| 腰臀比 | 0.82±0.05 | 0.80±0.05 | 1.02 | 0.315 |
| 体脂率(%) | 24.99±6.02 | 22.55±7.54 | 1.02 | 0.313 |
| 基础代谢率(%) | 1 229±104 | 1 208±74 | 0.75 | 0.457 |
| 骨骼肌含量(kg) | 21.37±2.94 | 21.02±2.31 | 0.42 | 0.681 |
| 骨矿物质含量(kg) | 2.42±0.32 | 2.39±0.24 | 0.36 | 0.724 |
注:FHA为功能性下丘脑性闭经
17例高雄激素FHA组和39例非高雄激素FHA组LH、LH/FSH、E2、DHEAS、卵巢体积和PCOM占比差异均无统计学意义(均P>0.05)。高雄激素FHA组TT为(2.24±0.92)nmol/L,高于非高雄激素组的(1.15±0.54)nmol/L(P<0.001),AMH为6.46(3.67,7.92)ng/ml,高于非高雄激素组的3.63(2.36,5.19)ng/ml(P=0.025),PRL为278.78(189.26,368.91)mU/ml,高于非高雄激素组的149.46(112.19,206.06)mU/ml(P=0.002)。详见表3。非高雄激素FHA组卵巢体积大小和AMH呈正相关(r=0.480,P=0.008)。
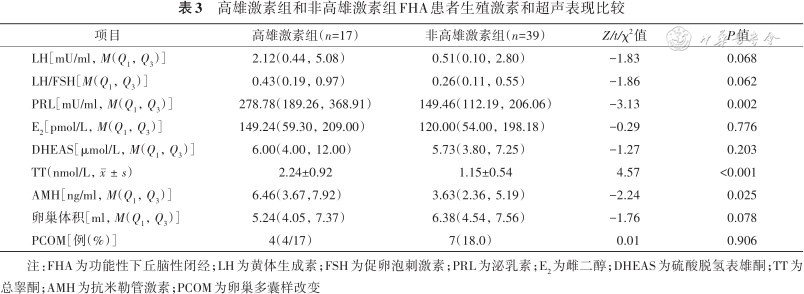
高雄激素组和非高雄激素组FHA患者生殖激素和超声表现比较
高雄激素组和非高雄激素组FHA患者生殖激素和超声表现比较
| 项目 | 高雄激素组(n=17) | 非高雄激素组(n=39) | Z/t/χ2值 | P值 |
|---|---|---|---|---|
| LH[mU/ml,M(Q1,Q3)] | 2.12(0.44,5.08) | 0.51(0.10,2.80) | -1.83 | 0.068 |
| LH/FSH[M(Q1,Q3)] | 0.43(0.19,0.97) | 0.26(0.11,0.55) | -1.86 | 0.062 |
| PRL[mU/ml,M(Q1,Q3)] | 278.78(189.26,368.91) | 149.46(112.19,206.06) | -3.13 | 0.002 |
| E2[pmol/L,M(Q1,Q3)] | 149.24(59.30,209.00) | 120.00(54.00,198.18) | -0.29 | 0.776 |
| DHEAS[μmol/L,M(Q1,Q3)] | 6.00(4.00,12.00) | 5.73(3.80,7.25) | -1.27 | 0.203 |
| TT(nmol/L,) | 2.24±0.92 | 1.15±0.54 | 4.57 | <0.001 |
| AMH[ng/ml,M(Q1,Q3)] | 6.46(3.67,7.92) | 3.63(2.36,5.19) | -2.24 | 0.025 |
| 卵巢体积[ml,M(Q1,Q3)] | 5.24(4.05,7.37) | 6.38(4.54,7.56) | -1.76 | 0.078 |
| PCOM[例(%)] | 4(4/17) | 7(18.0) | 0.01 | 0.906 |
注:FHA为功能性下丘脑性闭经;LH为黄体生成素;FSH为促卵泡刺激素;PRL为泌乳素;E2为雌二醇;DHEAS为硫酸脱氢表雄酮;TT为总睾酮;AMH为抗米勒管激素;PCOM为卵巢多囊样改变
56例FHA患者均完成了进食问卷和情绪障碍量表的评估,2组患者EAT-26、GAD-7和PHQ-9得分差异均无统计学意义(均P>0.05),详见表4。非高雄激素组GAD-7(r=0.455,P=0.005)、PHQ-9(r=0.664,P<0.001)评分均与EAT-26评分相关,高雄激素组PHQ-9(r=0.091,P=0.766)和GAD-7(r=0.304,P=0.313)与EAT-26无相关性。
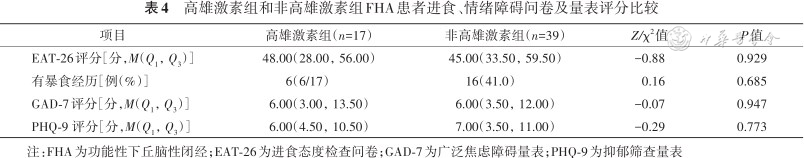
高雄激素组和非高雄激素组FHA患者进食、情绪障碍问卷及量表评分比较
高雄激素组和非高雄激素组FHA患者进食、情绪障碍问卷及量表评分比较
| 项目 | 高雄激素组(n=17) | 非高雄激素组(n=39) | Z/χ2值 | P值 |
|---|---|---|---|---|
| EAT-26评分[分,M(Q1,Q3)] | 48.00(28.00,56.00) | 45.00(33.50,59.50) | -0.88 | 0.929 |
| 有暴食经历[例(%)] | 6(6/17) | 16(41.0) | 0.16 | 0.685 |
| GAD-7评分[分,M(Q1,Q3)] | 6.00(3.00,13.50) | 6.00(3.50,12.00) | -0.07 | 0.947 |
| PHQ-9 评分[分,M(Q1,Q3)] | 6.00(4.50,10.50) | 7.00(3.50,11.00) | -0.29 | 0.773 |
注:FHA为功能性下丘脑性闭经;EAT-26为进食态度检查问卷;GAD-7为广泛焦虑障碍量表;PHQ-9为抑郁筛查量表
PCOS和FHA是妇科内分泌常见疾病,由于发病机制不同两者可有典型的临床内分泌差异,但存在部分重叠特征,例如排卵障碍、超声PCOM等[6]。PCOS临床表现极具异质性,因月经失调或雄激素过多就诊的患者多为PCOS[7],部分可无肥胖或无雄激素过多表现[8]。FHA患者也存在部分无低Gn和低雌激素表现[9],部分具备PCOM、雄激素过多等PCOS相似特征,造成鉴别困难[6],导致延迟诊断和错误治疗。
Phylactou等[6]曾提出“具有PCOS潜在特征的FHA”,此类人群经过饮食运动干预和治疗后,此前中枢受抑制所掩盖的高LH和高雄激素特征开始显现,可能转变为PCOS疾病状态。所以,具有PCOS特征的FHA患者,其治疗康复可能不同于普通FHA,临床甄别此类患者具有重要意义。
FHA患者由于中枢抑制,基础LH水平降低,LH水平一般<3 mU/ml[10, 11]。本研究约36%高雄激素组患者的LH水平>5 mU/ml,虽未表现低LH血症,但结合减重、月经改变病史和低雌激素特点,仍诊断为FHA。由于LH水平比体重和BMI更能灵敏地反映能量缺乏后的抑制状况[12],而体重和BMI下降较内分泌变化滞后。这或能解释本研究未发现LH与BMI具有相关性。
由于中枢抑制引起低Gn型卵巢功能低落,FHA一般处于低雌、雄激素状态。但本研究仍出现30.4%雄激素过多患者,其中53% TT升高,18% DHEAS升高,35%具有痤疮、多毛等高雄体征。这部分FHA高雄发生机制不明,其与病情转归间的联系值得探索。
本研究高雄激素组存在更高AMH和PRL水平。雄激素过多、超声PCOM和AMH增高这三者之间存在相关性,雄激素可促进小卵泡形成并上调颗粒细胞AMH和FSH受体的表达,放大促卵泡生长和AMH产生的效应[13]。推测高雄激素FHA即使在低Gn状态仍有AMH升高,可能与其颗粒细胞的雄激素和FSH受体数目或敏感性差异有关。而且由于FHA卵泡成熟障碍,卵巢储备池中小卵泡数目增加,AMH可存在轻度升高。文献报道30%~50%的FHA患者可出现PCOM,发生率较无症状女性(约30%)高[14]。本研究19.6%的FHA患者具有PCOM,其中高雄激素组占4/17,但其卵巢体积与非高雄激素组差异无统计学意义,有待扩大样本进一步探讨AMH与卵巢体积、PCOM在FHA患者中的相关意义。
FHA的PRL水平降低与中枢抑制导致垂体激素合成能力及反应性下降相关[15],本研究非高雄激素组PRL较高雄激素组降低幅度更为明显。PRL是一种应激激素,前期关于PCOS情绪障碍的研究显示情绪障碍组较无症状组的PRL水平升高[4]。FHA应激相关诱发因素也可引起PRL的升高,提示高雄激素组是否存在更明显的应激易感性。而本研究FHA患者 EAT-26与GAD-7和PHQ-9评分正相关,说明进食和情绪障碍这两种不良应激因素常同时存在,使病情向纵深发展。仅发现非高雄激素组的抑郁焦虑与进食障碍相关性较强,提示高雄激素组的情绪障碍有潜在的其他因素。
前期研究表明,50%FHA患者即使恢复甚至超过原有体重,生殖功能仍未能恢复[16]。本研究纳入研究的例数有限、随访时间不足,未能提供“潜在PCOS特征”的FHA患者与相区别的FHA患者长期随访结果的差异。雄激素过多与腹型肥胖、胰岛素抵抗及排卵障碍均密切相关[17],未来将深入探究FHA合并雄激素过多患者的糖脂代谢情况以及康复治疗中合理的饮食构成、运动指导和体重管理;避免此类女性随着体脂两极变化而始终“切换”在PCOS和FHA这两种疾病状态之间。
卢叶, 周一凡, 毛雅婷, 等. 功能性下丘脑性闭经合并雄激素过多患者的临床特征[J]. 中华医学杂志, 2023, 103(14): 1049-1054. DOI: 10.3760/cma.j.cn112137-20220928-02042.
所有作者均声明不存在利益冲突



























