
探讨列线图模型对胆管癌介入治疗预后评估的临床价值和效能。
回顾性分析2014年1月至2021年6月在郑州大学第一附属医院接受介入治疗的259例胆管癌患者临床资料,其中男148例,女111例,年龄26~91(65±12)岁。按7∶3的比例分为训练组(181例)和验证组(78例)。在训练组中进行Cox回归分析,筛选出影响患者预后的相关危险因素,构建患者6个月、1年及2年生存率的列线图预测模型,通过计算受试者工作特征曲线下面积(AUC)、校准曲线和决策曲线分析模型性能,并在验证组中评估模型的预测效能。
训练组和验证组基线资料差异无统计学意义,具有可比性。回归分析显示:T分期(T2:HR=0.147,95%CI:0.077~0.281;T3:HR=0.207,95%CI:0.122~0.351;T4:HR=0.864,95%CI:0.537~1.393)、肿瘤直径(17~33 mm:HR=0.201,95%CI:0.119~0.341;≥33 mm:HR=0.795,95%CI:0.521~1.211)及分化程度(中分化:HR=3.318,95%CI:2.082~5.289;高分化:HR=1.842,95%CI:1.184~2.867)是影响胆管癌介入治疗预后的危险因素。训练组和验证组生存率列线图预测模型的AUC基本一致,训练组6个月、1年、2年后AUC分别为0.925(95%CI:0.888~0.963)、0.921(95%CI:0.877~0.964)、0.974(95%CI:0.957~0.993);验证组6个月、1年、2年的AUC分别为0.951(95%CI:0.911~0.991)、0.917(95%CI:0.857~0.977)、0.848(95%CI:0.737~0.959),AUC均>0.8。两组生存率列线图预测模型的校准曲线基本相符,且在6个月、1年的校准曲线走形均与理想曲线基本拟合,而2年校准曲线拟合度则相对较差。
T分期、肿瘤直径及分化程度是影响经介入治疗胆管癌患者预后的危险因素,本列线图模型对其预后评估有着较好的区分能力及一定的临床价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆管癌起源于胆管上皮组织,发病较隐匿,多数患者早期缺乏临床特征,确诊时肿瘤已发展至中晚期,难以外科切除,且预后较差,5年生存率不超过30%[1, 2]。近年来,介入治疗广泛应用于不可切除胆管癌的治疗中,但受肿瘤异质性及治疗方式不同的影响,胆管癌患者介入治疗后的生存获益不尽相同[3, 4],且临床缺乏评价胆管癌介入治疗预后的有效方法。列线图作为一种临床预测模型,已广泛应用于多个瘤种的预后分析[5, 6, 7],但有关评价介入治疗胆管癌预后的列线图模型报道较为少见。本研究拟通过回顾性研究,分析接受介入治疗的胆管癌患者的临床特征,筛选出影响其生存期的危险因素,建立预测胆管癌6个月、1年及2年生存率的列线图模型,为临床准确评估胆管癌患者预后、制定个体化随访方案提供有益借鉴。
1. 研究对象:回顾性分析自2014年1月至2021年6月在郑州大学第一附属医院接受介入治疗的259例胆管癌患者的临床资料,其中男148例,女111例,年龄26~91(65±12)岁。259例胆管癌患者中,通过SPSS软件随机抽取181例(70%)作为训练组(男98例、女83例),患者年龄(66.2±11.0)岁;78例(30%)作为验证组(男50例、女28例),患者年龄(63.6±13.1)岁。(1)纳入标准:经皮肝穿刺胆道钳夹病理活检证实胆管癌;年龄>18岁;肝功能Child-Pugh A或B级;治疗前接受CT检查,存在可测量病灶;无法外科切除或拒绝外科治疗的患者;介入治疗作为首次治疗方式。(2)排除标准:肝功能Child-Pugh C级;介入治疗前后接受过除靶向免疫治疗之外的其他治疗;合并其他恶性肿瘤;合并严重的心、肝、肾等重要脏器功能障碍;严重凝血功能障碍;临床或随访资料不全。
2. 资料搜集:收集可能影响胆管癌患者预后的术前临床资料,包括人口学资料:性别、年龄等;实验室指标:血常规、肝功能、凝血功能、糖类抗原19-9、癌胚抗原等;肿瘤学特征:肿瘤直径、病理学形态分型、肿瘤位置、分化程度、TNM分期等;治疗相关资料:引流方式、治疗方式、治疗次数、靶向免疫治疗等。
3. 治疗方案:介入治疗方法包括经皮肝穿刺胆道引流术(percutaneous transhepatic cholangial drainage,PTCD)、粒子植入、动脉灌注化疗等,患者治疗前均签署知情同意书。患者均行经皮肝穿刺胆道活检及胆道引流术,经病理确诊胆管癌后续行抗肿瘤治疗。行125I粒子链置入者术前采用治疗计划系统(treatment planning system,TPS)计算所需粒子量,将125I粒子链经胆道引流管置入肿瘤区域。行动脉灌注化疗者,留置导管于肝动脉内,经导管持续微量泵入吉西他滨、顺铂等化疗药物,持续灌注时长为4 h,灌注化疗周期为21 d,累计治疗3~6次。
4. 随访:采用电话随访、门诊或住院复查等方式,记录每位患者的总生存期(overall survival,OS)及存活状态。OS定义为从第一次接受介入治疗到患者死亡或随访结束的时间,其中接受抗肿瘤治疗者从第一次抗肿瘤治疗时间计算,未接受抗肿瘤治疗者从第一次接受胆道引流时间计算。随访终点为患者死亡或研究终点(2022年2月20日)。
5. 统计学处理:使用SPSS 21.0软件和R 4.0.3软件对数据进行分析。符合正态分布的计量资料以表示,不符合正态分布者以M(Q1,Q3)表示;计量资料组间比较采用t检验或Mann-Whitney U检验。计数资料以例(%)形式表示,两两比较采用χ2检验。对两组患者的基线资料进行Cox比例风险回归分析,多因素分析采用向前逐步法筛选出相关变量建立胆管癌患者介入治疗后生存率列线图预测模型。采用校准曲线、受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)评价列线图的准确性,使用决策曲线分析(decision curve analysis,DCA)评估列线图模型的临床有效性。双侧检验,检验水准α=0.05。
1.患者临床特征:两组患者基线资料比较差异无统计学意义(P>0.05)(表1)。患者随访时间为0.3~47.7个月,中位随访时间5.7个月。患者中位生存期为5.8(2.7~11.1)个月,其中训练组为5.9(2.9~11.5)个月,验证组为5.6(2.8~10.2)个月。
2组胆管癌患者基线资料
2组胆管癌患者基线资料
| 项目 | 训练组(n=181,70%) | 验证组(n=78,30%) | t/Z/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 66.2±11.0 | 63.6±13.1 | 1.69 | 0.128 |
| 性别b | 2.21 | 0.137 | ||
| 男 | 98(54.14) | 50(64.10) | ||
| 女 | 83(45.86) | 28(35.90) | ||
| 白细胞(×109/L)c | 6.50(5.20,8.65) | 6.76(4.94,8.22) | -0.16 | 0.870 |
| 血红蛋白(g/L)c | 118.00(105.00,128.00) | 114.80(101.80,129.50) | -0.25 | 0.806 |
| 血小板(×109/L)c | 228.00(178.00,282.50) | 223.50(176.50,277.50) | -0.06 | 0.954 |
| 凝血酶原时间(s)c | 11.10(10.10,12.10) | 10.70(10.10,12.30) | -1.19 | 0.236 |
| 丙氨酸转氨酶(U/L)c | 115.00(56.50,185.00) | 108.50(58.00,180.00) | -1.00 | 0.320 |
| 天冬氨酸转氨酶(U/L)c | 126.00(66.00,226.00) | 94.00(64.50,221.30) | -0.24 | 0.810 |
| 谷氨酰转肽酶(U/L)c | 553.00(295.50,910.00) | 518.00(262.50,910.50) | -0.08 | 0.934 |
| 碱性磷酸酶(U/L)c | 438.00(290.00,640.50) | 356.00(262.80,645.80) | -0.84 | 0.404 |
| 白蛋白(g/L)c | 35.50(32.15,38.15) | 36.05(32.55,39.03) | 1.35 | 0.178 |
| 总胆红素(μmol/L)c | 171.00(106.95,254.75) | 178.20(105.53,275.00) | 0.30 | 0.765 |
| 糖类抗原19-9(U/ml)c | 335.90(91.60,1099.00) | 590.20(178.70,1 000.00) | 1.06 | 0.291 |
| 癌胚抗原(μg/L)c | 4.24(2.32,8.31) | 3.87(2.11,8.09) | -0.56 | 0.579 |
| Child-Pugh分级b | 0.03 | 0.856 | ||
| A | 15(8.29) | 7(8.97) | ||
| B | 166(91.71) | 71(91.03) | ||
| 治疗方案b | 0.68 | 0.713 | ||
| 胆汁引流 | 75(41.44) | 35(44.87) | ||
| 引流+125I粒子链 | 48(26.52) | 22(28.21) | ||
| 引流+动脉灌注化疗 | 58(32.04) | 21(26.92) | ||
| 有无支架b | 1.59 | 0.208 | ||
| 无 | 92(50.83) | 33(42.31) | ||
| 有 | 89(49.17) | 45(57.69) | ||
| 抗肿瘤治疗(次)b | 1.91 | 0.384 | ||
| 0 | 76(41.99) | 35(44.87) | ||
| 1 | 46(25.41) | 24(30.77) | ||
| ≥2 | 59(32.60) | 19(24.36) | ||
| 靶向免疫治疗b | 0.05 | 0.827 | ||
| 无 | 146(80.66) | 62(79.49) | ||
| 有 | 35(19.34) | 16(20.51) | ||
| T分期b | 0.90 | 0.825 | ||
| T1 | 35(19.34) | 19(24.36) | ||
| T2 | 56(30.94) | 22(28.20) | ||
| T3 | 54(29.83) | 23(29.49) | ||
| T4 | 36(19.89) | 14(17.95) | ||
| 淋巴结转移b | 0.02 | 0.883 | ||
| 无 | 133(73.48) | 58(74.36) | ||
| 有 | 48(26.52) | 20(25.64) | ||
| 远处转移b | 0.01 | 0.908 | ||
| 无 | 110(60.77) | 48(61.54) | ||
| 有 | 71(39.23) | 30(38.46) | ||
| 肿瘤直径(mm)c | 24.10(15.10,34.20) | 22.55(15.13,34.78) | -0.33 | 0.743 |
| 病理形态分型b | 0.61 | 0.738 | ||
| 肿块型 | 69(38.12) | 27(34.62) | ||
| 浸润型 | 92(50.83) | 40(51.28) | ||
| 管壁生长型 | 20(11.05) | 11(14.10) | ||
| 肿瘤位置b | 0.70 | 0.404 | ||
| 肝门部 | 78(43.09) | 38(48.72) | ||
| 远端胆管 | 103(56.91) | 40(51.28) | ||
| 分化程度b | 0.69 | 0.710 | ||
| 低分化(1) | 66(36.46) | 32(41.03) | ||
| 中分化(2) | 68(37.57) | 29(37.18) | ||
| 高分化(3) | 47(25.97) | 17(21.79) |
注:a;b例(%);cM(Q1,Q3)
2. 单因素及多因素Cox回归分析:对训练组各项指标进行单因素Cox回归分析,结果显示:白细胞、糖类抗原19-9、治疗方式、治疗次数、T分期、远处转移、肿瘤直径及分化程度等八项指标与胆管癌患者预后相关(P<0.05,表2)。对上述相关危险因素进行多因素分析,结果表明:T分期、肿瘤直径及分化程度是影响胆管癌预后的危险因素(P<0.05,表3)。
训练组胆管癌患者单因素Cox回归分析
训练组胆管癌患者单因素Cox回归分析
| 项目 | HR值 | 95%CI | P值 | 项目 | HR值 | 95%CI | P值 | |
|---|---|---|---|---|---|---|---|---|
| 年龄(岁) | Child-Pugh分级 | |||||||
| ≤65 | Re | A | Re | |||||
| >65 | 1.039 | 0.760~1.422 | 0.809 | B | 1.292 | 0.716~2.239 | 0.395 | |
| 性别 | 治疗方案 | |||||||
| 男 | Re | 引流 | Re | |||||
| 女 | 0.905 | 0.664~1.235 | 0.529 | 引流+125I粒子链 | 0.727 | 0.496~1.068 | 0.104 | |
| 白细胞(×109/L) | 引流+动脉灌注化疗 | 0.589 | 0.408~0.850 | 0.005 | ||||
| ≤10 | Re | 有无支架 | ||||||
| >10 | 1.560 | 1.022~2.382 | 0.040 | 无 | Re | |||
| 血红蛋白(g/L) | 有 | 0.735 | 0.538~1.004 | 0.053 | ||||
| ≤120 | Re | 抗肿瘤治疗(次) | ||||||
| >120 | 0.877 | 0.641~1.202 | 0.415 | 0 | Re | |||
| 血小板(×109/L) | 1 | 0.973 | 0.662~1.430 | 0.888 | ||||
| ≤100 | Re | ≥2 | 0.486 | 0.335~0.705 | <0.001 | |||
| >100 | 0.747 | 0.380~1.466 | 0.396 | 靶向免疫治疗 | ||||
| 凝血酶原时间(s) | 无 | Re | ||||||
| ≤13 | Re | 有 | 0.705 | 0.466~1.067 | 0.098 | |||
| >13 | 1.383 | 0.895~2.137 | 0.144 | T分期 | ||||
| 丙氨酸转氨酶(U/L) | T1 | Re | ||||||
| ≤40 | Re | T2 | 2.332 | 1.403~3.876 | 0.001 | |||
| >40 | 1.054 | 0.645~1.724 | 0.833 | T3 | 12.492 | 7.032~22.191 | <0.001 | |
| 天冬氨酸转氨酶(U/L) | T4 | 16.693 | 9.195~30.306 | <0.001 | ||||
| ≤40 | Re | 淋巴结转移 | ||||||
| >40 | 1.095 | 0.632~1.899 | 0.745 | 无 | Re | |||
| 谷氨酰转肽酶(U/L) | 有 | 1.143 | 0.805~1.622 | 0.456 | ||||
| ≤58 | Re | 远处转移 | ||||||
| >58 | 1.202 | 0.492~2.939 | 0.687 | 无 | Re | |||
| 碱性磷酸酶(U/L) | 有 | 1.533 | 1.117~2.103 | 0.008 | ||||
| ≤130 | Re | 肿瘤直径(mm) | ||||||
| >130 | 1.359 | 0.635~2.909 | 0.430 | <17 | Re | |||
| 白蛋白(g/L) | 17~33 | 0.126 | 0.080~0.198 | <0.001 | ||||
| ≤35 | Re | >33 | 0.557 | 0.380~0.814 | 0.003 | |||
| >35 | 0.849 | 0.623~1.159 | 0.303 | 病理学形态分型 | ||||
| 总胆红素(μmol/L) | 肿块型 | Re | ||||||
| ≤171 | Re | 浸润型 | 1.304 | 0.931~1.828 | 0.123 | |||
| >171 | 1.198 | 0.878~1.633 | 0.254 | 管壁生长型 | 1.683 | 1.104~2.564 | 0.178 | |
| 糖类抗原19-9(U/ml) | 肿瘤位置 | |||||||
| ≤150 | Re | 肝门部 | Re | |||||
| >150 | 0.585 | 0.418~0.818 | 0.002 | 远端胆管 | 0.887 | 0.649~1.212 | 0.451 | |
| 癌胚抗原(μg/L) | 分化程度 | |||||||
| ≤5 | Re | 低分化(1) | Re | |||||
| >5 | 1.304 | 0.954~1.782 | 0.096 | 中分化(2) | 0.581 | 0.406~0.831 | 0.003 | |
| 高分化(3) | 0.278 | 0.183~0.424 | <0.001 |
注:HR为危险比;Re为参考项
训练组胆管癌患者多因素Cox回归分析
训练组胆管癌患者多因素Cox回归分析
| 项目 | HR值 | 95%CI | P值 |
|---|---|---|---|
| T分期 | |||
| T1 | Re | ||
| T2 | 0.147 | 0.077~0.281 | <0.001 |
| T3 | 0.207 | 0.122~0.351 | <0.001 |
| T4 | 0.864 | 0.537~1.393 | 0.549 |
| 肿瘤直径(mm) | |||
| <17 | Re | ||
| 17~33 | 0.201 | 0.119~0.341 | <0.001 |
| ≥33 | 0.795 | 0.521~1.211 | 0.285 |
| 分化程度 | |||
| 低分化(1) | Re | ||
| 中分化(2) | 3.318 | 2.082~5.289 | <0.001 |
| 高分化(3) | 1.842 | 1.184~2.867 | 0.007 |
注:HR为危险比;Re为参考项
3. 预测模型的建立:基于训练组中筛选出的相关危险因素,构建预测接受介入治疗的胆管癌患者术后6个月、1年及2年生存率的列线图模型。该列线图显示T分期对胆管癌患者预后影响最大,其次是肿瘤直径、分化程度。各项指标均有相应风险分值,计算出总风险评分,可得出相应6个月、1年及2年生存率。
4. 预测模型的验证:训练组中患者6个月生存率列线图预测模型的AUC为0.925(95%CI:0.888~0.963)、1年AUC为0.921(95%CI:0.877~0.964)、2年AUC为0.974(95%CI:0.957~0.993);验证组中患者6个月、1年、2年AUC分别为0.951(95%CI:0.911~0.991)、0.917(95%CI:0.857~0.977)、0.848(95%CI:0.737~0.959),AUC均>0.8,显示该预测模型区分度良好,有着较高的准确性(图1、2)。
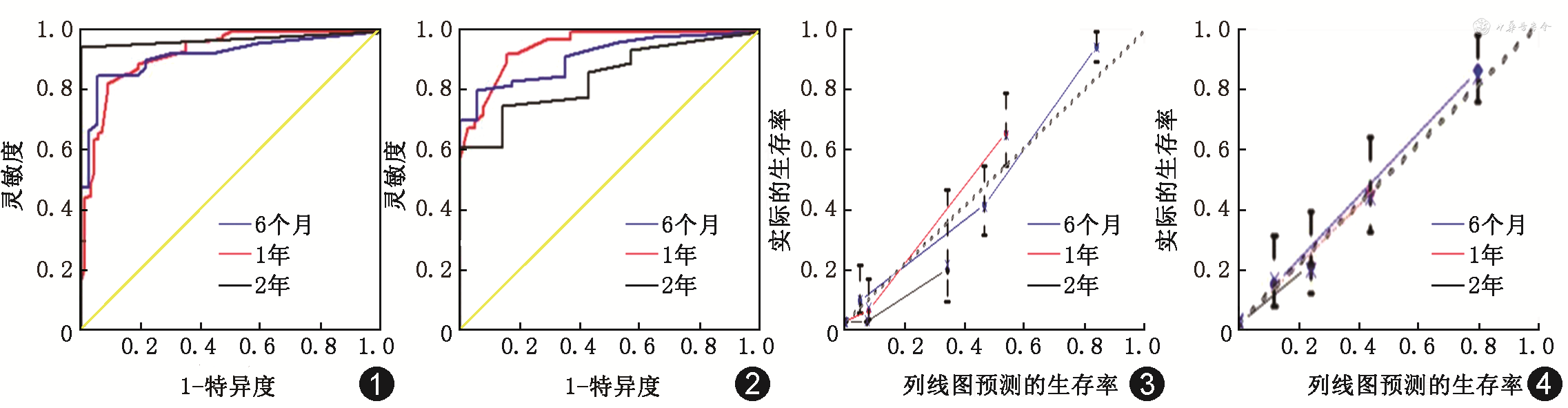

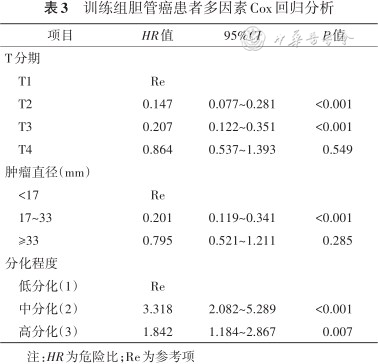
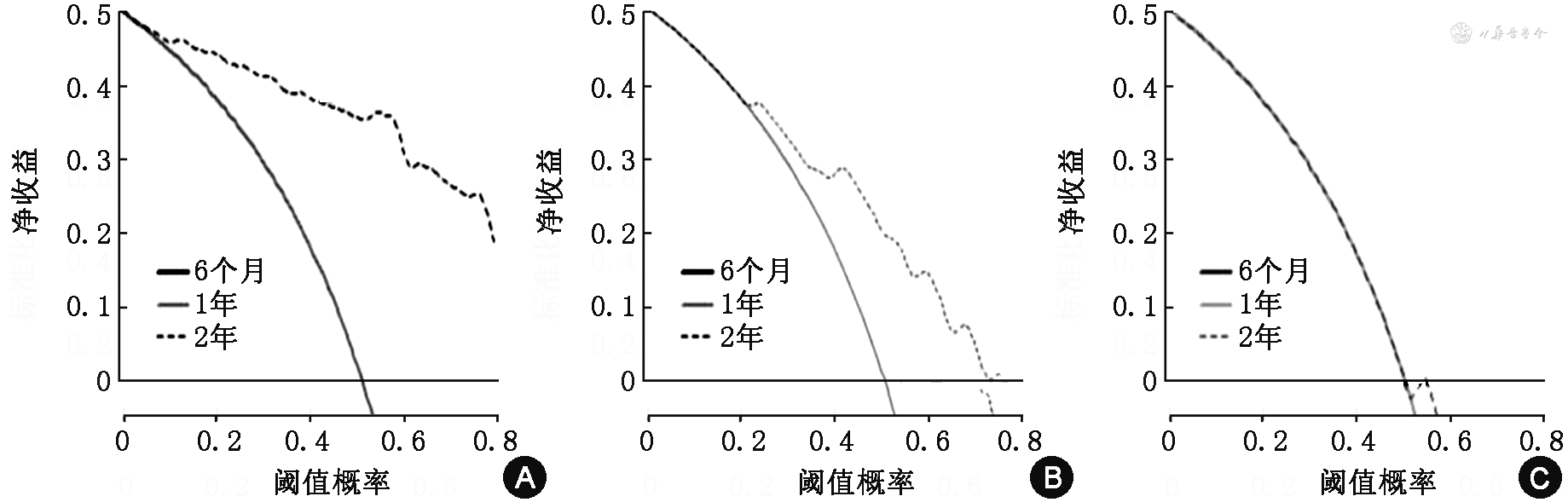
训练组和验证组6个月、1年校准曲线走形均与理想曲线基本吻合,2年校准曲线拟合度则欠佳,说明该模型预测胆管癌患者短期生存率与实际生存率有较高的一致性(图3、4)。训练组DCA曲线显示列线图模型6个月和1年的临床净收益较高,临床预测有效性较好,2年的净收益相对较低(图5)。胆管癌患者介入治疗前后的影像学表现见图6。


胆管癌的介入治疗方式众多,对无外科指征的患者,PTCD可有效缓解胆道梗阻症状,后期可联合动脉灌注化疗、125I粒子置入等多种介入治疗手段处理肿瘤,在提高胆道远期通畅率的同时,进一步延长患者生存时间[8]。然而介入治疗胆管癌疗效受多种因素的影响。研究表明,影响胆管癌患者生存预后的因素有白蛋白、糖类抗原19-9、肿瘤直径、肿瘤分化程度、远处转移及抗肿瘤治疗等[9, 10, 11],但是多数研究仅局限于探讨某些因素对胆管癌预后的影响,未系统分析各因素的影响比重。
本研究多因素Cox回归分析显示,T分期、肿瘤直径及分化程度是影响胆管癌预后的危险因素,且在构建的列线图模型中可以看出T分期对胆管癌患者预后影响最大,其次是肿瘤直径和分化程度。研究表明,随着T分期的增加,肿瘤对周围淋巴结、血管的侵犯几率及远处转移率亦有增加趋势,致使胆管癌患者预后不良[12, 13],这与本研究结果一致。
目前关于肿瘤大小对胆管癌介入治疗疗效及预后影响的研究较少,主要有以下原因:(1)胆管作为空腔脏器,肿瘤形态多样,多数表现为浸润型,测量肿瘤直径大小难度较大;(2)多数患者长期携带胆道引流管或支架,增加了后期影像学评估难度。为探讨肿瘤大小对胆管癌预后的影响,本研究对术前肿瘤最大横截面直径反复测量,进行多因素分析,结果表明肿瘤直径是影响预后的主要危险因素之一,肿瘤直径越大,患者生存率越低。有研究将肿瘤直径分成1~19 mm、>19~33 mm及>33 mm等3组后建立列线图模型,发现胆管癌灶越大的患者外科术后预后越差[14]。
肿瘤分化程度影响预后。列线图可以看出,低分化风险评分明显高于中、高分化患者。多项研究表明,肿瘤异质性越高、分化程度越高的患者,生存率也显著高于低分化患者,证实了本研究的结果[15, 16]。分析原因,主要与肿瘤微环境及新生血管等特征有关。肿瘤异质性越高,其代谢水平亦越高,血管分布越丰富,对治疗就有更好的响应[17]。
本研究构建的列线图模型在训练组和验证组中均展示出了良好的预测能力。在区分度方面,训练组和验证组AUC均在0.8以上,说明该预测模型区分度良好,评估预后能力较强。在校准度方面,训练组和验证组的6个月、1年校准曲线走形均与理想曲线基本拟合;而2年校准曲线拟合度则相对较差,考虑与本研究纳入的生存期高于2年的病例数较少有关,这从另一角度也说明了该模型对评估患者短期生存率有更高的预测价值。此外,训练组DCA曲线图显示,随着预测生存时间的增加,患者存在的净收益范围越来越小;在6个月时净收益最高,2年的净收益最低,间接反映了该列线图模型在预测短期生存率方面实用性更高。列线图也可以显示每个危险因素的分值,通过患者的临床资料可计算出具体的风险分值,进而可预测其6个月、1年及2年的生存率。
本研究通过Cox回归分析,确定了T分期、肿瘤直径及分化程度是影响胆管癌预后的独立危险因素,并基于这些因素首次构建了可预测胆管癌介入治疗后6个月、1年和2年生存率的列线图模型。该模型有利于临床医师把握介入治疗适应证、筛选获益患者,为制定个体化治疗策略及随访方案提供理论依据。但本方案也尚有待完善之处:(1)作为回顾性研究,有潜在的影响预后的其他因素,如动脉灌注化疗中药物种类不同对研究结果可能有影响;(2)该列线图模型只对本中心患者人群进行了内部验证,未行多中心验证,难免存在数据偏倚;后续会继续开展多中心研究,减少干扰因素,以进一步验证该预测模型的效能。
李臻, 谢炳灿, 吕培杰, 等. 列线图模型对胆管癌介入治疗预后评估的临床价值研究[J]. 中华医学杂志, 2023, 103(16): 1217-1224. DOI: 10.3760/cma.j.cn112137-20221124-02483.
所有作者均声明不存在利益冲突



























