
探索胆囊腺肌症(GA)和隐匿性胰胆反流(OPBR)患者临床特征的相关性。
本研究为病例对照研究。共纳入81例2020年12月至2022年1月于同济大学附属东方医院胆石病中心行胆囊切除术的GA患者,包含局限型48例、节段型28例、弥漫型5例。收集患者术中胆汁并进行淀粉酶检查,根据胆囊胆汁淀粉酶水平将纳入患者分为OPBR组(胆汁淀粉酶>110 U/L)和对照组(胆汁淀粉酶≤110 U/L),分析GA和OPBR临床特征的相关性。
81例患者中男32例,女49例,年龄(49.1±13.2)岁;其中对照组66例,包括男27例、女39例,年龄(50.0±12.9)岁;OPBR组15例,包括男5例、女10例,年龄(45.1±14.2)岁。比较两组患者的临床特征,除OPBR组胆汁淀粉酶较对照组显著升高外(P<0.001),其余指标差异均无统计学意义(均P>0.05)。然而,OPBR在不同类型GA中的发生率存在差异,局限型的OPBR发生率(10.4%,5/48)低于节段型(28.6%,8/28)和弥漫型(2/5),差异有统计学意义(P=0.038)。此外,节段型GA合并胆囊结石概率(85.7%,24/28)高于局限型(58.3%,28/48)和弥漫型(3/5)(P=0.031)。单因素和多因素logistic回归分析结果显示OPBR[OR(95%CI)=3.410(1.010~11.513),P=0.048]与合并胆囊结石[OR(95%CI)=2.974(1.011~8.745),P=0.048]是节段型和弥漫型GA的独立相关因素。
OPBR在节段型和弥漫型GA中的发病率较高,且合并胆囊结石、合并OPBR与节段型和弥漫型GA的发生相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
隐匿性胰胆反流(occult pancreaticobiliary reflux,OPBR)是指胰胆管汇合部解剖结构正常的患者发生胰液胆汁反流的现象[1, 2]。OPBR被认为与胆囊良恶性疾病存在密切的联系,如胆囊结石、胆囊癌,但是其在胆囊腺肌症(gallbladder adenomyomatosis,GA)中还少见报道[2, 3, 4, 5]。GA是一种以上皮过度增生伴固有肌层肥大,导致胆囊壁增厚为特征的病理状态,其发病机制不明[6, 7]。有文献报道,胰胆管合流异常(pancreaticobiliary maljunction,PBM)引起的胰液反流可能是导致GA发生的潜在原因[8, 9]。与PBM一样,OPBR引起的胰液反流可以造成胆囊黏膜的直接和间接损伤,引起胆囊黏膜的慢性炎症和增生,这可能与GA的形成相关[10, 11, 12]。本研究旨在分析GA和OPBR患者的临床特征,以探索他们之间的相关性,为临床同道诊治水平的提高提供决策。
本研究采用病例对照研究,获得同济大学医学与生命科学伦理委员会批准(2019tjdx46)和患者的知情同意。本次研究共纳入81例GA患者。纳入标准:(1)行腹腔镜胆囊切除术的成年GA患者;(2)术前24 h血清淀粉酶和脂肪酶水平在正常范围内;(3)磁共振胰胆管成像(magneticresonance cholangiopancreatography,MRCP)未见胰胆管汇合部解剖结构异常。排除标准:(1)急性胆囊炎、胆管炎、急慢性胰腺疾病、术前诊断或术中证实的胆总管结石、梗阻性黄疸、术前淀粉酶和脂肪酶值异常;(2)影像学或术中胆道造影证实的解剖性胆道异常或胰胆管合流异常;(3)胆囊萎缩,白胆汁,脓性胆汁,胆囊充盈黏稠胆汁或无胆汁,胆汁被血液污染,胆囊管闭塞胆;(4)合并恶性肿瘤、肝炎、肝硬化;(5)术前曾接受内镜胆管造影或括约肌切开术。
1. 数据收集:81例GA患者来自2020年12月至2022年1月于同济大学附属东方医院胆石病中心行胆囊切除术的患者。收集各病例临床资料,包括性别、身高、体重、体质指数(body mass index,BMI)、早晨空腹胆囊容积、腹痛、是否合并胆囊结石和胆囊息肉、胆总管直径以及术前总胆红素(total bilirubin,TBIL)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、γ-谷氨酰转移酶(gamma-glutamyl transferase,GGT)、碱性磷酸酶(alkaline phosphatase,ALP)、糖类抗原19-9(carbohydrate antigen19-9,CA19-9)。
2. 胆汁的收集和淀粉酶测定:在胆囊结石术中抽取胆囊胆汁5 ml,手术结束后立即送往检验科,通过罗氏cobas c702生化分析仪(瑞士罗氏公司)和罗氏公司配套试剂(比色法)检测胆汁淀粉酶水平。
3. 分组:根据文献报道,胆汁淀粉酶检测是诊断OPBR的直接证据,本研究将胆汁淀粉酶水平大于血清淀粉酶的上限值作为胰胆反流的诊断标准[2, 3, 4, 5]。本中心的血清淀粉酶参考值为30~110 U/L,因此在本研究中将胆汁淀粉酶>110 U/L的患者纳入OPBR组,≤110 U/L的患者纳入对照组。
4. GA的分型:GA根据组织形态学分为局限型、节段型和弥漫型[6, 7]。其中局限型最常见,多位于胆囊底部,表现为局部增厚。节段型多位于胆囊体部或体颈交界处,形成节段性增厚,胆囊囊腔变窄,可形成环形狭环,将胆囊颈部和基底部分隔开,呈葫芦状。弥漫型表现为胆囊黏膜和肌层弥散性和不规则增厚。
5. 统计学处理:所有的数据均用SPSS 24进行处理和分析。计量资料采用Shapiro-Wilk(SW)法进行正态性检验,符合正态分布的计量资料以表示,组间比较采用t检验或单因素ANOVA检验;不符合正态分布的数据以M(Q1, Q3)表示,组间比较采用Mann-Whitney U检验或Kruskal-Wallis H检验。计数资料采用例(%)表示,组间比较采用χ2检验。受试者工作特征(receiver operating characteristic,ROC)曲线及ROC曲线下面积(area under curve,AUC)用于分析GA类型对OPBR的预测价值。双侧检验,检验水准α=0.05。
本次研究共纳入的81例GA患者中男32例,女49例,年龄(49.1±13.2)岁;其中对照组66例,包括男27例、女39例,年龄(50.0±12.9)岁;OPBR组15例(18.5%),包括男5例、女10例,年龄(45.1±14.2)岁。比较两组患者的临床特征,除OPBR组胆汁淀粉酶较对照组升高外(P<0.001),其余差异均无统计学意义(均P>0.05)(表1)。
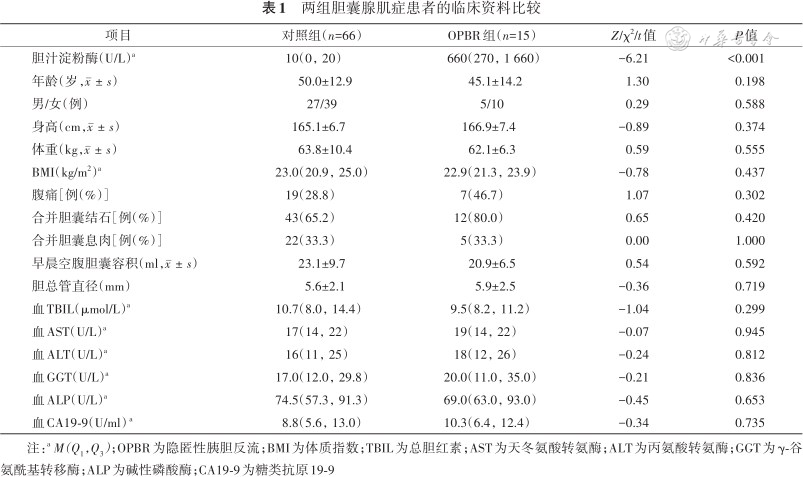
两组胆囊腺肌症患者的临床资料比较
两组胆囊腺肌症患者的临床资料比较
| 项目 | 对照组(n=66) | OPBR组(n=15) | Z/χ2/t值 | P值 |
|---|---|---|---|---|
| 胆汁淀粉酶(U/L)a | 10(0,20) | 660(270,1 660) | -6.21 | <0.001 |
| 年龄(岁,) | 50.0±12.9 | 45.1±14.2 | 1.30 | 0.198 |
| 男/女(例) | 27/39 | 5/10 | 0.29 | 0.588 |
| 身高(cm,) | 165.1±6.7 | 166.9±7.4 | -0.89 | 0.374 |
| 体重(kg,) | 63.8±10.4 | 62.1±6.3 | 0.59 | 0.555 |
| BMI(kg/m2)a | 23.0(20.9,25.0) | 22.9(21.3,23.9) | -0.78 | 0.437 |
| 腹痛[例(%)] | 19(28.8) | 7(46.7) | 1.07 | 0.302 |
| 合并胆囊结石[例(%)] | 43(65.2) | 12(80.0) | 0.65 | 0.420 |
| 合并胆囊息肉[例(%)] | 22(33.3) | 5(33.3) | 0.00 | 1.000 |
| 早晨空腹胆囊容积(ml,) | 23.1±9.7 | 20.9±6.5 | 0.54 | 0.592 |
| 胆总管直径(mm) | 5.6±2.1 | 5.9±2.5 | -0.36 | 0.719 |
| 血TBIL(μmol/L)a | 10.7(8.0,14.4) | 9.5(8.2,11.2) | -1.04 | 0.299 |
| 血AST(U/L)a | 17(14,22) | 19(14,22) | -0.07 | 0.945 |
| 血ALT(U/L)a | 16(11,25) | 18(12,26) | -0.24 | 0.812 |
| 血GGT(U/L)a | 17.0(12.0,29.8) | 20.0(11.0,35.0) | -0.21 | 0.836 |
| 血ALP(U/L)a | 74.5(57.3,91.3) | 69.0(63.0,93.0) | -0.45 | 0.653 |
| 血CA19-9(U/ml) a | 8.8(5.6,13.0) | 10.3(6.4,12.4) | -0.34 | 0.735 |
注:a M(Q1,Q3);OPBR为隐匿性胰胆反流;BMI为体质指数;TBIL为总胆红素;AST为天冬氨酸转氨酶;ALT为丙氨酸转氨酶;GGT为γ-谷氨酰基转移酶;ALP为碱性磷酸酶;CA19-9为糖类抗原19-9
本研究包含局限型48例、节段型28例、弥漫型5例。比较不同GA类型患者的临床资料,除OPBR发生率、年龄、合并胆囊结石率外,其余临床资料在各类型间的差异均无统计学意义(均P>0.05)。OPBR发生率在不同类型的GA中差异有统计学意义(P=0.038),局限型的OPBR发生率(10.4%,5/48)低于节段型(28.6%,8/28)和弥漫型(2/5);节段型GA合并胆囊结石的概率(85.7%,24/28)要高于局限型(58.3%,28/48)和弥漫型(3/5)(P=0.031);节段型和弥漫型GA患者的年龄要小于局限型GA患者(P=0.034)(表2)。
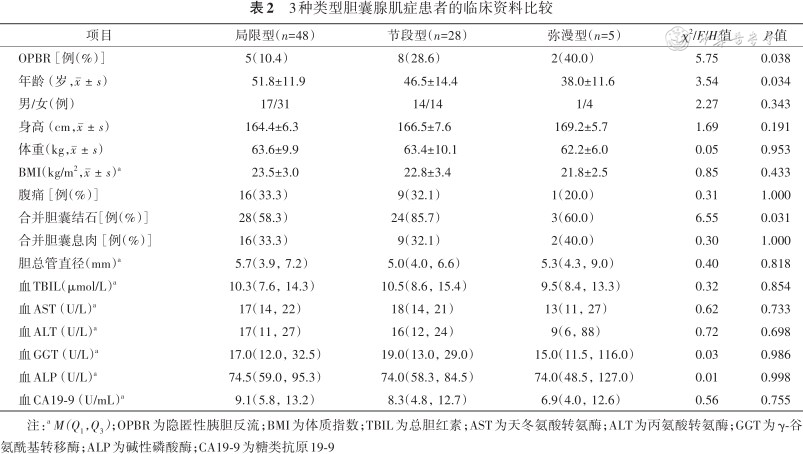
3种类型胆囊腺肌症患者的临床资料比较
3种类型胆囊腺肌症患者的临床资料比较
| 项目 | 局限型(n=48) | 节段型(n=28) | 弥漫型(n=5) | χ2/F/H值 | P值 |
|---|---|---|---|---|---|
| OPBR[例(%)] | 5(10.4) | 8(28.6) | 2(40.0) | 5.75 | 0.038 |
| 年龄(岁,) | 51.8±11.9 | 46.5±14.4 | 38.0±11.6 | 3.54 | 0.034 |
| 男/女(例) | 17/31 | 14/14 | 1/4 | 2.27 | 0.343 |
| 身高(cm,) | 164.4±6.3 | 166.5±7.6 | 169.2±5.7 | 1.69 | 0.191 |
| 体重(kg,) | 63.6±9.9 | 63.4±10.1 | 62.2±6.0 | 0.05 | 0.953 |
| BMI(kg/m2,)a | 23.5±3.0 | 22.8±3.4 | 21.8±2.5 | 0.85 | 0.433 |
| 腹痛[例(%)] | 16(33.3) | 9(32.1) | 1(20.0) | 0.31 | 1.000 |
| 合并胆囊结石[例(%)] | 28(58.3) | 24(85.7) | 3(60.0) | 6.55 | 0.031 |
| 合并胆囊息肉[例(%)] | 16(33.3) | 9(32.1) | 2(40.0) | 0.30 | 1.000 |
| 胆总管直径(mm)a | 5.7(3.9,7.2) | 5.0(4.0,6.6) | 5.3(4.3,9.0) | 0.40 | 0.818 |
| 血TBIL(μmol/L)a | 10.3(7.6,14.3) | 10.5(8.6,15.4) | 9.5(8.4,13.3) | 0.32 | 0.854 |
| 血AST(U/L)a | 17(14,22) | 18(14,21) | 13(11,27) | 0.62 | 0.733 |
| 血ALT(U/L)a | 17(11,27) | 16(12,24) | 9(6,88) | 0.72 | 0.698 |
| 血GGT(U/L)a | 17.0(12.0,32.5) | 19.0(13.0,29.0) | 15.0(11.5,116.0) | 0.03 | 0.986 |
| 血ALP(U/L)a | 74.5(59.0,95.3) | 74.0(58.3,84.5) | 74.0(48.5,127.0) | 0.01 | 0.998 |
| 血CA19-9(U/mL)a | 9.1(5.8,13.2) | 8.3(4.8,12.7) | 6.9(4.0,12.6) | 0.56 | 0.755 |
注:a M(Q1,Q3);OPBR为隐匿性胰胆反流;BMI为体质指数;TBIL为总胆红素;AST为天冬氨酸转氨酶;ALT为丙氨酸转氨酶;GGT为γ-谷氨酰基转移酶;ALP为碱性磷酸酶;CA19-9为糖类抗原19-9
通过ROC分析可见GA的类型对OPBR具有预测作用,其ROC下面积[AUC(95%CI)]为0.667(0.512~0.823),P=0.044(图1)。而且节段型和弥漫型是GA合并OPBR仅有的相关因素,OR(95%CI)为3.739(1.141~12.253),P=0.029(表3)。
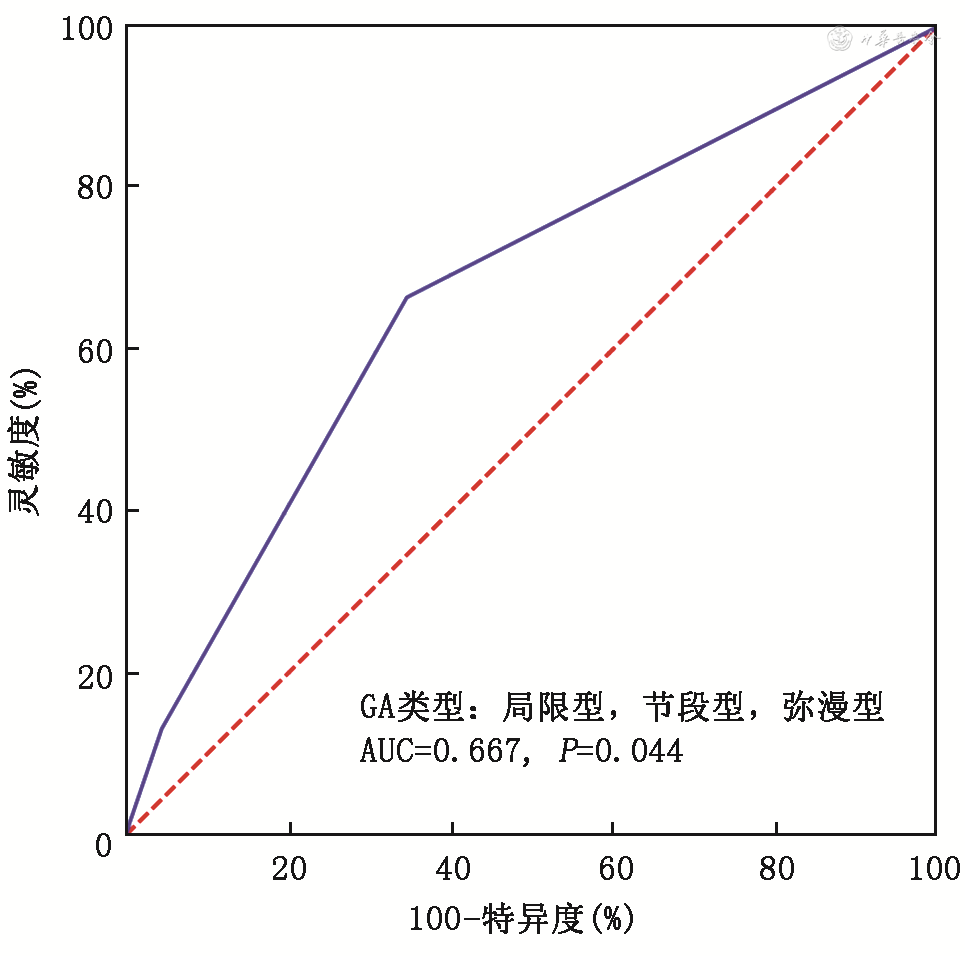

注:GA为胆囊腺肌症;AUC为曲线下面积
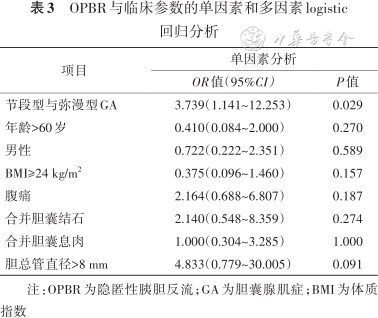
OPBR与临床参数的单因素和多因素logistic回归分析
OPBR与临床参数的单因素和多因素logistic回归分析
| 项目 | 单因素分析 | |
|---|---|---|
| OR值(95%CI) | P值 | |
| 节段型与弥漫型GA | 3.739(1.141~12.253) | 0.029 |
| 年龄>60岁 | 0.410(0.084~2.000) | 0.270 |
| 男性 | 0.722(0.222~2.351) | 0.589 |
| BMI≥24 kg/m2 | 0.375(0.096~1.460) | 0.157 |
| 腹痛 | 2.164(0.688~6.807) | 0.187 |
| 合并胆囊结石 | 2.140(0.548~8.359) | 0.274 |
| 合并胆囊息肉 | 1.000(0.304~3.285) | 1.000 |
| 胆总管直径>8 mm | 4.833(0.779~30.005) | 0.091 |
注:OPBR为隐匿性胰胆反流;GA为胆囊腺肌症;BMI为体质指数
单因素logistic回归分析显示,合并OPBR和合并胆囊结石是节段型和弥漫型GA的相关因素;多因素分析显示,合并OPBR和合并胆囊结石仍是节段型和弥漫型GA的相关因素,OR(95%CI)分别为3.410(1.010~11.513)、2.974(1.011~8.745)(均P<0.05)(表4)。
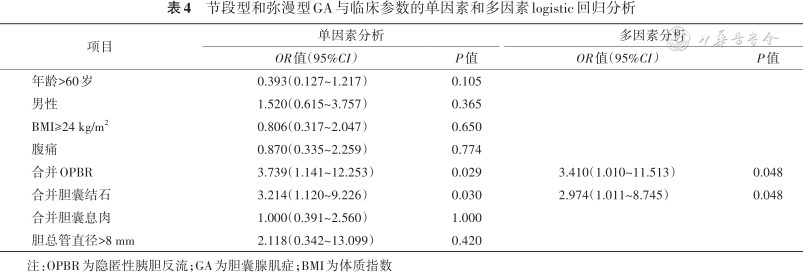
节段型和弥漫型GA与临床参数的单因素和多因素logistic回归分析
节段型和弥漫型GA与临床参数的单因素和多因素logistic回归分析
| 项目 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| OR值(95%CI) | P值 | OR值(95%CI) | P值 | |
| 年龄>60岁 | 0.393(0.127~1.217) | 0.105 | ||
| 男性 | 1.520(0.615~3.757) | 0.365 | ||
| BMI≥24 kg/m2 | 0.806(0.317~2.047) | 0.650 | ||
| 腹痛 | 0.870(0.335~2.259) | 0.774 | ||
| 合并OPBR | 3.739(1.141~12.253) | 0.029 | 3.410(1.010~11.513) | 0.048 |
| 合并胆囊结石 | 3.214(1.120~9.226) | 0.030 | 2.974(1.011~8.745) | 0.048 |
| 合并胆囊息肉 | 1.000(0.391~2.560) | 1.000 | ||
| 胆总管直径>8 mm | 2.118(0.342~13.099) | 0.420 | ||
注:OPBR为隐匿性胰胆反流;GA为胆囊腺肌症;BMI为体质指数
GA是一种胆囊黏膜增生性疾病,在组织病理学上表现为胆囊黏膜上皮增生,内陷或穿过增生肥厚的肌层形成胆囊壁内憩室,称为罗-阿氏窦(Rokitansky-Ashoff sinus,RAS)。GA的病因尚不清楚,根据目前的研究报道GA的形成可能与胆囊内压力升高、胆囊结石和慢性胆囊炎、先天性因素、雌激素等有关[6, 7, 8, 9]。此外,PBM引起的胰液反流进入胆囊也被认为与GA的发生密切相关[8, 9]。Chang等[9]发现胆囊癌和GA患者常合并PBM,其发生率分别是62.5%(5/8)和50%(6/12)。Tanno等[8]发现PBM患者合并GA的概率为31.8%(7/22),而且GA更好发于不伴胆管扩张的PBM。PBM是胰管和胆管在十二指肠壁外汇合的先天性畸形,十二指肠乳头括约肌因总通道异常长而失去对胆胰管汇合部的控制,导致了胰液胆汁反流的发生,进而诱发胆道系统的病变[1,12, 13]。胰胆管汇合部解剖结构正常的患者同样可以发生胰液反流,这种现象被称为OPBR,但是OPBR与GA之间的相关性目前还未见文献报道。
本研究发现GA患者合并OPBR的概率为18.5%(15/81),而且GA的发生与不同类型的GA相关,局限型的OPBR发生率(10.4%,5/48)低于节段型(28.6%,8/28)和弥漫型(2/5)(P=0.038)。此外,GA的类型对OPBR的发生具有一定的预测作用,其AUC(95%CI)为0.667(0.512~0.823),P=0.044。通过单因素和多因素logistic回归分析发现,节段型和弥漫型是GA合并OPBR仅有的相关因素,OR(95%CI)为3.739(1.141~12.253);合并OPBR和合并胆囊结石是节段型和弥漫型GA的独立相关因素,OR(95%CI)分别为3.410(1.010~11.513)、2.974(1.011~8.745)(均P<0.05)。以上结果说明节段型和弥漫型GA的发生与OPBR存在密切的联系。虽然目前胰胆反流引起GA发生的具体机制尚不清楚,但可能与3个因素有关。其一,胰液反流引起胆囊黏膜慢性炎症损伤,刺激胆囊黏膜慢性增生,最终形成GA[8, 9, 10, 11]。其二,由于PBM和OPBR存在胆胰流出道不畅的病理表现,可导致胆汁淤积和胆囊压力升高,继而引起GA的发生[1, 2, 3, 4, 5, 6]。其三,胰液反流引起胆囊结石的发生,在胆囊结石和胰液的共同刺激下,胆囊局部黏膜增生,肌层增厚,黏膜向胆囊壁内陷形成RAS[4, 5, 6, 7]。
OPBR被认为是胆囊癌的危险因素,而GA是否有癌变倾向仍存在争议[2, 3,6,11]。Ootani等[14]在切除的胆囊样本中发现节段型GA合并胆囊癌的概率(6.4%,12/188)显著高于其他胆囊样本(3.1%,93/3 009)。Nabatame等[15]同样报道了节段型GA患者的胆囊癌发生率(6.6%,22/334)显著高于无节段型GA的患者(4.3%,181/4 226)。Di Carlo等[16]则报道了弥漫型GA伴不典型增生的病例,提示弥漫型GA有癌变的风险。而部分学者则认为GA本身不能被视为癌前病变,但GA继发的结石和胆囊炎与胆囊癌有关[6]。本研究发现相较于局限型(58.3%,28/48)和弥漫型(3/5),节段型GA患者易合并胆囊结石(85.7%,24/28)(P=0.031)。Nishimura等[17]报道了类似的现象:节段型GA患者胆囊结石发生率(88.9%,88/99)高于局限型GA(48.1%,26/54)、弥漫性型GA(1/3)和无GA患者(52.3%,493/543)。OPBR可以诱导胆囊结石的发生,它和结石均是胆囊癌的危险因素,笔者认为节段型GA在胰液反流和胆囊结石的共同刺激下,易于发生慢性炎症、不典型增生和癌变。
对于GA的治疗,目前同样存在争议。有学者主张诊断明确的GA应适时行胆囊切除手术[18]。在本中心,鉴于节段型GA在某种程度上有发展为胆囊癌的风险,而弥漫型GA有时难以与胆囊癌相鉴别,因此建议行胆囊切除[14, 15];对于局限型GA,有症状、合并胰胆反流、合并结石或息肉、不能排除胆囊癌风险的患者建议行手术治疗;而对于无症状的局限型GA患者可以随访观察,这可能导致了本研究中数据的选择性偏倚,造成局限型GA患者年龄普遍大于节段型和弥漫型GA患者。
总之,OPBR在节段型和弥漫型GA中的发病率较高,且OPBR与节段型、弥漫型GA的发生有关,这提示OPBR可能是造成节段型和弥漫型GA发生和癌变的始动因素之一。然而由于该研究的样本量有限,特别是弥漫型GA患者的病例数少,且是回顾性研究,结果可能存在一定误差和局限性,期待能展开多中心前瞻性研究以进一步评估OPBR在GA发生以及癌变中的发挥的作用。
项雨凯, 张诚, 杨玉龙, 等. 胆囊腺肌症与隐匿性胰胆反流的相关性临床分析[J]. 中华医学杂志, 2023, 103(16): 1230-1235. DOI: 10.3760/cma.j.cn112137-20220831-01843.
所有作者均声明不存在利益冲突



























