
比较肾上腺皮质癌及肾上腺皮质腺瘤患者血清肾上腺皮质激素谱的特点。
回顾性分析2018年1月至2022年6月于北京大学第一医院内分泌科和(或)泌尿外科就诊的肾上腺皮质癌患者23例、肾上腺皮质腺瘤患者119例,获取两组患者影像学特征,通过液相色谱串联质谱方法检测两组患者血清肾上腺皮质激素谱,比较两组的差异,采用多因素logistic回归模型分析与肾上腺皮质癌发生相关的可能因素。
肾上腺皮质癌患者的年龄为46(35,57)岁,女性为15例(65.2%);肾上腺皮质腺瘤患者年龄为49(40,58)岁,女性为80例(67.2%);两组患者年龄及性别构成差异无统计学意义(均P>0.05)。影像学检查发现,肾上腺皮质癌患者的肿瘤最大径M(Q1,Q3)(下同)为7.05(5.45,9.78)cm,比肾上腺皮质腺瘤患者大[2.1(1.6,3.0)cm](P<0.001);雄烯二酮[4.056 9(1.619 5,7.907 9)比1.517 5(0.935 1,2.582 1)nmol/L(P<0.001)]升高,11-酮睾酮/11-酮雄烯二酮[0.034 3(0.020 6,0.079 2)比0.041 0(0.028 6,0.061 5)(P=0.089)]、11-酮雄烯二酮/11-羟雄烯二酮[0.013 0(0.006 4,0.086 7)比0.063 0(0.018 2,0.162 5)(P=0.042)]降低。多因素分析发现雄烯二酮、肿瘤最大径、11-酮睾酮/11-酮雄烯二酮、11-酮雄烯二酮/11-羟雄烯二酮是发生肾上腺皮质癌的相关因素,OR值(95%CI)分别为1.841(1.093~3.100)、5.130(2.332~11.285)、0.381(0.167~0.867)、0.000(0.000~0.014),均P<0.05。
肾上腺皮质肿瘤直径越大、雄烯二酮水平升高是肾上腺皮质癌的相关因素;11-羟雄烯二酮转换生成11-酮雄烯二酮及11-酮雄烯二酮转换生成11-酮睾酮减低与肾上腺皮质癌相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾上腺皮质癌(adrenal cortical carcinoma,ACC)是一种极为罕见的神经内分泌系统恶性肿瘤,仅占原发性肾上腺肿瘤的极小一部分,但预后差,中位总生存期为3~4年,且缺乏有效的治疗方案[1]。由于这种疾病的罕见性以及缺乏明显和特异性的预警提示症状,ACC的早期诊断仍然是一个很大的挑战。
ACC起源于肾上腺皮质细胞,但肿瘤有明显的异质性,仍保留着不同程度的肾上腺皮质分化。50%~60%的患者存在高皮质醇血症和(或)高雄激素血症,一小部分患者有雌激素和(或)盐皮质激素过量[1]。因此不同于分化更好的肾上腺皮质腺瘤/增生,ACC有着特征性的病理性类固醇生成信号。液相色谱串联质谱相色谱串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)方法检测肾上腺皮质激素谱,较传统化学发光法、酶联免疫吸附试验、放射免疫分析方法灵敏性及特异性更高,更准确地反映肾上腺皮质激素合成水平。因此本研究拟探讨LC-MS/MS法检测肾上腺皮质激素谱在肾上腺皮质疾病良恶性鉴别诊断中的价值。
选取2018年1月至2022年6月在北京大学第一医院内分泌科和(或)泌尿外科就诊的肾上腺皮质肿瘤患者共142例,其中ACC 23例,良性肾上腺皮质腺瘤119例。纳入标准:手术或活检病理明确诊断ACC、肾上腺皮质腺瘤。排除标准:(1)正在服用利尿剂、肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system,RAAS)阻断剂、糖皮质激素、性激素等药物的患者;(2)既往有癌症病史或近期接受过大型手术、放疗或化疗等治疗的患者;(3)合并肾功能不全患者;(4)拒绝参与本项目的患者。本研究得到了北京大学第一医院伦理委员会审核批准(批号:2017研93)。所有患者均在取样前签署知情同意书。
入院全部患者均有手术病理或活检病理结合临床结局明确诊断ACC、肾上腺皮质腺瘤。全部患者均进行了肾上腺CT、MRI检查,测定肾上腺肿瘤最大直径。手术、药物或介入等治疗前晨起8∶00—9∶00时立位采血,分离血清后-80 ℃冰箱冻存,送检北京金域医学检验中心采用LC-MS/MS方法进行肾上腺皮质激素谱检测18羟皮质酮、醛固酮、11脱氧皮质醇、皮质醇、18羟皮质醇、18氧皮质醇、硫酸脱氢表雄酮、雄烯二酮、睾酮、双氢睾酮、11羟雄烯二酮、11酮雄烯二酮、11羟睾酮、11-酮睾酮、表睾酮、雄酮、表雄酮、雌酮。根据目前已知肾上腺皮质激素合成路径计算相应质激素比值间接反应皮质激素合成酶活性水平:皮质醇/11-脱氧皮质醇、醛固酮/18羟皮质酮、11酮睾酮/11酮雄烯二酮、雌酮/雄烯二酮、11羟雄烯二酮/雄烯二酮、11酮雄烯二酮/11羟雄烯二酮、表睾酮/雄烯二酮。
采用SPSS 26.0软件进行数据整理和统计学分析。符合正态分布的计量资料采用表示,两组间比较采用独立样本t检验;非正态分布的计量资料采用M(Q1,Q3)表示,两组间比较采用Mann-Whitney U检验。分类变量采用例数(%)表示,组间比较采用χ²检验。采用多因素logistic回归模型分析发生ACC的相关因素。双侧检验,检验水准α=0.05。
23例ACC患者的年龄为46(35,57)岁,女性为15例(65.2%);119例良性肾上腺皮质腺瘤患者年龄为49(40,58)岁,女性为80例(67.2%);两组年龄及性别构成差异均无统计学意义。ACC患者的肿瘤最大径为7.05(5.45,9.78)cm,比肾上腺皮质腺瘤患者大[2.10(1.60,3.00)cm](P<0.001),ACC组雄烯二酮为4.056 9(1.619 5,7.907 9)nmol/L,比肾上腺皮质腺瘤组雄烯二酮[1.517 5(0.935 1,2.582 1)nmol/L](P<0.001)高,两组间其余临床指标的比较情况详见表1。
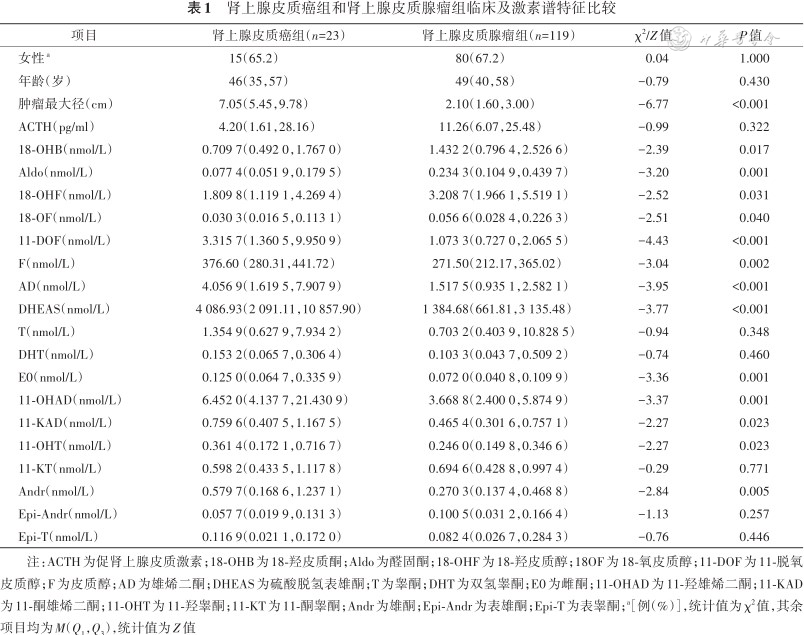
肾上腺皮质癌组和肾上腺皮质腺瘤组临床及激素谱特征比较
肾上腺皮质癌组和肾上腺皮质腺瘤组临床及激素谱特征比较
| 项目 | 肾上腺皮质癌组(n=23) | 肾上腺皮质腺瘤组(n=119) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 女性a | 15(65.2) | 80(67.2) | 0.04 | 1.000 |
| 年龄(岁) | 46(35,57) | 49(40,58) | -0.79 | 0.430 |
| 肿瘤最大径(cm) | 7.05(5.45,9.78) | 2.10(1.60,3.00) | -6.77 | <0.001 |
| ACTH(pg/ml) | 4.20(1.61,28.16) | 11.26(6.07,25.48) | -0.99 | 0.322 |
| 18-OHB(nmol/L) | 0.709 7(0.492 0,1.767 0) | 1.432 2(0.796 4,2.526 6) | -2.39 | 0.017 |
| Aldo(nmol/L) | 0.077 4(0.051 9,0.179 5) | 0.234 3(0.104 9,0.439 7) | -3.20 | 0.001 |
| 18-OHF(nmol/L) | 1.809 8(1.119 1,4.269 4) | 3.208 7(1.966 1,5.519 1) | -2.52 | 0.031 |
| 18-OF(nmol/L) | 0.030 3(0.016 5,0.113 1) | 0.056 6(0.028 4,0.226 3) | -2.51 | 0.040 |
| 11-DOF(nmol/L) | 3.315 7(1.360 5,9.950 9) | 1.073 3(0.727 0,2.065 5) | -4.43 | <0.001 |
| F(nmol/L) | 376.60(280.31,441.72) | 271.50(212.17,365.02) | -3.04 | 0.002 |
| AD(nmol/L) | 4.056 9(1.619 5,7.907 9) | 1.517 5(0.935 1,2.582 1) | -3.95 | <0.001 |
| DHEAS(nmol/L) | 4 086.93(2 091.11,10 857.90) | 1 384.68(661.81,3 135.48) | -3.77 | <0.001 |
| T(nmol/L) | 1.354 9(0.627 9,7.934 2) | 0.703 2(0.403 9,10.828 5) | -0.94 | 0.348 |
| DHT(nmol/L) | 0.153 2(0.065 7,0.306 4) | 0.103 3(0.043 7,0.509 2) | -0.74 | 0.460 |
| E0(nmol/L) | 0.125 0(0.064 7,0.335 9) | 0.072 0(0.040 8,0.109 9) | -3.36 | 0.001 |
| 11-OHAD(nmol/L) | 6.452 0(4.137 7,21.430 9) | 3.668 8(2.400 0,5.874 9) | -3.37 | 0.001 |
| 11-KAD(nmol/L) | 0.759 6(0.407 5,1.167 5) | 0.465 4(0.301 6,0.757 1) | -2.27 | 0.023 |
| 11-OHT(nmol/L) | 0.361 4(0.172 1,0.716 7) | 0.246 0(0.149 8,0.346 6) | -2.27 | 0.023 |
| 11-KT(nmol/L) | 0.598 2(0.433 5,1.117 8) | 0.694 6(0.428 8,0.997 4) | -0.29 | 0.771 |
| Andr(nmol/L) | 0.579 7(0.168 6,1.237 1) | 0.270 3(0.137 4,0.468 8) | -2.84 | 0.005 |
| Epi-Andr(nmol/L) | 0.057 7(0.019 9,0.131 3) | 0.100 5(0.031 2,0.166 4) | -1.13 | 0.257 |
| Epi-T(nmol/L) | 0.116 9(0.021 1,0.172 0) | 0.082 4(0.026 7,0.284 3) | -0.76 | 0.446 |
注:ACTH为促肾上腺皮质激素;18-OHB为18-羟皮质酮;Aldo为醛固酮;18-OHF为18-羟皮质醇;18OF为18-氧皮质醇;11-DOF为11-脱氧皮质醇;F为皮质醇;AD为雄烯二酮;DHEAS为硫酸脱氢表雄酮;T为睾酮;DHT为双氢睾酮;E0为雌酮;11-OHAD为11-羟雄烯二酮;11-KAD为11-酮雄烯二酮;11-OHT为11-羟睾酮;11-KT为11-酮睾酮;Andr为雄酮;Epi-Andr为表雄酮;Epi-T为表睾酮;a[例(%)],统计值为χ2值,其余项目均为M(Q1,Q3),统计值为Z值
皮质激素比值比方面,ACC患者11酮睾酮/11酮雄烯二酮[0.034 3(0.020 6,0.079 2)比0.041 0(0.028 6,0.061 5)(P=0.089)]和11酮雄烯二酮/11羟雄烯二酮[0.013 0(0.006 4,0.086 7)比0.063 0(0.018 2,0.162 5)(P=0.042)]比良性肾上腺皮质肿瘤患者低(表2)。
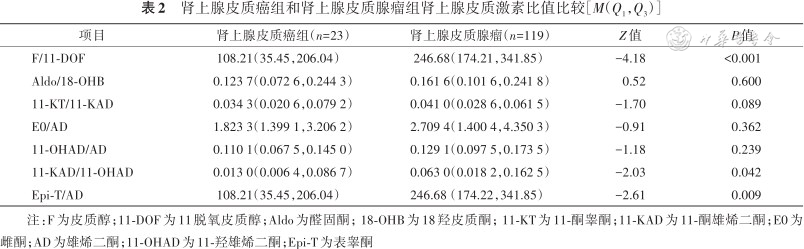
肾上腺皮质癌组和肾上腺皮质腺瘤组肾上腺皮质激素比值比较[M(Q1,Q3)]
肾上腺皮质癌组和肾上腺皮质腺瘤组肾上腺皮质激素比值比较[M(Q1,Q3)]
| 项目 | 肾上腺皮质癌组(n=23) | 肾上腺皮质腺瘤(n=119) | Z值 | P值 |
|---|---|---|---|---|
| F/11-DOF | 108.21(35.45,206.04) | 246.68(174.21,341.85) | -4.18 | <0.001 |
| Aldo/18-OHB | 0.123 7(0.072 6,0.244 3) | 0.161 6(0.101 6,0.241 8) | 0.52 | 0.600 |
| 11-KT/11-KAD | 0.034 3(0.020 6,0.079 2) | 0.041 0(0.028 6,0.061 5) | -1.70 | 0.089 |
| E0/AD | 1.823 3(1.399 1,3.206 2) | 2.709 4(1.400 4,4.350 3) | -0.91 | 0.362 |
| 11-OHAD/AD | 0.110 1(0.067 5,0.145 0) | 0.129 1(0.097 5,0.173 5) | -1.18 | 0.239 |
| 11-KAD/11-OHAD | 0.013 0(0.006 4,0.086 7) | 0.063 0(0.018 2,0.162 5) | -2.03 | 0.042 |
| Epi-T/AD | 108.21(35.45,206.04) | 246.68(174.22,341.85) | -2.61 | 0.009 |
注:F为皮质醇;11-DOF为11脱氧皮质醇;Aldo为醛固酮;18-OHB为18羟皮质酮;11-KT为11-酮睾酮;11-KAD为11-酮雄烯二酮;E0为雌酮;AD为雄烯二酮;11-OHAD为11-羟雄烯二酮;Epi-T为表睾酮
肾上腺皮质激素进行共线性诊,对激素谱中明显共线性激素进行筛选后,以是否为ACC为因变量,进行多因素logistic回归模型分析结果显示,调整了肿瘤最大径、18羟皮质酮、醛固酮、11脱氧皮质醇、皮质醇、雄烯二酮、硫酸脱氢表雄酮、双氢睾酮、雌酮、11羟雄烯二酮、雄酮后,雄烯二酮水平、肿瘤最大径是发生ACC的相关因素,OR值(95%CI)分别为1.841(1.093~3.100)、5.130(2.332~11.285),均P<0.05;调整了皮质醇/11脱氧皮质醇、11酮睾酮/11酮雄烯二酮、11酮雄烯二酮/11羟雄烯二酮、表睾酮/雄烯二酮后,11酮睾酮/11酮雄烯二酮、11酮雄烯二酮/11羟雄烯二酮是ACC的相关因素,OR值(95%CI)分别为0.381(0.167~0.867)、0.000(0.000~0.014),均P<0.05。详见表3。
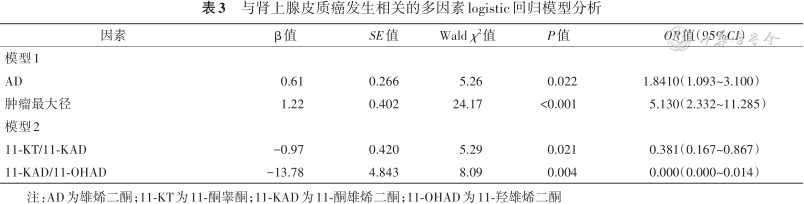
与肾上腺皮质癌发生相关的多因素logistic回归模型分析
与肾上腺皮质癌发生相关的多因素logistic回归模型分析
| 因素 | β值 | SE值 | Wald χ2值 | P值 | OR值(95%CI) |
|---|---|---|---|---|---|
| 模型1 | |||||
| AD | 0.61 | 0.266 | 5.26 | 0.022 | 1.8410(1.093~3.100) |
| 肿瘤最大径 | 1.22 | 0.402 | 24.17 | <0.001 | 5.130(2.332~11.285) |
| 模型2 | |||||
| 11-KT/11-KAD | -0.97 | 0.420 | 5.29 | 0.021 | 0.381(0.167~0.867) |
| 11-KAD/11-OHAD | -13.78 | 4.843 | 8.09 | 0.004 | 0.000(0.000~0.014) |
注:AD为雄烯二酮;11-KT为11-酮睾酮;11-KAD为11-酮雄烯二酮;11-OHAD为11-羟雄烯二酮
ACC是起源于肾上腺皮质细胞的恶性肿瘤[1, 2, 3, 4],年发病率每百万人口0.5~2例,该病临床罕见、预后不良且异质性明显[5],目前临床应用较多的病理诊断标准是Weiss标准[6],但仍有部分患者至发生转移才能确诊,因此需要更准确的术前诊断。目前国内外学者关注多组学研究对ACC进行新的分类以更好地预测临床预后及寻找潜在的治疗靶点[2,7, 8, 9, 10, 11]。
肾上腺皮质可以合成分泌数十种类固醇激素[12],随着质谱检测技术的进展,类固醇的生物合成和代谢可反映在血清类固醇代谢组中,基于质谱的类固醇代谢组学特征分析,可以鉴定与类固醇生物合成和代谢障碍相关的独特多胆固醇代谢物特征,对ACC的诊断、鉴别诊断和预后预测有着潜在的重要意义[1]。在雄激素产生方面,研究者既往认为肾上腺主要产生脱氢表雄酮、硫酸脱氢表雄酮和雄烯二酮等活性雄激素的前体,但最近的研究表明,肾上腺皮质也是具有强雄激素生物活性的类固醇化合物的潜在来源[13],如睾酮、11β羟睾酮和11酮睾酮。目前认为肾上腺的雄激素生成至少有包括经典雄激素合成通路、11氧雄激素合成和旁路雄激素合成三条雄激素合成通路[14, 15]。目前对于肾上腺皮质疾病功能诊断尤其是皮质醇增多症的分型诊断方面网状带雄激素表达水平的变化受到了越来越多的关注,如Eisenhofer等[16]研究比较不同亚型皮质醇增多症肾上腺皮质激素谱的差异,相比健康对照肾上腺源性皮质醇增多症雄烯二酮减低,促肾上腺皮质激素依赖性皮质醇增多症雄烯二酮较健康对照升高,其中异源促肾上腺皮质激素ACTH综合征雄烯二酮升高最为明显。Di Dalmazi等[17]研究发现无功能腺瘤组比健康对照人群、亚临床皮质醇增多症比无功能腺瘤组脱氢表雄酮、雄烯二酮水平明显减低,且临床上肾上腺皮质腺瘤所致临床显性库欣与亚临床库欣相比硫酸脱氢表雄酮减低更明显。本研究发现ACC患者多种网状带合成激素明显升高,其中雄烯二酮与ACC患者的独立相关因素,提示肾上腺网状带激素水平对于疾病良恶性的鉴别诊断有一定的价值。
在ACC中肾上腺皮质分化的改变导致皮质类固醇合成酶的功能改变从而可以表现出病理性类固醇生成谱[18],国外有学者发现尿液THS等指标对肾上腺疾病良恶性的鉴别有意义[19, 20, 21, 22],也有学者结合血清肾上腺皮质激素谱及人工智能进行ACC术后复发检测优于影像学检查。本研究通过激素产物/底物比值间接评价皮质类固醇合成酶活性发现11酮睾酮/11酮雄烯二酮、11酮雄烯二酮/11羟雄烯二酮比值的降低与ACC独立相关,而11酮睾酮/11酮雄烯二酮、11酮雄烯二酮/11羟雄烯二酮可以在一定程度上反映皮质类固醇合成过程中17-βHSD和11-βHSD酶功能受到影响。
肿瘤直径是目前公认的ACC的危险因素[22, 23, 24],目前认为肿瘤直径超过4 cm需要警惕恶性可能,且肿瘤体积与肾上腺皮质激素产生量相关,因此本研究纳入分析CT或者核磁检查的肿瘤最大径,与既往研究类似,本研究分析肿瘤最大径是ACC的重要相关因素。
本研究存在的不足:(1)样本量小,ACC组样本量仅23例;(2)本研究仅观察到肾上腺网状带雄激素的异常表达可能与ACC相关,不能从发病机制角度阐释。
综上,肾上腺网状带雄激素的异常表达对于肾上腺皮质疾病的良恶性诊断存在一定的辅助意义。
刘林, 王聃妮, 虢晶翠, 等. 肾上腺皮质癌及肾上腺皮质腺瘤患者血清肾上腺皮质激素谱的特点比较[J]. 中华医学杂志, 2023, 103(18): 1423-1428. DOI: 10.3760/cma.j.cn112137-20220930-02065.
所有作者均声明不存在利益冲突



























