
探讨乳腺癌扩增基因1(AIB1)和雄激素受体(AR)表达在雌激素受体(ER)阳性乳腺癌他莫昔芬(TAM)疗效中的意义。
本研究为回顾性病例研究,收集天津医科大学肿瘤医院2008年6月至2013年7月188例病理诊断ER阳性乳腺癌组织,均为女性,年龄25~87岁,采用免疫组化方法(IHC)检测AIB1及AR在188例乳腺癌患者组织中的表达情况,分析二者与TAM疗效及耐药的关系,并通过基因表达研究交互式分析(GEPIA)数据库验证本研究的结果。
TAM治疗的总有效率为80.3%。TAM治疗有效率在AR阳性组、阴性组中分别为79.6%(109/137)、82.4%(42/51),差异无统计学意义(P=0.669)。TAM治疗有效率在AIB1高表达组为68.4%(67/98),AIB1低表达组为93.3%(84/90),差异有统计学意义(P<0.001),显示AIB1高表达患者容易对TAM产生耐药。TAM在AR阴性AIB1低表达、AR阴性AIB1高表达,AR阳性AIB1低表达以及AR阳性AIB1高表达四组中的治疗有效率分别为89.7%(26/29)、71.4%(15/21)、96.7%(59/61)、66.2%(51/77),低表达组与高表达组比较差异有统计学意义(P<0.001)。
AIB1表达与乳腺癌TAM疗效具有相关性,其高表达易产生TAM耐药,而AR阳性且AIB1高表达更易引起TAM耐药,并且AIB1可作为乳腺癌TAM治疗疗效的影响因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
雄激素受体(androgen receptor,AR)是类固醇激素受体家族的成员之一。有研究报道称,AR的表达水平与乳腺癌他莫西芬(tamoxifen,TAM)耐药的发生有相关性,通过阻断AR信号通路可以减少TAM耐药的发生率[1]。因此AR可作为乳腺癌预后相关的重要指标以及潜在治疗靶点。乳腺癌扩增基因1(amplified in breast cancer 1,AIB1)为细胞核激素受体共激活剂P160家族的成员,是较新定义的一种原癌基因,也称为核受体共激活因子3(recombinant nuclear receptor coactivator 3,NCOA3)[2]。此外AIB1具有3个保守的LXXLL基序,即NR盒[3]。研究表明,AIB1在许多生物学过程中均发挥重要作用,如细胞的增殖、迁移、分化等[4, 5, 6]。此外,有研究表明,AIB1基因的扩增与乳腺癌的发生和发展密切相关,并在人表皮生长因子2(human epidermal growth factor receptor-2,HER2)/雌激素受体(estradiol receptor,ER)信号途径导致内分泌治疗耐药的过程中扮演了重要角色[2],这与乳腺癌预后不良以及内分泌耐药等密切相关。AIB1参与ER依赖乳腺上皮增殖[2],在ER阳性乳腺癌TAM耐药中发挥重要作用。研究表明,AR在雌激素依赖性疾病中可以发挥抑制性作用,在约90%的ER阳性乳腺癌中AR呈阳性表达,且患者预后较好[7]。本研究旨在探讨AIB1、AR的表达与ER阳性乳腺癌TAM耐药之间的相关性,为判断ER阳性乳腺癌TAM治疗的疗效和预后提供新的靶点。
选取天津医科大学肿瘤医院乳腺病理研究室2008年6月至2013年7月病理诊断证实的ER阳性乳腺癌共188例,均为女性,年龄25~87岁,均具有完整临床病理资料,并由两位副高级以上职称病理医师复习切片证实诊断。本研究为回顾性病例系列研究,得到了患者的知情同意并符合《赫尔辛基宣言》对伦理的一般要求。
1. 免疫组织化学(immunohistochemistry,IHC)检测:所有标本常规制片、苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,采用链霉菌抗生物素-过氧化物酶法进行ICH染色。兔抗人AIB1单克隆抗体(bs-3571R;稀释度为1∶100,购自北京Bioss公司),鼠抗人AR单克隆抗体(ZA-0554;稀释度为1∶100)、磷酸盐缓冲液(phosphate buffer,PBS)、乙二胺四乙酸(ethylenediamine tetraaceticacid,EDTA)(pH=9.0)、封闭血清、生物素标记二抗人辣根酶标记链酶卵白素工作液、DAB显色液均购自北京中杉生物技术开发有限公司。
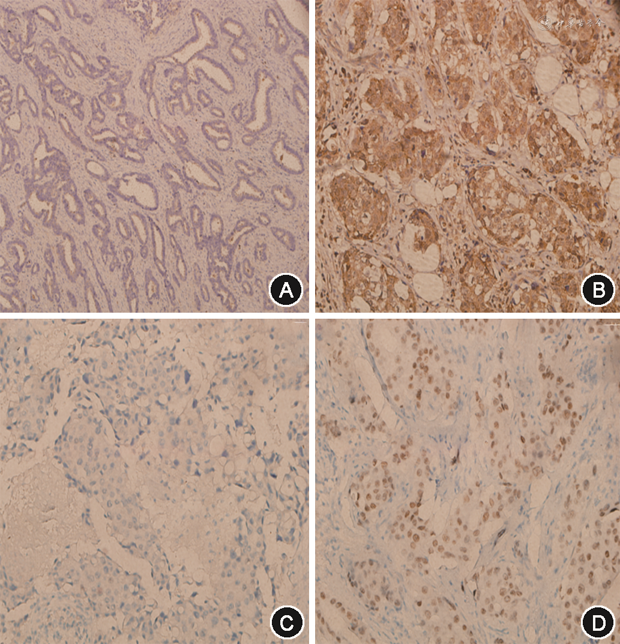
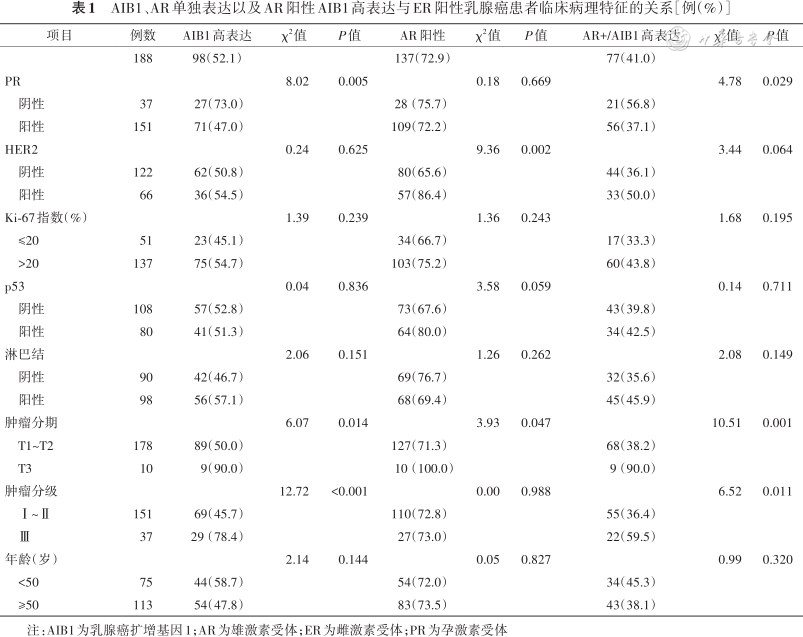
2. 结果判断:AR:细胞核内有棕黄色细颗粒者为阳性细胞,阳性细胞数<10%为阴性。AIB1在乳腺癌细胞胞质内呈棕黄色颗粒状着色。AIB1:对于癌细胞胞质着色的百分比和染色强度,每个样品半定量地评分为0~6。比例评分0:表示无染色,1:1%~10%,2:11%~50%,3:51%~100%。染色强度0表示阴性染色,1:弱,2:中度,3:强烈染色。将比例和强度评分相加,总评分从0到6。AIBI总评分≥5来定义为AIB1高表达。
3. 随访:对188例乳腺癌病例进行了全部随访,对术后内分泌治疗的患者进行每月1次的电话及短信随访,随访时间85~125个月,患者均接受TAM治疗。无病生存期(disease free survival,DFS)定义为根治术后到肿瘤复发、转移或由于疾病进展导致患者死亡时间,总生存期(overall survival,OS)定义为肿瘤确诊的第1天直到死于各种原因为止的时间或末次随访时间。
4. 基因表达研究交互式分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库:该数据库专门分析基因在正常组织和癌组织中的表达差异。在GEPIA数据库中AIB1也称为NCOA3。基于该数据库的测序数据,在ER阳性乳腺癌组织中AIB1与AR表达之间的关系进行统计分析。
5. 统计学处理:采用SPSS 20.0统计软件进行数据处理。AIB1、AR阳性率的差异比较采用χ 2检验或Fisher确切概率法,相关性的分析采用相关系数法,患者生存率的生存分析采用Kaplan-Meier生存曲线。双侧检验,检验水准为P<0.05。
1. 光镜下对AIB1在乳腺癌细胞胞质中的着色情况进行评分(图1A~B),表达情况在PR、T分期、不同组织学分级间差异有统计学意义(均P<0.05)(表1),而在不同年龄、HER2、Ki-67以及p53表达等分组间差异无统计学意义(均P>0.05),见表1。

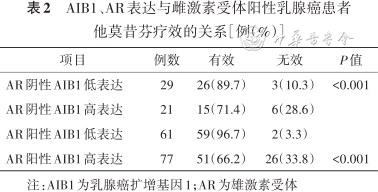
AIB1、AR单独表达以及AR阳性AIB1高表达与ER阳性乳腺癌患者临床病理特征的关系[例(%)]
AIB1、AR单独表达以及AR阳性AIB1高表达与ER阳性乳腺癌患者临床病理特征的关系[例(%)]
| 项目 | 例数 | AIB1高表达 | χ2值 | P值 | AR阳性 | χ2值 | P值 | AR+/AIB1高表达 | χ2值 | P值 |
|---|---|---|---|---|---|---|---|---|---|---|
| 188 | 98(52.1) | 137(72.9) | 77(41.0) | |||||||
| PR | 8.02 | 0.005 | 0.18 | 0.669 | 4.78 | 0.029 | ||||
| 阴性 | 37 | 27(73.0) | 28(75.7) | 21(56.8) | ||||||
| 阳性 | 151 | 71(47.0) | 109(72.2) | 56(37.1) | ||||||
| HER2 | 0.24 | 0.625 | 9.36 | 0.002 | 3.44 | 0.064 | ||||
| 阴性 | 122 | 62(50.8) | 80(65.6) | 44(36.1) | ||||||
| 阳性 | 66 | 36(54.5) | 57(86.4) | 33(50.0) | ||||||
| Ki-67指数(%) | 1.39 | 0.239 | 1.36 | 0.243 | 1.68 | 0.195 | ||||
| ≤20 | 51 | 23(45.1) | 34(66.7) | 17(33.3) | ||||||
| >20 | 137 | 75(54.7) | 103(75.2) | 60(43.8) | ||||||
| p53 | 0.04 | 0.836 | 3.58 | 0.059 | 0.14 | 0.711 | ||||
| 阴性 | 108 | 57(52.8) | 73(67.6) | 43(39.8) | ||||||
| 阳性 | 80 | 41(51.3) | 64(80.0) | 34(42.5) | ||||||
| 淋巴结 | 2.06 | 0.151 | 1.26 | 0.262 | 2.08 | 0.149 | ||||
| 阴性 | 90 | 42(46.7) | 69(76.7) | 32(35.6) | ||||||
| 阳性 | 98 | 56(57.1) | 68(69.4) | 45(45.9) | ||||||
| 肿瘤分期 | 6.07 | 0.014 | 3.93 | 0.047 | 10.51 | 0.001 | ||||
| T1~T2 | 178 | 89(50.0) | 127(71.3) | 68(38.2) | ||||||
| T3 | 10 | 9(90.0) | 10(100.0) | 9(90.0) | ||||||
| 肿瘤分级 | 12.72 | <0.001 | 0.00 | 0.988 | 6.52 | 0.011 | ||||
| Ⅰ~Ⅱ | 151 | 69(45.7) | 110(72.8) | 55(36.4) | ||||||
| Ⅲ | 37 | 29(78.4) | 27(73.0) | 22(59.5) | ||||||
| 年龄(岁) | 2.14 | 0.144 | 0.05 | 0.827 | 0.99 | 0.320 | ||||
| <50 | 75 | 44(58.7) | 54(72.0) | 34(45.3) | ||||||
| ≥50 | 113 | 54(47.8) | 83(73.5) | 43(38.1) |
注:AIB1为乳腺癌扩增基因1;AR为雄激素受体;ER为雌激素受体;PR为孕激素受体
2. AIB1高表达患者组TAM耐药率为31.6%(31/98),有效率为68.4%(67/98);低表达患者耐药率为6.7%(6/90),有效率为93.3%(84/90),两组有效率比较,差异有统计学意义(χ2=18.5,P<0.001)。
1. AR的着色部位为细胞核(图1C~D),AR细胞核表达在HER2表达、T分期间差异均有统计学意义(均P<0.05),见表1。
2. AR阳性组治疗有效率为79.6%(109/137),耐药率为20.4%(28/137);AR阴性组治疗有效率为82.4%(42/51),耐药率为17.6%(9/51),两组有效率比较,差异无统计学意义(χ2=0.18,P=0.669),显示AR表达水平与TAM耐药没有相关性。
1. AR阳性且AIB1高表达在PR表达、T分期、不同组织学分级间差异均有统计学意义(均P<0.05),而在有无淋巴结转移、年龄、Ki-67、p53分组间差异均无统计学意义(均P>0.05),见表1。
2. TAM在AR阴性AIB1低表达、AR阴性AIB1高表达、AR阳性AIB1低表达、AR阳性AIB1高表达四组中的治疗有效率分别为89.7%(26/29)、71.4%(15/21)、96.7%(59/61)、66.2%(51/77),其中AR阳性且AIB1高表达组中TAM耐药的发生率最高33.8%(26/77),差异有统计学意义(P<0.001),见表2。
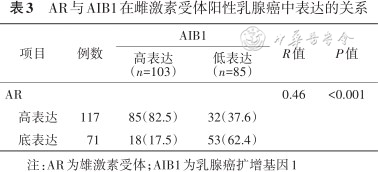
AIB1、AR表达与雌激素受体阳性乳腺癌患者他莫昔芬疗效的关系[例(%)]
AIB1、AR表达与雌激素受体阳性乳腺癌患者他莫昔芬疗效的关系[例(%)]
| 项目 | 例数 | 有效 | 无效 | P值 |
|---|---|---|---|---|
| AR阴性AIB1低表达 | 29 | 26(89.7) | 3(10.3) | <0.001 |
| AR阴性AIB1高表达 | 21 | 15(71.4) | 6(28.6) | |
| AR阳性AIB1低表达 | 61 | 59(96.7) | 2(3.3) | |
| AR阳性AIB1高表达 | 77 | 51(66.2) | 26(33.8) | <0.001 |
注:AIB1为乳腺癌扩增基因1;AR为雄激素受体
ER阳性乳腺癌中AIB1细胞质表达与AR细胞核表达呈正相关(R=0.46,P<0.001),见表3。
AR与AIB1在雌激素受体阳性乳腺癌中表达的关系
AR与AIB1在雌激素受体阳性乳腺癌中表达的关系
| 项目 | 例数 | AIB1 | R值 | P值 | |
|---|---|---|---|---|---|
高表达 (n=103) | 低表达 (n=85) | ||||
| AR | 0.46 | <0.001 | |||
| 高表达 | 117 | 85(82.5) | 32(37.6) | ||
| 底表达 | 71 | 18(17.5) | 53(62.4) | ||
注:AR为雄激素受体;AIB1为乳腺癌扩增基因1
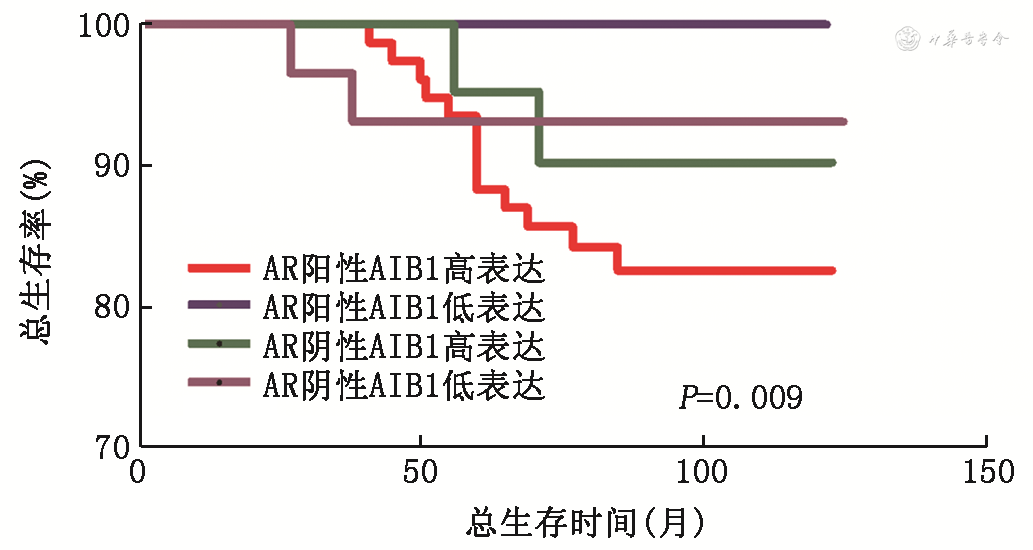
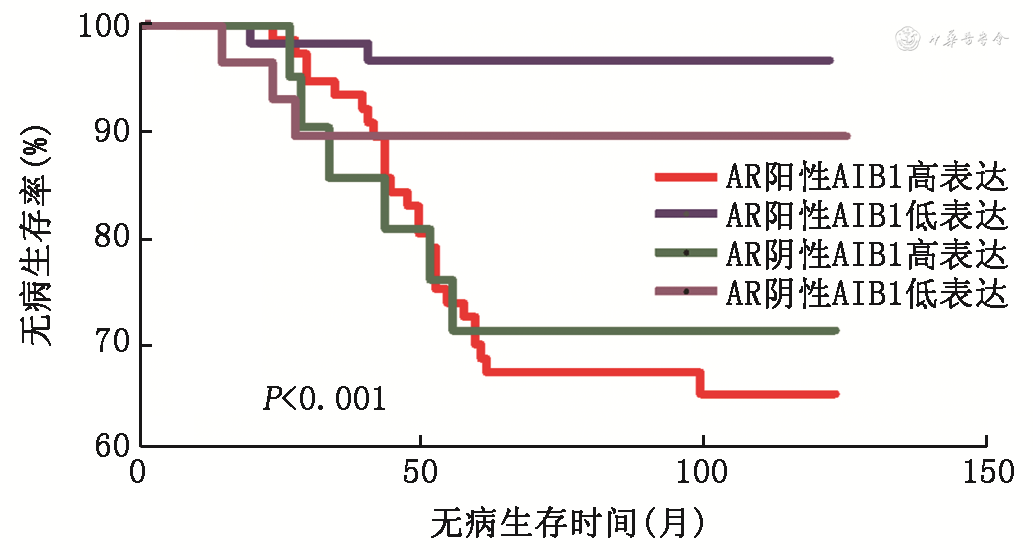
通过Kaplan-Meier生存曲线分析发现,AR阳性且AIB1高表达组与其他3个亚组相比预后较差(OS,P=0.009,图2;DFS,P<0.001,图3)。单因素分析结果显示患者淋巴结转移情况、组织学分级、HER2表达、AIB1表达、AR阳性AIB1高表达与患者预后相关,Cox风险回归模型提示AR阳性且AIB1高表达是影响ER阳性乳腺癌预后的危险因素,见表4。


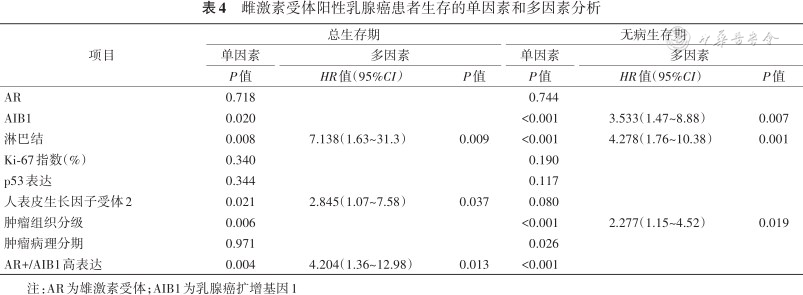
雌激素受体阳性乳腺癌患者生存的单因素和多因素分析
雌激素受体阳性乳腺癌患者生存的单因素和多因素分析
| 项目 | 总生存期 | 无病生存期 | ||||
|---|---|---|---|---|---|---|
| 单因素 | 多因素 | 单因素 | 多因素 | |||
| P值 | HR值(95%CI) | P值 | P值 | HR值(95%CI) | P值 | |
| AR | 0.718 | 0.744 | ||||
| AIB1 | 0.020 | <0.001 | 3.533(1.47~8.88) | 0.007 | ||
| 淋巴结 | 0.008 | 7.138(1.63~31.3) | 0.009 | <0.001 | 4.278(1.76~10.38) | 0.001 |
| Ki-67指数(%) | 0.340 | 0.190 | ||||
| p53表达 | 0.344 | 0.117 | ||||
| 人表皮生长因子受体2 | 0.021 | 2.845(1.07~7.58) | 0.037 | 0.080 | ||
| 肿瘤组织分级 | 0.006 | <0.001 | 2.277(1.15~4.52) | 0.019 | ||
| 肿瘤病理分期 | 0.971 | 0.026 | ||||
| AR+/AIB1高表达 | 0.004 | 4.204(1.36~12.98) | 0.013 | <0.001 | ||
注:AR为雄激素受体;AIB1为乳腺癌扩增基因1
通过GEPIA数据库分析ER阳性乳腺组织中AR及AIB1的mRNA表达水平,结果显示ER阳性乳腺癌组织中AR及AIB1的mRNA表达水平均高于癌旁正常组织(图4)。
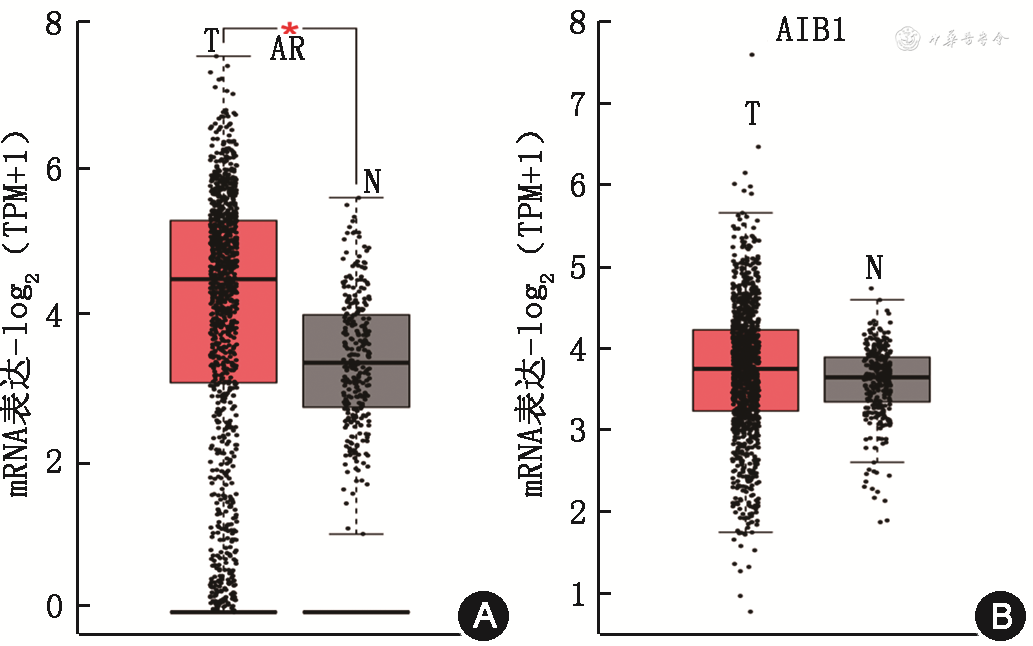

注:T为乳腺癌组织;N为癌旁正常组织
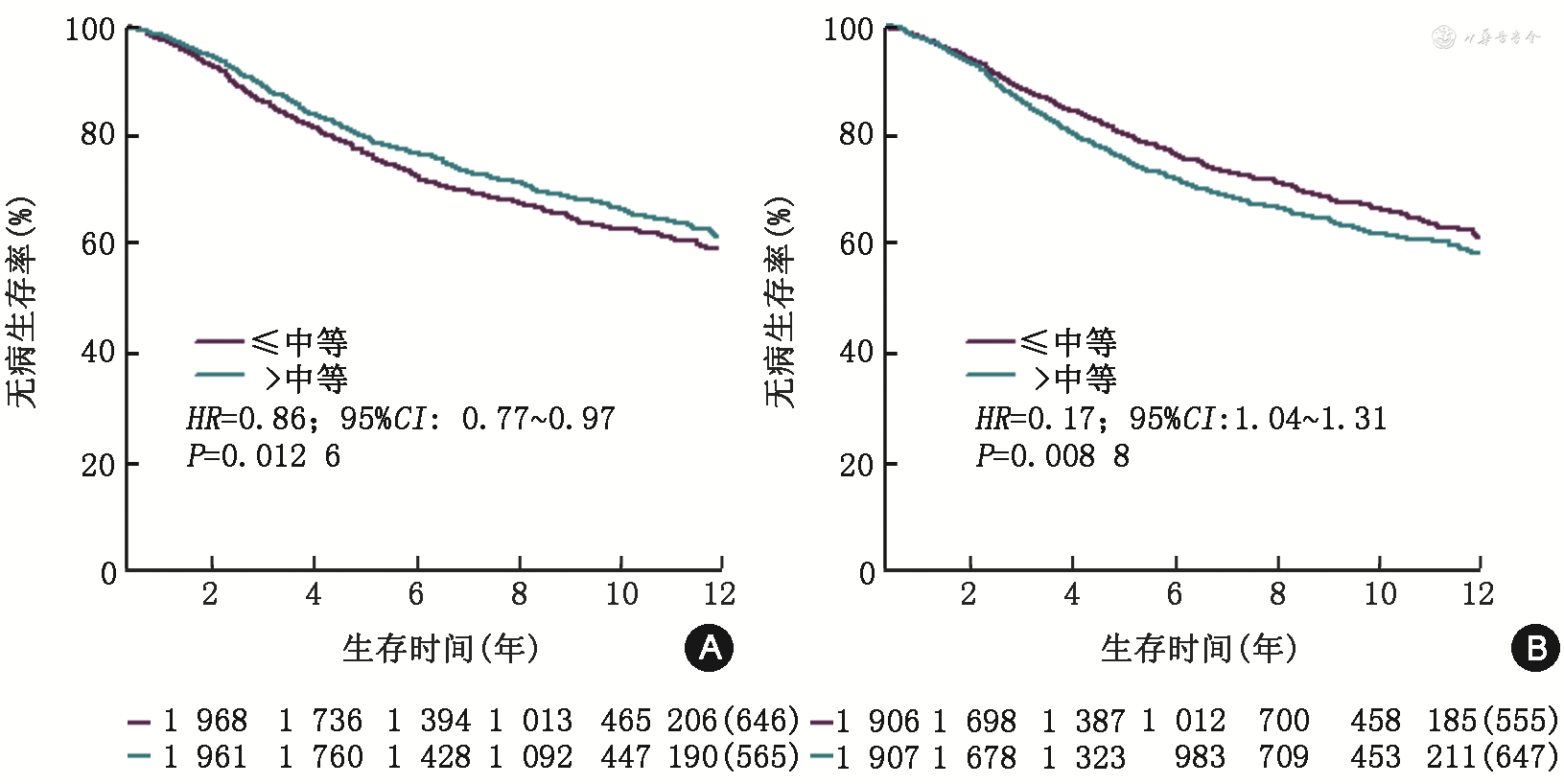
此外,通过GEPIA数据库评估乳腺癌患者预后,发现ER阳性乳腺癌中AR高表达患者预后较好,差异有统计学意义(P=0.012 6),而AIB1(NCOA3)高表达患者预后较差(P=0.008 8),其差异有统计学意义(图5)。

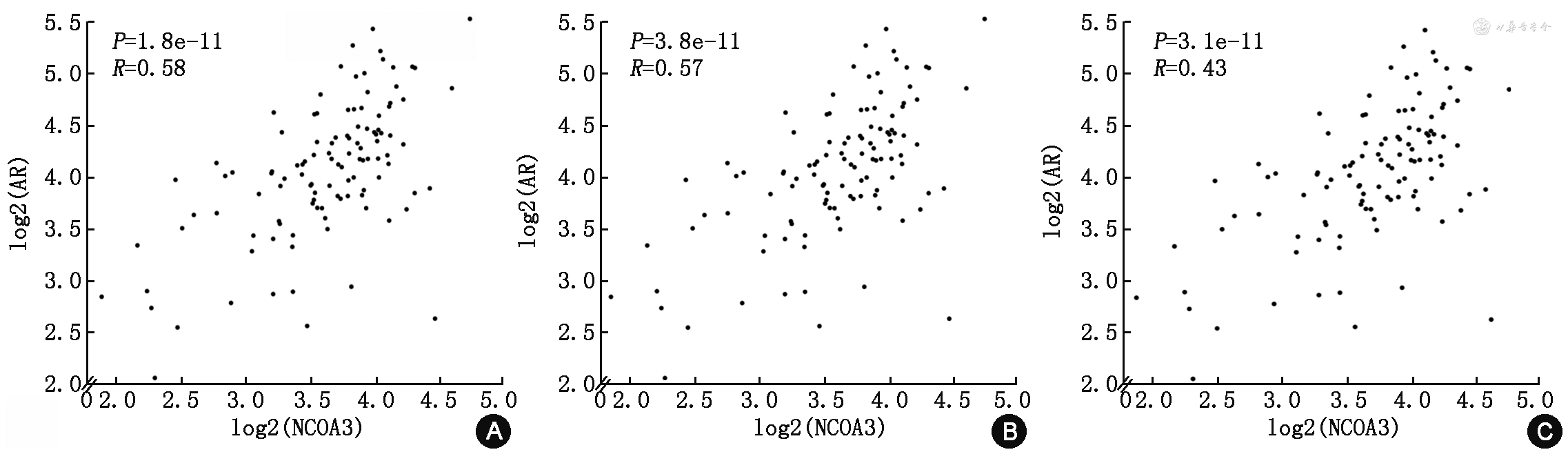
本研究还通过GEPIA数据库对AR及AIB1(NCOA3)表达水平之间的关系进行了分析,发现AR与AIB1(NCOA3)的表达水平呈正相关关系(图6)。

乳腺癌是女性最常见的恶性肿瘤之一,ER阳性乳腺癌是乳腺癌中最常见的亚型,约占70%[8]。TAM是一种抗雌激素药物,40年来一直被纳入ER阳性乳腺癌患者的标准治疗方案[9],但在治疗2~3年后有可能产生耐药[10]。TAM耐药可分为两种形式,其一为原发内分泌耐药,即辅助内分泌治疗时间<2年复发,或晚期一线内分泌治疗<6个月出现疾病进展。另一种则为继发性(获得性)内分泌耐药,其定义为辅助内分泌治疗时间>2年且于停药后1年内复发的患者,或晚期一线内分泌治疗>6个月出现疾病进展。然而ER阳性乳腺癌对TAM产生耐药的现象仍然是目前临床治疗所面临的一大难题[11]。有研究表明,多种生化因子及分子途径包括ER信号通路、RTKs(receptor tyrosine kinases)信号通路(HER2,EGFR,FGFR,IGF1R)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的改变、microRNA的异常表达以及遗传多态性对TAM代谢活性的影响等,被认为是产生TAM耐药的关键因素[12]。
AIB1作为重要的ER辅助激活因子,AIB1的高表达见于30%~60%的乳腺癌中,并且与侵袭性肿瘤表型相关联(HER2过表达、高组织学分级及Ki-67高增殖指数)[13]。此外,Varešlija 等[14]的研究结果表明AIB1 可与 转移关联蛋白2(metastasis associated protein,MTA2)相互作用形成抑制复合物,抑制编码 E-钙黏蛋白1基因(CDH1)以促进上皮间质转化和疾病进展,进一步表明AIB1有可能通过调控上皮间质转化蛋白的表达,从而在乳腺癌的侵袭、转移过程中发挥作用。AIB1丢失后可通过抑制受体的降解和灭活转录的启动而影响ER的信号途径[15]。与此同时,临床研究也证实当ER阳性乳腺癌在使用TAM治疗期间,AIB1可表现出拮抗作用[16]。Alkner等[17]的研究结果显示AIB1与肿瘤患者内分泌治疗的敏感性和预后相关,在ER阳性的异时对侧乳腺癌中,AIB1高表达与预后差相关联。与此同时,徐迎春等[18]研究发现了HER2的表达产物具有内源性酪氨酸激酶活性,可通过丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路增强AIB1的活性。提示了HER2与AIB1之间的关系十分密切,TAM耐药的发生可能与AIB1及HER2过表达并激活其下游通路有关。已经在体外实验及动物实验中证实,AIB1、HER2共同参与了乳腺癌TAM获得性耐药的发生,AIB1在HER2介导的生长信号的作用下使TAM 的激动剂效应增强,激活ER途径导致耐药细胞生长[19]。在一项最新的研究中,Jahangiri等[20]发现,在TAM耐药患者中观察到异常启动子甲基化和AIB1的过表达,他们认为需要进一步的研究来证明AIB1表达及其甲基化所介导的调节机制作为预后指标或更好治疗靶点的可能性。
早期有研究者提出,AR信号传导在正常乳腺组织中发挥抗雌激素、抑制生长的作用,这种作用可能在ER阳性的乳腺导管癌中持续存在,然而AR又可能促进ER阴性、AR阳性乳腺大汗腺癌亚群的生长,因此AR可能在不同的乳腺癌类型中发挥着不同的抑癌或促癌的作用[21]。有研究表明在ER阳性乳腺癌中AR阳性表达的患者预后较好[12]。然而较新的研究显示,在经TAM治疗的ER阳性乳腺癌中,AR/ER的比值≥2时,会增加TAM治疗失败的风险[22],同时还有可能导致出现侵袭性的生物学特征[23]。2015年,Ciupek等[24]证实了AR过表达可以活化其下游的EGFR信号通路,进而促使TAM耐药的发生,然而这种耐药现象可以被恩杂鲁胺以及表皮生长因子受体抑制剂吉非替尼所阻断。这些研究结果表明AR过表达可能会导致乳腺癌患者对TAM的敏感性降低,并且是导致ER阳性乳腺癌对TAM发生耐药的重要原因。最近的一项体外实验研究表明雌激素受体α基因(ESR1)突变经常发生在ER阳性转移性乳腺癌中,而AR可通过抑制体内雌激素调节的基因表达、促进EMT和远处转移而发挥促癌作用[25]。
本研究发现,AIB1的表达水平与乳腺癌TAM治疗疗效具有明显的相关性,其高表达易发生TAM耐药,而AR的表达水平与TAM耐药没有相关性。TAM在AR阴性AIB1低表达、AR阴性AIB1高表达、AR阳性AIB1低表达以及AR阳性AIB1高表达四组中的治疗有效率分别为 89.7%、71.4%、96.7%、66.2%,其中AR阳性且AIB1高表达组TAM耐药的发生率最高,提示:当AR阳性时且AIB1高表达更易引起TAM耐药的发生。而在ER阳性乳腺癌中发现,AIB1细胞质表达与AR细胞核表达呈正相关关系,因此推测在乳腺癌中AIB1可能与AR之间进行相互作用,同时激活HER2或EGFR的表达,进而活化MAPK和AKT信号通路,共同作用并减弱TAM对激素受体阳性乳腺癌患者的治疗效果。本研究结果观察到AIB1和AR的阳性共表达最易发生TAM耐药,这为AR阳性且AIB1高表达患者出现TAM耐药率较高这一现象提供了理论依据,然而关于AIB1、AR与TAM耐药相关性的研究报道目前仍然较少,AIB1与AR之间发挥的具体作用机制尚不明确,仍需进一步深入研究探讨。
刘宁, 孟庆祥, 王广舜. 乳腺癌扩增基因1与雄激素受体表达与乳腺癌他莫昔芬耐药的关系[J]. 中华医学杂志, 2023, 103(20): 1553-1559. DOI: 10.3760/cma.j.cn112137-20230115-00081.
所有作者均声明不存在利益冲突



























