
探讨游离三碘甲腺原氨酸(FT3)/游离甲状腺素(FT4)比值对心力衰竭(心衰)患者预后的影响。
回顾性分析2009年3月至2018年6月在中国医学科学院阜外医院心衰中心住院的3 527例心衰患者的临床资料。根据FT3/FT4比值的中位数分为低FT3/FT4比值组(1 764例,FT3/FT4<2.15)和高FT3/FT4比值组(1 763例,FT3/FT4≥2.15)。收集患者临床资料,患者出院后进行系统的门诊复查或电话随访,研究主要终点定义为全因死亡或心脏移植或植入左心室辅助装置的复合终点。比较基线时不同FT3/FT4比值组患者临床资料差异,采用多因素Cox比例风险回归模型分析FT3/FT4比值与住院心衰患者预后的相关性。
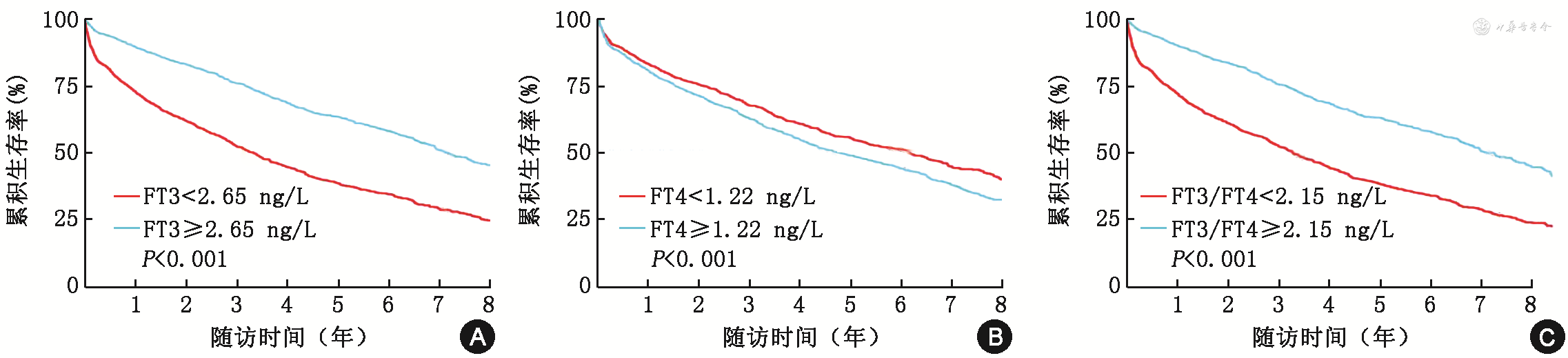
3 527例患者的年龄为(56.8±16.0)岁,男性为2 544例(72.1%);随访时间[M(Q1,Q3)]为2.79(1.00,5.03)年,最终随访时共记录了1 542例患者的终点事件。低FT3/FT4比值组和高FT3/FT4比值组患者的年龄分别为(58.8±16.5)和(54.8±15.2)岁(P<0.001),随访期间累积生存率分别为38.4%、61.9%(P<0.001)。FT3(HR=0.72,95%CI:0.63~0.84,P<0.001)、FT3/FT4比值(HR=0.76,95%CI:0.65~0.87,P<0.001)是心衰患者全因死亡、心脏移植或植入左心室辅助装置复合终点的相关因素;FT3/FT4比值预测左心室射血分数(LVEF)为<40%、40%~49%、≥50%患者复合终点风险的HR值(95%CI)分别为0.91(0.77~1.08),0.83(0.50~1.39),0.65(0.50~0.85)(P交互=0.045)。
低FT3和低FT3/FT4比值是住院心衰患者不良预后的相关因素;在LVEF≥50%患者中FT3/FT4比值具有更显著的预测作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心力衰竭(心衰)是各种心脏疾病的晚期阶段,目前全世界心衰患者超过6 000万,我国心衰现患例数达890万例[1, 2],且发病率及死亡率仍居高不下。甲状腺激素通过调节不同的信号通路,影响心脏收缩功能、血管阻力、传导系统及血脂代谢等心血管系统的病理生理过程。甲状腺功能障碍与心血管疾病患者不良预后有关[3, 4]。低三碘甲腺原氨酸(triiodothyronine,T3)综合征指的是游离T3(free triiodothyronine,FT3)水平减低而促甲状腺激素(thyroid stimulating hormone,TSH)和游离甲状腺素(free thyroxine,FT4)水平正常的甲状腺状态,是心衰患者不良预后的预测指标[5]。近年来研究表明甲状腺激素在参考范围内的变化也会影响患者预后,可能与外周甲状腺激素脱碘功能障碍和脱碘酶活性的下调有关[6, 7]。FT3/FT4比值反映了脱碘酶活性,是反映甲状腺激素代谢变化的指标。既往研究表明FT3/FT4比值与心血管疾病的预后相关,如冠心病[8]、心肌梗死[9]、扩张型心肌病[10]等,在心衰患者中的预后关系数据较少。因此本研究旨在研究FT3、FT4或FT3/FT4比值在住院心衰患者中与心衰预后的关系,为心衰患者中高危人群的识别提供参考。
本研究为回顾性队列研究,纳入了2009年3月至2018年6月于中国医学科学院阜外医院心衰重症监护病房住院的心衰患者的临床资料。入选标准:(1)≥18岁;(2)符合《中国心力衰竭诊断与治疗指南2018》[11]及《2021年欧洲心脏病学会急慢性心力衰竭诊断与治疗指南》[12]心衰诊断标准并住院治疗的患者;(3)纽约心脏协会(New York Heart Association,NYHA)心功能分级Ⅱ~Ⅳ级。排除标准:(1)基线甲状腺功能(包括TSH、FT3、FT4)结果缺失;(2)既往合并甲状腺疾病[如甲状腺功能亢进(甲亢)、甲状腺功能减低(甲减)]者;(3)患有淀粉样变、自身免疫性疾病、活动性恶性肿瘤、严重感染或妊娠等疾病。最终共纳入3 527例。本研究获得中国医学科学院阜外医院伦理委员会批准(批号:2018-1041),所有患者均已签署知情同意书。
所有临床资料均为研究者从中国医学科学院阜外医院电子病历系统中提取,所有患者基线静脉血标本均为患者入院后24 h内空腹采集,采集后4 h内送至中国医学科学院阜外医院核医学科由技师进行常规检测。根据核医学科实验室常规操作流程,甲状腺功能检测采用直接化学发光法(ADVIA Centaur,西门子,德国),甲状腺激素正常参考值:FT3∶1.79~4.09 ng/L,FT4∶0.80~1.88 ng/dL,TSH:0.35~5.5 mU/L。根据FT3/FT4比值的中位值2.15分为低FT3/FT4比值组(1 764例,FT3/FT4<2.15)和高FT3/FT4比值(1 763例,FT3/FT4≥2.15)组。本研究终点定义为全因死亡、心脏移植或植入左心室辅助装置的复合终点。终点事件的数据由2名心脏专科医师进行收集和确定。
采用 R 4.0.2软件和SPSS 25.0软件进行统计分析。计量资料符合正态分布,以表示,采用独立样本t检验进行组间比较。计数资料以例(%)表示,采用χ2检验进行组间比较。不符合正态分布的计量资料则用M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。采用多因素Cox比例风险回归模型分析影响预后的危险因素。采用Kaplan-Meier法绘制生存曲线,log-rank比较随访期间组间累积生存率的差异。通过采用限制性立方样条(restricted cubic splines,RCS)曲线评估FT3、FT4或FT3/FT4比值与复合终点的关系。采用似然比检验验证FT3/FT4比值与各协变量间的交互作用。双侧检验,检验水准α=0.05。
3 527例患者的年龄为(56.8±16.0)岁,男性为2 544例(72.1%)。低FT3/FT4比值组、高FT3/FT4比值组患者年龄分别为(58.8±16.5)和(54.8±15.2)岁(P<0.001)。与高FT3/FT4比值组患者相比,低FT3/FT4比值组男性、合并高血压比例、左心室射血分数(left ventricular ejection fraction,LVEF)、体质指数、白蛋白、血红蛋白、血钠、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇更低,而年龄、白细胞、天冬氨酸转移酶、高敏C反应蛋白(high-sensitivity C-reactive Protein,hsCRP)、肌钙蛋白I、N末端B型利钠肽原(N-terminal brain natriuretic peptide precursor,NT-proBNP)、血肌酐及NYHA心功能分级 Ⅲ~Ⅳ级比例更高(均P<0.05),见表1。
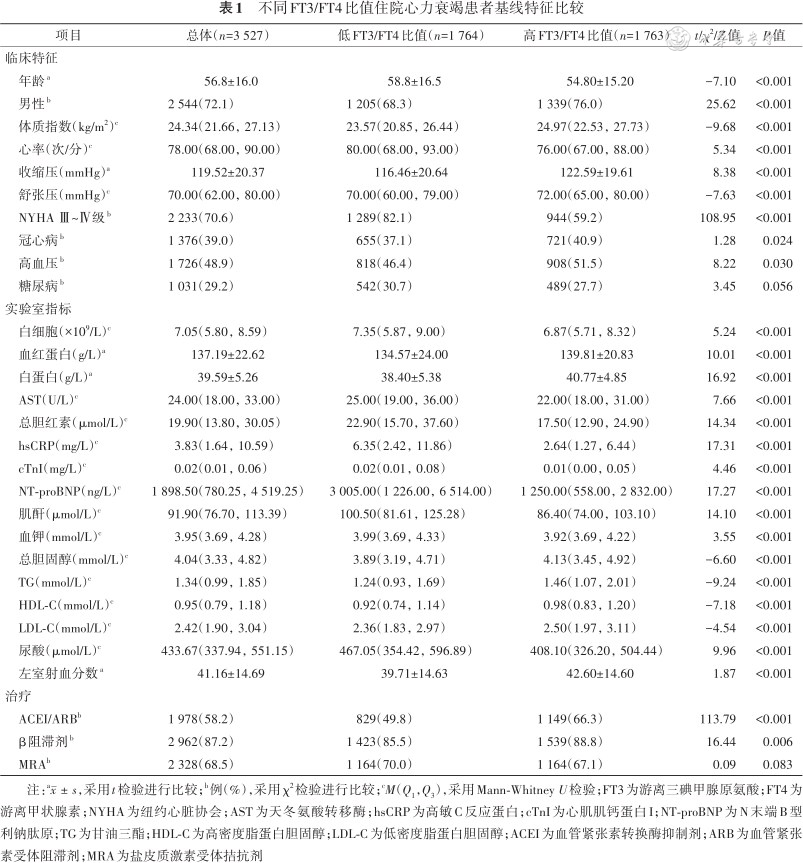
不同FT3/FT4比值住院心力衰竭患者基线特征比较
不同FT3/FT4比值住院心力衰竭患者基线特征比较
| 项目 | 总体(n=3 527) | 低FT3/FT4比值(n=1 764) | 高FT3/FT4比值(n=1 763) | t/χ2/Z值 | P值 |
|---|---|---|---|---|---|
| 临床特征 | |||||
| 年龄a | 56.8±16.0 | 58.8±16.5 | 54.80±15.20 | -7.10 | <0.001 |
| 男性b | 2 544(72.1) | 1 205(68.3) | 1 339(76.0) | 25.62 | <0.001 |
| 体质指数(kg/m2)c | 24.34(21.66,27.13) | 23.57(20.85,26.44) | 24.97(22.53,27.73) | -9.68 | <0.001 |
| 心率(次/分)c | 78.00(68.00,90.00) | 80.00(68.00,93.00) | 76.00(67.00,88.00) | 5.34 | <0.001 |
| 收缩压(mmHg)a | 119.52±20.37 | 116.46±20.64 | 122.59±19.61 | 8.38 | <0.001 |
| 舒张压(mmHg)c | 70.00(62.00,80.00) | 70.00(60.00,79.00) | 72.00(65.00,80.00) | -7.63 | <0.001 |
| NYHA Ⅲ~Ⅳ级b | 2 233(70.6) | 1 289(82.1) | 944(59.2) | 108.95 | <0.001 |
| 冠心病b | 1 376(39.0) | 655(37.1) | 721(40.9) | 1.28 | 0.024 |
| 高血压b | 1 726(48.9) | 818(46.4) | 908(51.5) | 8.22 | 0.030 |
| 糖尿病b | 1 031(29.2) | 542(30.7) | 489(27.7) | 3.45 | 0.056 |
| 实验室指标 | |||||
| 白细胞(×109/L)c | 7.05(5.80,8.59) | 7.35(5.87,9.00) | 6.87(5.71,8.32) | 5.24 | <0.001 |
| 血红蛋白(g/L)a | 137.19±22.62 | 134.57±24.00 | 139.81±20.83 | 10.01 | <0.001 |
| 白蛋白(g/L)a | 39.59±5.26 | 38.40±5.38 | 40.77±4.85 | 16.92 | <0.001 |
| AST(U/L)c | 24.00(18.00,33.00) | 25.00(19.00,36.00) | 22.00(18.00,31.00) | 7.66 | <0.001 |
| 总胆红素(μmol/L)c | 19.90(13.80,30.05) | 22.90(15.70,37.60) | 17.50(12.90,24.90) | 14.34 | <0.001 |
| hsCRP(mg/L)c | 3.83(1.64,10.59) | 6.35(2.42,11.86) | 2.64(1.27,6.44) | 17.31 | <0.001 |
| cTnI(mg/L)c | 0.02(0.01,0.06) | 0.02(0.01,0.08) | 0.01(0.00,0.05) | 4.46 | <0.001 |
| NT-proBNP(ng/L)c | 1 898.50(780.25,4 519.25) | 3 005.00(1 226.00,6 514.00) | 1 250.00(558.00,2 832.00) | 17.27 | <0.001 |
| 肌酐(μmol/L)c | 91.90(76.70,113.39) | 100.50(81.61,125.28) | 86.40(74.00,103.10) | 14.10 | <0.001 |
| 血钾(mmol/L)c | 3.95(3.69,4.28) | 3.99(3.69,4.33) | 3.92(3.69,4.22) | 3.55 | <0.001 |
| 总胆固醇(mmol/L)c | 4.04(3.33,4.82) | 3.89(3.19,4.71) | 4.13(3.45,4.92) | -6.60 | <0.001 |
| TG(mmol/L)c | 1.34(0.99,1.85) | 1.24(0.93,1.69) | 1.46(1.07,2.01) | -9.24 | <0.001 |
| HDL-C(mmol/L)c | 0.95(0.79,1.18) | 0.92(0.74,1.14) | 0.98(0.83,1.20) | -7.18 | <0.001 |
| LDL-C(mmol/L)c | 2.42(1.90,3.04) | 2.36(1.83,2.97) | 2.50(1.97,3.11) | -4.54 | <0.001 |
| 尿酸(μmol/L)c | 433.67(337.94,551.15) | 467.05(354.42,596.89) | 408.10(326.20,504.44) | 9.96 | <0.001 |
| 左室射血分数a | 41.16±14.69 | 39.71±14.63 | 42.60±14.60 | 1.87 | <0.001 |
| 治疗 | |||||
| ACEI/ARBb | 1 978(58.2) | 829(49.8) | 1 149(66.3) | 113.79 | <0.001 |
| β阻滞剂b | 2 962(87.2) | 1 423(85.5) | 1 539(88.8) | 16.44 | 0.006 |
| MRAb | 2 328(68.5) | 1 164(70.0) | 1 164(67.1) | 0.09 | 0.083 |
注:a,采用t检验进行比较;b例(%),采用χ2检验进行比较;cM(Q1,Q3),采用Mann-Whitney U检验;FT3为游离三碘甲腺原氨酸;FT4为游离甲状腺素;NYHA为纽约心脏协会;AST为天冬氨酸转移酶;hsCRP为高敏C反应蛋白;cTnI为心肌肌钙蛋白I;NT-proBNP为N末端B型利钠肽原;TG为甘油三酯;HDL-C为高密度脂蛋白胆固醇;LDL-C为低密度脂蛋白胆固醇;ACEI为血管紧张素转换酶抑制剂;ARB为血管紧张素受体阻滞剂;MRA为盐皮质激素受体拮抗剂
3 527例患者的随访时间为2.79(1.00,5.03)年,最终随访时共记录了1 542例患者的复合终点事件。低FT3、高FT4及低FT3/FT4比值的心衰患者随访期间累积生存率分别为38.7%、46.4%、38.4%,均低于高FT3、低FT4及高FT3/FT4比值患者的61.3%、54.0%、61.9%,差异均有统计学意义(χ2值分别为155.90、17.30、171.60,均P<0.001)。见图1。

校正年龄、性别和体质指数后,FT3(HR=0.43,95%CI:0.38~0.48,P<0.001),FT4(HR=1.81,95%CI:1.43~2.28,P<0.001)及FT3/FT4比值(HR=0.41,95%CI:0.37~0.46,P<0.001)均与住院心衰患者复合终点相关。经过校正年龄、性别、体质指数、心率、收缩压、LVEF、血钠、总胆红素、丙氨酸转移酶、总胆固醇、血肌酐、对数转化(log)NT-proBNP、NYHA心功能分级、接受血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂、β受体阻滞剂、盐皮质激素受体拮抗剂治疗,冠心病、高血压、糖尿病、房颤后,FT3(HR=0.76,95%CI:0.65~0.87,P<0.001)、FT3/FT4比值(HR=0.72,95%CI:0.63~0.84,P<0.001)仍是住院心衰患者发生复合终点事件的相关因素。见表2。
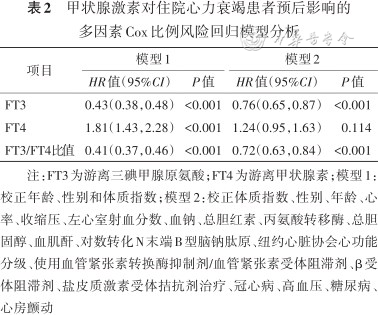
甲状腺激素对住院心力衰竭患者预后影响的多因素Cox比例风险回归模型分析
甲状腺激素对住院心力衰竭患者预后影响的多因素Cox比例风险回归模型分析
| 项目 | 模型1 | 模型2 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| FT3 | 0.43(0.38,0.48) | <0.001 | 0.76(0.65,0.87) | <0.001 |
| FT4 | 1.81(1.43,2.28) | <0.001 | 1.24(0.95,1.63) | 0.114 |
| FT3/FT4比值 | 0.41(0.37,0.46) | <0.001 | 0.72(0.63,0.84) | <0.001 |
注:FT3为游离三碘甲腺原氨酸;FT4为游离甲状腺素;模型1:校正年龄、性别和体质指数;模型2:校正体质指数、性别、年龄、心率、收缩压、左心室射血分数、血钠、总胆红素、丙氨酸转移酶、总胆固醇、血肌酐、对数转化N末端B型脑钠肽原、纽约心脏协会心功能分级、使用血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂、β受体阻滞剂、盐皮质激素受体拮抗剂治疗、冠心病、高血压、糖尿病、心房颤动
如图2所示,RCS曲线显示FT3和FT3/FT4比值与住院心衰患者复合终点时间风险呈负相关,结果与多因素Cox风险回归模型分析一致。对性别、年龄、肌酐、NYHA分级、是否合并缺血病因、是否合并高血压、是否合并糖尿病等协变量进行亚组分析,FT3/FT4比值与复合终点风险的关系在各亚组间大致相同(P交互>0.05)。而根据LVEF进行亚组分析发现,FT3/FT4比值预测LVEF为<40%、40%~49%、≥50%的患者复合终点风险的HR值(95%CI)分别为0.91(0.77~1.08),0.83(0.50~1.39),0.65(0.50~0.85)(P交互=0.045)。
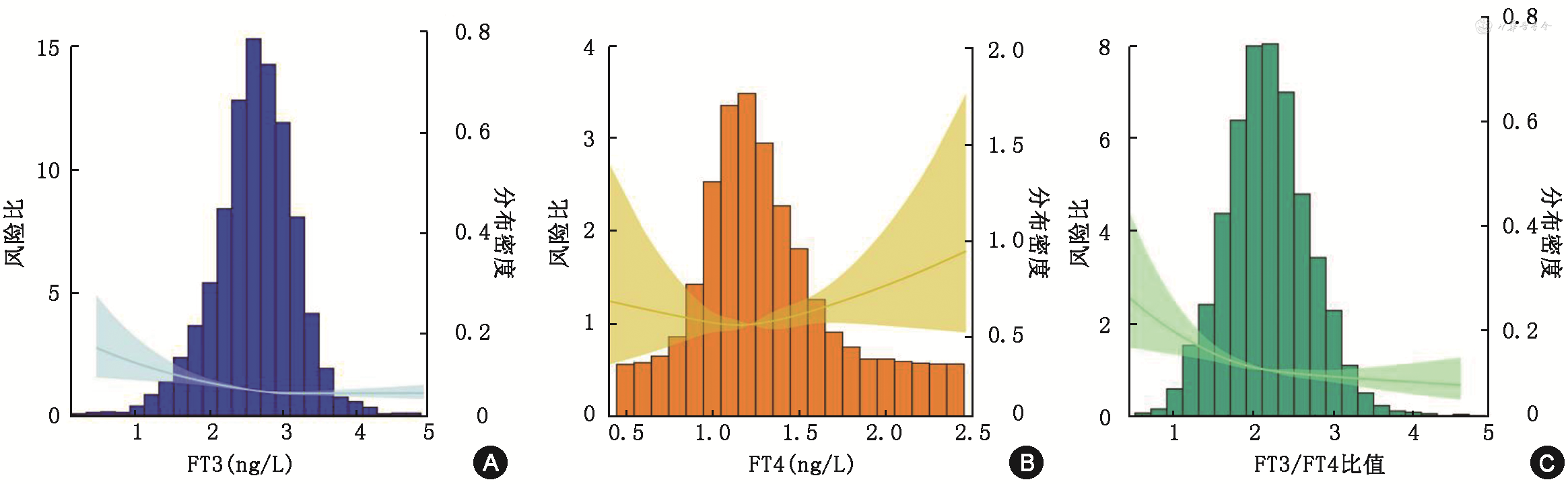

注:校正了体质指数、性别、年龄、心率、收缩压、左心室射血分数、血钠、总胆红素、丙氨酸转移酶、总胆固醇、血肌酐、对数转化后的N末端B型脑钠肽原、纽约心脏协会心功能分级、接受血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂、β受体阻滞剂、盐皮质激素受体拮抗剂治疗、冠心病、高血压、糖尿病、房颤
本研究结果显示,低FT3和低FT3/FT4比值是住院心衰患者全因死亡、心脏移植或植入左心室辅助装置的复合终点的相关因素,在LVEF≥50%患者中FT3/FT4比值具有更显著的预测作用。
心血管系统是甲状腺激素作用的主要靶器官之一,甲状腺激素水平异常可增加心血管疾病风险。甲状腺功能异常包括甲亢、甲减、低T3综合征,均可影响心血管疾病的临床表现及转归[13]。亚临床甲亢、亚临床甲减和低T3综合征与房颤风险增高及心血管相关死亡率升高有关[14]。正常甲状腺激素水平轻微的变化也可影响心血管系统病理生理过程,从而影响预后。Cappola等[15]调查了美国2 843名老年社区居民,并进行了18年的跟踪调查,结果发现在正常参考范围内较高的FT4与全因死亡风险增加有关。FT4正常高值与心衰和猝死相关。Kannan等[16]研究提示FT4升高和总胆固醇下降与植入左室辅助装置、心脏移植或全因死亡的复合终点风险增加相关。Neves等[17]在全国健康与营养调查数据库中纳入了7 116名成年受试者,发现正常参考范围内较低的血清FT3与心血管相关死亡风险增加相关。
甲状腺激素中FT3和FT4是T3和T4的生理活性形式,前者更敏感且与临床关系更密切,对靶器官发挥重要生物学作用。外周甲状腺素脱碘是循环T3产生的主要来源,脱碘酶起着至关重要的作用。FT3/FT4比值反映了脱碘酶的活性,故 FT3/FT4比值的降低表示外周血T4向T3转化的减少,这种情况可见于各种急慢性疾病。然而心衰患者外周血甲状腺素脱碘酶功能障碍与心衰不良预后风险增加之间的病理生理机制尚不清楚。目前认为外周甲状腺素转化生成的不足是一种对组织损伤的全身适应性反应,可反映疾病的严重程度。此外甲状腺激素脱碘的减少与氧化应激失衡和全身炎症反应过程相关[18, 19]。本研究中基线数据也提示低FT3/FT4比值组hsCRP水平更高。此外,心衰患者中FT3转化生成的不足可引起内质网氧化应激损伤,影响心肌细胞对ATP的利用,同样导致心肌收缩功能的损伤和心衰的进展[18]。
相比于FT3或FT4,FT3/FT4比值作为评价外周甲状腺激素脱碘程度和脱碘酶活性的替代指标,代表甲状腺激素的轻度代谢变化,与预后的相关性更强[8]。一项纳入111例扩张型心肌病的研究显示,FT3/FT4比值是心功能严重受损的间接指标,且与LVEF减低和死亡风险增高密切相关[10]。在三支病变的冠心病患者中,FT3/FT4比值降低会增加甲状腺功能正常患者长期心源性死亡和严重心脑血管不良事件的风险[8]。而在普通人群中FT3、FT4和FT3/FT4比值仍是全因死亡的独立预测因素[20]。本研究主要在心衰人群中探索甲状腺激素对于预后的影响,结果与以上研究结果一致,低FT3和低FT3/FT4比值会增加心衰患者全因死亡、心脏移植或植入左心室辅助装置的复合终点风险。
射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)指的是LVEF≥50%的心衰,常合并多种内分泌代谢紊乱,如肥胖、糖尿病、血脂异常、铁代谢异常等[21]。外周T4到T3转换的减少所致FT3/FT4比值降低可引起多种代谢紊乱,增加10年心血管事件风险[22]。因此低FT3/FT4比值作为HFpEF不良预后的高危因素[23],或许可成为HFpEF的潜在治疗靶点,仍需进一步探索。
本研究仍存在一些不足:首先,甲状腺功能仅在基线时检查,随访期间甲状腺功能未进行评估;其次,本研究为单中心、回顾性、观察性研究,虽然已尽可能控制了混杂因素,但仍可能存在一些潜在混杂因素影响,结果可能存在一定程度的偏倚。
综上所述,低FT3和低FT3/FT4比值是住院心衰患者不良预后的重要危险因素,在LVEF≥50%患者中FT3/FT4具有更显著的预测作用。
周萍, 黄丽燕, 翟玫, 等. 游离三碘甲腺原氨酸/游离甲状腺素比值对住院心力衰竭患者预后的影响[J]. 中华医学杂志, 2023, 103(22): 1679-1684. DOI: 10.3760/cma.j.cn112137-20230220-00239.
所有作者均声明不存在利益冲突



























